Сегодня поговорим об очень большой группе соединений, которые называются гидроксиды. Как говорит учебник химии,
гидроксид – это химическое соединение, в котором есть группа –ОН.
Собственно, именно по этому признаку и можно определить, что перед нами гидроксид: в нём всегда есть одна или несколько гидроксильных групп –ОН.
Также запомните, что есть понятие «щёлочь». К щелочам относят гидроксиды металлов щелочных (то есть стоящих в первой группе таблицы Менделеева в основной подгруппе), щёлочноземельных (то есть стоящих во второй группе таблицы Менделеева в основной подгруппе) и аммония NH4+.
В чём разница между гидроксидами и щелочами
Щёлочь – понятие более узкое, гидроксид – более широкое. То есть щёлочь – всегда гидроксид, но гидроксид – не всегда щёлочь.
Например, гидроксид натрия NaOH. Натрий находится в первой группе периодической таблицы, это щелочной металл. Поэтому NaOH – это щёлочь. Но если вы назовёте его гидроксидом, ошибкой это не будет.
Другой пример. Гидроксид меди (II) Сu(OH)2 – это гидроксид, но никак не щёлочь (посмотрите в таблицу Менделеева. Медь находится в первой группе, но не в основной, а в побочной! Медь – не щелочной металл!). То есть назвать Сu(OH)2 щёлочью будет ошибкой, это гидроксид.
Как составить формулу гидроксида
Первым делом вспоминаем про валентность, без неё в химии никуда. Далее нужно понять, что группа ОН – это цельная структурная единица. Составляя формулу, мы всегда заключаем её в скобки (если ОН группа одна, то скобки не нужны), а индекс, маленькая цифра внизу справа, относится ко всей гидроксильной группе.
Также сразу запомните, что
группа –ОН всегда имеет валентность I.
Чтобы этот факт навсегда врезался вам в память, запомните следующее. Группа –ОН образуется из воды. Формула воды Н2О, это всем известно. Выглядит молекула воды так: Н-О-Н. То есть в ней две части Н– и –ОН. Каждая из этих частей имеет валентность I, это видно и из формулы:
Нам здесь важно, что гидроксильная группа имеет валентность I. Это надо запомнить.
Теперь переходим к практике и решению химии.
Пример 1.
Составьте формулу гидроксида калия.
Это очень просто. Калий в таблице Менделеева находится в первой группе в основной подгруппе, он имеет валентность I. Группа –ОН также имеет валентность I. Следовательно, формула гидроксида калия КОН.
Пример 2.
Составьте формулу гидроксида кальция.
Кальций находится в периодической таблице во второй группе в основной подгруппе, его валентность II. Тогда:
Здесь надо припомнить, как составляется формула вещества, если известна валентность. Нужно, чтобы произведение валентности и индекса у каждого элемента совпадало. Поэтому формула гидроксида кальция выглядит так:
Напоминаю, что если гидроксильных групп больше одной, то мы из заключаем в скобки. Обратите внимание, что такое написание (ОН)2 означает, что в формуле не два атома водорода, а две группы ОН!
Итак, формула гидроксида кальция – Ca(ОН)2.
Пример 3.
Составьте формулу гидроксида железа (III).
Валентность железа задана условиями, поэтому:
Отсюда следует:
Таким образом, формула гидроксида железа (III) – Fe(OH)3.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Методическая
разработка:
«Алгоритм
составления названий и формул оснований (гидроксидов)»
При изучении химии в 8 классе учащиеся
сталкиваются с затруднениями в названии химических веществ и составления формул
химических соединений. Для лучшего усвоения данного материала им помогут
«Алгоритмы» – краткая запись последовательности действий.
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ ОСНОВАНИЙ.
Основания – сложные химические вещества ,
состоящие из ионов металла связанных с гидроксогруппой (-ОН)
При названии оснований необходимо соблюдать
данную последовательность действий:
1. Дается
название последней части вещества – гидроксид.
2. Называется
металл, который связан с гидроксогруппой (-ОН), в родительном падеже (записан
перед гидроксогруппой).
3. Если
заряд металла переменный, в скобках указывается валентность металла.
Запомните: количество
гидроксогрупп равно заряду и валентности металла.
ПРИМЕР:
Fe( OH)2
гидроксид железа (ii)
Al(OH)3
гидроксид алюминия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ ОСНОВАНИЙ.
1.
Записываются символы металла и гидроксогруппы
(-ОН).
2.
Указывается заряд металла.
3.
Записывается индекс для гидроксогруппы. Если
заряд металла больше 1, гидроксогруппу заключают в скобки. Индекс указывается
за скобками.
ПРИМЕР:
Гидроксид
алюминия гидроксид меди (II)
1. Al OH
1.
Cu
OH
2. 3+
2.
2+
Al OH
Cu OH
3. Al
(OH)3
3. Cu
(OH)2
Схема образования гидроксида натрия:
Na+ + H-O-H > NaOH + H+;
Уравнение реакции: 2Na + 2HOH = 2NaOH + H2
OH– – гидроксид-ион является сложным ионом.
Название основания = Гидроксид + Название металла в родительном падеже + С.О. римскими цифрами
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II)
Fe(OH)3 – гидроксид железа (III)
Дай название веществам: Ba(OH)2, KOH , Al(OH)3, Zn(HO)2. Воспользуйся тренажером. (Оценка за тренажер не входит в итоговую оценку. Нажми на ссылку ответь на вопросы и закрой страницу с тестами.)
Порядок составления формул оснований
При
составлении формулы конкретного основания, необходимо в таблице
растворимости найти ион металла, для которого составляем формулу, и в
соответствии с зарядом этого иона металла составить, формулу основания:
-
Если заряд иона металла “+”, то с ионом металла связанна только одна гидроксогруппа OH–, например гидроксид натрия Na+OH;
-
Если “2+”, то две Ca2+(OH)2.
![]() Вопрос:
Вопрос:
Заряд иона алюминия “3+” (Al3+) сколько гирдроксогупп связанно с алюминием в гидроксиде алюминия?
![]() Запомни:
Запомни:
Оксиду металла соответствует основание: Ca > CaO > Ca(OH)2. Такие оксиды называют основные оксиды. СаО – основный оксид.
Составим основания из оксидов: Na2O , FeO , Fe2O3
|
Na+2O > Na+OH– |
Fe2+O > Fe+2(OH)2 |
Fe23+O3 > Fe3+(OH)3 |
|
|
|
|
Составь:
-
Основания из оксидов: ZnO , Li2O , MgO
-
Оксиды из оснований: CuOH , Cu(OH)2
* * *
.
Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
“Оксид” |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: “оксид углерода два”);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:
 ,
,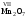
Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:
 ,
, ,
, ,
,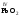 ,
,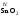 и др. Оксиды металлов свалентностью
и др. Оксиды металлов свалентностью
V,
VI,
VII
.являются
кислотными:
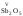 ,
, ,
, и
и
др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.

Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #