Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.

Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
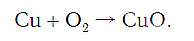
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
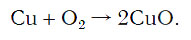
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
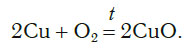
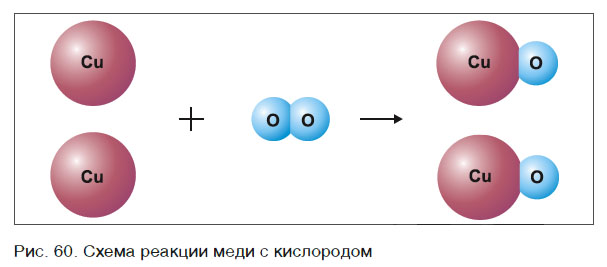
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
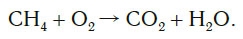
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
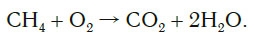
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
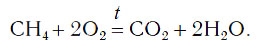
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
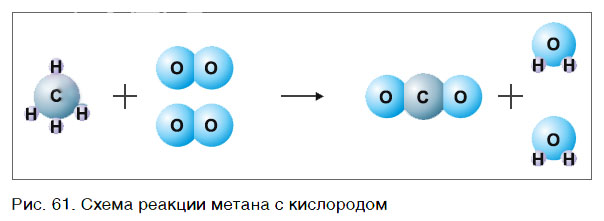
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Как составить уравнение химической реакции: пошаговая инструкция

Превращение одних веществ в другие — обычное явление, которое происходит в ходе химических реакций. Для того чтобы обозначить, как протекают такие процессы, используют специальную систему уравнений. Так, например, горение метана (мы можем наблюдать его каждый день, когда зажигаем газовую плиту) протекает по следующей схеме:
СН4 + 2О2 → СО2 + Н2О
Расшифровать уравнение реакции можно следующим образом. Две молекулы кислорода соединяются с молекулой метана и в результате формируют две молекулы воды и молекулу углекислого газа. Можно отметить, что во время протекания реакции связи между некоторыми атомами (например, водорода и углерода) разрываются. Вместо них появляются новые, благодаря которым и формируются углекислород и вода.
Особенности записи формул химических реакций

Уравнения химических реакций: способы решения заданий
Для удобства записи уравнения химических реакций делают предельно схематичными: их записывают только при помощи латинских букв и цифр. В левой части уравнения указываются реагенты (те вещества, которые взаимодействуют между собой), а в правой — так называемые продукты реакции (те вещества, которые формируются после завершения процесса). При записи уравнения важно помнить о двух правилах.
- Атомы не исчезают никуда и не появляются из ниоткуда (соответственно, их число в обоих частях формулы должно быть одинаковым).
- Общая масса реагентов не может отличаться от итоговой массы продуктов реакции (именно по этой причине записи протекания реакций называют уравнениями).
Какими бывают химические реакции
Выделяют четыре варианта взаимодействия химических веществ друг с другом.
| Тип реакции | Пример | Особенности |
| Соединения | Формула образования воды:
2H2 + O2 = 2H2O |
Несколько реагентов (простых или сложных веществ) создают один продукт. |
| Разложения | При нагревании известняка он разделяется на углекислый газ и негашеную известь:
Стрелка, направленная вверх, показывает, что сформировавшийся газ улетучился и больше не участвует в процессе. |
Одно вещество распадается на несколько простых компонентов. |
| Замещения | При образовании хлорида цинка атомы цинка встают на место атомов водорода, который включен в состав хлороводорода:
Zn + 2HCl = H2↓ + ZnCl2 Направленная вниз стрелка показывает, что вещество осталось в осадке. |
В таких реакциях обязательно участвуют простое и сложное вещества. При более активные атомы простого вещества вытесняют (замещают) компоненты сложного. |
| Обмена | CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl | В таких реакциях обязательно участвуют два сложных вещества, которые обмениваются атомами. Важно помнить: в уравнениях обмена обязательно формируются газ, осадок или вода. |
Как расставить коэффициенты в химических уравнениях
Чтобы уравнение реакции было верным, крайне важно правильно расставить в нем коэффициенты. С помощью этих цифр указывается, какое число молекул необходимо для протекания реакции. Внешне коэффициент выглядит как число, поставленное перед формулой вещества (например, 2NaCl). Важно не перепутать их с индексами: последние как раз ставятся под символом химического элемента и указывают на количество атомов (например, H2).
Если вам требуется узнать, сколько атомов конкретного вещества участвует в реакции, следует индекс умножит на коэффициент. Например, при использовании двух молекул воды (2H₂O) речь идет о четырех атомах водорода и двух атомах кислорода. При решении уравнения реакции задача ученика — подобрать коэффициент и узнать, сколько молекул участвует в процессе.
Помочь разобраться в этом нелегком деле могут наши репетиторы по химии в Москве. Ведь, согласитесь, поспеть за школьной программой порой непросто и некоторые темы требуют более детального изучения, чем отведенные несколько школьных уроков.
Как составить уравнение химической реакции: пошаговая инструкция
- Подготовьте схему реакции. Для этого потребуется выделить реагенты и продукты реакции. Например, для формирования оксида магния схема будет выглядеть так: Mg + O2 → MgO.
- Расставьте коэффициенты. Из предыдущего примера видно, что в левой части уравнения представлено два атома кислорода, а в правой — только один. Поэтому в продукте реакции нужно увеличить количество молекул: Mg + O2 → 2MgO. Теперь у нас есть равное количество атомов кислорода, а вот с магнием возникла проблема. Уравняем и его число: 2Mg + O2 = 2MgO. Обратите внимание, что знак равно можно ставить только после того, как уравнение решено, до этого используется символ горизонтальной стрелки.

Уравнения химических реакций: способы решения заданий
В качестве завершающего примера предложим реакцию разложения нитрата калия. Он образует два вещества: кислород и нитрит калия. Схема реакции выглядит следующим образом: KNO₃ → KNO₂ + О₂. Если с атомами азота и калия все в порядке, то кислорода до момента начала реакции было три, а вот по завершении разложения стало уже четыре. Чтобы уравнять части поставим перед реагентом удвоенный коэффициент: 2KNO₃ → KNO₂ + О₂.
Теперь нужно разобраться с цифрами. До реакции мы имеем по два атома азота и калия и шест атомов кислорода. После же разложения атомов азота и калия по одному, а атомов кислорода всего четыре. Чтобы создать равенство, потребуется поставить удвоенный коэффициент перед нитритом калия в продуктах реакции: 2KNO₃ = 2KNO₂ + О₂. В итоге мы получили равное количество атомов в обеих частях: по два калия и азота и шесть кислорода. Важность уравнений состоит в том, что они не только дают определить, какие вещества получатся в ходе протекания реакции, но и позволяют понять количественное соотношение используемых реагентов.
Как составить химическое уравнение: правила, примеры. Запись химической реакции
Поговорим о том, как составить химическое уравнение, ведь именно они являются основными элементами данной дисциплины. Благодаря глубокому осознанию всех закономерностей взаимодействий химических процессов и веществ, можно управлять ими, применять их в различных сферах деятельности.

Теоретические особенности
Составление химических уравнений – важный и ответственный этап, рассматриваемый в восьмом классе общеобразовательных школ. Что должно предшествовать данному этапу? Прежде чем педагог расскажет своим воспитанникам о том, как составить химическое уравнение, важно познакомить школьников с термином «валентность», научить их определять данную величину у металлов и неметаллов, пользуясь таблицей элементов Менделеева.

Составление бинарных формул по валентности
Для того чтобы понять, как составить химическое уравнение по валентности, для начала нужно научиться составлять формулы соединений, состоящих из двух элементов, пользуясь валентностью. Предлагаем алгоритм, который поможет справиться с поставленной задачей. Например, необходимо составить формулу оксида натрия.
Сначала важно учесть, что тот химический элемент, который в названии упоминается последним, в формуле должен располагаться на первом месте. В нашем случае первым будет записываться в формуле натрий, вторым кислород. Напомним, что оксидами называют бинарные соединения, в которых последним (вторым) элементом обязательно должен быть кислород со степенью окисления -2 (валентностью 2). Далее по таблице Менделеева необходимо определить валентности каждого из двух элементов. Для этого используем определенные правила.
Так как натрий – металл, который располагается в главной подгруппе 1 группы, его валентность является неизменной величиной, она равна I.
Кислород – это неметалл, поскольку в оксиде он стоит последним, для определения его валентности мы из восьми (число групп) вычитаем 6 (группу, в которой находится кислород), получаем, что валентность кислорода равна II.
Между определенными валентностями находим наименьшее общее кратное, затем делим его на валентность каждого из элементов, получаем их индексы. Записываем готовую формулу Na2O.
Инструкция по составлению уравнения
А теперь подробнее поговорим о том, как составить химическое уравнение. Сначала рассмотрим теоретические моменты, затем перейдем к конкретным примерам. Итак, составление химических уравнений предполагает определенный порядок действий.
- 1-й этап. Прочитав предложенное задание, необходимо определить, какие именно химические вещества должны присутствовать в левой части уравнения. Между исходными компонентами ставится знак «+».
- 2-й этап. После знака равенства необходимо составить формулу продукта реакции. При выполнении подобных действий потребуется алгоритм составления формул бинарных соединений, рассмотренный нами выше.
- 3-й этап. Проверяем количество атомов каждого элемента до и после химического взаимодействия, в случае необходимости ставим дополнительные коэффициенты перед формулами.

Пример реакции горения
Попробуем разобраться в том, как составить химическое уравнение горения магния, пользуясь алгоритмом. В левой части уравнения записываем через сумму магний и кислород. Не забываем о том, что кислород является двухатомной молекулой, поэтому у него необходимо поставить индекс 2. После знака равенства составляем формулу получаемого после реакции продукта. Им будет оксид магния, в котором первым записан магний, а вторым в формуле поставим кислород. Далее по таблице химических элементов определяем валентности. Магний, находящийся во 2 группе (главной подгруппе), имеет постоянную валентность II, у кислорода путем вычитания 8 – 6 также получаем валентность II.
Запись процесса будет иметь вид: Mg+O2=MgO.
Для того чтобы уравнение соответствовало закону сохранения массы веществ, необходимо расставить коэффициенты. Сначала проверяем количество кислорода до реакции, после завершения процесса. Так как было 2 атома кислорода, а образовался всего один, в правой части перед формулой оксида магния необходимо добавить коэффициент 2. Далее считаем число атомов магния до и после процесса. В результате взаимодействия получилось 2 магния, следовательно, в левой части перед простым веществом магнием также необходим коэффициент 2.
Итоговый вид реакции: 2Mg+O2=2MgO.
Пример реакции замещения
Любой конспект по химии содержит описание разных видов взаимодействий.
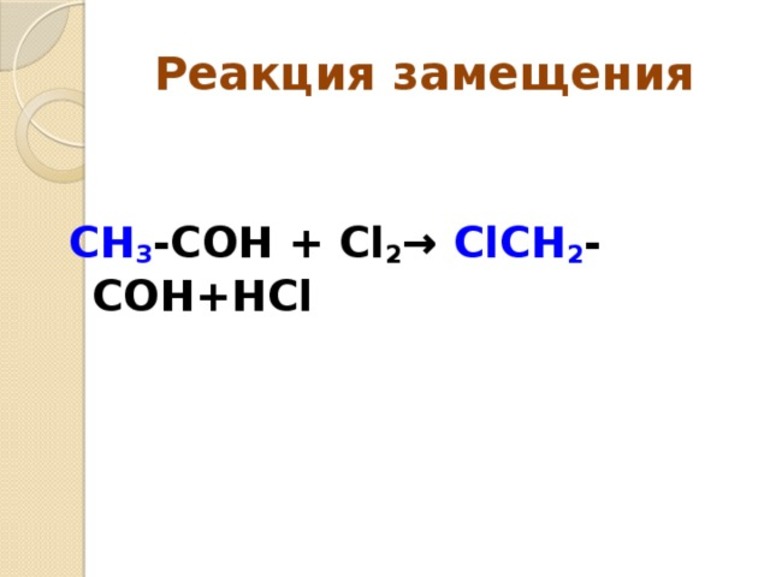
В отличие от соединения, в замещении и в левой, и в правой части уравнения будет два вещества. Допустим, необходимо написать реакцию взаимодействия между цинком и раствором соляной кислоты. Алгоритм написания используем стандартный. Сначала в левой части через сумму пишем цинк и соляную кислоту, в правой части составляем формулы получаемых продуктов реакции. Так как в электрохимическом ряду напряжений металлов цинк располагается до водорода, в данном процессе он вытесняет из кислоты молекулярный водород, образует хлорид цинка. В результате получаем следующую запись: Zn+HCL=ZnCl2+H2.
Теперь переходим к уравниванию количества атомов каждого элемента. Так как в левой части хлора был один атом, а после взаимодействия их стало два, перед формулой соляной кислоты необходимо поставить коэффициент 2.
В итоге получаем готовое уравнение реакции, соответствующее закону сохранения массы веществ: Zn+2HCL=ZnCl2+H2.

Заключение
Типичный конспект по химии обязательно содержит несколько химических превращений. Ни один раздел этой науки не ограничивается простым словесным описанием превращений, процессов растворения, выпаривания, обязательно все подтверждается уравнениями. Специфика химии заключается в том, что с все процессы, которые происходят между разными неорганическими либо органическими веществами, можно описать с помощью химических символов, знаков, коэффициентов, индексов.
Чем еще отличается от других наук химия? Химические уравнения помогают не только описывать происходящие превращения, но и проводить по ним количественные вычисления, благодаря которым можно осуществлять лабораторное и промышленное получение разных веществ.
[spoiler title=”источники:”]
http://egevpare.ru/%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D1%85-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B9-%D1%81%D0%BF%D0%BE%D1%81%D0%BE%D0%B1/
http://fb.ru/article/276850/kak-sostavit-himicheskoe-uravnenie-pravila-primeryi-zapis-himicheskoy-reaktsii
[/spoiler]
Реакция замещения в химии — как определить, признаки, примеры уравнений
Перераспределение электронов и ядер, при котором образуется новое вещество, называется химической реакцией. Это физико-химическое взаимодействие, приводящее к образованию нового соединения. Если атомы простого реагента занимают места химических элементов в сложном, то этот процесс называют реакцией замещения. При этом может образовываться не одно, а сразу два вещества.

Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.

Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:

- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).

Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
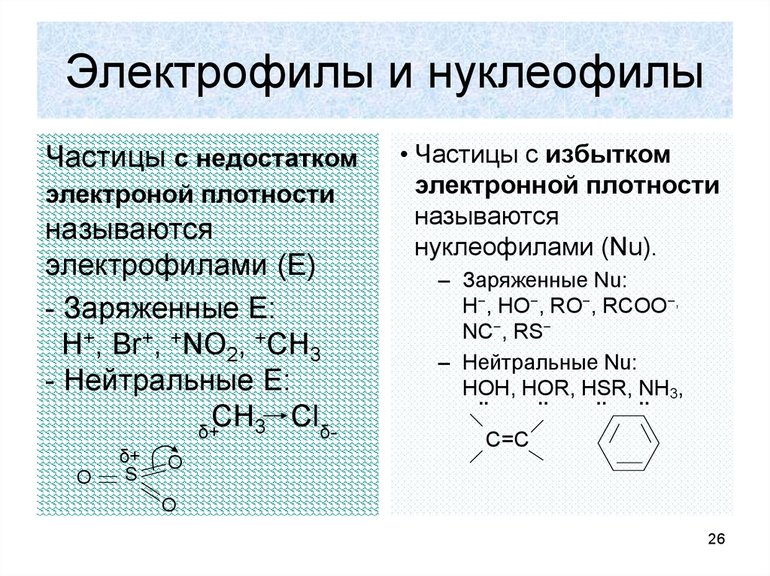
Электрофильные и нуклеофильные

Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).

Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.

К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:

- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Реакции замещения
Тип урока. Приобретение новых знаний.
Вид урока. Лабораторная работа.
Обучающие – рассмотреть новый тип реакций – реакции замещения; научить учащихся писать уравнения реакций замещения; формировать умение предсказывать продукты реакций замещения; дать первоначальные понятия об электрохимическом ряде напряжений металлов.
Развивающие – развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; продолжить формирование умений оформлять результаты учебного эксперимента; развивать способность к адекватному само- и взаимоконтролю.
Воспитательные – продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в парах «ученик–ученик», «учитель–ученик», а также наблюдательность, внимание, пытливость, инициативу.
Методы и методические приемы. Лабораторная работа; фронтальный опрос; самостоятельная работа с карточками, взаимопроверка результатов самостоятельной работы в парах, выставление отметок; работа с наглядными средствами – периодической системой химических элементов Д.И.Менделеева и карточками.
Оборудование и реактивы. Кодоскоп, карточки с заданиями для самостоятельной работы по теме «Реакции разложения и соединения», карточки с таблицей «Классификация реакций на основании количества и состава реагирующих веществ», лабораторный штатив с пробирками, кристаллизатор, прибор для получения водорода, лучинка, спички; цинк и магний в гранулах, железный гвоздь, медная проволока, растворы – соляной кислоты, хлорида меди(II), хлорида железа(II).
Учитель. Думаю, что урок вам понравится, вы узнаете много нового. Сегодня вы не соскучитесь, потому что сами будете проводить опыты. Но для начала проверим материал прошлого урока.
 Актуализация знаний
Актуализация знаний
Проводится фронтальный опрос, во время которого трое учащихся записывают на доске решение домашних упражнений (Габриелян О.С. «Химия-8», М.: изд-во «Дрофа», 2002, упр. 1а, б; 2г; с. 100.)
Учитель. На прошлом уроке* вы познакомились с классификацией химических реакций. По каким признакам классифицируют реакции?
Ученик. Реакции классифицируют по количеству вступивших и образовавшихся веществ и по их составу.
Учитель. С реакциями каких типов вы познакомились?
Ученик. С реакциями разложения и соединения.
Учитель. Дайте определение реакции разложения.
Ученик. Реакцией разложения называется реакция, в результате которой из одного сложного вещества образуется несколько простых или сложных веществ.
Учитель. Какая реакция называется реакцией соединения?
Ученик. Реакцией соединения называется реакция, в результате которой из двух или более простых или сложных веществ образуется одно сложное вещество.
Учитель. Для чего в схемах химических реакций расставляют коэффициенты?
Ученик. Для того, чтобы соблюдался закон сохранения массы веществ.
Учитель проверяет домашние упражнения, выполненные на доске, ученики задают дополнительные вопросы отвечающим, выставляются оценки.
Задание 1а, б, с. 100. Запишите в виде химических уравнений следующие предложения:
а) при обжиге карбоната кальция образуются оксид кальция и оксид углерода(IV);
б) при взаимодействии оксида фосфора(V) с водой образуется фосфорная кислота.
Укажите типы этих реакций. Какая из них экзотермическая, а какая – эндотермическая?
Первая – реакция разложения, эндотермическая:
СаСО3  СаО + СО2.
СаО + СО2.
Вторая – реакция соединения, экзотермическая:
Задание 2г, с. 100. Составьте уравнение по следующей схеме и укажите тип реакции:
СuОН  Сu2О + Н2О.
Сu2О + Н2О.
Под формулами веществ напишите их названия.
Тип реакции – разложение:

Учитель. Следующий этап урока – самостоятельная работа на два варианта.
Самостоятельная работа (8–10 мин)
Задание. Расставьте коэффициенты, укажите типы химических реакций.
1) MgO + CO2  MgCO3;
MgCO3;
2) NO2 + O2 + H2O  HNO3;
HNO3;
3) Na2O + H2O  NaOH;
NaOH;
4) KClO3  KCl + O2;
KCl + O2;
5) CO + O2  CO2.
CO2.
1) KNO3  KNO2 + O2;
KNO2 + O2;
2) SO2 + O2  SO3;
SO3;
3) SO3 + H2O  H2SO4;
H2SO4;
4) K2O + H2O  KOH;
KOH;
5) NO + O2  NO2.
NO2.
Максимально можно набрать 10 баллов (по 1 баллу за правильно указанный тип химической реакции и по 1 баллу за правильно расставленные коэффициенты).
На «5» – 10–9 баллов,
на «4» – 8–7 баллов,
на «3» – 6–5 баллов.
После выполнения заданий учащиеся, сидящие за одной партой, обмениваются работами. Ученики взаимно проверяют работы с помощью кодоскопа, им выставляют отметки по вышеуказанным критериям.
Учитель. Сейчас вы познакомитесь еще с одним типом химических реакций – реакциями замещения, научитесь записывать уравнения этих реакций, предсказывать, какие вещества должны образоваться, потренируетесь в расстановке коэффициентов.
 Изучение нового материала
Изучение нового материала
Учитель. Какие ассоциации вызывает у вас название «реакция замещения»?
Выслушать все мнения, выбрать предположение о том, что одно должно замещаться другим.
Учитель. Каким по составу – простым или сложным – должно быть вещество, которое замещает элемент сложного вещества?
Ученик. Простым.
Учитель. Каким должен быть состав вещества, в котором происходит замещение?
Ученик. Это вещество должно быть сложным, чтобы атомы одного элемента могли замещаться, а атомы других элементов остались.
Учитель. Обозначим простое вещество буквой А, а сложное вещество – двумя буквами – ВС. Как в этом случае записать общую схему реакции замещения?
Ученик у доски записывает общую схему реакции замещения, учащиеся на местах делают записи в таблицу (табл. 1), которую начали заполнять на прошлом уроке.
| Тип реакции | Уравнения реакций в общем виде |
|---|---|
| Реакция соединения | Соединение двух (нескольких) простых веществ в одно сложное вещество: А + В = АВ. Соединение двух бинарных веществ в одно трехэлементное сложное вещество: АВ + СВ = АСВ2 |
| Реакция разложения | Разложение сложного вещества на два (несколько) простых вещества: АВ = А + В. Разложение трехэлементного сложного вещества на два бинарных вещества: АСВ2 = АВ + ВС |
| Реакция замещения | Взаимодействие простого вещества со сложным, в результате которого образуются другие – простое и сложное – вещества: А + ВС = В + АС |
Учитель. Реакцией замещения называется реакция, в которой участвуют одно простое и одно сложное вещество, при этом атомы простого вещества замещают один из видов атомов в сложном веществе и образуются новые вещества – простое и сложное (запись определения в тетрадь).
Рассмотрим на практике реакции замещения. Для этого проведем лабораторную работу. (Учащиеся получают карточки с таблицей (табл. 2) для составления отчета по лабораторной работе «Реакции замещения»). В карточке заполнена графа, дающая представление о том, что нужно сделать. Две другие графы вы заполните после выполнения опытов.
Прежде чем приступить к выполнению опытов, вспомните, что работать с растворами кислот нужно осторожно, т. к. они опасны. С растворами работайте по принципу «не разлей», с твердыми веществами – по принципу «не рассыпь». Опыт проводить над кристаллизатором. Вещества наливать и насыпать в небольших количествах.
Приступаем к выполнению опыта № 1.
Лабораторная работа «Реакции замещения»
| № опыта | Ход работы (что нужно сделать) |
Наблюдения (что увидели) |
Уравнения химических реакций, выводы |
|---|---|---|---|
| 1 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу цинка | Выделяются пузырьки газа | Произошла химическая реакция: Zn + 2HCl = ZnCl2 + H2  . Это реакция замещения, цинк вытеснил водород из соляной кислоты . Это реакция замещения, цинк вытеснил водород из соляной кислоты |
| 2 | Налейте в пробирку раствор соляной кислоты, затем добавьте гранулу магния | Выделяются пузырьки газа | Произошла химическая реакция: Mg + 2HCl = MgCl2 + H2  . Это реакция замещения, магний вытеснил водород из соляной кислоты . Это реакция замещения, магний вытеснил водород из соляной кислоты |
| 3 | Налейте в пробирку раствор хлорида меди(II), опустите в раствор железный гвоздь | Гвоздь покрывается красным налетом | Произошла химическая реакция: Fe + CuCl2 = FeCl2 + Cu. Это реакция замещения, железо вытеснило медь из раствора соли |
| 4 | Налейте в пробирку раствор хлорида железа(II) и опустите в раствор медную проволоку | Никаких изменений не происходит | Эта реакция невозможна: FeCl2 + Cu  .Менее активная медь не может вытеснить более активное железо из раствора соли .Менее активная медь не может вытеснить более активное железо из раствора соли |
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, поскольку выделился газ.
Учитель. Чтобы составить уравнение химической реакции, надо предположить, какие вещества образовались в результате этой реакции. (Учитель у доски объясняет принцип составления уравнений реакций такого типа и предлагает учащимся самостоятельно расставить коэффициенты.)
Из уравнения реакции видно, что получился газ водород. Открою вам маленький секрет: вы сейчас прошли тем же путем, который проделал английский химик Генри Кавендиш. Именно он предложил такой способ получения водорода в лаборатории.
Но водород еще нужно собрать. Догадайтесь, как собрать водород в другую пробирку.

Правило при работе с кислотами:
«Не разлей!» Фото Л.Ларионовой
Ученик. Нужно закрыть пробирку пробкой с газоотводной трубкой, конец которой опустить в другую пробирку.
Учитель. Что находится в пустой пробирке?
Ученик. Воздух.
Учитель. Найдите относительную молекулярную массу водорода и скажите, что легче – водород или воздух?
Ученик. Легче водород, потому что его относительная молекулярная масса Mr(H2) равна двум.
Учитель. В этом случае пробирку, в которую собирают водород, необходимо перевернуть вверх дном. Такой способ собирания газов называется способом вытеснения воздуха.
Учитель проводит демонстрационный опыт. после этого учащиеся приступают к самостоятельному выполнению опыта № 2.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Можем ли мы сказать, что произошла химическая реакция?
Ученик. Да, т.к. выделился газ.
Учитель. Предположите, какой газ выделился в результате этой химической реакции.
Ученик. В результате замещения атомов водорода в соляной кислоте на атомы магния выделился водород.
Учитель. Составьте уравнение этой химической реакции и расставьте в нем коэффициенты. Сравните скорости взаимодействия магния и цинка с соляной кислотой.
Оказывается, скорость взаимодействия металла с кислотой зависит от активности металла. Все металлы в зависимости от своей активности расположены в ряд. Этот ряд называется электрохимическим рядом напряжений металлов. Посмотрите, какой неметалл занесен в этот ряд.
Ученик. Неметалл в ряду металлов – водород.
Учитель. Металлы, стоящие в электрохимическом ряду напряжений до водорода, способны вытеснять его из растворов кислот. Будет ли медь вытеснять водород из раствора соляной кислоты?
Ученик. Нет, такая реакция невозможна, т.к. медь находится в электрохимическом ряду напряжений металлов за водородом.
Учитель демонстрирует опыты, подтверждающие выдвинутую гипотезу, и делает вывод, что электрохимический ряд напряжений металлов позволяет не только предсказывать продукты реакции, но и определять возможность протекания той или иной реакции.
Учащиеся выполняют опыты № 3 и 4.
Фронтальная беседа
(обсуждение результатов опыта)
Учитель. Что вы наблюдали при проведении этих опытов?
Ученик. В первой реакции гвоздь покрылся красным налетом меди, а во второй никаких изменений не произошло.
Учитель. Почему невозможна вторая реакция?
Ученик. Медь в электрохимическом ряду напряжений металлов находится правее железа, значит, она менее активна и не может его вытеснить.
Учитель. Запишите уравнения взаимодействия железа с хлоридом меди(II). (Результаты работы проверяются с помощью кодоскопа.)
 Закрепление изученного материала
Закрепление изученного материала
Учитель. Итак, сегодня вы познакомились еще с одним типом химических реакций – реакциями замещения. Узнали, что продукты реакций замещения можно предсказывать, используя электрохимический ряд напряжений металлов. Теперь для закрепления полученных знаний выполните упражнения.
На доске предложены схемы реакций замещения. Укажите, какие из этих реакций можно осуществить, а какие – нет. Дайте развернутый ответ. (Спрашивать по одному ученику на составление каждого уравнения реакции.)
Задание. Расставьте коэффициенты в схемах возможных химических реакций.
Аg + Н2SO4 (р-р)  . ,
. ,
Fe + НСl  . ,
. ,
АgNO3 + Сu  . ,
. ,
СuO + H2  . ,
. ,
Al + FeSO4  . ,
. ,
Fe(NO3)3 + Hg  . ,
. ,
Аl + Н2SO4 (р-р)  . .
. .
Ответ. Уравнения возможных реакций:
Заключительная часть. Учитель подводит итоги урока, анализирует полученные результаты.
Домашнее задание. По учебнику О.С.Габриеляна «Химия-8» § 27, упр. 2а, 3в, с. 100.
* См. № 7/2006, «Реакции разложения и соединения»
Литература
Габриелян О.С. Химия. 8 класс. М.: Дрофа, 2002, 208 с.; Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. 8 класс. М.: Дрофа, 2002, 416 с.; Габриелян О.С., Смирнова Т.В. Изучаем химию в 8 классе. Методическое пособие к учебнику О.С.Габриеляна «Химия-8» для учащихся и учителей. М.: Блик и Ко, 2001, 224 с.; Кузнецова Н.Е., Титова И.М.,
Гара Н.Н., Жегин А.Ю. Химия. 8 класс. М: Вентана-Граф, 2003, 224 с.; Гин А. Приемы педагогической техники. Пособие для учителя. М.: Вита-Пресс, 2003, 88 с.
Реакция замещения в химии — как определить, признаки, примеры уравнений
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.

Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).

Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
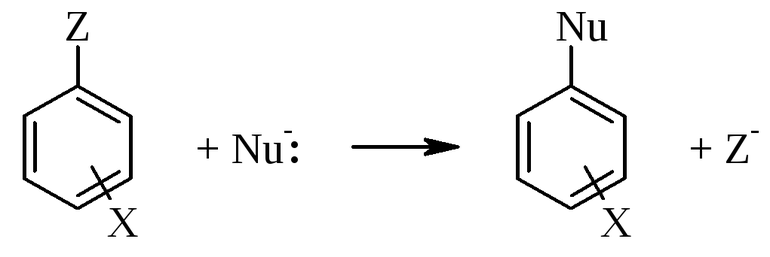
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.

К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
источники:
http://him.1sept.ru/article.php?ID=200601011
http://nauka.club/khimiya/reaktsiy-zameshcheniya.html
Содержание
- Как составлять уравнения химических реакций замещения
- Виды химических реакций
- Коэффициенты в уравнениях химических реакций
- Алгоритм составления уравнений химических реакций
- Реакция замещения в химии — как определить, признаки, примеры уравнений
- Общие сведения
- Механизмы взаимодействия
- Электрофильные и нуклеофильные
- Радикальные реакции
- Типичное замещение
- Примеры и онлайн-решения
Как составлять уравнения химических реакций замещения
Когда химические вещества вступают во взаимодействие, химические связи между их атомами разрушаются и образуются новые, уже в других сочетаниях. В результате одни вещества превращаются в другие.
Рассмотрим реакцию горения метана, происходящую в конфорке газовой плиты:
.jpg)
Молекула метана (CH₄) и две молекулы кислорода (2O₂) вступают в реакцию, образуя молекулу углекислого газа (CO₂) и две молекулы воды (2H₂O). Связи между атомами углерода (С) и водорода (H) в метане, а также между атомами кислорода (O) разрываются, и образуются новые связи между атомами углерода и кислорода в молекуле углекислого газа (CO₂) и между атомами водорода и кислорода в молекуле воды (H₂O).
Картинка даёт наглядное представление о том, что произошло в ходе реакции. Но зарисовывать сложные химические процессы такими схемами неудобно. Вместо этого учёные используют уравнения химических реакций.
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Виды химических реакций
Вещества вступают в реакции по-разному, можно выделить четыре наиболее частых варианта:
.jpg)
- Соединение. Два или несколько реагентов образуют один продукт. В реакцию могут вступать как простые вещества, так и сложные. Например, простые вещества водород и кислород взаимодействуют и образуют сложное — воду:
.jpg)
Сложное вещество негашёная известь соединяется с водой, и образуется новое сложное вещество — гашёная известь:
.jpg)
- Разложение. Обратный процесс: одно вещество распадается на несколько более простых. Например, если нагреть известняк, получаются негашёная известь и углекислый газ:

Стрелка вверх означает, что образовался газ. Он улетучивается и больше не участвует в реакции.
- Замещение. В реакции участвуют два вещества — простое и сложное. Если атомы химического элемента в простом веществе более активны, они замещают атомы одного из менее активных химических элементов в составе сложного вещества.
В примере атомы цинка замещают атомы водорода в составе хлороводорода, и образуется хлорид цинка:

- Обмен. Два сложных вещества обмениваются составными частями, в результате получаются два новых сложных вещества. В такой реакции обязательно образуется вода, газ или осадок.
.jpg)
Стрелка вниз означает, что вещество выпало в осадок, поскольку оно нерастворимо.
Коэффициенты в уравнениях химических реакций
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под символом химического элемента, например, О₂). Индекс обозначает количество атомов этого элемента в молекуле (формульной единице).
.jpg)
Чтобы узнать общее число атомов элемента в формуле, нужно умножить его индекс на коэффициент вещества. В примере на картинке (2H₂O) — четыре атома водорода и два кислорода.
Подобрать коэффициент — значит определить, сколько молекул данного вещества должно участвовать в реакции, чтобы она произошла. Далее мы расскажем, как это сделать.
Алгоритм составления уравнений химических реакций
Для начала составим схему химической реакции. Например, образование оксида магния (MgO) в процессе горения магния (Mg) в кислороде (O₂). Обозначим реагенты и продукт реакции:
.jpg)
Чтобы схема стала уравнением, нужно расставить коэффициенты. В левой части схемы два атома кислорода, а в правой — один. Уравняем их, увеличив число молекул продукта:
.jpg)
Теперь число атомов кислорода до и после реакции одинаковое, а число атомов магния — нет. Чтобы уравнять их, добавим ещё одну молекулу магния. Когда количество атомов каждого из химических элементов в составе веществ уравнено, вместо стрелки можно ставить равно:
.jpg)
Уравнение химической реакции составлено.
Рассмотрим реакцию разложения. Нитрат калия (KNO₃) разлагается на нитрит калия (KNO₂) и кислород (О₂):
.jpg)
В обеих частях схемы по одному атому калия и азота, а атомов кислорода до реакции 3, а после — 4. Необходимо их уравнять.
Для начала удвоим коэффициент перед реагентом:
.jpg)
Теперь в левой части схемы шесть атомов кислорода, два атома калия и два атома азота. В левой по-прежнему по одному атому калия и азота и четыре атома кислорода. Чтобы уравнять их, в правой части схемы нужно удвоить коэффициент перед нитритом калия.
.jpg)
Снова посчитаем число атомов каждого химического элемента в составе веществ до и после реакции: два атома калия, два атома азота и шесть атомов кислорода. Равенство достигнуто.
Химические уравнения не только позволяют предсказать, что произойдёт при взаимодействии тех или иных веществ, но и помогают рассчитать их количественное соотношение, необходимое для реакции.
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.

У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

 Попробовать бесплатно
Попробовать бесплатно
Источник
Реакция замещения в химии — как определить, признаки, примеры уравнений

Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.

Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:

- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).

Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
Электрофильные и нуклеофильные

Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
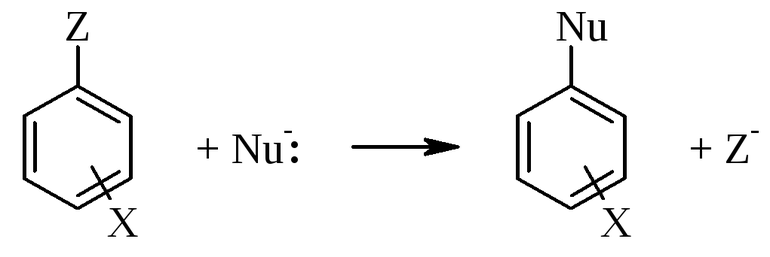
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.

К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:

- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Источник
Содержание:
Типы химических реакций: присоединения, разложения, обмена и замещения:
Химические реакции подразделяются на несколько типов в зависимости от вступающих в реакцию исходных веществ (реагентов), количества образующихся продуктов реакции и выделения или поглощения энергии.
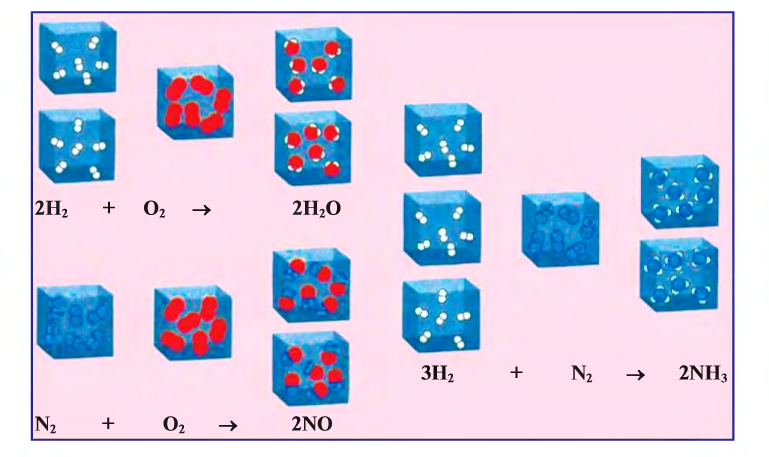
Рис. 17. Образование различных веществ (реакции присоединения)
По количеству образующихся и вступающих в реакцию компонентов их можно разделить на следующие типы:
Реакции присоединения
1. В реакциях присоединения (рис. 17) из одного или нескольких исходных веществ получается одно новое вещество: А + В + … = С:
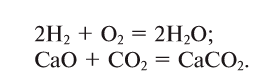
Реакции разложения
2. В реакциях разложения из одного вещества образуется несколько новых веществ: С = А + В …:
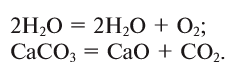
Реакции замещения
3. В реакциях замещения простое вещество, вступая в реакцию со сложным веществом, занимает место в составе сложного вещества, в результате образуются новое простое и сложное вещества: АВ + С = АС + В:
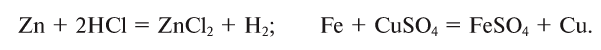
Реакции обмена
4. В реакциях обмена составные части сложных веществ взаимообмениваются: АВ + CD = AD + ВС:
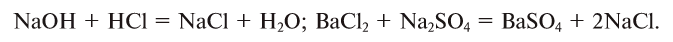
В процессе протекания химических реакций может выделяться или поглощаться тепло.
Энергия, выделяющаяся в процессе химической реакции, называется химической энергией.
Химическая энергия может быть превращена в тепловую, световую, механическую и электрическую энергию.
В большинстве случаев химическая энергия превращается в тепловую энергию и наоборот.

Рис. 18. Экзотермические реакции
Количество выделяемой или поглощаемой во время химической реакции энергии называется тепловым эффектом (Q).
Тепловой эффект наблюдается в результате разрыва или возникновения химической связи и количественно выражается в килоджоулях (кДж).
Реакции, сопровождающиеся выделением тепла (энергии), называются экзотермическими (ekzo — наружу) (см. рис. 18). В этих реакциях тепловой эффект изображается знаком «+» (плюс).
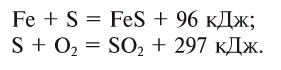
Реакции, сопровождающиеся поглощением тепла (энергии), называются эндотермическими (endo — внутрь). В таких реакциях тепловой эффект обозначается знаком «—» (минус):
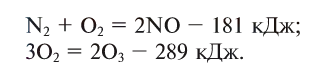
Расчет относительной молекулярной массы и количества вещества
Для определения относительной молекулярной массы вещества  необходимо сложить величины относительных атомных масс, входящих в состав молекулы элементов.
необходимо сложить величины относительных атомных масс, входящих в состав молекулы элементов.
Например, 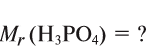
Зная относительную атомную массу водорода, фосфора и кислорода, вычисляем относительную молекулярную массу 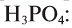
1. Определите относительную молекулярную массу следующих веществ:

Расчет массовой доли элементов в сложных веществах
Массовые доли (содержание) элементов в составе вещества выражаются в процентах (%).
Найдем процент содержания (со) углерода и кислорода в углекислом газе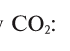
Расчет:
1. Вычисляем относительную молекулярную массу 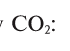
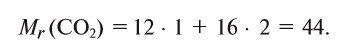
2. Находим массовую долю кислорода в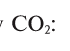
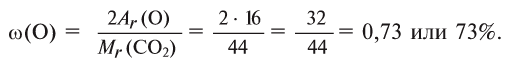
3. Находим массовую долю углерода в 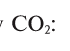
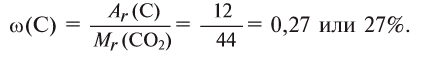
О т в е т: 73% О и 27% С.
1. Определите массовые доли элементов, входящих в состав следующих веществ:
2. Каковы массовые доли (%) S и О в составе оксида серы (IV)?
3. На предприятии «Ферганаазог» производится минеральное удобрение 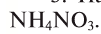 . Сколько процентов азота в этом удобрении?
. Сколько процентов азота в этом удобрении?
4. В каком из этих удобрений процентная доля азота наибольшая: 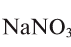 ,
, 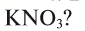
Определение формулы вещества по количественным отношениям входящих в его состав элементов
1. Определите формулу соединения, в состав которого входит 50% серы и 50% кислорода.
Вычисление:
Из условия задания известно, что вещество содержит атомы серы (S) и кислорода (О). Следовательно, формулу вещества можно изобразить как 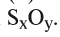 . Для установления соотношения атомов в молекуле вещества и расчета значений х и у необходимо процент содержания каждого элемента разделить на относительную атомную массу входящих в состав вещества атомов:
. Для установления соотношения атомов в молекуле вещества и расчета значений х и у необходимо процент содержания каждого элемента разделить на относительную атомную массу входящих в состав вещества атомов:
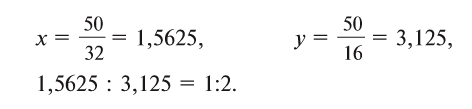
Отсюда формула вещества – 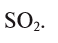
2. Определите формулу соединения, содержащего 2,4% Н, 39,1% S и 58,5% О.
Расчет:
Известно, что в состав вещества входят атомы Н, S и О. Искомая формула вещества будет иметь вид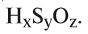 . Для нахождения х, у, z необходимо процент содержания элементов разделить на их атомные массы и найти их численные соотношения:
. Для нахождения х, у, z необходимо процент содержания элементов разделить на их атомные массы и найти их численные соотношения:
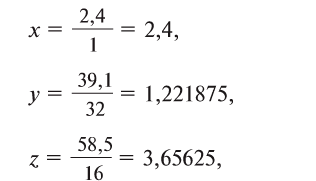
Из этого следует, что формула вещества — 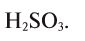
Вычисление эквивалента простых и сложных веществ
Определение эквивалента простых веществ и элементов.
Эквивалент химического элемента (£) — отношение атомной массы 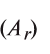 и валентности элемента (V), которое вычисляется по формуле:
и валентности элемента (V), которое вычисляется по формуле:
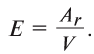
Пользуясь этой формулой, можно легко вычислить эквивалент элемента. Например, Аг алюминия — 27, а его валентность V — 3. Подставляя эти значения в формулу, находим его эквивалент:
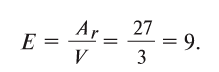
Если элемент обладает переменной валентностью, то меняется и его эквивалент. Например, медь может иметь валентность 1 и 2, при этом в первом случае ее эквивалент будет равен 64, а во втором — 32.
Определение эквивалента оксидов
Чтобы определить эквивалент оксида, необходимо его относительную молекулярную массу  разделить на произведение валентности (V) на число элемента (n), образующего оксид:
разделить на произведение валентности (V) на число элемента (n), образующего оксид:
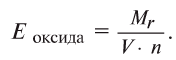
Например, эквивалент оксида меди (СиО) будет равен:
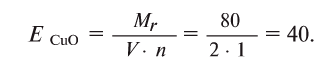
Определение эквивалента оснований
Для определения эквивалента оснований следует относительную молекулярную массу вещества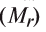 разделить на число (n) гидроксильных групп, имеющихся в составе основания:
разделить на число (n) гидроксильных групп, имеющихся в составе основания:
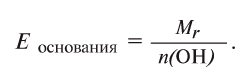
Например, эквивалент гидроксида меди 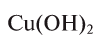 2 будет равен:
2 будет равен:
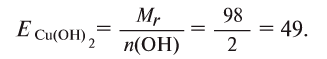
Определение эквивалента кислот
Для определения эквивалента кислот нужно относительную молекулярную массу вещества 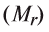 разделить на число (n) водородных атомов, входящих в состав кислоты:
разделить на число (n) водородных атомов, входящих в состав кислоты:
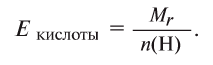
Например, эквивалент 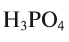 определяется так:
определяется так:
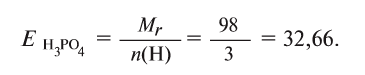
32’66′
Определение эквивалента солей
Для определения эквивалента солей следует относительную молекулярную массу вещества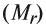 разделить на произведение валентности (V) металла на число атомов металла, входящего в состав соли (n):
разделить на произведение валентности (V) металла на число атомов металла, входящего в состав соли (n):
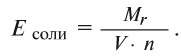
Например, эквивалент хлорида меди (II)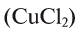 определяется так:
определяется так:
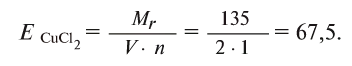
Решение задач на закон эквивалентов
Под эквивалентностью вещества понимают количество участвующего в определенной реакции вещества с 1 г водорода 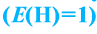 или с 8 г кислорода
или с 8 г кислорода
Вещества вступают в реакции пропорционально их эквивалентам.
При вступлении в реакцию вещества A и вещества В математическое выражение их эквивалентной закономерности будет следующим:
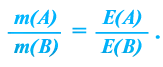
1. В составе оксида алюминия имеется 52,94% алюминия и 47,06% кислорода. Найдите эквивалент алюминия, если известно, что эквивалент кислорода равен 8.
Решение:
Из условия задачи известно массовое соотношение А1 и О: 52,94 : 47,06
В соответствии с формулой 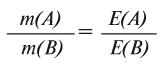
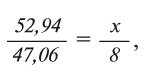 отсюда х=9
отсюда х=9
Следовательно, эквивалент алюминия А1 равен 9.
Расчеты по уравнениям химических реакций и закону сохранения массы
Массы всех веществ, участвующих в химических реакциях, находятся в постоянных пропорциональных соотношениях. Например:
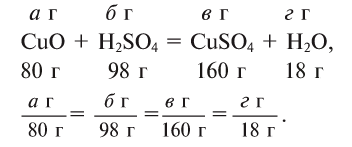
Если известно количество хотя бы одного вступающего в реакцию вещества, то можно рассчитать количество других участвующих в реакции веществ.
Пример:
Сколько граммов 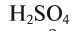 вступят в реакцию с 4 г CuO и сколько при этом образуется соли и воды?
вступят в реакцию с 4 г CuO и сколько при этом образуется соли и воды?
Решение:
Напишем уравнение реакции:
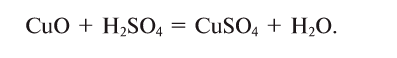
Под формулами участвующих в реакции веществ запишем значения их молярных масс. Над уравнением запишем приведенные в условиях задачи значения масс веществ и те, которые необходимо найти:
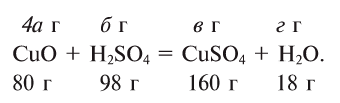
Теперь находим, сколько серной кислоты нужно для реакции. Для этого составляем пропорцию и решаем ее:
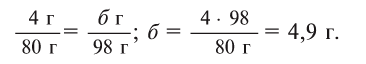
Далее рассчитываем, сколько образуется сернокислой меди (II):
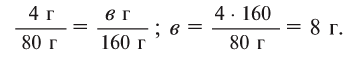
Теперь находим количество образовавшейся воды:
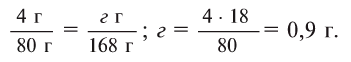
Ответ: 4,9 г серной кислоты, 8 г сульфата меди и 0,9 г воды.
- Атом в химии
- Кислород как химический элемент
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Основные законы и понятия химии
- Место химии в системе наук
- Перспективы химического производства
- Высоко-молекулярные соединения
Реакцию замещения можно представить в виде общей схемы:
где (A), (B), (C) — условные обозначения составных частей веществ.
Суть реакции заключается в том, что атомы простого вещества «(C)» замещают атомы вещества «(B)» в сложном веществе «(A)(B)». При этом образуется новое сложное вещество «(AC)» и новое простое вещество «(B)».
Рассмотрим это на конкретных примерах.
- При взаимодействии цинка с соляной кислотой атомы цинка замещают атомы водорода соляной кислоты. При этом образуются хлорид цинка и водород:
- При взаимодействии железа с раствором сульфата меди((II)) атомы железа замещают атомы меди. При этом образуются медь и раствор сульфата железа((II)):
- При взаимодействии оксида железа((III)) с алюминием образуются оксид алюминия и железо:
В рассмотренных случаях из одного сложного вещества и одного простого вещества в результате реакций образовались два новых вещества — одно сложное и одно простое.
При этом атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из химических элементов в сложном веществе.


