Вода относится к числу реакционноспособных веществ — она реагирует со многими простыми и сложными веществами.
Взаимодействие с простыми веществами
- При комнатной температуре вода реагирует с активными металлами с образованием щелочей и водорода:
- При нагревании вода вступает в реакции с менее активными металлами, расположенными в ряду активности до водорода. При этом образуются оксиды и водород:
-
Вода может реагировать с некоторыми неметаллами. Так, вода загорается в атмосфере фтора:
При высокой температуре происходит её взаимодействие с углём:
Взаимодействие со сложными веществами
-
Вода реагирует с оксидами активных металлов с образованием щелочей:
-
Вода реагирует с кислотными оксидами (кроме оксида кремния). При этом образуются кислоты:
-
Некоторые неорганические и многие органические вещества подвергаются гидролизу (разложению водой).
Необратимый гидролиз характерен для солей, образованных слабым основанием и слабой кислотой:
Гидролиз белков, жиров и углеводов происходит в органах пищеварения животных и является неотъемлемой частью обмена веществ в живых организмах.
-
Вода может присоединяться к некоторым веществам. Такой процесс называется гидратацией.
В результате гидратации многих солей образуются их кристаллогидраты:
-
Одна из важнейших реакций с участием воды — фотосинтез:
.
Разложение воды (электролиз)
Правило 1.1. Взаимодействие простых веществ (металлов и неметаллов) с водой
1) Щелочные (Li-Fr) и щелочноземельные (Ca-Ra) металлы взаимодействуют с водой при комнатной температуре с образованием щелочи (растворимого основания) и выделением водорода. Например:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2.
2) Магний также взаимодействует с водой, но при сильном нагревании и с образованием нерастворимого гидроксида:
Mg + 2H2O → Mg(OH)2 + H2.
3) Алюминий реагирует с водой, но только если убрать оксидную пленку:
2Al + 6H2O → 2Al(OH)3 + 3H2.
4) Металлы, находящиеся в ряду активности от Zn (включительно) до Pb (включительно), взаимодействуют с парами воды (т.е. при температуре выше 100°С), при этом образуются оксиды соответствующих металлов и водород:
Zn + H2O → ZnO + H2.
5) Металлы, стоящие в ряду активности правее водорода, с водой не взаимодействуют даже при нагревании.
Cu + H2O → реакция не идет.
6) Из неметаллов с водой реагируют галогены, C и Si при высоких температурах:
С + H2O → CO + H2
Si + 2H2O → SiO2 + 2H2.
Правило 1.2. Взаимодействие оксидов с водой
1) Основные оксиды щелочных и щелочноземельных металлов реагируют с водой при комнатной температуре с образованием соответствующих щелочей:
M2O + H2O → 2MOH или MO + H2O → M(OH)2.
Например:
Na2O + H2O → 2NaOH или CaO + H2O → Ca(OH)2.
2) Амфотерные оксиды не реагируют с водой и не растворяются в ней.
Примеры амфотерных оксидов: ZnO, BeO, Al2O3, Fe2O3, Cr2O3.
ZnO + H2O → реакция не идет.
3) Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот: P2O5 + 3H2O → 2H3PO4
Только в случае NO2 образуются две кислоты:
2NO2 + H2O → HNO2 + HNO3 и, как следствие, при взаимодействии с щелочами образуются две соли (нитраты и нитриты соответствующего металла):
2NO2 + 2NaOH → NaNO2 + NaNO3 + H2O
Исключение: SiO2 + H2O → реакция не идет.
Макеты страниц
Составление уравнений реакций с участием воды
Вода является очень реакционноспособным веществом вследствие наличия в ее молекуле двух неподеленных пар электронов.
Химические реакции с участием воды можно разделить на 3 группы:
1. Реакции, в которых вода проявляет окислительные свойства.
2. Реакции, в которых вода является восстановителем.
3. Реакции обмена и присоединения.
1. При комнатной температуре вода окисляет щелочные и щелочноземельные металлы (кроме магния):

Аналогично окисляются водой и гидриды щелочных и щелочноземельных металлов:

Магний и цинк в виде пыли окисляются водой при  . Менее активные вещества взаимодействуют с
. Менее активные вещества взаимодействуют с  лишь при довольно высокой температуре
лишь при довольно высокой температуре

2. Вода окисляется атомарным кислородом и фтором при обычной температуре

В этой реакции образуются  благодаря взаимодействию атомов кислорода как друг с другом, так и с
благодаря взаимодействию атомов кислорода как друг с другом, так и с  и
и  .
.
При взаимодействии хлора с водой протекает реакция с образованием хлорноватистой и соляной кислот

Аналогично протекают реакции при растворении в воде брома и иода с той лишь разницей, что равновесие сильно сдвинуто (в особенности для  ) справа налево.
) справа налево.
Следует также иметь в виду, что хлор при температуре выше 100° или на холоду при действии света, а бром при 550° и выше окисляют воду с выделением кислорода

3. Многие вещества (соли, галогенангидриды и др.) вступают с водой в реакции обмена и присоединения:

При растворении в воде солей, кислот, оснований и других веществ происходит их гидратация, т. е. присоединение молекул воды к молекуле растворенного вещества.
Большое значение имеет каталитическое действие воды. Многие реакции протекают только в присутствии следов воды и совсем не идут без нее. Так, например, хлор при полном отсутствии влаги не действует на железо, гремучая смесь без следов влаги не взрывает, в сухом виде  и
и  не вступают в реакцию.
не вступают в реакцию.
В некоторых случаях вода является каталитическим ядом, например, для железа при синтезе аммиака.
Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Урок химии. Химические свойства воды.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
8 класс. Урок № 35.
Тема. Химические свойства воды.
Цель урока: изучить с обучающимися химические свойства воды. Научить записывать уравнения реакций воды с активными металлами, оксидами металлов и неметаллов.
Планируемые результаты обучения
1) личностные. Ф ормировать ответственное отношение к обучению, готовность и способность к саморазвитию и самообразованию на основе мотивации к обучению и познанию.
2) метапредметные. Развивать умение применять знаки и символы для решения учебных и познавательных задач.
3) предметные. Уметь составлять уравнения реакций воды с активными металлами, а также оксидами металлов и неметаллов.
Демонстрационный опыт №12. Взаимодействие воды с металлами (натрием, магнием).
Демонстрационный опыт №13. Взаимодействие воды с оксидами кальция, фосфора, углекислым газом. Испытание полученных растворов индикаторами.
Оборудование: периодическая система химических элементов Д.И. Менделеева, таблица растворимости кислот, оснований, солей, мультимедиа доска, комплект реактивов и химической посуды для выполнения демонстрационных опытов, учебник «Х имия. 8 класс. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, 2014».
1. Организация начала урока.
Проверяю готовность класса к уроку, отмечаю отсутствующих, записываем число и « Классная работа» .
Просмотр наличия выполнения домашнего задания, один обучающийся на доске записывает ответы домашнего задания для самопроверки правильности.
2. Актуализация опорных знаний обучающихся. Подготовка к усвоению нового материала.
2.1. На рабочих местах фронтальная беседа по вопросам (демонстрация вопросов на мультимедиа доске).
1. Какие простые вещества мы изучили?
2. Назовите формулы простых веществ кислорода и водорода.
3. Приведите примеры соединений, содержащих атомы водорода и запишите их формулы.
4. В результате каких реакций можно получить водород?
5. Что называют химической реакцией?
6. Какие типы реакций Вы знаете?
2.2. Объявляются (и комментируются) оценки за практическую работу.
3. Формулирование темы урока при участии обучающихся.
– На предыдущем уроке мы выполняли практическую работу по приготовлению растворов солей.
– Вы заметили главную особенность растворов – свойства воды и свойства соли в растворе сохраняются.
– То есть, приготовление растворов – это физическое явление.
– А возможно ли такое взаимодействие с водой, при котором образуются новые вещества, то есть будет протекать химическая реакция между водой и веществом?
– Как можно сформулировать тему урока в этом случае?
Обучающиеся формулируют возможную тему урока.
– Запишите тему нынешнего урока: Химические свойства воды.
4. Формулирование целей и задач урока при помощи обучающихся. Мотивация учебной деятельности.
– изучить взаимодействие воды с другими веществами, в результате которого образуются новые химические вещества;
– научиться составлять уравнения химических реакций воды с различными простыми и сложными веществами;
– повторить алгоритм составления уравнений химических реакций;
– ф ормировать ответственное отношение к обучению, готовность и способность к саморазвитию.
5. Изучение нового материала. Химические реакции.
5.1. Разложение под действием электрического тока или сильного нагревания (около 2000 о С).
В результате реакции образуются прозрачные газообразные вещества – водород и кислород
Демонстрационный опыт №12. Взаимодействие воды с металлами (натрием, магнием).
Вода при комнатной температуре легко вступает в реакцию с активными металлами. При этом атом металла замещает один из атомов водорода, вытесняя его из воды с последующим образованием газообразного водорода. Также образуются хорошо растворимые в воде гидроксиды металлов.
2 Na + 2 HOH = 2 NaOH + H 2
С a + 2 HOH = С a ( OH ) 2 + H 2
5.3. Взаимодействие с металлами средней активными ( Mg , Zn , Fe ).
Вода при повышенной температуре (500 – 600 о С) вступает в реакцию с металлами средней активности. При этом атом металла замещает атомы водорода, вытесняя их из воды в виде газообразного водорода. Также образуются оксиды металлов.
М g + HOH = MgO + H 2
Zn + HOH = ZnO + H 2
Ф И З К У Л Ь Т М И Н У Т К А
Демонстрационный опыт №13. Взаимодействие воды с оксидами кальция, фосфора, углекислым газом. Испытание полученных растворов индикаторами.
Вода при комнатной температуре легко вступает в реакцию со сложными веществами – оксидами активных металлов:
С aO + H 2 O = С a ( OH ) 2
При добавлении к образующемуся раствору гидроксида металла (щелочи) раствора красного лакмус а весь объём раствора становится синим , а прозрачный раствор фенолфталеин а становится малиновым.
Вода при комнатной температуре легко вступает в реакцию со сложными веществами – оксидами неметаллов:
Вода вступает в реакцию с оксидом фосфора ( V ) при комнатной температуре:
При нагревании или с горячей водой реакция протекает по-другому:
При добавлении к образующемуся раствору кислоты раствора синего лакмус а весь объём раствора становится красным , а прозрачный раствор фенолфталеин а не изменяет свой цвет.
5.6. Взаимодействие с некоторыми неметаллами при нагревании.
Водяной пар при температуре свыше 1000°C взаимодействует с раскаленным коксом (углём) с образованием водяного газа (смесь водорода и оксида углерода (II) – угарного газа).
6. Первичное закрепление изученного материала.
6.1. Игра «Найди пару». К формуле простого или сложного вещества найдите соответствующую формулу продукта реакции его с водой.
Г) Na 4) С a ( OH ) 2
7. Закрепление, обсуждение и коррекция изученного материала.
Обсуждение правильности выполнения заданий игры, повторение химических свойств воды.
8. Подведение итогов занятия.
Подводится итог-обобщение изученного на уроке материала.
Объявление оценок, полученных обучающимися за урок.
9. Задаётся и объясняется домашнее задание.
– Ребята! Запишите, пожалуйста, домашнее задание к следующему уроку (задание появляется на мультимедиа доске или записано на обороте обычной доски):
Учить §32 (с.107, 108) (химические свойства воды),
Как решать химические уравнения – схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO – 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
[spoiler title=”источники:”]
http://infourok.ru/urok-himii-himicheskie-svojstva-vody-4119127.html
http://nauka.club/khimiya/khimicheskie-uravneniya.html
[/spoiler]
В уроке 28 «Химические свойства воды» из курса «Химия для чайников» узнаем о взаимодействии воды с различными веществами.

При обычных условиях вода является достаточно активным веществом по отношению к другим веществам. Это означает, что со многими из них она вступает в химические реакции.
Содержание
- Взаимодействие с оксидами неметаллов
- Взаимодействие с оксидами металлов
- Взаимодействие с металлами
Взаимодействие с оксидами неметаллов
Если струю газообразного оксида углерода(IV) CO2 (углекислого газа) направить в воду, то часть его растворится в ней (рис. 109).

При этом в растворе протекает химическая реакция соединения, в результате которой образуется новое вещество — угольная кислота H2CO3:
![]()
На заметку: Собирая углекислый газ над водой, Дж. Пристли обнаружил, что часть газа растворяется в воде и придает ей приятный терпкий вкус. По сути дела, Пристли впервые получил напиток типа газированной, или содовой, воды.
Реакция соединения происходит также, если к воде прибавить твердый оксид фосфора(V) P2O5. При этом протекает химическая реакция с образованием фосфорной кислоты H3PO4 (рис. 110):

Испытаем растворы, полученные при взаимодействии CO2 и P2O5 с водой, индикатором метиловым оранжевым. Для этого прибавим по 1—2 капли раствора индикатора к полученным растворам. Цвет индикатора изменится с оранжевого на красный, что говорит о присутствии кислот в растворах. Значит, при взаимодействии CO2 и P2O5 с водой действительно образовались кислоты H2CO3 и H3PO4.
Оксиды, подобные CO2 и P2O5, которые при взаимодействии с водой образуют кислоты, относят к кислотным оксидам.
Кислотные оксиды — это оксиды, которым соответствуют кислоты.
Некоторые из кислотных оксидов и соответствующих им кислот приведены в таблице 11. Обратите внимание, что это оксиды элементов неметаллов. Как правило, оксиды неметаллов являются кислотными оксидами.
Взаимодействие с оксидами металлов
С оксидами металлов вода реагирует иначе, чем с оксидами неметаллов.
Исследуем взаимодействие оксида кальция CaO с водой. Для этого поместим в стакан с водой небольшое количество CaO и тщательно перемешаем. При этом протекает химическая реакция:
![]()
в результате которой образуется новое вещество Ca(OH)2, относящееся к классу оснований. Таким же образом реагируют с водой оксиды лития, натрия. При этом также образуются основания, например:
![]()
Подробнее с основаниями вы познакомитесь в следующем уроке. Оксиды металлов, которым соответствуют основания, называют основными оксидами.
Основные оксиды — это оксиды, которым соответствуют основания.
В таблице 12 приведены формулы некоторых основных оксидов и соответствующих им оснований. Заметьте, что, в отличие от кислотных оксидов, в состав основных оксидов входят атомы металлов. Большинство оксидов металлов — это основные оксиды.
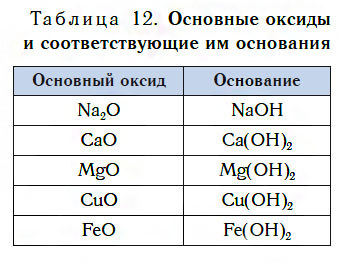
Несмотря на то что каждому основному оксиду соответствует основание, не все основные оксиды взаимодействуют с водой, подобно CaO, образуя основания.
Взаимодействие с металлами
При обычных условиях активные металлы (K, Na, Ca, Ba и др.) бурно реагируют с водой:
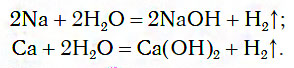
В этих реакциях выделяется водород и образуются растворимые в воде основания.
Как химически активное вещество вода вступает в реакции со многими другими веществами, но об этом вы узнаете при дальнейшем изучении химии.
Краткие выводы урока:
- Вода — химически активное вещество. Она вступает в реакции с кислотными и основными оксидами, активными металлами.
- При взаимодействии воды с большинством кислотных оксидов образуются соответствующие кислоты.
- Некоторые основные оксиды при реакции с водой образуют растворимые основания.
- При обычных условиях вода реагирует с наиболее активными металлами. При этом образуются растворимые основания и водород.
Надеюсь урок 28 «Химические свойства воды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
