Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 ноября 2022 года; проверки требуют 8 правок.
| Хлорная кислота | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Хлорная кислота | |
| Хим. формула | HClO4 | |
| Физические свойства | ||
| Состояние | бесцветная жидкость | |
| Молярная масса | 100,46 г/моль | |
| Плотность | 1,76 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | −102 °C | |
| • кипения | 203 °C | |
| Энтальпия | ||
| • образования | −40,4 кДж/моль | |
| Химические свойства | ||
Константа диссоциации кислоты  |
−10 | |
| Растворимость | ||
| • в воде | смешивается | |
| Классификация | ||
| Рег. номер CAS | 7601-90-3 | |
| PubChem | 24247 | |
| Рег. номер EINECS | 231-512-4 | |
| SMILES |
OCl(=O)(=O)=O |
|
| InChI |
InChI=1S/ClHO4/c2-1(3,4)5/h(H,2,3,4,5) VLTRZXGMWDSKGL-UHFFFAOYSA-N |
|
| RTECS | SC7500000 | |
| ChEBI | 29221 | |
| Номер ООН | 1873 | |
| ChemSpider | 22669 | |
| Безопасность | ||
| NFPA 704 |
0 3 3 OX |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
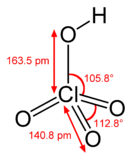
Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7.
Свойства[править | править код]
Физические свойства[править | править код]
Бесцветная летучая жидкость, сильно дымящая на воздухе, в парах мономерна. Безводная хлорная кислота очень реакционноспособна и неустойчива.
Химические свойства[править | править код]
Жидкая HClO4 частично димеризована, для неё характерна равновесная автодегидратация:
Безводная кислота взрывоопасна из-за наличия в ней оксида хлора(VII). Водные растворы с концентрацией ниже 72 % более безопасны, но на свету желтеют с образованием взрывоопасных оксидов хлора. Пожелтевшую кислоту рекомендуется аккуратно разбавить и нейтрализовать щелочами или карбонатами.
Являясь сильной неустойчивой кислотой, хлорная кислота разлагается:
Хлорную кислоту и её соли (перхлораты) применяют как окислители. Хлорная кислота, как одна из самых сильных кислот и окислитель, растворяет золото и платиновые металлы:
а в реакции с серебром образует хлорноватую кислоту:
Неметаллы и активные металлы восстанавливают концентрированную хлорную кислоту до хлороводорода
(данная реакция используется в металлургии для очистки руд.
Аммиак окисляется в концентрированной хлорной кислоте до азотной кислоты:

В отличие от других кислот, хлорная при этом не образует соответствующей соли аммония.
Разбавленная хлорная кислота обладает слабыми окислительными свойствами (не окисляет сероводород, диоксид серы, иодоводород, хром(II), азотистую кислоту) и при реакции с металлами до водорода в электрохимическом ряду выделяет водород с образованием перхлоратов. Водные растворы хлорной кислоты устойчивы.
Хлорная кислота хорошо растворима во фтор- и хлорорганических растворителях, таких, как CF3COOH, CHCl3, CH2Cl2 и др. Смешивание с растворителями, проявляющими восстановительные свойства (например, с диметилсульфоксидом), может привести к воспламенению и взрыву.
С водой хлорная кислота смешивается в любых соотношениях и образует ряд гидратов HClO4·nH2O (где n = 0,25…4). Моногидрат HClO4·H2O имеет ионную природу и температуру плавления +50 °C.
Хлорная кислота с водой образует азеотропную смесь, кипящую при 203 °C и содержащую 72 % хлорной кислоты.
Растворы хлорной кислоты в хлорсодержащих углеводородах являются сверхкислотами (суперкислотами). Хлорная кислота является одной из сильнейших неорганических кислот, в её среде даже кислотные соединения ведут себя как основания, присоединяя протон и образуя катионы ацилперхлоратов: P(OH)4+ClO4−, NO2+ClO4−.
При слабом нагревании при пониженном давлении смеси хлорной кислоты с фосфорным ангидридом, отгоняется бесцветная маслянистая жидкость — хлорный ангидрид:
Соли хлорной кислоты называются перхлоратами. Их большинство растворимо в воде. Малорастворимы перхлораты калия, цезия и рубидия. Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном:
Перхлорат фтора можно получить прямым синтезом:
2F2+4HClO4→4FClO3+2H2O+О2↑
Получение[править | править код]

- Для получения безводной хлорной кислоты требуется нагрев насыщенного раствора перхлората аммония с добавлением азотной, а затем и соляной кислоты, вследствие чего образуется хлорная кислота, вода, хлор и оксид азота (I):

Для получения особо чистого оксида хлора семь требуется нагрев сухих хлоратов металлов с жидким фторидом кислорода:

Применение[править | править код]
- Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии, а также для получения перхлоратов.
- Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
- Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется в производстве взрывчатых веществ, перхлорат магния (ангидрон) — осушитель, перхлорат аммония — добавка к ракетному топливу и взрывчатое вещество.
Безводную хлорную кислоту нельзя длительно хранить и перевозить, так как при хранении в обычных условиях она медленно разлагается, окрашивается оксидами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Зато её водные растворы вполне устойчивы.
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М., 2001.
- Реми Г. Курс неорганической химии. — М.: Иностранная литература, 1963.
| Хлорная кислота | ||
|---|---|---|
|
||
| Систематическое наименование |
Хлорная кислота | |
| Хим. формула | HClO4 | |
| Состояние | бесцветная жидкость | |
| Молярная масса | 100,46 г/моль | |
| Плотность | 1,76 г/см³ | |
| Температура | ||
| • плавления | −102 °C | |
| • кипения | 203 °C | |
| Энтальпия | ||
| • образования | −40,4 кДж/моль | |
| Константа диссоциации кислоты pKa | −10 | |
| Растворимость | ||
| • в воде | смешивается | |
| Рег. номер CAS | 7601-90-3 | |
| PubChem | 24247 | |
| Рег. номер EINECS | 231-512-4 | |
| SMILES |
OCl(=O)(=O)=O |
|
| InChI |
1S/ClHO4/c2-1(3,4)5/h(H,2,3,4,5) VLTRZXGMWDSKGL-UHFFFAOYSA-N |
|
| RTECS | SC7500000 | |
| ChEBI | 29221 | |
| Номер ООН | 1873 | |
| ChemSpider | 22669 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
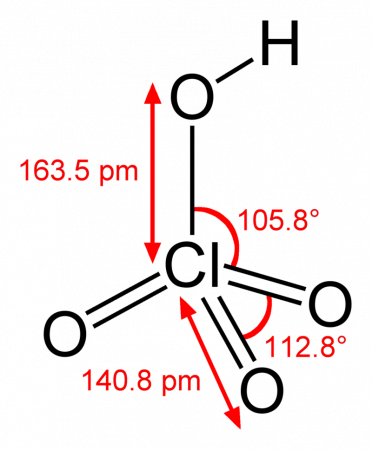
Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
Свойства
Физические свойства
Бесцветная летучая жидкость, сильно дымящая на воздухе, в парах мономерна. Безводная хлорная кислота очень реакционноспособна и неустойчива.
Химические свойства
Жидкая HClO4 частично димеризована, для неё характерна равновесная автодегидратация:
- 3HClO4 ⇄ H3O+ + ClO4− + Cl2O7
Безводная кислота взрывоопасна из-за наличия в ней оксида хлора (VII). Водные растворы с концентрацией ниже 72% более безопасны, но на свету желтеют с образованием взрывоопасных оксидов хлора. Пожелтевшую кислоту рекомендуется аккуратно разбавлять и нейтрализовать щелочами или карбонатами.
Являясь сильной неустойчивой кислотой, хлорная кислота разлагается:
- 4HClO4 = 4ClO2 + 3O2 + 2H2O
Хлорную кислоту и её соли (перхлораты) применяют как окислители. Хлорная кислота, как одна из самых сильных кислот и окислитель, растворяет золото и платиновые металлы (9HClO4 + 2Au = 2Au(ClO4)3 + 3HClO3 + 3H2O), а в реакции с серебром образует хлорноватую кислоту:
- 3HClO4 + 2Ag = 2AgClO4 + HClO3 + H2O
Неметаллы и активные металлы восстанавливают концентрированную хлорную кислоту до хлороводорода
- 8As + 5HClO4 + 12H2O = 8H3AsO4 + 5HCl (данная реакция используется в металлургии для очистки руд)
Разбавленная хлорная кислота обладает слабыми окислительными свойствами (не окисляет сероводород, диоксид серы, йодоводород, хром(II), азотистую кислоту) и при реакции с металлами до водорода в электрохимическом ряду выделяет водород с образованием перхлоратов. Водные растворы хлорной кислоты устойчивы.
Хлорная кислота хорошо растворима во фтор- и хлорорганических растворителях, таких, как CF3COOH, CHCl3, CH2Cl2 и др. Смешивание с растворителями, проявляющими восстановительные свойства (например, с диметилсульфоксидом), может привести к воспламенению и взрыву. С водой хлорная кислота смешивается в любых соотношениях и образует ряд гидратов HClO4·nH2O (где n = 0,25…4). Моногидрат HClO4·H2O имеет ионную природу и температуру плавления +50 °C. Хлорная кислота с водой образует азеотропную смесь, кипящую при 203 °C и содержащую 72 % хлорной кислоты. Растворы хлорной кислоты в хлорсодержащих углеводородах являются сверхкислотами (суперкислотами). Хлорная кислота является одной из сильнейших неорганических кислот, в её среде даже кислотные соединения ведут себя как основания, присоединяя протон и образуя катионы ацилперхлоратов: P(OH)4+ClO4−, NO2+ClO4−.
При слабом нагревании при пониженном давлении смеси хлорной кислоты с фосфорным ангидридом, отгоняется бесцветная маслянистая жидкость — хлорный ангидрид:
- 2HClO4 + P4O10 → Cl2O7 + H2P4O11
Соли хлорной кислоты называются перхлоратами. Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном:
- I2 + 6HClO4 + O3 = 2I(ClO4)3 + 3H2O
Получение
- Водные растворы хлорной кислоты получают электрохимическим окислением соляной кислоты или хлора, растворённых в концентрированной хлорной кислоте, а также обменным разложением перхлоратов натрия или калия сильными неорганическими кислотами.
- Безводная хлорная кислота образуется при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой, а также водных растворов хлорной кислоты с олеумом:
-
- KClO4 + H2SO4 → KHSO4 + HClO4
Применение
- Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии, а также для получения перхлоратов.
- Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
- Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется в производстве взрывчатых веществ, перхлорат магния (ангидрон) — осушитель.
Безводную хлорную кислоту нельзя длительно хранить и перевозить, так как при хранении в обычных условиях она медленно разлагается, окрашивается оксидами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Зато её водные растворы вполне устойчивы.
Хлорная кислота
| Хлорная кислота | ||
|---|---|---|
|
||
| Систематическое наименование |
Хлорная кислота | |
| Хим. формула | HClO4 | |
| Состояние | бесцветная жидкость | |
| Молярная масса | 100,46 г/моль | |
| Плотность | 1,76 г/см³ | |
| Температура | ||
| • плавления | −102 °C | |
| • кипения | 203 °C | |
| Энтальпия | ||
| • образования | −40,4 кДж/моль | |
| Константа диссоциации кислоты pKa | −10 | |
| Растворимость | ||
| • в воде | смешивается | |
| Рег. номер CAS | 7601-90-3 | |
| PubChem | 24247 | |
| Рег. номер EINECS | 231-512-4 | |
| SMILES | ||
| RTECS | SC7500000 | |
| ChEBI | 29221 | |
| Номер ООН | 1873 | |
| ChemSpider | 22669 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7.
Содержание
- 1 Свойства
- 1.1 Физические свойства
- 1.2 Химические свойства
- 2 Получение
Свойства
Физические свойства
Бесцветная летучая жидкость, сильно дымящая на воздухе, в парах мономерна. Безводная хлорная кислота очень реакционноспособна и неустойчива.
Химические свойства
Жидкая HClO4 частично димеризована, для неё характерна равновесная автодегидратация:
Безводная кислота взрывоопасна из-за наличия в ней оксида хлора (VII). Водные растворы с концентрацией ниже 72% более безопасны, но на свету желтеют с образованием взрывоопасных оксидов хлора. Пожелтевшую кислоту рекомендуется аккуратно разбавлять и нейтрализовать щелочами или карбонатами.
Являясь сильной неустойчивой кислотой, хлорная кислота разлагается:
Хлорную кислоту и её соли (перхлораты) применяют как окислители. Хлорная кислота, как одна из самых сильных кислот и окислитель, растворяет золото и платиновые металлы (9HClO4 + 2Au = 2Au(ClO4)3 + 3HClO3 + 3H2O), а в реакции с серебром образует хлорноватую кислоту:
Неметаллы и активные металлы восстанавливают концентрированную хлорную кислоту до хлороводорода
8As + 5HClO4 + 12H2O = 8H3AsO4 + 5HCl (данная реакция используется в металлургии для очистки руд)
Разбавленная хлорная кислота обладает слабыми окислительными свойствами (не окисляет сероводород, диоксид серы, йодоводород, хром(II), азотистую кислоту) и при реакции с металлами до водорода в электрохимическом ряду выделяет водород с образованием перхлоратов. Водные растворы хлорной кислоты устойчивы.
Хлорная кислота хорошо растворима во фтор- и хлорорганических растворителях, таких, как CF3COOH, CHCl3, CH2Cl2 и др. Смешивание с растворителями, проявляющими восстановительные свойства (например, с диметилсульфоксидом), может привести к воспламенению и взрыву. С водой хлорная кислота смешивается в любых соотношениях и образует ряд гидратов HClO4·nH2O (где n = 0,25…4). Моногидрат HClO4·H2O имеет ионную природу и температуру плавления +50 °C. Хлорная кислота с водой образует азеотропную смесь, кипящую при 203 °C и содержащую 72 % хлорной кислоты. Растворы хлорной кислоты в хлорсодержащих углеводородах являются сверхкислотами (суперкислотами). Хлорная кислота является одной из сильнейших неорганических кислот, в её среде даже кислотные соединения ведут себя как основания, присоединяя протон и образуя катионы ацилперхлоратов: P(OH)4 + ClO4 − , NO2 + ClO4 − .
При слабом нагревании при пониженном давлении смеси хлорной кислоты с фосфорным ангидридом, отгоняется бесцветная маслянистая жидкость — хлорный ангидрид:
Соли хлорной кислоты называются перхлоратами. Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном:
Получение
- Водные растворы хлорной кислоты получают электрохимическим окислением соляной кислоты или хлора, растворённых в концентрированной хлорной кислоте, а также обменным разложением перхлоратов натрия или калия сильными неорганическими кислотами.
- Безводная хлорная кислота образуется при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой, а также водных растворов хлорной кислоты с олеумом:
KClO4 + H2SO4 → KHSO4 + HClO4
Применение
- Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии, а также для получения перхлоратов.
- Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
- Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется в производстве взрывчатых веществ, перхлорат магния (ангидрон) — осушитель.
Безводную хлорную кислоту нельзя длительно хранить и перевозить, так как при хранении в обычных условиях она медленно разлагается, окрашивается оксидами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Зато её водные растворы вполне устойчивы.
Кислородсодержащие соединения галогенов
Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее – оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным элементом.
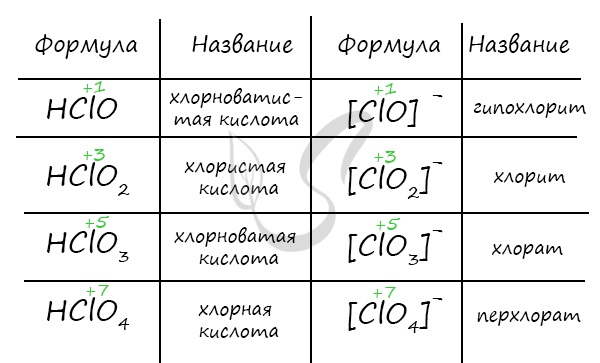
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к брому, и к йоду. Так например HBrO – бромноватистая кислота (соли гипобромиты), HIO – иодноватистая кислота (соли гипоиодиты).
HIO3 – иодноватая кислота (соли иодаты), HBrO3 – бромноватая кислота (соли броматы). По аналогии несложно составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
- Хлорноватистая кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Хлористая кислота может быть получена из собственных солей – хлоритов, а также в реакции с оксидом хлора IV.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Самая сильная кислота в природе – хлорная кислота – может быть получена реакцией перхлората калия или натрия с концентрированной серной кислотой.
Химические свойства
- Кислотные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная – к сильным. Кислоты образуют соли в реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
Разложение кислот и солей
И кислоты, и их соли разлагаются схожим образом.
KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кислородсодержащие соединения галогенов
HBrO2 – бромистая кислота, слабая
HClO4 – хлорная кислота, сильная
Бертолетова соль – KClO3
HClO3 – хлорноватая кислота, сильная
Хлорная, хлорноватая, хлороноватистая, хлористая кислота.
Хлорная кислота.
Хлорная кислота HClO4, степень окисления у атома хлора максимальная – +7. Это одна из самых сильных кислот.
Бесцветная летучая жидкость, дымит на воздухе. Безводная кислота очень неустойчива, а активна. Взрывоопасна. Растворяет благородные металлы:
С неметаллами и металлами хлорная кислота реагирует:
Получение хлорной кислоты.
Получение хлорной кислоты из солей:
Хлорноватая кислота.
Хлороноватая кислота HClO3, степень окисления у атома хлора – +5. Сильная одноосновная кислота. В воде хлороноватая кислота диссоциирует:
Получение хлорноватой кислоты .
Хлороноватистая кислота.
Формула хлороноватистой кислоты – HClO, степень окисления у хлора – +1. Кислота неустойчивая.
При комнатных условиях и при низких температурах окислительная способность у данной кислоты самая высокая из других возможных кислородосодержащих кислоты с атомом хлора.
Получение хлороноватистой кислоты .
Хлорную известь под действием влажности воздуха, в котором присутствует углекислый газ, превращается в хлороноватистую кислоту:
Хлористая кислота.
Формула хлористой кислоты – HСlO2. Степень окисления у хлора – +3.
Весьма неустойчива, но более устойчивое соединение, чем хлороноватистая.
Свойства хлористой кислоты.
Получение хлористой кислоты.
1. Из хлоритов хлористой кислоты:
2. По взаимодействию:
Соли хлористой кислоты бесцветны, хорошо растворимы в воде. Хлорит натрия получают так:
[spoiler title=”источники:”]
http://studarium.ru/article/176
http://www.calc.ru/Khlornaya-Khlornovataya-Khloronovatistaya-Kislota.html
[/spoiler]
целесообразно в один этап получать из хлорида натрия перхлорат натрия?
Если электроды из двуокиси свинца на графите, и дать высокую плотность тока, то не будет ли потерь больших хлора?
Как зделать поверхность графитовых электродов пористой для равномерного осаждения двуокиси свинца?
В домашних условиях будут однозначно очень большие потери хлора + защелачивание электролита. И солянку при этом подливать не получится для нормализации pH. Слишком большие токи нужны для нормального выхода, много солянки, вовсю летят оксиды хлора. Оптимальные температурные режимы тоже разные.
Сначала окислите хлорид до хлората на обычном графите при плотности тока 5-7 А/дм2 и температуре 80-95оС, выделите, перекристаллизуйте пару раз, чтобы от Cl(-) избавиться, а потом уже окисляйте хлорат до перхлората на диоксиде свинца при плотности тока 15-25 А/дм2 и температуре 40-50оС.
Для создания пористой поверхности проведите частичное анодное окисление графита в конц. азотной кислоте, а потом – сильно нагрейте. Но ИМХО, прочный слой садится даже на электрод от батарейки, непрокаленный и необезжиренный. А с кусками электродов от дуговых печей поверхность вообще зеркальная, если при осаждении сильно ток не задирать.
P.s. В промышленности тоже обычно сначала получают хлорат, хотя есть и предприятия-исключения.
Изменено 13 Марта, 2012 в 01:28 пользователем popoveo
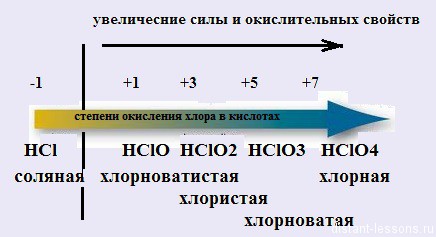
Кислоты хлора
29-Окт-2012 | Нет комментариев | Лолита Окольнова

Хлор — самый богатый на кислоты элемент!
5 кислот — таким рекордом может похвастаться не каждый!
Хлор — элемент 7-й группы главной подгруппы и к тому же 3-го периода.
Что это означает?
Это означает много степеней окисления! 🙂
- Т.к. элемент находится в 7-й группе, то ему не хватает всего 1 электрона до завершения электронной оболочки — минимальная степень окисления хлора = -1.
- Т.к. хлор находится в 3-ем периоде, то он может распаривать электроны с p-подуровня на d-подуровень — степени окисления +1, +3, +5 и +7.
Кислоты хлора
- HCl — хлороводородная или соляная кислота.
Степень окисления хлора= -1.
Сильная кислота. Едкая жидкость, дымит на воздухе. В воде практически полностью диссоциирует на ионы:HCl = H(+) + Cl(-) .
Ей присущи все свойства кислот: взаимодействие с металлами до водорода, взаимодействие с основными оксидами, с основаниями, с солями.
При взаимодействии с окислителями окисляется до Cl2:
2HCl + H2SO4 = SO2 + Cl2↑ + 2H2O
2. HClO — хлорноватистая кислота.
Степень окисления хлора = +1.
Бесцветный раствор. Это очень слабая кислота. Неустойчивая. Небольшая степень диссоциации. Ей соответствует кислотный оксид Cl2O.
Получение:
Сl2 + H2O = HCl + HClO
Cl2O + H2O = 2HClO
НО: это сильная кислота-окислитель: 2HClO + H2S = S + Cl2 + H2O
Cоли — гипохлориты.
3. HClO2 — хлористая кислота.
Степень окисления хлора = +3.
Бесцветная. Кислота средней силы. Неустойчивая. Ей соответствует кислотный оксид Cl2O3.
Проявляет окислительные свойства.
Соли — хлориты.
4. HClO3 — хлорноватая кислота.
Степень окисления хлора = +5
В свободном виде она не получена, «живет» только в растворах. Сильное вещество как просто кислота, и как кислота-окислитель. Кислотный оксид — Cl2O5.
Сильная кислота — окислитель: HClO3 + S + H2O= H2SO4 + HCl
Соли — хлораты.
5. HClO4 — хлорная кислота.
Степень окисления хлора= +7
Одна из самых сильных кислот, одна из самых сильных окислителей.
Взрывоопасна. Бесцветная, летучая, парит на воздухе.
Кислотный оксид — Cl2O7.
Соли — перхлораты.
Обратите внимание на изменение свойств кислот с изменением степени окисления:
- хлор в минимальной степени окисления дает сильную кислоту, но не окислитель;
- с увеличением степени окисления увеличивается сила кислот и окислительные свойства
Обсуждение: “Кислоты хлора”
(Правила комментирования)