На протяжении более чем 215-летней истории вакцинопрофилактика доказала свою исключительную эффективность в сохранении жизни людей, сокращении заболеваемости и смертности населения. По мнению экспертов ВОЗ вакцинация и чистая питьевая вода — единственные доказанные меры, реально влияющие на общественное здоровье. Вакцинация является самым эффективным и экономически выгодным профилактическим мероприятием, известным в современной медицине [1–3].
Благодаря иммунизации международному сообществу удалось достигнуть глобальной ликвидации оспы, ликвидации полиомиелита в большинстве стран мира, провозгласить цель элиминации кори и врожденной краснухи, резко снизить заболеваемость многими детскими инфекциями, обеспечить эффективную защиту населения в очагах ряда бактериальных и вирусных инфекций. Сегодня массовая вакцинация является фактором экономического роста в мировом масштабе. Вакцинация признана во всем мире стратегической инвестицией в охрану здоровья, благополучие индивидуума, семьи и нации с выраженным экономическим и социальным эффектом. По данным ВОЗ благодаря развернутым по всему миру программам вакцинации ежегодно удается сохранить 6 млн детских жизней. 750 тысяч детей не становятся инвалидами. Вакцинация ежегодно дарит человечеству 400 млн дополнительных лет жизни [4, 5].
Развитие программ иммунопрофилактики в России, нашедшее отражение в четырех редакциях Календаря иммунопрофилактики 1997, 2001, 2008 и 2011 гг. и Федеральном законе об иммунопрофилактике РФ 1998 г., позволило добиться значительных успехов. В соответствии с рекомендациями ВОЗ был резко сокращен список противопоказаний, узаконено одновременное введение всех положенных по возрасту вакцин, а также открыт доступ населения к использованию всех отечественных и зарубежных вакцин, лицензированных в России.
Стратегическая цель ВОЗ к 2015 году — снижение детской смертности на 66%, а от инфекционных заболеваний — на 25% [6]. Сегодня зарегистрированный охват вакцинацией составляет 106 млн детей в год, что позволяет предотвратить до 2,5 млн летальных исходов в мире ежегодно. К концу 2010 г. 130 из 193 (67%) стран — членов ВОЗ достигли 90% охвата DTP3 (diphtheria toxoid, tetanus toxoid and pertussis — дифтерия, столбняк, коклюш) вакцинации и 85% детей во всем мире получили ≥ 3 doses of DTP. Однако 19,3 млн детей не вакцинированы полностью и составляют группу риска заболеть и умереть от инфекций, от которых есть вакцины. Около 50% всех не вакцинированных детей живут в Конго, Индии и Нигерии [4].
26 мая 2012 года 65 сессия Всемирной ассамблеи здравоохранения утвердила Глобальный план действий в отношении вакцин. Ассамблея призывает государства-члены применять концепцию и стратегии Глобального плана действий в отношении вакцин для разработки вакцин и компонентов иммунизации своих национальных стратегий и планов в области здравоохранения. ВОЗ отмечает, что настоящий век должен стать веком вакцин и иммунизация станет основной стратегией профилактики [4].
Вакцинация относится к числу мероприятий, требующих значительных материальных затрат, поскольку предусматривает охват прививками широких слоев населения. В связи с этим важно иметь правильное представление об эффективности иммунизации. На сегодняшний день в арсенале практической медицины имеется большой перечень вакцинных препаратов. В России зарегистрировано более 100 наименований вакцин, число их увеличивается с каждым годом. Выбор вакцины для тех или иных целей должен осуществляться на основе критериев доказательной медицины, среди которых основными являются: доказанная эпидемиологическая эффективность и безопасность применения, продолжительность периода применения и количество примененных доз, а также экономичность [5, 7–9]. Состояние вакцинопрофилактики оценивается по трем группам критериев: показатели документированной привитости (охват прививками), показатели иммунологической или клинической эффективности (efficacy) и показатели эпидемиологической или полевой эффективности (effectiveness) [10, 11].
Показатели охвата прививками позволяют косвенно оценить возможное состояние популяционного иммунитета. Объективными критериями качества вакцинного препарата, а также состояния защищенности коллектива против того или иного инфекционного заболевания являются показатели иммунологической (клинической) и эпидемиологической (полевой) эффективности. Иммунологическая эффективность отвечает на вопрос: «Работает ли вакцина?», в то время как эпидемиологическая эффективность: «Помогает ли прививка людям?» [10, 11]. Иными словами, иммунологическая эффективность вакцины и эффективность иммунизации как профилактического мероприятия — разные понятия. Если под иммунологической эффективностью вакцины принято понимать способность препарата вызывать выработку иммунитета у привитого, то эффективность иммунизации представляет собой различие в заболеваемости в группе привитых и непривитых лиц [10].
Качество профилактических (противоэпидемических) мероприятий, включая и иммунопрофилактику, оценивается по следующим основным критериям: полнота охвата подлежащих объектов/лиц данным мероприятием, своевременность его проведения и соответствие определенным требованиям, включая и лабораторные критерии [12]. Критерии качества мероприятий изложены в различных нормативных документах.
Качество проведения мероприятий оказывает большое влияние на эпидемический процесс, т. к. является одним из факторов, определяющих фактическую эффективность мероприятия по снижению заболеваемости. Некачественные мероприятия — мероприятия с низкой фактической эпидемиологической эффективностью. Некачественно проведенные мероприятия рассматриваются как активный фактор риска возникновения и распространения инфекционных заболеваний, поэтому при эпидемиологическом надзоре за инфекцией осуществляется сбор информации и динамическая оценка профилактических мероприятий. Контроль качества проведения мероприятий — это важная составляющая системы контроля, которая, в свою очередь, является компонентом системы управления эпидемическим процессом инфекционного заболевания.
Все указанные общие положения в полной мере относятся и к иммунопрофилактике. Особое значение качество вакцинопрофилактики имеет при вакциноуправляемых инфекциях, поскольку является основным фактором, влияющим на эпидемический процесс. Рост заболеваемости вакциноуправляемой инфекцией — это косвенный показатель недостаточной эффективности вакцинопрофилактики, что может быть следствием ряда причин, прежде всего — некачественного проведения вакцинации населения.
Информационной основой для оценки качества иммунопрофилактики населения являются:
-
формы государственной статистической отчетности:
- № 5 «Сведения о профилактических прививках» полугодовая и годовая;
- № 6 «Сведения о контингентах детей, подростков и взрослых, привитых против инфекционных заболеваний по состоянию на 31 декабря отчетного года» (годовая);
- отчеты ЛПУ о выполнении плана профилактических прививок (ежемесячно);
- результаты серологического обследования «индикаторных» групп.
Качество проведения иммунопрофилактики включает следующие разделы:
- Анализ выполнения плана профилактических прививок.
- Оценка проведения иммунопрофилактики по документам («документированная» привитость).
- Оценка фактической привитости по результатам иммунологического (серологического) мониторинга.
Анализ выполнения плана профилактических прививок. Рассчитывается процент выполнения плана профилактических прививок отдельно по каждому ЛПУ и в целом по району, городу и т. д. Выполнение плана прививок ниже, чем на 100%, может быть обусловлено недостаточным охватом прививками подлежащих лиц вследствие отказов от прививок, временными или постоянными медицинскими противопоказаниями, перебоями с обеспечением медицинскими иммунобиологическими препаратами (МИБП), отсутствием кадров, отсутствием вызова на прививку, а также с миграционными процессами, вследствие чего снижается численность подлежащего прививкам населения по сравнению с запланированным. Перевыполнение плана также может быть связано с миграцией (прибытие на территорию новых лиц, не включенных ранее в план), а также с неправильным планированием прививок и другими причинами. Причины невыполнения плана анализируются в оперативном режиме для принятия управленческих решений по улучшению качества иммунопрофилактики.
Анализируется удельный вес непривитых в каждом декретированном возрасте, а также структура причин непривитости по каждому виду прививки. Оценивается работа с лицами, отказывающимися от прививок, с временно выбывающими детьми, беженцами, переселенцами, выясняются причины отсутствия кадров, несвоевременного получения МИБП, несвоевременного вызова на прививки. Анализируется обоснованность медицинских отводов в соответствии с современными противопоказаниями и правильность оформления отводов, качество диспансерного наблюдения за больными детьми и другие показатели. На основании анализа причин неполного охвата прививками разрабатывают план мероприятий по их устранению.
Оценка проведения иммунопрофилактики по документам («документированная» привитость). Иммунопрофилактика по документам против инфекции, предусмотренной календарем прививок (туберкулез, гепатит А, дифтерия, столбняк, коклюш, полиомиелит, корь, эпидемический паротит, краснуха, гепатит В, грипп), оценивается в различных возрастных группах по следующим показателям: охват прививками, привитость и своевременность вакцинации.
Охват прививками отражает долю вакцинированных против инфекции (т. е. получивших хотя бы одну дозу вакцины) среди тех лиц, кто подлежал вакцинации согласно плану профилактических прививок. Охват прививками определяется среди лиц определенной возрастной группы, проживающих на определенной территории в изучаемый период времени. При расчете охвата прививками учитывают и детей, находящихся в стадии вакцинации (например, при расчете охвата детей первого года жизни вакцинацией против дифтерии учитывают всех детей, получивших хотя бы одну прививку).
Расчет ведется по формуле:
Ox = (A/B) × 100,
где Ох — охват прививками (%), А — число детей определенного возраста (исполнилось в анализируемый период), получивших прививку, B — общее число детей данного возраста, состоящих на учете в ЛПУ.
Например, оценка полноты охвата вакцинацией против дифтерии детей в возрасте до одного года в 2000 г. в поликлинике № 1.
А — число детей, которые в возрасте до одного года в 2011 г. (т. е. возраст до одного года — это значит от 0 до 11 месяцев 29 дней) и которые получили 1, 2 или 3 прививки против дифтерии, — 162 человека.
B — общее число детей в возрасте до одного года (0–11 месяцев 29 дней), состоящих на учете в ЛПУ на момент анализа (на 31 декабря 2011 г.), — 332 человека.
Ox = (A/B) × 100 = (162/332) × 100 = 48,8%
Нормативные показатели для оценки полноты охвата прививками постоянно повышаются, но, как правило, охват прививками не должен быть ниже 95% для детей до трех лет и 97–98% в более старших возрастных группах. Низкий показатель охвата прививками детей до одного года связан с тем, что при расчетах учитываются также дети, родившиеся во второй половине года и не достигшие возраста начала прививок (3 мес).
Охват прививками косвенно отражает состояние иммунологической структуры населения при вакциноуправляемых инфекциях.
Опыт борьбы с различными инфекционными болезнями показал, что охват прививками на уровне 80–90% недостаточен для эффективного управления инфекцией и может привести к вспышкам и эпидемиям, а для ликвидации инфекции (на примере натуральной оспы) потребовался охват прививками на уровне 99%.
Привитость означает долю лиц, полностью привитых против инфекции (т. е. получивших законченный курс вакцинации), среди тех, кто должен быть полностью привит). При расчете привитости (в отличие от охвата прививками) учитывают только тех детей, которые получили законченную вакцинацию против инфекции (например, 3 прививки АКДС (адсорбированная коклюшно-дифтерийно-столбнячная), 3 прививки против полиомиелита, гепатита В и др.).
Формула расчета:
Пр = (А/В) × 100,
где Пр — привитость (%), А — число детей определенного возраста (исполнилось в анализируемый период), получивших законченную вакцинацию, B — общее число детей данного возраста, состоящих на учете в ЛПУ.
Понятно, что если вакцинация против инфекции предполагает введение только 1 дозы прививки (туберкулез, корь, паротит, краснуха), то показатель привитости равен охвату прививками. Если полный курс вакцинации включает введение нескольких доз (гепатит В, дифтерия, столбняк, полиомиелит), показатель привитости будет ниже показателя охвата привиками.
Своевременность прививок представляет долю лиц, получивших определенное число доз вакцины до достижения декретированного возраста, среди всех лиц декретированного возраста, и отражает своевременность проведения вакцинации в соответствии со сроками, установленными календарем прививок.
Расчет ведется по формуле:
Сп = (А/В) × 100,
где Сп — своевременность прививок (%), А — число детей, получивших соответствующую прививку по достижении ими декретированного возраста, B — число детей декретированного возраста, состоящих на учете в ЛПУ.
Декретированным возрастом считается:
- новорожденные (30 дней) — вакцинация против туберкулеза;
- 12 мес — вакцинация против дифтерии, коклюша, полиомиелита, вирусного гепатита В;
- 24 мес — первая ревакцинация против дифтерии, полиомиелита, ревакцинация против коклюша, вакцинация против кори, эпидемического паротита, краснухи;
- 36 мес — вторая ревакцинация против полиомиелита.
Например, оценка своевременности вакцинации против полиомиелита в поликлинике № 1 в 2010 г.:
А — число детей в 2010 г., полностью вакцинированных против полиомиелита (3 прививки) по достижении ими 12 мес, — 290 человек.
B — число детей, состоящих на учете в поликлинике № 1, которым в 2010 г. исполнилось 12 мес, — 296 человек.
Сп = (290/296) × 100 = 98,0%
Основываясь на указанных показателях для всех инфекций, входящих в Национальный календарь прививок, разработаны показатели для оценки работы ЛПУ. Например, при оценке иммунопрофилактики туберкулеза определяют:
- долю вакцинированных до 30 дней жизни;
- удельный вес детей, выписанных из родильного дома без прививки БЦЖ (бацилла Кальметта — Герена (Bacillus Calmette–Guerin, BCG; Mycobacterium bovis));
- удельный вес детей, привитых БЦЖ к 2 месяцам жизни, из числа не привитых в родильном доме;
- охват от числа отрицательных проб Манту в 7 лет;
- охват от числа отрицательных проб Манту в 14 лет.
Оценка фактической привитости по результатам иммунологического (серологического) мониторинга. Оценка качества иммунопрофилактики только по документации не всегда объективна. Существуют лица, которые в силу индивидуальных особенностей организма не способны к выработке полноценного иммунного ответа на качественно проведенную вакцинацию, их удельный вес среди населения может достигать 5–15%. У части людей отмечается повышенный уровень антител. После вакцинации количество людей с высоким и очень высоким уровнем антител может достигать 10–15% от числа привитых. Отсутствие полноценного иммунного ответа при проведенной вакцинации также следствие введения некачественного препарата, выбора неправильной тактики вакцинации и др. К сожалению, имеет место и оформление документов без проведения вакцинации. Поэтому оценка «документированной» привитости населения является обязательным, но не единственным методом контроля качества иммунопрофилактики.
Истинное состояние иммунитета населения при иммунопрофилактике определяется по результатам планового иммунологического (серологического) мониторинга.
Иммунологический (серологический) мониторинг — это слежение за состоянием популяционного, коллективного и индивидуального специфического иммунитета и неспецифической резистентности. Иммунологический мониторинг — это компонент подсистемы информационного обеспечения системы эпидемиологического надзора за инфекциями.
Иммунологический мониторинг проводится в следующих целях:
- слежение за интенсивностью и характером скрыто протекающего эпидемического процесса;
- выявление групп, территорий и времени риска;
- расшифровка причин возникновения единичных и групповых случаев заболеваний в домашних очагах и в организованных коллективах, ЛПУ;
- выявление признаков активизации эпидемического процесса;
- оценка истинной иммунной прослойки населения, объективная оценка качества проводимой иммунопрофилактики.
При осуществлении мониторинга применяют различные серологические методы исследований (РНГА (реакция непрямой гемагглютинации), РТГА (реакции торможения гемагглютинации), ИФА (иммуноферментный анализ), РИФ (реакция иммунофлюоресценции), РА (реакция агглютинации), РН (реакция нейтрализации вируса) и др.), иммунологические методы, позволяющие оценивать состояние иммунитета и неспецифической резистентности.
Иммунологический мониторинг осуществляется в плановом порядке и по эпидемиологическим показаниям.
Плановым иммунологическим мониторингом охвачены:
- различные возрастные группы населения;
- контингенты эпидемиологического риска;
- индикаторные группы для оценки иммунопрофилактики.
По эпидемическим показаниям обследуются:
- больные инфекционным заболеванием;
- при подозрении на инфекционное заболевание;
- контактные с источником инфекции или фактором передачи;
- лица без документов о вакцинации в целях верификации прививочного анамнеза;
- по клиническим показаниям (дети групп риска поствакцинальных осложнений при проведении вакцинации).
Серологические исследования по определению напряженности иммунитета при оценке качества иммунопрофилактики являются многоцелевыми и предусматривают одновременное определение в сыворотке крови антител к дифтерии, столбняку, коклюшу, кори, эпидемическому паротиту и др. в определенных индикаторных группах:
- Дети 3–4 лет (посещающие дошкольные образовательные учреждения (ДОУ)), получившие полный комплекс профилактических прививок против дифтерии, коклюша, столбняка, полиомиелита, гепатита В, кори, эпидемического паротита, краснухи (за 6–12 мес до обследования).
- Дети 9–10 лет (школьники младших классов), получившие ревакцинацию против кори, эпидемического паротита, краснухи, 3 ревакцинации против полиомиелита и 2 ревакцинации против дифтерии и столбняка за 6–12 мес до обследования.
- Лица 15–17 лет (учащиеся школ, средних специальных учебных заведений), получившие прививку против дифтерии, столбняка за 6–12 мес до обследования.
- Лица в возрасте 23–25 лет (доноры, студенты вузов) и другие возрастные группы взрослых, привитые против дифтерии и столбняка.
В каждом районе численность каждой индикаторной группы должна быть 80–100 человек ежегодно (по 25–30 человек по ЛПУ, ДОУ). Результаты серологического обследования каждого человека вносятся в документы о прививке: форма № 63 (карта профилактических прививок), форма № 112 (карта индивидуального развития ребенка), прививочный сертификат и другие документы. Все серонегативные лица подлежат вакцинации — им вводится дополнительная доза вакцины с последующим контролем иммунологического сдвига.
При формировании групп следует придерживаться следующих принципов: единство места получения прививки, единство прививочного анамнеза, идентичность эпидемиологической ситуации.
Оценка фактической привитости проводится на основании сопоставления привитости детей по документации и результатов серологических исследований.
Для многих инфекций, при которых формируется гуморальный иммунитет, определен защитный титр антител, обеспечивающий устойчивость к заражению у привитых (табл. 1). Термин «защитный титр», естественно, является относительным понятием. Титры ниже защитного могут играть существенную роль в противоинфекционной резистентности, а защитные титры антител не являются абсолютной гарантией защиты.
Защищенным от инфекции считается человек, если в сыворотке крови титр антител соответствует обозначенным в таблице титрам антител.
На основании указанных значений титров антител определяется защищенность от этих инфекций по каждой индикаторной группе по формуле:
З = (А/В) × 100,
где З — защищенность от инфекций (%), А — число лиц, в сыворотке которых антитела обнаруживаются в защитных титрах и выше; В — число обследованных лиц, идеально привитых против инфекции по документам.
Кроме этого рассчитывают удельный вес лиц, в сыворотке которых антитела не определяются, определяются в минимальных титрах (не достигающих защитного уровня) и определяются в защитных титрах, а также оценивают уровень популяционного и коллективного иммунитета путем расчета средней геометрической титров антител, выраженной через двоичный логарифм.
Считается, что показатель защищенности при кори и краснухе должен быть не ниже 93% (допускается до 7% лиц с уровнем антител ниже протективного), при эпидемическом паротите — 85% (до 15% лиц с уровнем антител ниже протективного). В целом показатель защищенности должен быть 95% и выше (табл. 2). Для большинства инфекций, защита против которых обусловлена клеточными факторами (туберкулез, туляремия, бруцеллез и др.), «защитные титры» клеточных реакций после вакцинации не установлены.

Оценка эффективности иммунопрофилактики
Эффективность любого профилактического мероприятия, включая иммунопрофилактику, — это степень достижения необходимого результата за счет реализации данного мероприятия при отсутствии побочного действия или побочное действие в установленных границах. Выделяют эпидемиологическую, экономическую и социальную эффективность иммунопрофилактики.
Определение эпидемиологической эффективности вакцинации
В условиях плановой вакцинации контролируемые испытания являются непрактичными и неэтичными, поэтому применяют классические эпидемиологические исследования, детально описанные рядом авторов [7, 10, 12, 13]. Исследования эпидемиологической (полевой) эффективности прививки прямо отвечают на вопрос: «Помогает ли прививка людям?» Оценка эпидемиологической эффективности предусматривает сбор информации об уровне заболеваемости, проявлениях эпидемического процесса во времени, в пространстве и среди различных групп населения. Кроме того, проводится сопоставление заболеваемости на территории, где иммунизацию проводили, и на территории, где иммунизацию не проводили, при условии одинакового уровня заболеваемости на этих территориях в течение нескольких предыдущих лет. Основными критериями оценки эффекта массовой иммунизации служат не только показатели заболеваемости, но и смертности, изменения в характере очаговости, сезонности и цикличности, возрастной структуры болеющих, а также клинического течения соответствующей вакцине инфекционной болезни, которые учтены за достаточно длительный период времени до и после проведения прививок. Предусматривается определение индекса эффективности, коэффициента (показателя) защищенности, коэффициента тяжести клинического течения болезни.
Принято разграничивать потенциальную эпидемиологическую эффективность и фактическую эффективность мероприятия. Применительно к иммунопрофилактике потенциальная эпидемиологическая эффективность — это максимально достижимая возможность предупреждения и снижения заболеваемости при осуществлении вакцинопрофилактики по данной схеме данным препаратом. Потенциальная эффективность иммунопрофилактики тождественна понятию «профилактическая эффективность вакцины».
Фактическая эпидемиологическая эффективность вакцинопрофилактики определяется как реально достигнутое снижение и предупреждение заболеваемости в результате проведения вакцинопрофилактики по данной схеме данным препаратом.
Оценка потенциальной эпидемиологической эффективности вакцинопрофилактики определенной вакциной проводится в рамках работ по регистрации новой вакцины по специальной утвержденной программе. Такой опыт проводится только в условиях специально организованного контролируемого полевого эпидемиологического эксперимента [7, 8, 14, 15].
Сохраняются все общие положения дизайна данного вида эксперимента с внесением дополнительных требований, специфических для оценки иммунопрофилактики:
- Члены групп должны быть равнозначны по всем характеристикам, кроме подверженности вакцинации.
- Опытная группа получает испытуемую вакцину, а контрольная — плацебо («наполнитель» вакцины без антигена) или вместо плацебо вводят препарат сравнения. Требуется идентичность схемы иммунизации, дозировки и места введения испытуемой вакцины и препарата сравнения.
- Опытная и контрольная группы формируются на основе индивидуальной или групповой выборки. Если единицей выборки принимается один человек, тогда все лица должны принадлежать к одному коллективу. Такая выборка «через одного» создает в коллективе 50% иммунную прослойку, что влияет на распространение инфекции в контрольной группе и искусственно занижает эпидемиологическую эффективность вакцинации. Предпочтительнее является групповая выборка (например, группы в дошкольных образовательных учреждениях), особенно при широко распространенных инфекциях и одинаковой интенсивности эпидемического процесса инфекции в разных группах.
- Репрезентативная численность групп определяется расчетным путем исходя из ожидаемой минимальной заболеваемости ожидаемой инфекцией и минимального индекса эффективности, принятого как существенный для данной вакцины.
- Распределение на опытную и контрольную группы осуществляется случайно-выборочным методом (рандомизация), поэтому эксперимент носит название «рандомизированный».
- Участники эксперимента находятся в обычных условиях жизни («полевых» условиях).
- Эксперимент является двойным слепым.
- Сроки наблюдения для оценки заболеваемости в опытной и контрольной группах выбираются с учетом сезонного подъема данного заболевания в основном не меньше 10–12 мес.
- Необходим качественный и полный сбор данных о случаях заболеваний в группах. Учитываются все случаи инфекции независимо от клинических проявлений, в т. ч. со стертыми (инаппарантными) формами инфекций, для чего должна быть организована качественная диагностика.
Потенциальная эффективность вакцинопрофилактики оценивается по двум основным показателям: индексу эффективности и коэффициенту эффективности (показателю защищенности).
Индекс эффективности вакцинопрофилактики против той или иной инфекции отражает отношение заболеваемости в группе непривитых и привитых данным препаратом, т. е. показывает, во сколько раз заболеваемость среди привитых ниже, чем заболеваемость среди непривитых.
Рассчитывается по формуле:
ИЭ = В/А,
где ИЭ — индекс эффективности, А — заболеваемость привитых лиц, B — заболеваемость непривитых лиц. Выражается в разах. Этот показатель аналогичен показателю «относительный риск» (Relative Risk, RR).
Коэффициент эффективности (показатель защищенности) характеризует удельный вес лиц из числа привитых, защиту которых от инфекции обеспечила именно вакцинация данным препаратом.
Формула расчета:
КЭ = ((В – А)/В) × 100,
где КЭ — коэффициент эффективности (%), А — заболеваемость привитых лиц, В — заболеваемость непривитых лиц.
Коэффициент эффективности — наиболее предпочтительный показатель, поскольку показывает только эффект вакцинации, без влияния других профилактических факторов, которые могут иметь место в контрольной и опытной группах.
Фактическая эпидемиологическая эффективность вакцинопрофилактики осуществляется после регистрации новой вакцины в период ее массового применения.
Оценка фактической эффективности вакцинопрофилактики представляет собой не разовое исследование, а постоянно проводимый анализ при осуществлении эпидемиологического надзора за инфекцией, является компонентом оперативного и ретроспективного эпидемиологических анализов.
Фактическая эпидемиологическая эффективность вакцинопрофилактики оценивается в ходе неконтролируемого эпидемиологического эксперимента следующими способами:
- сопоставляется заболеваемость до и после внедрения вакцинопрофилактики среди данного населения на определенной территории;
- сравнивается заболеваемость на территории (среди определенных групп населения), где проводилась иммунопрофилактика, и на территории (среди групп), где иммунопрофилактика не проводилась, при условии одинакового уровня заболеваемости на этих территориях (в группах) в течение нескольких предыдущих лет;
- сопоставляется не только показатель заболеваемости, но и другие количественные и качественные проявления эпидемического процесса инфекции: смертность, инвалидизация, структура заболеваемости по возрасту, полу, социальным характеристикам, тяжесть течения заболевания, показатели очаговости, вспышечная заболеваемость, характер многолетней динамики, сезонность и др.;
- неконтролируемый эпидемиологический эксперимент не предполагает наличие опытной и контрольной групп, но все анализируемые показатели (заболеваемость, смертность, тяжесть течения заболевания и другие) могут оцениваться и сравниваться среди привитых и непривитых лиц. Только эти группы не являются равнозначными, они специально не формируются, а образуются естественным путем при массовой вакцинации населения в силу временных или постоянных противопоказаний к вакцинации, миграционных процессов или недостаточного охвата прививками. Более информативные данные будут получены, если сравнивать показатели в одних возрастных или профессиональных группах, в одни и те же сроки, на одной и той же территории.
Потенциальная эпидемиологическая эффективность вакцинации зависит прежде всего от иммуногенности вакцины, а также от выбора тактики вакцинации и схемы прививок.
Фактическая эпидемиологическая эффективность, оцениваемая в условиях реального практического здравоохранения при массовой вакцинопрофилактике, как правило, ниже потенциальной эффективности, испытанной при оптимальной организации. Фактическая эффективность во многом определяется и качеством применяемого препарата, и качеством организации и проведения мероприятия. Чем больше различия между потенциальной и фактической эффективностью, тем больше причин усомниться в качестве средства и мероприятия и усилить контроль за вакцинопрофилактикой. Однако различия в эффективности могут быть обусловлены и другими причинами, например, изменением эпидемиологической обстановки, эволюцией эпидемического процесса инфекции, требующими изменения схемы и тактики вакцинации.
Оценка фактической эпидемиологической эффективности, осуществляемая при эпидемиологическом надзоре за инфекцией в рамках оперативного и ретроспективного эпидемиологического анализа, является действенным инструментом своевременной корректировки вакцинопрофилактики.
Экономическая эффективность вакцинопрофилактики — это выраженный в денежных единицах положительный вклад от практического проведения мероприятия. Иммунопрофилактика — весьма затратное мероприятие, требующее значительных государственных материальных ресурсов. Особенно тяжким бременем эти затраты ложатся на плечи стран с ограниченными материальными ресурсами, что и является основной причиной недостаточного охвата вакцинацией населения и требует дополнительной помощи, которая активно оказывается ВОЗ, в частности, в Африке и Латинской Америке. Однако ущерб от заболеваний людей болезнями, которые могут быть предотвращены иммунизацией, в десятки раз выше. Это и определяет высокую экономическую эффективность вакцинопрофилактики. Примером является кампания по ликвидации натуральной оспы, на которую было затрачено 313 млн долларов США, а величина предотвращенного ущерба ежегодно составляет 1–2 млрд долларов США.
Для оценки экономической эффективности вакцинопрофилактики вычисляется критерий выгоды (прибыли): отношение затрат на вакцинацию к предотвращенным затратам, т. е. связанным с лечением заболеваний невакцинированных людей. Может также определяться стоимость снижения затрат, денежное соотношение выгоды/затраты.
Экономические затраты на вакцинопрофилактику существенно варьируют в зависимости от применяемого препарата, схемы вакцинации, подлежащих контингентов, тактики вакцинации в целом и других. Соответственно, оценка экономической эффективности иммунопрофилактики чрезвычайно важна для определения оптимальных с точки зрения соотношения «выгода/затраты» параметров вакцинации. Например, более экономична тривакцина против кори, эпидемического паротита и краснухи — соотношение равно 14,1 доллара на 1 затраченный на вакцинацию доллар, при применении моновакцин это соотношение составит 6,7 доллара (моновакцина против паротита), 7,7 (вакцина против краснухи) и до 11,9 доллара (вакцина против кори) на 1 доллар. Иммунопрофилактика коклюша и ХИБ-инфекции (вызываемой гемофильной палочкой тип b — Haemophilus influenzae тип b, или ХИБ) приносит прибыль 2,1–3,1 и 3,8 доллара США соответственно [5, 12, 15]. Однако следует помнить, что приоритетное значение имеет эпидемиологическая эффективность.
Социальная эффективность вакцинопрофилактики — это степень снижения социальной значимости болезни в результате проведения вакцинопрофилактики. Социальная значимость инфекционного заболевания определяется как совокупность отрицательных сдвигов в состоянии здоровья населения, общественной жизни и народного хозяйства вследствие распространения этого заболевания. Социальная эффективность вакцинопрофилактики оценивается по влиянию на смертность населения и рождаемость, инвалидизацию населения, улучшение здоровья, продление жизни и другие показатели. Примером социальной эффективности иммунопрофилактики является увеличение в среднем на 25 лет продолжительности жизни людей в развитых странах в ХХ в.
Определение истинной иммунологической структуры населения
Иммунологическая структура населения — это состояние иммунитета населения к отдельной инфекции на определенной территории в изучаемый период времени.
При оценке иммунологической структуры определяют долю лиц, имеющих специфический иммунитет к данной инфекции (прослойка иммунных лиц), и долю лиц, восприимчивых к данной инфекции (прослойка неиммунных лиц). Прослойка иммунных лиц включает лиц с естественным иммунитетом (врожденным, приобретенным) и искусственным иммунитетом (полученным при проведении иммунопрофилактики).
Оценка иммунологической структуры населения особенно важна для инфекций, управляемых средствами иммунопрофилактики, поскольку определяет тактику проведения вакцинации и является основным фактором, определяющим характер эпидемического процесса инфекции на территории и тенденции его развития.
Косвенно о состоянии иммунной структуры населения при вакциноуправляемых инфекциях можно судить по охвату прививками, по изменению заболеваемости и другим проявлениям эпидемического процесса.
Однако истинная иммунная прослойка определяется на основании данных прививочной документации, результатов серологического обследования и информации о случаях заболевания данным инфекционным заболеванием. Истинная иммунная прослойка (ИИП) по каждой индикаторной группе рассчитывается по формуле:
ИИП = Ох + П — Сн,
где Ох — охват лиц определенного возраста соответствующими прививками (%); П — доля переболевших данным инфекционным заболеванием от общего числа лиц данной группы (%); Сн — доля лиц, серонегативных по той или другой инфекции (нулевые титры или титры ниже защитных) (%).
В медицинской практике пока нет условий для определения уровня антител у всех вакцинированных, хотя серологический мониторинг широко применяется для оценки коллективного иммунитета, а серологический скрининг — для подбора контингентов людей при испытании новых вакцин. В идеале желательно знать потенциальную способность каждого человека развивать иммунитет против возбудителей конкретных инфекций еще до проведения вакцинации. Проблема прогнозирования развития иммунитета на вакцину у отдельных людей практически не разрабатывается [16]. Иммунологическую персонализацию вакцинации можно проводить за счет подбора вакцин (среди однонаправленных препаратов), выбора доз, схем введения вакцин, использования адъювантов и других средств иммуномодуляции. Имеется мнение, что общее количество людей, нуждающихся в коррекции развития иммунитета, составляет 25% от числа всех вакцинируемых людей [16].
Литература
- Всемирный Банк: Отчет о тенденциях экономического развития в мире в 1993 году. Нью-Йорк: Издательство «Оксфорд Юниверсити Пресс», 1993, стр. 72–107.
- Зверев В. В., Юминова Н. В. Вакцинопрофилактика вирусных инфекций от Э. Дженнера до настоящего времени // Вопросы вирусологии. Приложение 1. 2012, 33–43.
- Таточенко В. К., Озерецковский Н. А., Федоров А. М. Иммунопрофилактика-2011 (справочник). М.: Из-во Союза педиатров России. 2011, 198 с
- http://www.who.int/immunization/en/.
- Вакцины и вакцинация: национальное руководство. Ред. В. В. Зверев, Б. Ф. Семенов, Р. М. Хаитов. М.: Гэотар-Медиа, 2011. 880 с.
- WHO WeeklyEpidemiologicalRecord, 24 October 2008, № 43, 2008, 83, 385–392, http://www.who.int/wer.
- Горбунов М. А. Принципы и система организации полевых испытаний эпидемиологической эффективности вакцин // Вакцинация. 2000, 11 (5), с. 6–7.
- Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология (основы доказательной медицины). М.: Из-во Медиа Сфера. 1998, с. 345.
- Giesecke Johan. Modern Infectious Disease Epidemiology, London. Sydney. Auckland, 1994, p. 220–234.
- Fedson David S. Measuring protection: efficacy vs effectiveness. Pasteur Merieux MSD Lyon, Франция
- Plotkin Stanley A., Orenstein Walter, Offit Paul A. Vaccines.Fifth edition. Elsevier, 2008, 1748 p.
- Брико Н. И. Критерии оценки эффективности вакцинации // Лечащий Врач. 2001, № 3, с. 64–70.
- Медуницин Н. В. Вакцинология. М.: Триада-Х, 1999, с. 204–211.
- Общая эпидемиология с основами доказательной медицины. Учебное пособие. Второе издание. Под ред. В. И. Покровского, Н. И. Брико. М.: Издательская группа «Гэотар-Медиа», 2012. С. 494.
- Руководство к практическим занятиям по эпидемиологии инфекционных болезней. 2-е издание. Под ред. В. И. Покровского, Н. И. Брико. М.: Гэотар-Медиа, 2007, с. 767.
- Медуницин Н. В., Миронов А. Н. Вакцины. Новые способы повышения эффективности и безопасности вакцинации // Вопросы вирусологии. Приложение 1. 2012. С. 51.
Н. И. Брико, доктор медицинских наук, профессор, академик РАМН
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова Минздравсоцразвития России, Москва
Контактная информация об авторе для переписки: nbrico@mail.ru
ОБЗОРЫ
© КОЛЛЕКТИВ АВТОРОВ, 2016 УДК 612.017.1:615.371:614.47
Персональный и коллективный иммунитет при вакцинации
Н. В. Медуницын, Ю. В. Олефир, В. А. Меркулов, В. П. Бондарев
Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации, Москва, Россия
Поступила 12.09.2016 г. Принята к публикации 17.11.2016 г.
Приведены доказательства необходимости персонализации вакцинации и примеры из практики, свидетельствующие о возможности такого подхода. Для проведения персонализации вакцинации необходимы предварительное определение титров антител (или кожных проб замедленного типа) и последующая коррекция развития иммунитета улиц с низкими титрами защитных антител или с признаками гипериммунизации. Описаны преимущества персонализации вакцинации и перечислены мероприятия, которые следует провести для достижения этой цели. Указаны трудности такой персонализации и способы их преодоления. Персонализация вакцинации не требует больших финансовых затрат и способствует развитию вакцинопрофилактики. Персонализация вакцинации необходима для скорейшего достижения коллективного иммунитета, при котором происходит снижение заболеваемости данной инфекцией и, как правило, сокращение циркуляции ее возбудителя. Решающим условием формирования коллективного иммунитета является появление «иммунной прослойки», которая состоит преимущественно из переболевших и вакцинированных лиц, а также лиц, иммунизированных естественным путем циркулирующим в среде возбудителем инфекции. Эффективность коллективного иммунитета снижается при генетической изменчивости возбудителя, частых отводов и отказов от вакцинации. Длительное сохранение коллективного иммунитета обеспечивает иммунологическая память.
Ключевые слова: вакцины; вакцинация; дифференцированный подход; коррекция иммунитета; защитные титры антител; индивидуализация (персонализация) вакцинации.
Библиографическое описание: Медуницын НВ, Олефир ЮВ, Меркулов ВА, Бондарев ВП. Персональный и коллективный иммунитет при вакцинации. БИОпрепараты. Профилактика, диагностика, лечение 2016; 16 (4): 195-207.
Одним из наиболее эффективных методов предупреждения инфекционных болезней является вакцинация, с помощью которой во всем мире сделаны большие успехи. В России по сравнению с допрививочным периодом заболеваемость инфекциями календаря прививок снизилась в десятки и сотни раз (табл. 1).
ВОЗ считает, что настоящий век является веком вакцинации (иммунизации). Однако возможности вакцинации далеко не исчерпаны. В настоящее время 19,3 млн детей остаются невакцинированными. Они входят в группу риска заболеть инфекционными болезнями, против которых есть вакцины [1].
Существует представление, что со временем (с годами) иммунологическая активность населения падает. Предполагаемыми причинами снижения иммунологической активности населения могут быть:
• уменьшение числа эпидемий и вспышек инфекций;
• сокращение циркуляции микрофлоры;
• уменьшение количества лиц, способных отвечать сильной иммунной реакцией на антигены;
• широкое применение дезсредств, антибиотиков и других антимикробных препаратов;
• использование стерильной и рафинированной пищи;
• действие других неблагоприятных факторов внутренней и внешней среды.
В соответствии с календарем прививок широкую вакцинацию детей проводят с первых дней их жизни, несмотря на то, что в это время иммунная система ребенка недостаточно развита.
Причины слабости иммунного ответа у новорожденных детей:
• недоразвитие лимфоидной ткани;
• недостаточное образование цитокинов (у-интерферо-на и других медиаторов иммунного ответа);
• слабая функция макрофагов, дендритных клеток и кле-ток-хелперов;
• присутствие у новорожденных детей материнских антител, которые поступают в плод через плаценту и тормозят образование собственных антител у реципиента. В течение первого полугода жизни ребенок плохо отвечает на вакцины, например, на Т-независимые полиса-харидные вакцины. Лишь конъюгирование полисахарида с белковым носителем (например, микробным анатоксином) придает вакцине хорошую иммуногенность.
Содержание антител у детей в годовалом возрасте составляет всего 60 % от уровня антител взрослого, уро-
Таблица 1. Эффективность вакцинации
Наименование инфекции Заболевание на 100 тыс. населения Снижение заболеваемости
до прививок по состоянию на 2014 год
Корь 800-1000 1,6 500 раз
Эпидемический паротит 300-500 0,2 150 раз
Коклюш 100-200 3,15 40 раз
Дифтерия 50-90 2,0 200 раз
Полиомиелит 10 0 Случаев заболевания нет
Гепатит В 30-40 1,3 10 раз
Краснуха 120-400 0,16 100 раз
вень 1дО — 80 %, а количество 1дА, столь важного для секреторного иммунитета, — всего лишь 20 % от концентрации иммуноглобулина взрослого человека.
У детей после рождения наблюдаются пять критических периодов, связанных, прежде всего, с недостаточной функцией иммунной системы. В течение первых двух периодов (до полугода), когда наблюдается низкое содержание лимфоцитов и исчезают материнские антитела, ребенку вводят БЦЖ и по три дозы вакцин против полиомиелита, гепатита В, коклюша, дифтерии, столбняка и гемофильной инфекции. В последующие три периода (до 15 лет) также происходят различного рода возрастные изменения, и появляется повышенный риск возникновения воспалительных, аллергических и аутоиммунных болезней, тесным образом связанных с недостаточной функцией иммунной системы.
Все это свидетельствует о необходимости более внимательного отношения к вакцинации детей раннего возраста.
Известно, что вакцины по своим свойствам отличаются от фармацевтических препаратов. Для производства вакцин необходимы особые условия. Вакцины имеют сложный состав, сложный механизм действия, обладают способностью вызывать нежелательные реакции и осложнения. Страна располагает основными видами вакцин против 50 инфекций. По основным показателям безопасности и эффективности отечественные вакцины соответствуют требованиям ВОЗ.
В России зарегистрировано более 100 вакцин, из них чуть меньше половины составляют вакцины зарубежного производства. Некоторых вакцин, которые выпускаются за рубежом, у нас нет [2]. Разрабатываются вакцины против особо опасных инфекционных заболеваний [3]. Бесклеточная коклюшная вакцина проходит клинические исследования.
Нет производства вакцин против:
– вируса папилломы человека;
– ветряной оспы;
– пневмококковой инфекции;
– ротавирусной диарейной инфекции.
Основой современной медицины является дифференцированный подход к лечению и профилактике разных заболеваний человека. Несмотря на общий характер развития иммунитета на чужеродные антигены, в том числе на прививку, иммунный ответу каждого человека всегда индивидуальный. Лица, плохо реагирующие на одну вакцину, могут хорошо отвечать на другую. Это связано с генетическими особенностями людей. Существует тесная связь между чувствительностью человека к отдельным видам инфекций, интенсивностью возникающего иммунитета и наличием или отсутствием у него определенных антигенов главного комплекса гистосовместимости, которые контролируются генами, расположенными в локусах А, В и С класса I и локусах йР, йО и йР класса II Н1_А системы человека.
Механизмы действия продуктов генов ГКГ, присутствие которых увеличивает риск возникновения заболевания, остаются слабо изученными [4-8]. Восприимчивость к инфекциям связана с присутствием на клетках специальных рецепторов для патогенов, вызывающих эти инфекции. Например, существует линия мышей восприимчивых к заражению вирусом полиомиелита. Мыши получены путем введения в их геном гена, кодирующего клеточный рецептор к вирусу полиомиелита [9, 10]. Таким образом,
без специальных клеточных рецепторов инфекционный процесс не развивается.
Существование обратной ассоциации, когда высокий уровень отдельных продуктов генов сочетается с высокой степенью устойчивости к инфекционному агенту [11-14] объясняется тем, что эти трансплантационные антигены являются продуктами 1г-генов (генов иммунного ответа), от которых зависит сила иммунного ответа на конкретные внешние и внутренние антигены.
I. Персональный иммунитет
Люди неодинаково реагируют на одну и ту же вакцину. Более того, каждый человек по-разному реагирует на разные вакцины, на одну из них он может реагировать слабо, на другую — сильно. Календарь прививок, жесткие правила и инструкции по вакцинации составлены для «усредненных» по иммунологической активности людей. Врач не имеет права менять эти правила, любые отступления ведут к юридической ответственности в случае возникновения каких-либо побочных явлений после введения вакцины.
Дифференцированный подход применяется при вакцинации отдельных групп лиц повышенного риска [15-17], среди них:
– медицинские работники, персонал общепита;
– контингенты домов престарелых, домов ребенка, интернатов;
– беременные, новорожденные;
– лица, выезжающие за рубеж в эндемичные регионы, беженцы.
К группам детей особого повышенного риска, к которым в первую очередь необходимо применять дифференцированный метод, относятся:
– недоношенные и ослабленные дети;
– дети с иммунодефицитами;
– дети, больные острыми и хроническими заболеваниями.
В арсенал существующих средств, которые могут быть использованы для дифференцированной вакцинации, входят:
– одноименные вакцины с разной степенью реакто-генности и иммуногенности (живые, инактивированные, расщепленные, субъединичные вакцины) [3, 18, 19];
– вакцины с уменьшенным содержанием анатоксина (АДС-М, АД-М-вакцины для плановой возрастной иммунизации) или с уменьшенным количеством бактериальных клеток (БЦЖ-М-вакцина для вакцинации недоношенных и ослабленных детей);
– разные дозы одной и той же вакцины, выпускаемые для иммунизации взрослых и детей (вакцины против гепатитов А и В, гриппа, клещевого энцефалита и др.);
– вакцины с разными адъювантами и разными консервантами;
– обычные и ускоренные схемы иммунизации против некоторых инфекций, например, против гепатита В.
На этом селективные методы вакцинации кончаются. Нет ни индивидуального подхода, ни тем более индивидуальных вакцин. В свое время исследователи увлекались аутовакцинами для лечения хронических инфекционных болезней. Вакцины готовили из тех микроорганизмов, которые были выделены у конкретных пациентов [20]. Принцип замечательный и истинно индивидуальный, но метод не вошел в практику из-за технических трудностей и невозможности организовать независимый контроль таких индивидуальных вакцин.
Т-вакцины для профилактики инфекций В-вакцины для профилактики инфекций
с внутриклеточным паразитированием микроорганизмов с внеклеточным паразитированием микроорганизмов
4 4
Антигены (белки) Антигены (белки, полисахариды)
4 4
Т-хелперы 1 Т-хелперы 2
Тх1 Тх2
4
Цитокины: уИФ, ИЛ-2, 3, ФНОа Цитокины: ИЛ-3,4, 5, 6, 9,10, 13
4
Т-клетки-киллеры, Т-эффекторы ГЗТ, макрофаги В-клетки, плазматические клетки, антитела
4 4
Т-клетки памяти В-клетки памяти
Рис. 1. Т- и В-вакцины.
Трудность в коррекции иммунитета заключается в существовании двух типов иммунитета: гуморального и клеточного. На основании этого различают Т- и В-вакцины (рис. 1). У таких вакцин все разное: антигены, разные Т-хелперы, разный набор цитокинов, разные эффекторные клетки и даже разные клетки памяти. Это учитывается при разработке новых вакцин, вакцин со сложной конструкцией, включающей разные антигены и цитокины, ответственные за разные типы иммунного ответа.
Любой крупномолекулярный антиген, используемый для приготовления вакцины, содержит несколько детер-минантных групп. Каждая из них вызывает свой иммунный ответ. Иммунологическая реакция на вакцину является, по существу, суммой ответов на пептиды, поэтому различия между группами, сильно и слабо реагирующими на вакцину, сглажены. Еще более сложная мозаика иммунных ответов возникает при введении комплексных вакцин, направленных на профилактику нескольких инфекций. В этом случае большинство вакцинируемых хорошо реагируют одновременно на несколько компонентов сложных комбинированных вакцин, однако всегда можно выделить группы людей, отвечающих слабо или сильно на 1-2 или несколько видов моновакцин, входящих в состав препарата [21].
Из двух типов иммунитета наиболее изучен гуморальный иммунный ответ. Для многих управляемых инфекций, при которых он развивается, установлен так называемый защитный титр антител (табл. 2). Это понятие относительное, потому что защита может проявляться, если титр антител ниже защитного, а присутствие антител еще не является полной гарантией защиты. Например, защитный титр при вакцинации против гриппа — 1:40 по реакции ге-магглютинации. В контролируемых исследованиях показано, что риск заболеть гриппом исчезает только при более высоком титре антител — 1:100, т.е. в 2,5 раза превышающем защитный титр. Вероятно, это характерно не только для гриппа, но и для других инфекций. Некоторое количество лиц, которые имеют так называемый защитный титр антител, на самом деле могут быть недостаточно защищены от инфекций.
Для большинства инфекций, защита против которых обусловлена клеточными факторами иммунитета (туберкулез, туляремия, бруцеллез и др.), «защитные титры» клеточных реакций после вакцинации не установлены.
Изучено распределение численности лиц с разным уровнем антител к компонентам комбинированной вакцины против кори, паротита и краснухи [22]. Вакцинированные дети были разделены на 3 группы в соответствии с тремя видами моновакцин, входящих в состав комбинированной вакцины (табл. 3). Для каждой группы подбирали
детей с низкими и высокими титрами антител (для вируса кори — три группы). При анализе всех данных можно сделать общий вывод: у одних и тех же детей уровни антител к трем видам вакцин изменяются синхронно. Одни и те же дети, имеющие высокие титры антител к вирусу паротита, также хорошо реагируют на вакцины против краснухи и кори. Конечно, нет прямой корреляции, это лишь общая закономерность.
В таблице 4 представлены результаты испытаний 4 новых гепатитных вакцин разных предприятий на 1120 взрослых лицах. У каждой вакцины был свой препарат сравнения. Испытания проведены с препаратами разных фирм и в разное время. Анализ данных всех групп вакцинированных показал, что после вакцинации по схеме 0-1-2 мес. антитела отсутствовали примерно у 8% лиц, высокий уровень антител зарегистрирован у 39 % и очень высокий (более 1000 мМЕ) — у 16,4 %. Таким образом, после вакцинации образуются группы лиц с очень сильным и очень слабым иммунным ответом на вакцины, хотя основная масса людей занимает среднее положение [23-25].
Сохраняется ли со временем, с возрастом вакцинированных такое соотношение численности лиц с разными уровнями титров антител? При определении уровня антител к гепатиту В у медицинских работников через 1 мес. и через 5 лет после трехразовой вакцинации показано (табл. 5), что соотношение групп с разным уровнем антител меняется слабо, т.е. группы лиц с низким, средним и высоким уровнем антител сохраняются, отношение лишь
Таблица 2. Защитные титры антител
Инфекция Титры антител после вакцинации Методы определения антител
Защитные титры Высокие титры
Грипп 1:40 >1:2560 РТГА
Дифтерия 1:40 >1:640 РПГА
Столбняк 1:20 >1:320 РПГА
Коклюш 1:160 >1:2560 РА
Корь 1:10 >1:80 РНГА
1:4 >1:64 РТГА
Краснуха 1:20 >1:320 РТГА
Паротит 1:10 >1:80 РПГА
Полиомиелит 1:8 >1:256 РТГА
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
Гепатит В 5-10 мМЕ/мл >1000 мМЕ/мл ИФА
Клещевой 1:20 >1:60 РТГА
энцефалит
Таблица 3. Титры антител у 35 лиц, привитых тривакциной Приорикс (Бельгия) для профилактики кори, паротита и краснухи
Методы определения Распределение привитых по группам в зависимости от уровня антител Средние и средние геометрические значений титров антител в величинах, обратных разведению сыворотки крови привитых
Число привитых Титры антител Вирус паротита Вирус краснухи Вирус кори
ИФА Вирус 19 0-200 158 2,10±0,19 1058 2,84±0,20 68 1,80±0,10
паротита 16 400-1600 675 2±0,12 1566 2,96±0,19 84 1,86±0,12
ИФА Вирус 13 100-400 308 2±0,29 330 2,49±0,12 58 1,73±0,12
краснухи 22 800-3200 445 2,46±0,21 1600 3,13±0,11 86 1,87±0,10
РТГА Вирус кори 5 16-32 280 2,42±9,19 1240 2,90±0,55 29 1,44±0,15
23 64 304 2,36±0,18 1022 2,85±0,18 64 1,81±0
7 128-256 742 2,54±0,69 1371 3,03±0,21 146 2,15±0,10
Таблица 4. Результаты испытаний вакцин против гепатита В
Соотношение групп привитых (процент) в зависимости от титров антител (мМЕ/мл) Количество привитых
Вакцины Нет антител Невысокий уровень (10-50) Средний уровень (51-100) Высокий уровень (101-1000) Очень высокий уровень (>1000)
Биовак Энджерикс 12,5 10,4 20,4 11,8 21,6 19,3 26,2 31,1 19.3 27.4 176 195
Шанвак Энджерикс 8,1 4,1 22,6 4,1 8,1 67,5 48,3 24,3 12,9 74 62
Регевак Вирион 4,8 6,1 23,0 18,4 21,5 15,9 32,3 44,0 18,3 15,5 223 205
Р-ДНК Энджерикс 18,2 17,4 34.3 38.4 7,1 8,1 34.3 31.4 6,1 4,7 99 86
Средний показатель 8,3 21,3 15,0 39,0 16,4 Всего 1120
сглаживается, несмотря на достаточно большой срок после вакцинации [26].
Таким образом, при вакцинации всегда можно выделить две крайние группы. Одна их них — лица, у которых антитела отсутствуют или не достигают защитного уровня. Это не защищает от инфекций и, вероятно, способствует развитию бактерио- и вирусоносительства. Даже при хорошо выполненной вакцинации людей в рамках календаря прививок значительное количество вакцинированных остается беззащитным (серонегативным).
Согласно Методическим указаниям МУ 3.1.2943-11 по организации и проведению серологического мониторин-
Таблица 5. Соотношение численности вакцинированных с разным уровнем антител к вирусу гепатита В через 1 месяц и 5 лет после вакцинации
Уровень титров антител (мМЕ/мл) Через 1 мес. (процент) Через 5 лет (процент)
Низкий (<10) 8,3 13,5
Средний (11-100) 36,3 31,1
Высокий (101-1000) 39,0 36,5
Очень высокий (>1000) 16,4 18,9
га, эта численность детей и взрослых по инфекциям календаря прививок составляет 5-10 %. Таким образом, при массовой вакцинации мы заранее закладываем достаточно большой процент лиц, которые будут лишены защиты после проведения вакцинации по существующим правилам.
Низкий уровень антител опасен еще с точки зрения возможности развития феномена антитело-зависимого усиления инфекции [27]. Суть феномена заключается в усилении инфекционного процесса в присутствии антител в низкой концентрации. Феномен подробно изучен на примере инактивированной коревой вакцины и инактиви-рованной вакцины против респираторно-синцитиального вируса [28, 29]. Феномен появляется у болеющих лиц, имеющих низкий уровень антител, и у лиц, которым проводили неполноценную иммунизацию. В условиях in vitro можно наблюдать интенсивное размножение вирусов в клетках, культивируемых в среде с низким содержанием специфических антител. Происходит образование комплекса микроба с низкоаффинными антителами, фагоцитоз комплекса (с участием или без участия системы комплемента) и развитие инфекционного процесса. Феномен описан при разных вирусных и бактериальных заболеваниях (лихорадках Эбола, Марбург, денге, Ку, желтой ли-
хорадке, гепатите С, бешенстве, стафилококковой инфекции, туберкулезе и др.). Возможно, феномен является общим явлением для всех возбудителей инфекционных заболеваний. Этот же феномен наблюдается даже при введении иммуноглобулинов при применении по схеме лечения [30-34]. Установлено также, что феномен возникает на фоне инфекции или вакцинации, которые не обеспечивают достаточно высокий уровень антител. Антитела в низкой концентрации не могут подавить инфекцию, но связываются с возбудителем, способствуют его фиксации на клеточной поверхности и проникновению внутрь клетки.
В связи с постоянной циркуляцией возбудителей некоторых инфекций происходит естественная иммунизация людей до прививок. Часть из них могут иметь высокий исходный титр антител и они не нуждаются даже в первичной вакцинации. Другие лица могут давать очень высокие титры антител после вакцинации, и им, вероятно, не надо проводить ревакцинацию.
Гипериммунизация возникает чаще после повторной вакцинации, которая требуется в соответствии с инструкцией по применению для большинства вакцин календаря прививок. Лица с высоким уровнем предшествующих антител плохо реагируют на ревакцинацию. Например, среди лиц, имевших перед вакцинацией высокие титры противодифтерийных антител, у 12,9 % людей титры антител не изменялись после введения АДС-М-анатоксина, а у 5,6 % лиц титры антител падали ниже исходного уровня [35]. Таким образом, 18,5 % людей не нуждались в ревакцинации против дифтерии.
Иллюстрацией этого же являются данные по изменению уровня антител у 71 человека, которые были вакцинированы дивакциной против гепатитов А и В (табл. 6). У 1/3 части лиц после 3-й инъекции увеличения титров антител не отмечалось. У 15 вакцинированных титры антител против гепатита А остались без изменения, у 7 — титры уменьшились, а у 2 пациентов антитела даже исчезли. Аналогичные изменения отмечены у лиц, вакцинированных гепатитной В вакциной. Важно отметить, что титры уменьшались или антитела исчезали преимущественно у лиц, которые имели высокий уровень антител после 2-й инъекции вакцины. Таким образом, из 71 человека не следовало бы вакцинировать 3-й раз: 24 человека против гепатита А и 17 человек против гепатита В.
Спрашивается, выгодно ли с точки зрения целесообразности, экономичности и медицинской этики вакцинировать таких лиц 3-й раз, если уровень антител у них не повышался, а уменьшался, а в отдельных случаях антитела исчезали полностью?
Для сравнения следует отметить, что для профилактики и лечения гепатита В людям вводят только 1 мл гомологичного иммуноглобулина с активностью 100 МЕ/мл. При вакцинации концентрация иммуноглобулина бывает в 100 раз больше, чем при пассивной иммунизации. Такая высокая концентрация антител бывает также при искусственной иммунизации доноров с целью получения специфического 1д.
Таким образом, избыточная иммунизация является неоправданной, нецелесообразной с точки зрения медицинской этики, риска развития нежелательных реакций и осложнений и, что тоже немаловажно, с точки зрения финансовых затрат.
Повторное введение вакцины на фоне высоких титров антител:
– подавляет образование новых антител;
– препятствует приживлению живых микроорганизмов, входящих в состав живых вакцин;
– способствует образованию иммунных комплексов;
– усиливает побочное действие вакцин;
– не соответствует требованиям медицинской этики;
– увеличивает экономические затраты.
Многочисленные экспериментальные и клинические
наблюдения свидетельствуют о необходимости индивидуализации (персонализации) вакцинации. Один из методов персонализации в медицине заключается в анализе полиморфизма генов, в поиске ассоциаций между наличием отдельных генов и способностью больных отвечать на различные лекарственные фармацевтические препараты. Если установлена зависимость лечебного эффекта от наличия того или иного гена или сочетания генов, это дает врачам мощное средство для направленного действия на отдельные звенья патологического процесса.
С помощью этого метода обнаружены различия в генетических ассоциациях у серопозитивных и серонегатив-ныхлиц, вакцинированных против кори, паротита, краснухи и гриппа [36], что, по мнению авторов, может быть основой для разработки групповых вакцин с учетом полиморфизма генов, контролирующих иммунный ответ у разных групп лиц. Метод имеет большое будущее, однако сейчас он позволяет судить об ассоциации только по принципу «есть связь-нет связи» без количественной оценки такой связи.
Эффективным методом персонализации является метод иммунологической коррекции вакцинации. Многочисленные данные свидетельствуют, что после вакцинации значительное число незащищенных лиц и лиц с очень высокими титрами антител нуждается в принятии мер по коррекции формирования у них иммунитета. Вакцину вводят, как правило, два и более раз. По динамике развития поствакцинального иммунитета после первичного или вторичного введения вакцины можно составить прогноз дальнейшего его развития для последующего введения вакцины и в случае необходимости провести иммунологическую коррекцию.
Основным методом возможной коррекции специфического иммунитета является определение титров антител или интенсивности кожной реакции замедленного типа. Решение проблем индивидуализации вакцинации в значительной степени ускорилось бы, если бы мы заранее знали степень чувствительности каждого человека к отдельным инфекциям. Надежных методов определения такой чувствительности пока нет. Определенную помощь в составлении прогноза развития иммунитета может оказать определение иммунного статуса человека [37, 38].
Проведен модельный анализ эффективности ранней иммунизации населения. Показана возможность коррекции результатов первичной вакцинации с помощью повторной прививки путем подбора оптимальной интен-
Таблица 6. Изменение уровня антител после 3-й инъекции дивакцины против гепатитов А и В
Титры антител через 1 мес
71 человек Увеличение Без изменений Уменьшение Исчезновение
Гепатит А 47 15 7 2
Гепатит В 54 9 5 3
Существующая схема Возможные схемы
100% 100% 4. 100% 4т
вен вен вен
Те же 100% Только 60-80 % 4 Только 30-40 % 1
вен с н н
Те же 100 % Только 30-40 % 4 Только 10-20% 1
вен н Н
Только 10-20 % 4
н
Рис. 2. Существующая и возможные схемы вакцинации: В — лица, имеющие высокие титры антител, С — средние титры, Н — низкие титры антител. %% — количество вакцинируемых лиц (в процентах).
сивности первой прививки [39]. Существуют методы математического прогнозирования иммунологической эффективности вакцинации (ревакцинации), основанные на иммунологическом мониторинге больших коллективов людей [40]. Однако проблема прогнозирования развития иммунного ответа на вакцину у отдельных людей практически не разрабатывается.
Коррекция уровня иммунитета по титрам антител у лиц повышенного риска доступна и реальна. В настоящее время в стране есть тест-системы для определения антител практически ко всем возбудителям инфекций. Следует использовать стандартные высокочувствительные диагностические препараты, прошедшие все стадии регистрации.
Коррекция иммунного ответа на вакцины проводится с целью:
• защиты слабо реагирующих на вакцину лиц;
• недопущения излишней иммунизации лиц с высокими защитными титрами антител;
• создания необходимого уровня иммунитета у всех привитых людей.
Процентное соотношение групп людей с разной интенсивностью иммунного ответа зависит от свойств вакцин и иммунологической активности вакцинируемых лиц. Ниже указаны средние значения, основанные на анализе изменения иммунного ответа у отдельных лиц, участвующих в клинических испытаниях вакцин:
• отсутствие иммунного ответа или слабый иммунный ответ — 5-15 % привитых;
• сильный и очень сильный иммунный ответ — 5-15 % привитых;
• иммунитет средней (достаточной) интенсивности — 70-85 % привитых;
• требуют коррекции развития иммунитета — 10-15 % привитых.
На первых порах принципы коррекции следует распространить на лиц из групп повышенного риска. В этом случае численность лиц, нуждающихся в коррекции иммунитета, будет в десятки раз меньше указанных цифр.
Учитывая необходимость индивидуального подхода к вакцинации, в отдельных случаях могут быть внесены некоторые изменения в существующие схемы иммунизации, регламентированные календарем прививок. По существующей традиционной схеме всех здоровых лиц многократно вакцинируют одинаковыми дозами препарата без учета индивидуальных особенностей этих лиц. И каждый раз после очередной дозы вакцины могут быть лица с низкими и высокими титрами антител. По предлагаемым вариантам схем рекомендуется не вакцинировать лиц, у которых титры антител уже высокие, а иммунизировать только лиц с низким, а в некоторых случаях — со средним уровнем антител (рис. 2).
Как правило, у слабо реагирующих лиц всегда удается достичь повышения титров антител. Процент абсолютно рефрактерных лиц, которые вообще не реагируют на какую-то вакцину, крайне низкий. Конечно, для изменения схемы вакцинации необходимы веские научные доказательства возможности такого изменения для каждого вида вакцин.
Персонализация вакцинации — это создание безопасного и эффективного иммунитета у каждого прививаемого человека с помощью коррекции вакцинации, введения вакцин, применения неспецифических средств иммунологической коррекции или изменение схемы вакцинации, если это необходимо. Основные положения такой коррекции:
• коррекция проводится на основании оценки иммунологической активности вакцинируемого по результатам определения титров антител или интенсивности кожных проб замедленного типа после введения вакцины;
• коррекция проводится с помощью: дополнительного введения вакцины, разных вариантов вакцин, разных доз, схем и методов вакцинации и дополнительных средств иммуностимуляции или отмены вакцинации в случае появления признаков гипериммунизации. Преимущества индивидуализации вакцинации следующие:
• обеспечение более рациональной и эффективной вакцинации;
• достижение коллективного иммунитета в более короткие сроки;
• уменьшение риска развития поствакцинальных реакций и осложнений;
• решение этических проблем, связанных с недостаточной или избыточной иммунизацией.
В медицинской практике пока нет условий для определения уровня антител у всех вакцинируемых, хотя серологический мониторинг широко применяется для оценки коллективного иммунитета, а серологический скрининг — для подбора контингентов людей при испытании новых вакцин [41, 42].
Поскольку правильное проведение вакцинации уже сейчас позволяет предотвратить эпидемический процесс в отношении любой управляемой инфекции, можно полагать, что иммунологическая коррекция вакцинации не является столь необходимой. Однако процесс снижения заболеваемости в этом случае занимает многие годы, иногда десятилетия. Коррекция вакцинации значительно ускорит процесс снижения заболеваемости. Но главное, уже на ранних сроках иммунологической коррекции большая часть слабо реагирующих лиц будет защищена от инфекций, а другая часть населения — избавлена от гипериммунизации. Есть все основания полагать, что индиви-
дуальная коррекция вакцинации в значительной степени снизит частоту возникновения побочных реакций и осложнений после вакцинации. Затраты на внедрение методов иммунологической коррекции будут минимальными, они будут скомпенсированы отменой вакцинации гиперактивных людей. Произойдет частичное перераспределение объемов вакцин от тех, для кого они излишни, тем, кому они необходимы для дополнительной стимуляции иммунитета.
Следует подчеркнуть, что персонализация вакцинации это не утопия. Такой подход к вакцинации является необходимым и реальным. В некоторых исследовательских центрах уже в 1990-е годы осуществлялся дифференцированный подход к вакцинации лиц, страдающих тяжелыми видами патологии: иммунодефицитами, аллергией, злокаченственными новообразованиями [43-45].
В соответствии с инструкциями по применению вакцин против бруцеллеза, туляремии и некоторых других инфекций вакцинацию проводят после предварительной оценки иммунитета у вакцинируемых с помощью одной из серологических или кожно-аллергических реакций. Прививкам подлежат лица с отрицательными реакциями.
Вот выдержки из Методических указаний МУ 3.1.3018-12 по серологическому контролю антитоксического иммунитета: «Подход к иммунизации лиц с отрицательным результатом после вакцинации против дифтерии (титр антител ниже 1:20) должен быть индивидуальным. При отсутствии защитных титров дифтерийных и столбнячных антител в сыворотке крови обследуемого ему следует провести дополнительную прививку. Лиц, у которых в ответ на дополнительную прививку не отмечается выраженная продукция дифтерийного и столбнячного антитоксинов, следует считать непривитыми. Их необходимо привить заново, считая сделанную прививку началом иммунизации». Замечательный документ, но, к сожалению, в широкой практике вакцинации он не используется.
Не все высказанные положения являются бесспорными. Существуют факторы, роль которых необходимо учитывать при разработке принципов персонализации вакцинации. Вот некоторые из таких факторов:
• относительность понятия «защитный титр» антител;
• роль разных классов антител в развитии иммунитета;
• аффинитет антител;
• длительность иммунитета и иммунологическая память.
Необходимы новые диагностические тест-системы
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
для одновременного определения антител к возбудителям инфекций календаря прививок и методы прогнозирования силы иммунного ответа на основании результатов иммунометрии, необходимы научные исследования по разработке рекомендаций для врачей и пациентов.
Изменения ранее установленных доз и схем применения вакцин, а также использование дополнительных средств иммунологической коррекции должны быть научно обоснованы и одобрены в установленном порядке [46, 47].
II. Коллективный иммунитет
Эффективность вакцинации можно рассматривать с точки зрения создания персонального иммунитета, который обеспечивает защиту от заболевания, его тяжелых форм и осложнений. Эффективность вакцинации оценивается также как противоэпидемическое мероприятие по созданию коллективного иммунитета, снижению заболеваемости и прекращению вспышки инфекции. Основным мето-
дом создания коллективного иммунитета является вакцинация. Важно, чтобы используемые для этой цели вакцины имели высокую степень иммунологической и противо-эпидемиологической эффективности [48].
Коллективный (стадный, популяционный) иммунитет — это приобретенный иммунитет отдельных групп, коллективов, контингентов и общества в целом против определенного вида инфекций. Это общее определение, хотя предложено несколько определений коллективного иммунитета, большинство из них включает упоминание о способности коллективного иммунитета защищать невак-цинированных лиц.
Термин «стадный иммунитет» («herd immunity») был впервые введен в 1923 году, а его проявления были описаны в 30-е годы на примере коревой инфекции, когда после вакцинации большого числа детей заболеваемость корью уменьшалась не только среди вакцинированных детей, но и среди непривитых чувствительных к кори лиц и лиц, у которых после вакцинации отсутствовал специфический иммунитет к возбудителю кори [46].
Основным показателем напряженности коллективного иммунитета является значение «R» — индекс (коэффициент) репродукции, который означает среднее число заражаемых лиц одним зараженным лицом [47]. Если R < 1, то коллективный иммунитет есть и заболеваемость уменьшается, если R > 1, то коллективного иммунитета нет и заболеваемость растет. R0 — среднее количество лиц, которые могут быть заражены одним инфицированным больным в условиях гомогенной популяции, когда каждый человек коллектива может контактировать с любым членом этого же коллектива. Есть еще один показатель ПКИ — порог (охват в процентах), необходимый для появления коллективного иммунитета (табл. 7). Охват прививками не идентичен защищенности. Процент защищенности людей всегда меньше процента охвата прививками.
Достаточный охват необходим для создания коллективного иммунитета, снижения циркуляции возбудителя и уменьшения инфекционной заболеваемости. Процент охвата для большинства управляемых инфекций календаря прививок колеблется от 80 до 95 %.
Факторами, влияющими на распространение инфекций, являются: чувствительность населения к инфекциям, контагиозность инфекции, демографические особенности, природные, социальные факторы и пр. Восприимчивость населения принято выражать индексом контагиозности — отношением числа заболевших к числу неболевших лиц, контактирующих с источником инфекции. Индекс выражается в дроби или в %%. Например, корь 1 или 100 %, диф-
Таблица 7. R0 и ПКИ при некоторых инфекциях
Болезни Способ передачи R0 ПКИ, %
Корь Воздушный 12-18 92-94
Коклюш Воздушно-капельный 12-17 92-94
Дифтерия Слюна 6-7 85
Краснуха Воздушно-капельный 6-7 80-85
Оспа Воздушно-капельный 5-7 80-86
Примечание. 1. R0 — среднее количество лиц, которые могут быть заражены одним инфицированным больным в условиях гомогенной популяции.
2. ПКИ — порог (охват в процентах), необходимый для появления коллективного иммунитета.
терия 0,2 или 20 % и т.д. Порог охвата зависит от вида инфекции, прежде всего от ее контагиозности.
Среди инфекций календаря прививок наиболее высокий порог охвата характерен для кори, коклюша и дифтерии. Например, коревая инфекция обладает высокой степенью контагиозности, а после перенесенной болезни или вакцинации возникает прочный и длительный иммунитет, в механизме которого принимают участие гуморальные и клеточные факторы. Считается, что носительство при кори без появления признаков инфекции невозможно, а обнаружение антител в этом случае признается диагностической ошибкой [50].
Естественная восприимчивость к коклюшной инфекции высокая. Болеют лица всех возрастов. Трансплацентарный иммунитет не обеспечивает защиту от заболевания. Развивающийся иммунитет после перенесенного коклюша пожизненный. Повторно болеют лица пожилого возраста. Происходят периодические подъемы и спады заболевания с интервалом 3-4 года. При введении клеточной коклюшной вакцины возникает гуморальный и клеточный иммунитет, хотя не обнаруживается прямой связи между уровнем циркулирующих антител и восприимчивостью к инфекции. Бесклеточная коклюшная вакцина индуцирует преимущественно выработку антител, возникающий иммунитет слабее по сравнению с иммунитетом, который появляется после введения клеточной вакцины.
Резервуаром и источником заболевания дифтерией является больной человек или носитель токсигенных штаммов. Восприимчивость людей к инфекции высокая и определяется интенсивностью антитоксического иммунитета. Низкое содержание антитоксинов (0,03 АЕ/мл) обеспечивает защиту, но не препятствует носительству патогенных микробов. Антитоксические антитела передаются от матери плоду трансплацентарно и защищают новорожденного от заболевания в течение первого полугода жизни ребенка. Дифтерийный анатоксин может прервать передачу инфекции, но плохо защищает от развития самого заболевания. Большую опасность представляет бактерионосительство, которое может длиться длительное время без регистрируемой заболеваемости. В начале 90-х годов произошло снижение коллективного иммунитета с небывалым подъемом заболеваемости дифтерией. Вспышку заболеваемости удалось купировать с помощью вакцинации.
В формировании коллективного иммунитета имеют значение все три звена эпедемиологического процесса: источник инфекции, передача возбудителя и особенности популяции людей.
Для оценки эпидемиологической ситуации в каждой развитой стране проводится мониторинг состояния коллективного иммунитета с помощью сбора информации о напряженности иммунитета среди населения. Устанавливаются лимиты — допустимый процент вакцинированных с уровнем антител ниже защитного.
На эффективность вакцинации, которая обеспечивает развитие специфического коллективного иммунитета, влияют следующие факторы:
• особенности возбудителя инфекции: вирулентность, контагиозность, способы передачи и пр.;
• свойства вакцины: иммуногенность, реактогенность, соответствие антигенов вакцин антигенам циркулирующих штаммов и пр.;
• особенности популяции людей, подлежащих вакцинации, ее генетические и фенотипические признаки;
• социальные факторы, профессиональные и возрастные особенности;
• географические и другие особенности среды. Состояние коллективного иммунитета зависит от генетической изменчивости возбудителей инфекций. Известно, что новый микробный штамм, например штамм вируса гриппа, появляется в результате антигенного шифта. При этом меняются эпитопы вируса, иммунная система и ее Т-клетки памяти не распознают новый штамм, выработка вируснейтрализующих антител прекращается и коллективный иммунитет теряет силу. Население становится чувствительным к новому штамму. Возникает новая вспышка заболевания, а затем развивается коллективный иммунитет новой специфичности. Основу коллективного иммунитета составляет «иммунная прослойка». Она выражается в проценте лиц, иммунных к данной инфекции. В состав иммунной прослойки входят:
• переболевшие данной болезнью;
• вакцинированные против этой инфекции;
• группа лиц, иммунизированных естественным путем циркулирующим штаммом возбудителя инфекции (случаи бессимптомной болезни, легкого заболевания без обращения за медицинской помощью);
• иммунизированные в результате вторичного иммунного ответа на перекрестные антигены введенной когда-то вакцины (феномен антигенного импринтинга или «первородного греха»).
Важной особенностью коллективного иммунитета является тот факт, что среди лиц, косвенно защищенных благодаря коллективному иммунитету, присутствует группа лиц, которые не могут быть привиты по медицинским показаниям. Это особая форма непрямой защиты неиммунных лиц, которые не болеют данной инфекцией благо-
Таблица 8. Оценка коллективного иммунитета при управляемых инфекциях
Инфекции Методы определения титров антител Контингент Наличие антител Допустимый % вакцинированных с уровнем антител ниже защитного
Дифтерия, столбняк РПГА Дети Взрослые Титры антител меньше 1:20 Серонегативные Не более 10 % Не более 20 %
Корь ИФА Дети Серонегативные Не более 7 %
Краснуха ИФА Дети Серонегативные Не более 4 %
Паротит ИФА ИФА Дети, вакцинированные однократно Дети, вакцинированные двухкратно Серонегативные Серонегативные Не более 15 % Не более 10 %
Полиомиелит РН Дети Серонегативные Не более 20 % к каждому штамму
даря прекращению контактов с инфицированными лицами. К таким лицам относятся:
• – новорожденные, которых еще рано иммунизировать данной вакциной;
• – больные с врожденными и приобретенными имму-нодефицитами, находящиеся на химиотерапии или радиационной терапии и другие случаи глубоких поражений иммунной системы;
• – лица с другими противопоказаниями к введению данной вакцины, например, с повышенной чувствительностью к компонентам вакцины;
• – часть здоровых невакцинированных лиц.
Охват людей прививками никогда не бывает 100-процентным. Всегда остается часть лиц, не привитых по тем или иным причинам. Их численность составляет 5-10 %. Кроме того, среди привитых примерно такой же процент составляют лица, у которых после вакцинации антитела отсутствуют или титры антител не достигают защитного уровня.
Вакцинация напрямую защищает вакцинированных от инфекций и косвенно — остальных непривитых лиц. При создании подавляющего большинства защищенных лиц больной человек все реже встречается непосредственно с людьми, восприимчивыми к данной инфекции, и заболеваемость данной инфекцией падает.
Таким образом, для снижения заболеваемости необходимо, чтобы иммунитет приобрела большая часть населения. Когда восприимчивых к инфекции лиц становится мало, циркуляция возбудителя сокращается. Коллективный иммунитет может исчезнуть из-за слишком частых отводов и отказов от вакцинации, ложных противопоказаний, как это было в отношении дифтерии и коклюша в бывшем Советском Союзе, Великобритании и Японии.
Хорошей моделью для изучения персонального и коллективного иммунитета является гриппозная инфекция (рис. 3). В 2014 году было привито 42,2 млн человек против гриппа, что составляет чуть больше 30 % населения.
Почему при гриппе такой низкий порог вакцинации позволяет ликвидировать вспышку заболевания? При расчете индекса репродукции и процента инфицированных лиц надо иметь в виду, что при вспышке инфекции всегда формируется группа лиц, которые иммунизируются естественным путем циркулирующими возбудителями без возникновения признаков заболевания. Вторая группа лиц — лица с легкой формой заболевания, которые не обращаются за медицинской помощью. Численность случаев и интенсивность естественной иммунизации можно установить по лабораторным данным, по появлению или повышению уровня специфических антител. Выявить таких
Рис. 4. Образование клеток памяти в лимфатическом узле: 1 — афферентный лимфатический сосуд, 2 — дендритная клетка, 3 — венулы с высоким эндотелием, 4 — паракортикальная зона, 5 — зародышевый центр, 6 — эфферентный лимфатический сосуд, 7 — кровеносный сосуд, О — наивная клетка, ® — В-клетка памяти, • — Т-клетка памяти.
лиц чрезвычайно трудно, хотя их роль в формировании иммунной прослойки и в становлении коллективного иммунитета, вероятно, огромная. Количество случаев естественной иммунизации бывает очень большим. Например, при гриппе у 50-80 % не вакцинированных взрослых людей появляются антитела без признаков заболевания [51].
Определенную роль в иммунной прослойке может играть феномен «первородного» греха или импринтинга [52, 53] Это обычный анамнестический эффект, наблюдаемый через большой промежуток времени после первичной встречи с антигеном. Этот промежуток может длиться десятилетия. Феномен проявляется при некоторых инфекциях, например, при гриппе и противогриппозной вакцинации. Он наблюдается улиц старшего возраста, которые были инфицированы или вакцинированы много лет назад.
Существует также группа с естественной врожденной невосприимчивостью к инфекции. Она составляет лишь небольшой процент населения и ее трудно учесть при оценке коллективного иммунитета. Численность лиц в этой группе зависит от вида инфекции. Механизмы развития естественной врожденной резистентности к инфекциям связаны, вероятно, с супрессией или отсутствием генов, контролирующих рецепторы к данному возбудителю.
Коллективный иммунитет к конкретной инфекции может сохраняться многие годы. Основу длительного сохранения иммунитета составляет иммунологическая память, в которой участвуют клетки памяти (Т- и В-клетки памяти). Клетки образуются в лимфатических узлах, селезенке и лимфоидных образованиях кишечника из наивных лимфоцитов, которые еще не контактировали с антигеном.
На рисунке 4 показан процесс образования клеток памяти. Различают В-клетки памяти, которые образуются в экстрафолликулярной ткани, и Т-клетки памяти, которые находятся в паракортикальной области лимфатического узла. Клетки памяти слабо пролиферируют (исключение составляет небольшая группа Т-клеток памяти). При вторичной встрече с антигеном клетки памяти превращаются в эффекторные клетки, это обеспечивает быстрый и сильный вторичный иммунный эффект.
Можно предположить, что информация о специфическом иммунитете может храниться в комплексе, который
^^ —инфицированные
— переболевшие или иммунизированные естественным путем —вакцинированные
— невакцинированные
Рис. 5. Схема развития коллективного иммунитета.
состоит из эпитопов антигена и продуктов генов гистосов-местимости I и II типов [53]. Продукты (антигены) гистосов-местимости имеют молекулярные щели и расположенные по бокам спирали. В таких щелях и спиралях могут находиться осколки (эпитопы) антигенов вакцин. В таком виде эпитопы не расщепляются ферментами, это обеспечивает длительное существование иммунологической памяти.
На рисунке 5 указана схема развития коллективного иммунитета. В процессе вакцинации количество лиц, чувствительных к инфекции, уменьшается. Наступает момент, когда они перестают контактировать с инфицированными людьми, появляется коллективный иммунитет и заболеваемость уменьшается.
Существуют факторы, которые препятствуют развитию коллективного иммунитета. Среди них следует отметить следующие факторы:
• генетическая изменчивость микробных штаммов в результате антигенного дрейфа и шифта;
• бактерио- и вирусоносительство;
• случаи «завозных» инфекций;
• большой процент непривитых лиц;
• большое количество привитых лиц без антител или с низкими титрами антител;
• антипрививочное движение.
Особенности коллективного иммунитета зависят от вида инфекции. Ставится под сомнение существование коллективного иммунитета при столбняке.
Нередко ставится под сомнение роль коллективного иммунитета в уменьшении инфекционной заболеваемости. Противники вакцинации считают, что вспышки инфекционных заболеваний можно ликвидировать и без вакцинации населения, а только с помощью соблюдения санитарно-гигиенических правил и повышения неспецифической сопротивляемости к инфекциям.
Конечно, с помощью одних гигиенических и лечебных мероприятий можно снизить инфекционную заболеваемость, однако не в такой степени и не столь эффективно, как это происходит при вакцинации [54, 55]. Для формирования иммунитета, в том числе коллективного иммунитета, решающее значение имеют специфичность иммунитета и иммунологическая память. Они отсутствуют
при проведении мероприятий, укрепляющих только неспецифический иммунитет.
В заключение следует указать основные направления работ по персонализации вакцинации и созданию коллективного иммунитета у вакцинированных людей:
• обеспечить развитие эффективного коллективного иммунитета и формирование иммунитета у слабо реагирующих лиц;
• оградить сильно реагирующих лиц от излишней иммунизации;
• сократить число лиц с поствакцинальными реакциями и осложнениями;
• уменьшить число случаев бактерио- и вирусоноситель-ства;
• решить отдельные вопросы медицинской этики, возникающие при вакцинации.
Индивидуализация вакцинации позволит в более короткие сроки достичь достаточной степени специфического «коллективного иммунитета» и снизить уровень инфекционной заболеваемости.
Литература
1. Брико НИ. Оценка качества и эффективности иммунопрофилактики. Available from: http//www.lvrach.ru/2012/10/ 15435557/22/02/2016.
2. Борисевич ИВ, Мовсесянц АА, Горбунов МА, Медуницын НВ. Вакцины. Проблемы и перспективы. БИОпрепараты. Профилактика, диагностика, лечение 2010; (3): 8-9.
3. Борисевич ИВ, Дармов ИВ, ред. Руководство по вакцинопро-филактике особо опасных инфекций. Ниров; 2011.
4. Dhiman N, Bonilla R, Jacobson R, et al. Differential HLA Gene E expression in Measles Vaccine Seropositive and Seronegative Subjects: A Pilot Study. Scand J Infect Dis. 2003; (35): 332-6.
5. Hohler T, Gerken G, Notghi A, et al. HLA-DRB1*1301 and *1302 protect against chronic hepatitis. B J Hepatol. 1997; 26(3): 503-7.
6. Kaslow RA, Duquesnoy R, Van Raden M, et al.A1, Cw7, B8, DR3 HLA antigen combination associated with rapid decline of T-hel-per lymphocytes in HIV-1 infection. A report from the Multicenter AIDS Cohort Study. Lancet 1990; 335(8695): 927-30.
7. Khomenko AG, LitvinovVI, Chukanova VP, Pospelov LE. Tuberculosis in patients with various HLA phenotypes. Tubercle 1990; 71(3): 187-92.
8. Zavaglia C, Bortolon C, Ferrioli G, et al. HLA typing in chronic type B, D and C hepatitis. J Hepatol. 1996; 24(6): 658-65.
9. Koike S, Taya C, Kurata Т, et al. Transgenic mice susceptible to polioviruses. Proc Nat Acad Sci USA 1991; (88): 951-5.
10. Ren R, Constantini F, GorgaszEJ, etal. Transgenic mice expressing a human poliovirus receptor: a new model for poliomyelitis. Cell 1990; (63): 353-62.
11. Прилуцкий AC, Сохин AA, Майлян ЭА. Связь интенсивности выработки антител к возбудителям дифтерии и столбняка с некоторыми генетическими маркерами у детей, вакцинированных АНДС. Журнал микробиологии, эпидемиологии и иммунологии 1994; (2): 89-92.
12. Bothamley GH, Beck JS, Schreuder GM, et al. Association of tuberculosis and M. tuberculosis-specific antibody levels with HLA. J Infect Dis. 1989; 159(3): 549-55.
13. Hayney MS, Poland GA, Jacobson RM, et al. The influence of the HLA DRB1*13 allele on measles vaccine response. J Invest Med. 1996; (44): 261-3.
14. McNeil AJ, Yap PL, Gore SM, et al. Association of HLA types A1-B8-DR3 and B27 with rapid and slow progression of HIV disease. Quarterly Journal of Medicine 1996; 89(3): 177-85.
15. Нраснянский ВП, Потрываева HB, Борисевич ИВ, Градобоев ВН, Пашанина ТП, Пшеничнов ВА. Оценка возможности получения инактивированной вакцины против лихорадки Ласса. Журнал микробиологии, эпидемиологии и иммунобиологии 1994; (6): 74-5.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
16. Бондарева ТА, Налининский ВБ, Борисевич ИВ, Бондарев ВП, Фоменков ОО. Современное состояние и перспективы решения проблемы повышения эффективности экстренной профилактики и лечения системных бактериальных инфекций. Молекулярная медицина 2009; (5): 21-5.
17. Борисевич ИВ, Михайлов ВВ, Махлай АА. Патогенетические принципы специфической профилактики и лечения особо опасных вирусных геморрагических лихорадок. В кн.: Патогенетические основы лечения острых инфекционных заболеваний. Сборник научных трудов к 70-летию со дня рождения академика В. И. Покровского. М.; 1999. С. 236-44.
18. Нраснянский ВП, Потрываева НВ, Борисевич ИВ, Градобоев ВН, Пашанина ТП, Пшеничнов ВА. Опыт получения инактиви-рованной вакцины лихорадки Ласса. Вопросы вирусологии 1993; (6): 276-9.
19. Богачева НВ, Дармов ИВ, Борисевич ИВ, Нрючков АВ, Печен-кин ДВ. Динамика показателей клеточного иммунитета на фоне введения чумной живой сухой вакцины. Нлиническая лабораторная диагностика 2009; (8): 24-6.
20. Георгиев ТБ. Об аутовакцинотерапии и изготовлении ауто-вакцин. Днепропетровск; 1958.
21. Егорова НБ, Мирошниченко ИВ, Нрейнин ЛС. Иммунологическая реактивность людей к нескольким одновременно вводимым анатоксинам. В кн.: Иммунологические аспекты эпидемиологии. Нишинев; 1977. С. 15-6.
22. Попов ВФ. Норь и коревая вакцина Л-16. М.: Триада-Х; 2002.
23. Басова НН, Русакова ГВ, Готвянская ТП. и др. Результаты серологического контроля медицинских работников для коррекции прививок против дифтерии. Эпидемиология и инфекционные болезни 1997; (5): 42-6.
24. Ерш АВ, Полтавченко АГ, Пьянков СА. и др. Метод комплексной оценки гуморального иммунитета к детским вакциноуп-равляемым вирусным инфекциям. Вопросы вирусологии 2015; 60(1): 41-5.
25. Медуницын НВ. Вакцинология. М.: Триада-Х; 2010.
26. PlatkovE, Berlin K, Glik Y, FischbeinA. Peculiarities of immune status among hospital employees following vaccination with recombinant DNA Hepatitis В vaccine. Intern Journal on Immunorehabilitation 1999; (12 Suppl): 77.
27. Миронов АН, Супотницкий МВ, Лебединская ЕВ. Феномен антитело-зависимого усиления инфекции у вакцинированных и переболевших. БИОпрепараты. Профилактика, диагностика, лечение 2013; (3): 12-25.
28. Fulginiti FA, Eller JJ, Downie AW, Kempe CH. Altered reactivity to measles virus. Atypical measles in children previously immunized with inactivated measles virus vaccines. JAMA 1967; 202:1075-80.
29. Kim HW, Canchola JG, Brandt CD, et al. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine. Am J Epidemiol. 1969; 89:422-34.
30. Маркин ВА, Борисевич ИВ, Махлай АА. Особенности патогенеза вирусных особо опасных геморрагических лихорадок. В
кн.: Патогенетические основы лечения острых инфекционных заболеваний. Сборник научных трудов к 70-летию со дня рождения академика В. И. Покровского. М.; 1999. С. 228-36.
31. Борисевич ИВ, Потрываева НВ, Мельников СА, Евсеев АА, Нраснянский ВП, Максимов ВА. Получение иммуноглобулина к вирусу Марбург на основе сыворотки крови лошадей. Вопросы вирусологии 2008; 53(1): 39-41.
32. Михайлов ВВ, Борисевич ИВ, Тиманькова ГД, Нраснянский ВП, Потрываева НВ, Лебединская ЕВ, Черникова НН. Препарат, содержащий иммуноглобулин против лихорадки Эбола, из сыворотки крови лошадей, жидкий (иммуноглобулин Эбола). Патент на изобретение RUS 2130318 05.07.1996.
33. Нраснянский ВП, Михайлов ВВ, Борисевич ИВ, Потрываева НВ, Мельников СА, Тиманькова ГД. Препарат, содержащий иммуноглобулин против лихорадки Марбург из сыворотки крови лошадей жидкий (иммуноглобулин лошадиный Марбург). Патент на изобретение RUS 2257916 04.12.2003.
34. Хмелев АЛ, Борисевич ИВ, Пантюхов ВБ, Пирожков АП, Сыро-мятникова СИ, Шатохина ИВ, Мельников СА, Шагаров ЕЕ. Использование морских свинок для оценки эффективности ге-терологичного иммуноглобулина против боливийской геморрагическойлихорадки. Вопросы вирусологии 2009; 54(4): 42-4.
35. Ноза НМ, Фельдблюм ИВ, Маркович НИ, Паршин АА. Иммунологический надзор за дифтерией и корью как основа коррекции иммунитета в группах риска. В кн.: Иммунологические реакции в диагностике, профилактике и эпидемиологическом надзоре за инфекционными болезнями. Пермь; 1991. C. 66-71.
36. Polland G, Ovsyannikova I, Jacobson R. Identification of an association between HLA class II alleles and low antibody level afnermea-sels immunization. Vaccine 2002; 20:230-8.
37. Петров РВ, Хаитов РМ, Пинегин БВ, и др. Оценка иммунного статуса человека при массовых обследованиях. Иммунология 1992; (6): 51-62.
38. Пинегин БВ, Чередеев АН, Хаитов PM. Оценка иммунной системы человека: сложности и достижения. Вестник РАМН 1999; (5): 1-15.
39. Нолесин ИД, Воробьева АА, Циберная АЮ. Модельный анализ эффективности ранней иммунизации населения. Эпидемиология и вакцинопрофилактика 2015; (5): 21-6.
40. Иванченко ОИ, Лисицина ТС, Никулина НВ. Математическое прогнозирование иммунологической эффективности ревакцинации взрослых анатоксином. В кн.: Иммунологические реакции в диагностике, профилактике и эпидемиологическом надзореза инфекционными болезнями. Пермь; 1991. С. 71-4.
41. Ношкина НА. Опыт организации серологического контроля защищенности от дифтерии медработников ЛПУ МПС. В кн.: Современная вакцинология. Пермь; 1998. С. 46-7.
42. Организация и проведение серологического мониторинга состояния коллективного иммунитета против управляемых инфекций (дифтерия столбняк, корь, краснуха, эпидемический паротит, полиомиелит). Методические указания МУ 3.1.1760-03.
43. НостиновМП. Вакцинация детей с аллергическими заболеваниями. Методические рекомендации. М.; 1991.
44. Учайкин ВФ, Скачкова ЛО, Смирнов АВ. и др. Вакцинация детей с тяжелой соматической патологией. В кн.: Современная вакцинология. Пермь; 1998. С. 33-4.
45. Юшков ВВ, Юшкова ТА. Иммунодефициты и вакцинация. В кн.: Современная вакцинология. Пермь; 1998. С. 24-5.
46. Hedrich AW. The corrected average attack rate of measles among city children. Am J Epidemiol. 1930; 11(3): 576-600.
47. Брико НИ. Оценка качества и эффективности вакцинации. Медицинский вестник 2015; (9): 1-6.
48. Брико НИ, Лобзин ЮВ, Баранов АА. и др. Оценка эффективности вакцинации: основные подходы и спорные вопросы. Педиатрическая фармакология 2014; 11(4): 8-14.
49. Покровский ВИ, Пак СГ, Брико НИ, Данилкин БН. Инфекционные болезни и эпидемиология. Учебник для врачей. М.: ГЭО-ТАР-Медиа; 2008.
50. Ющук НД, Нулагина МГ. Грипп. В кн.: Инфекционные болезни. Национальное руководство. М.: ГЭОТАР-Медиа; 2009. С. 701-9.
51. Жданов ВМ, Ершов ФИ. Укрощение строптивых: рассказы о вирусах и вирусологии. М.: Медицина; 1988.
52. Супотницкий МВ. Феномен антигенного импринтинга в эпидемических, инфекционных и поствакцинальных процессах. БИОпрепараты. Профилактика, диагностика, лечение 2014; (3): 27-40.
Об авторах
53. Медуницын НВ, Миронов АН, МовсесянцАА. Теория и практика вакцинологии. М.: Ремедиум; 2015.
54. Зверев ВВ, Семенов БФ, Хаитов РМ. Вакцины и вакцинация. Национальное руководство. М.: ГЭОТАР-Медиа; 2011.
55. Медуницын НВ. Нужны ли людям вакцины? М.: Номпания БОРГЕС; 2006.
Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации. Российская Федерация, 127051, Москва, Петровский бульвар, 8, стр. 2. Медуницын Николай Васильевич. Руководитель научного направления, д-р мед. наук, профессор, академик РАН. Олефир Юрий Витальевич. Генеральный директор, д-р мед. наук.
Меркулов Вадим Анатольевич. Заместитель генерального директора по экспертизе лекарственных средств, д-р мед. наук, профессор. Бондарев Владимир Петрович. Директор Центра экспертизы и контроля медицинских иммунобиологических препаратов, д-р мед. наук, профессор.
Адрес для переписки: Медуницын Николай Васильевич; Medunitsyn2012@yandex.ru
Vaccination contribute to the development of personal and herd immunity
N. V. Medunitsyn, Yu. V. Olefir, V. A. Merkulov, V. P. Bondarev
Federal State Budgetary Institution
«Scientific Centre for Expert Evaluation of Medicinal Products» of the Ministry of Health of the Russian Federation, Moscow, Russia
The present article adduces the evidence in support of the need in the development of personalized vaccines and provides with case studies, substantiating the possibility of the mentioned approach. In order to personalize vaccines one should perform preliminary determination of antibody titers (or delayed-type hypersensitivity skin testing) and the subsequent correction of the immunity in patients with low titers of protective antibodies or hyperimmunization symptoms. Vaccine personalization does not require serious financial expenses. The article provides with the advantages of vaccine personalization and the measures that should be taken to achieve this goal. The difficulties of the personalization and the ways to overcome them are described in the article. Vaccine personalization does not require serious financial expenses. It will contribute to the development of preventive vaccination. Personalization of vaccines is necessary for achieving herd immunity, which leads to the reduction in the incidence of the mentioned infection and usually to the reduction of agent circulation. «Immune domain», which includes mostly recovered and vaccinated patients as well as naturally immuned individuals (by circulating infectious agents), plays a decisive role in the development of herd immunity. The effectiveness of herd immunity is reduced due to genetic variability of an agent, frequent vaccination refusals and rejections. Long-term herd immunity is stipulated by immunological memory.
Key words: vaccines; vaccination; differentiated approach; correction of immunity; protective antibody titers; vaccination personalization.
For citation: Medunitsyn NV, Olifer YuV, Merkulov VA, Bondarev VP. Vaccination contribute to the development of personal and herd immunity. BlOpreparations. Prevention, Diagnosis, Treatment 2016; 16 (4): 195-207.
References
1. Briko NY. Assessment of the quality and effectiveness of immunization. Available from: http//www.lvrach.ru/2012/10/15435557/ 22/02/2016 (in Russian).
2. Borisevich IV, Movsesyants AA, Gorbunov MA, Medunitsyn NV. Vaccines. Problems and prospects. BlOpreparaty. Profilaktika, di-agnostika, lechenie 2010; (3): 8-9 (in Russian).
3. Borisevich IV, Darmov IV, eds. Manual on vaccinoprophylaxis of especially dangerous infections. Kirov; 2011 (in Russian).
4. Dhiman N, Bonilla R, Jacobson R, et al. Differential HLA Gene E expression in Measles Vaccine Seropositive and Seronegative Subjects: A Pilot Study. Scand J Infect Dis. 2003; (35): 332-6.
5. Höhler T, Gerken G, Notghi A, et al. HLA-DRB1*1301 and *1302 protect against chronic hepatitis. B J Hepatol. 1997; 26(3): 503-7.
6. Kaslow RA, Duquesnoy R, Van Raden M, et al. A1, Cw7, B8, DR3 HLA antigen combination associated with rapid decline of T-hel-per lymphocytes in HIV-1 infection. A report from the Multicenter AIDS Cohort Study. Lancet 1990; 335(8695): 927-30.
7. Khomenko AG, Litvinov VI, Chukanova VP, Pospelov LE. Tuberculosis in patients with various HLA phenotypes. Tubercle 1990; 71(3): 187-92.
8. Zavaglia C, Bortolon C, Ferrioli G, et al. HLA typing in chronic type B, D and C hepatitis. J Hepatol.1996; 24(6): 658-65.
9. Koike S, Taya C, Kurata T, et al. Transgenic mice susceptible to polioviruses. Proc Nat Acad Sci USA 1991; (88): 951-5.
10. Ren R, Constantini F, Gorgasz EJ, et al. Transgenic mice expressing a human poliovirus receptor: a new model for poliomyelitis. Cell 1990; (63): 353-62.
11. PrilutskyAS, SohinAA, Maylyan EA. The relationship of intensity of development of antibodies to the causative agents of diphtheria and tetanus with some genetic markers in children vaccinated with DTP. Zhurnal mikrobiologii, epidemiologii i immunobiologii 1994; (2): 89-92 (in Russian).
12. Bothamley GH, Beck JS, Schreuder GM, et al. Association of tuberculosis and M. tuberculosis-specific antibody levels with HLA. J Infect Dis. 1989; 159(3): 549-55.
13. Hayney MS, Poland GA, Jacobson RM, et al. The influence of the HLA DRB1*13 allele on measles vaccine response. J Invest Med. 1996; (44): 261-3.
14. McNeil AJ, Yap PL, Gore SM, et al. Association of HLA types A1-B8-DR3 and B27 with rapid and slow progression of HIV disease. Quarterly Journal of Medicine 1996; 89(3): 177-85.
15. Krasnyansky VP, Potryvaeva NV, Borisevich IV, Gradoboev VN, Pashanina TP, Pshenichnov VA. An evaluation of the possibility of obtaining an inactivated vaccine against Lassa fever. Zhurnal mikrobio-logii, epidemiologii i immunobiologii 1994; (6): 74-5 (in Russian).
16. Bondareva TA, Kalininsky VB, Borisevich IV, Bondarev VP, Fomen-kov OO. Modern state and prospects for the solution of the problem of the increase the efficacy of emergency prophylaxis and therapy of systemic bacterial infections. Molekulyarnaya meditsina 2009; (5): 21-5 (in Russian).
17. Borisevich IV, Mikhaylov VV, MakhlayAA. Pathogenetic principles of specific prevention and treatment of dangerous viral hemorrhagic fevers. In: Pathogenetic bases of treatment of acute infectious diseases. Collection of scientific works of the 70th anniversary of the birth of Academician V. I. Pokrovsky. Moscow; 1999. P. 236-44 (in Russian).
18. Krasnyansky VP, Potryvaeva NV, Borisevich IV, Gradoboev VN, Pashanina TP, Pshenichnov VA. Experience of preparing inactivated vaccine against Lassa fever. Voprosyvirusologii 1993; (6): 276-9 (in Russian).
19. Bogacheva NV, Darmov IV, Borisevich IV, KryuchkovAV, Pechenkin DV. The time course of changes in cell immunological parameters during administration of live dry plague vaccine. Klinicheskaya la-boratornaya diagnostika 2009; (8): 24-6 (in Russian).
20. Georgiev Tb. On autovaccinotherapy and the manufacture of autovaccines. Dnepropetrovsk; 1958 (in Russian).
21. EgorovaNB, Miroshnichenko IV, KreyninLS. Immunological reactivity of people at the same time the injected toxoids. In:. Immunological aspects of epidemiology. Kishinev; 1977: 15-6 (in Russian).
22. Popov V. F. Measles and measles vaccine L-16. Moscow: Triada-X; 2002 (in Russian).
23. Basova NN, Rusakova GV, Gotvyanskaya TP, et al. The results ofse-rological testing of healthcare workers for the correction of vaccinations against diphtheria. Epidemiologiya i infektsionnye bolezni 1997; (5): 42-6 (in Russian).
24. Ersh AV, Poltavchenko AG, P’yankov SA, et al. The method of estimation of humoral immunity to vaccine-controlled children’s viral infections. Voprosyvirusologii 2015; 60(1): 41-5 (in Russian).
25. Medunitsyn NV. Vaccinology. Moscow: Triada-X; 2010 (in Russian).
26. PlatkovE, Berlin K, Glik Y, FischbeinA. Peculiarities of immune status among hospital employees following vaccination with recombinant DNA Hepatitis B vaccine. Intern Journal on Immunorehabilitation 1999; (12 Suppl): 77.
27. MironovAN, Supotnitsky MV, Lebedinskaya EV. The phenomenon of antibody-dependent enhancement of infection in vaccinated and convalescents. BIOpreparaty. Profilaktika, diagnostika, lechenie 2013; (3): 12-25 (in Russian).
28. Fulginiti FA, EllerJJ, Downie AW, Kempe CH. Altered reactivity to measles virus. Atypical measles in children previously immunized with inactivated measles virus vaccines. JAMA 1967; 202:1075-80.
29. Kim HW, Canchola JG, Brandt CD, et al. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine. Am J Epidemiol. 1969; 89:422-34.
30. Markin VA, Borisevich IV, MakhlayAA. Features of the pathogenesis of viral hemorrhagic especially dangerous fevers. In: Pathogenetic bases of treatment of acute infectious diseases. Collection of scientific works of the 70th anniversary of the birth of Academician V. I. Pokrovsky. Moscow; 1999. P. 228-36 (in Russian).
31. Borisevich IV, Potryvayeva NV, MelnikovSA, EvseevAA, Krasnyansky VP, Maksimov VA. Design of equine serum-based Marburg virus immunoglobulin. Voprosy virusologii 2008; 53(1): 39-41 (in Russian).
32. Mikhaylov VV, Borisevich IV, Timankova GD, Krasnyansky VP, Potryvaeva NV, Lebedinskaya EV, Chernikova NK. Preparation containing immunoglobulin against Ebola fever from horse blood serum and liquid Ebola immunoglobulin. Patent RUS 2130318 05.07.1996 (in Russian).
33. Krasnyansky VP, Mikhaylov VV, Borisevich IV, Potryvaeva NV, MelnikovSA, Timankova GD. Liquid preparation containing immunog-lobulin efficient against Marburg fever from horse blood serum (horse immunoglobulin Marburg). Patent RUS 2257916 04.12.2003 (in Russian).
34. KhmelevAL, Borisevich IV, PantyukhovVB, PirozhkovAP, Syromy-atnikovaSI, Shatokhina IV, MelnikovSA, Shagarov EE. Use of gui-
nea pigs to evaluate the efficacy of a heterological immunoglobulin against Bolivian hemorrhagic fever. Voprosy virusologii 2009; 54(4): 42-4 (in Russian).
35. Koza NM, Feldblyum IV, Markovych NI, Parshin AA. Immunological surveillance of diphtheria and measles as a basis of correction of immunity in high-risk groups. In: Immunological reactions in diagnostics, prevention and epidemiological surveillance for infectious diseases. Perm; 1991. P. 66-71 (in Russian).
36. Polland G, Ovsyannikova I, Jacobson R. Identification of an association between HLA class II alleles and low antibody level afnermea-sels immunization. Vaccine 2002; 20: 230-8.
37. Petrov RV, Haitov RM, Pinegin BV, et al. Evaluation of the immune status of the person at mass inspections. Immunologiya 1992; (6): 51-62 (in Russian).
38. Pinegin BV, Cheredeev AN, Haitov RM. Assessment of the human immune system: complexities and achievements. Vestnik RAMN 1999; (5): 1-15 (in Russian).
39. Kolesin ID, Vorobieva AA, Tsibernaya AYu. Model analysis of the effectiveness of early immunization. Epidemiologiya i vaktsinoprofi-laktika 2015; (5): 21-6 (in Russian).
40. Ivanchenko OI, Lisitsyna TS, Nikulina NV. Mathematical prediction of the immunological efficacy of revaccination of adults toxoid. In: Immunological reactions in diagnostics, prevention and epidemiological surveillance for infectious diseases. Perm; 1991. P. 71-74 (in Russian).
41. Koshkina NA. The experience of organization of control ofserologi-cal protection against diphtheria health care workers. In: Modern vaccinology. Perm; 1998. P. 46-7 (in Russian).
42. Organizing and conducting serological monitoring of the state of collective immunity against controllable infections (diphtheria, tetanus, measles, rubella, mumps, polio). Guidelines MU 3.1.1760-03 (in Russian).
43. Kostinov MP. Vaccination of children with allergic diseases. Guidelines. Moscow; 1991 (in Russian).
44. Uchaykin VF, Skachkova LO, SmirnovAV, etal. Vaccination ofchild-ren with severe somatic pathology. In: Modern vaccinology. Perm; 1998. P. 33-4 (in Russian).
45. Yushkov VV, Yushkova TA. Immunodeficiency and vaccination. In: Modern vaccinology. Perm; 1998. P. 24-5 (in Russian).
46. Hedrich AW. The corrected average attack rate of measles among city children. Am J Epidemiol. 1930; 11(3): 576-600.
iНе можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
47. Briko NI. Assessment of the quality and the effectiveness of vaccination. Meditsinski vestnik 2015; (9): 1-6 (in Russian).
48. Briko NI, Lobzin YuV, BaranovAA, etal. Evaluation of the effectiveness of vaccination: basic approaches and controversial. Pediatric-heskaya farmakologiya 2014; 11(4): 8-14 (in Russian).
49. Pokrovsky VI, Pak SG, Briko NI, Danilkin BK. Infectious diseases and epidemiology. Manual for doctors. Moscow: GEOTAR-Media; 2008 (in Russian).
50. Yushchuk ND, Kulagina MG. Flu. In: Infectious Diseases. National guideline. Moscow: GEOTAR-Media; 2009. P. 701-9 (in Russian).
51. Zhdanov VM, Ershov FI. Taming of the Shrew: stories about viruses and virology. Moscow: Meditsina; 1988 (in Russian).
52. Supotnitsky MV. The phenomenon of antigenic imprinting in the epidemic, infectious and post-vaccination processes. BIOpreparaty. Profilaktika, diagnostika, lechenie 2014; (3): 27-40 (in Russian).
53. Medunitsyn NV, MironovAN, Movsesyants AA. Theory and practice of vaccinology. Moscow: Remedium; 2015 (in Russian).
54. Zverev VV, Semenov BF, Haitov RM. Vaccines and vaccination. National guideline. Moscow: GEOTAR-Media; 2011 (in Russian).
55. Medunitsyn NV. Do people need the vaccines? Moscow: BORGES; 2006 (in Russian).
Authors
Federal State Budgetary Institution «Scientific Centre for Expert Evaluation of Medicinal Products» of the Ministry of Health of the Russian Federation, Petrovsky boulevard 8, bld. 2, Moscow 127051, Russian Federation.
Medunitsyn NV. Head of scientific direction. Doctor of Medical Sciences, professor, academician of the Russian Academy of Sciences. Olefir YuV. Director-General. Doctor of Medical Sciences.
Merkulov VA. Deputy Director-General for Evaluation of Medicinal Products. Doctor of Medical Sciences, professor.
BondarevVP. Director of Centre for examination and control of medical immunobiological preparations. Doctor of Medical Sciences, professor.
Работа человеческого иммунитета сложна, а её сбои грозят тяжёлыми последствиями. Поэтому вокруг прививок возникает много мифов и заблуждений. Отделить факты от вымысла нам поможет врач-иммунолог из «Клиники Эксперт» Смоленск Ульяна Владимировна Чемова.
– Ульяна Владимировна, расскажите, пожалуйста, о действии прививок.
– Это сложный процесс, но объяснить его в общих чертах вполне возможно. При попадании в организм обезвреженных (убитых или ослабленных) микроорганизмов лимфоциты активизируются. Для борьбы с антигеном вырабатываются иммуноглобулины. Вырабатываются и антитела и плазматические лимфоциты – клетки памяти. И если человеку придётся вновь столкнуться с теми же болезнетворными микроорганизмами, но уже не ослабленными, благодаря клеткам памяти иммунный ответ будет сильнее и быстрее. Скорее всего, человек не заболеет вовсе. Если же заболеет, болезнь будет протекать намного легче, риск осложнений у привитых людей ниже.
– Существует идея, что естественный иммунитет способен сопротивляться любым инфекциям, а прививки его ослабляют. Прививки действительно вредны для иммунитета?
– Есть два вида иммунитета: врождённый и адаптивный. Врождённый начинает действовать сразу при появлении ребёнка на свет. Он не обладает специфичностью: организм одинаково реагирует на все микроорганизмы, с которыми взаимодействует. Этот вид иммунитета заложен генетически, на него нельзя повлиять.
Последний случай оспы в Европе
зарегистрирован в 1978 году
Потом включается и адаптивный иммунитет. Он формируется в течение жизни и зависит от того, с какими микроорганизмами человеку приходится сталкиваться. Адаптивный иммунитет специфичен. Прививки не ослабляют, а тренируют его: контакт с обезвреженными микроорганизмами помогает сформировать иммунитет до непосредственной угрозы заболевания.
Ротавирусная инфекция протекает
у детей особенно тяжело,
приводит к обезвоживанию
Эпидемии прошлого, уносившие множество жизней – яркий пример того, что без тренировки с помощью прививок иммунитет далеко не всегда может справиться с угрозой. Теперь многие болезни забыты. Так, последний случай оспы в Европе зарегистрирован в 1978 году. На 99% сократилась заболеваемость паротитом, почти побеждены дифтерия, полиомиелит.
– Какие вакцины сейчас входят в национальный календарь прививок?
– До 2017 года в календарь входило 10 прививок. Это первичные прививки и ревакцинации от гепатита В, туберкулёза, пневмококковой инфекции, полиомиелита, комплексные вакцины АКДС (от коклюша, дифтерии и столбняка) и ККП (от кори, краснухи и эпидемического паротита). После 2017 года в национальный календарь добавили прививки от гемофильной и пневмококковой инфекции, вируса гриппа.
– На чём основаны даты в этом календаре?
– На заре эры прививок у учёных было мало данных, поэтому о составлении графика речи не шло. Но с развитием медицины получилось собрать данные о том, в какое время человек особенно уязвим для разных инфекций, когда происходит первый контакт с возбудителями болезней в естественной среде, как долго формируется иммунитет после той или иной прививки и как долго клетки сохраняют память о специфике антигена. Это позволило определить оптимальные сроки для вакцинации и ревакцинации и составить график.
В 2011 году почти все штаты США не провели нужного числа вакцинаций от коклюша. В итоге на следующий год заболели 42 тысячи человек. Цитата из материала «Кто придумал прививки?»
– С какими последствиями можно столкнуться, если делать детям прививки не по графику?
– При отклонении от графика человек может оказаться беззащитен перед опасными болезнями именно в тот период, когда защита особенно необходима. Это повышает вероятность заболевания, грозит тяжёлым течением болезни и возникновением осложнений.
– Некоторые делают все прививки по графику, а помимо них ещё и ряд прививок, не включённых в график. Есть ли в этом смысл?
– Обычно о дополнительных прививках задумываются ответственные, образованные родители, которые привыкли сами во всё вникать и анализировать информацию. Востребованы прививки от ротавируса, гепатита А, ветряной оспы. Безусловно, в этом есть смысл.
Как происходит заражение ротавирусной инфекцией? Узнать здесь
Ротавирусная инфекция протекает у детей особенно тяжело, приводит к обезвоживанию, нередко дело доходит до реанимации. Часто болеют дети в возрасте от года до пяти лет. Вакцина «Ротатек» применяется орально, вводится трёхкратно детям до года. Таким образом, к моменту контакта с вирусом в естественной среде ребёнок уже защищён.
Бельгийская вакцина «Хаврикс» и французская «Аваксим» позволяют защититься от вируса гепатита А. Гепатит А излечим, но может приводить к таким осложнениям, как холангит, печёночная недостаточность. Лучше защитить себя заранее.
– Расскажите, пожалуйста, про коллективный иммунитет?
– Коллективный (популяционный) иммунитет – это снижение вирусной нагрузки на популяцию в целом благодаря большому количеству переболевших (и выживших после болезни) или вакцинации. Формируется иммунная прослойка, вследствие чего люди, не обладающие специфическим иммунитетом к той или иной болезни, тоже не попадают в зону риска. Чтобы обезопасить общество от коклюша, иммунная прослойка должна составлять как минимум 80% от популяции. Для предотвращения гепатита В необходимо создать специфический иммунитет не менее чем у 90% населения.
– Кому прививки действительно противопоказаны? На какую защиту могут надеяться эти люди?
– Есть люди с иммунодефицитом. Они не могут сформировать специфический ответ даже после вакцинации. Любые болезнетворные микроорганизмы, даже в ослабленных живых вакцинах, при иммунодефиците опасны. Контакт же с вирусами и бактериями в естественной среде для пациента с иммунодефицитом часто оказывается роковым. Причины иммунодефицита различны: врождённые нарушения, терапия при онкологических заболеваниях и трансплантации, ряд инфекционных и неинфекционных патологий.
Защитить этих людей можно. Чем выше коллективный иммунитет, тем ниже риск встретиться с болезнетворными микроорганизмами. Таким образом, человек, у которого нет противопоказаний, прививкой в первую очередь защищает себя, но также помогает выжить людям, не способным сформировать иммунный ответ.
– Какие заблуждения по поводу прививок вы сами как врач встречали у пациентов?
– Есть две категории пациентов. В первую входят люди, отказывающиеся от прививок по религиозным, идеологическим и иным нерациональным мотивам. Их основной аргумент: «Это чужое, этого в организме быть не должно». Такие пациенты не думают о конкретном вреде или пользе. Переубедить их сложно.
Связи аутизма и расстройств
аутического спектра с прививками
обнаружить не удалось
Ко второй категории относятся люди, боящиеся того или иного вреда, прочитавшие что-то пугающее на антипрививочных сайтах. Если таким людям предоставить достоверную информацию, объяснить, как обстоят дела в действительности, они обычно отказываются от заблуждений.
– Среди мифов о прививках популярна версия о связи прививок и аутизма. Прокомментируйте, пожалуйста.
– Впервые о такой связи заговорил британский врач Эндрю Уэйкфилд в середине 90-х гг. ХХ века. Однако выяснилось, что достоверных исследований врач не проводил. Более того, у него был коммерческий интерес в том, чтобы общество опасалось действующих вакцин: он старался продвигать свой препарат.
Но, поскольку теорию уже выдвинули, стали проводить масштабные исследования. Какой-либо связи аутизма и расстройств аутического спектра с прививками обнаружить не удалось. Не подтвердилась и версия о роли тиомертиолятов (консервирующих средств для прививок) в возникновении подобных состояний.
К возможным осложнениям от прививок аутизм не относится.
– Какие осложнения действительно могут вызвать прививки?
– В первую очередь стоит разграничить термин «осложнение» и «реакция». Реакция на прививку – нормальное явление. Пока формируется иммунный ответ, у пациента может наблюдаться изменение эмоционального фона (раздражительность и т. д.), временное ухудшение самочувствия, утомляемость, подъём температуры. При этом при нормальной реакции температура никогда не поднимается выше 40°. При прививках от кори и краснухи могут возникать высыпания. Реакция отличается от осложнений тем, что она кратковременна и не несёт угрозы жизни и здоровью.
Пример подала сама императрица: начало прививочной кампании было положено 12 октября 1768 года. Цитата из материала «Екатерина Великая: организатор здравоохранения, педиатр и педагог»
Температура выше 40° считается осложнением, встречается редко. К осложнениям относится слишком выраженная местная реакция: гиперемия, папула более 10 сантиметров, судороги, высокая температура более 2 дней. Осложнение может стать следствием неправильной трактовки состояния ребенка перед прививкой (если вакцину вводят уже заболевшему ребенку в продромальном периоде).
Осложнения возникают в одном случае на нескольких сотен или тысяч прививок. Каждый случай подробно изучают, выясняют причины. Болезни у непривитых – гораздо более частое и опасное явление.
– Как правильно вести себя после прививки?
– В течение 40 минут следует оставаться рядом с процедурным кабинетом. В кабинете есть противошоковые средства, поэтому при возникновении анафилактического шока помощь будет оказана немедленно. В первый день не стоит мочить место укола, чтобы избежать инфицирования. Также не надо загорать, перегреваться, допускать иные перегрузки. Нельзя резко менять климат: такая нагрузка может оказаться для организма чрезмерной. Нужно следить, чтобы прививка не сочеталась с введением в рацион новых продуктов, приёмом не употреблявшихся ранее лекарств. Иначе при возникновении аллергической реакции невозможно будет понять, чем она вызвана.
После оральных вакцин на два часа следует отказаться от приёма пищи.
Желательно держать связь с лечащим врачом, сообщать о появлении тех или иных симптомов.
– Надо ли делать прививки взрослым?
– Надо. Вакцина АКДС требует ревакцинации каждые 7 – 9 лет. Если в детстве женщина пропустила прививку от краснухи, желательно сделать прививку до наступления репродуктивного периода (согласно клиническим рекомендациям, до 25 лет). Краснуха страшна не столько для взрослых людей, сколько для плода в период формирования. Вакцинацию от кори проводят до 35 лет, но лицам из группы риска до 55 лет. Существуют и другие показания (поездки в другие регионы и т. д.) о которых предупредит врач.
Беседовала Дарья Ушкова
Редакция рекомендует:
Иммунитет под контролем! Создаём крепкий тыл ребёнку
Детская ложь. Разбираемся с причинами
Непривитые дети – самые здоровые?
Для справки:
Чемова Ульяна Владимировна
В 2006 году окончила Смоленскую государственную медицинскую академию
В 2006-2007 годах прошла интернатуру по специальности «Педиатрия»
В 2013 – первичную переподготовку по специальности «Аллергология и иммунология»
С декабря 2016 года работает врачом-педиатром и аллергологом-иммунологом в ООО «Клиника Эксперт Смоленск»
На самом ли деле ребенок первого года жизни защищен от инфекций материнскими антителами и грудным вскармливанием, и прививать его не обязательно?
Норожденный ребенок способен к полноценному иммунному ответу на большинство антигенов, в том числе на некоторые вакцинные, такие как вакцина БЦЖ и вакцина против гепатита В.
Первые дни после рождения ребенок защищен только теми антителами, которые он получил внутриутробно от матери. А это значит, что он защищен от инфекций настолько, насколько защищена его мать.
Внутриутробно ребенок получает защитные антитела (IgG) только к тем инфекциям, которыми его мать переболела или от которых была привита. Если после вакцинации матери после дифтерии и столбняка прошло более 10 лет, то она не защищена и, соответственно, антител к этим инфекциям ребенку передать не может.
При этом, чем ниже уровень циркулирующих антител у матери, тем раньше исчезнут из крови ребенка материнские антитела. Но даже наличие материнских антител не всегда является гарантией защиты ребенка от инфицирования.
При ряде заболеваний, таких, например, как коклюш и туберкулез, иммунная защита обуславливается главным образом клеточным компонентом. Полученные от матери антитела при этих заболеваниях не в состоянии полностью освободить организм ребенка от возбудителя, если заражение произошло.
Материнские антитела, переданные младенцем, имеют малую продолжительность жизни, их потенциальный протективный эффект достаточно короткий. Они не снижают эффективность вакцинации инактивированными вакцинами, требующими нескольких введений.
Прививки против вирусных инфекций (корь, паротит, ветряная оспа) проводят в возрасте 1 года, т.к. против данных инфекций материнские антитела сохраняются более длительное время и влияют на эффективность вакцинации.
Создать специфическую защиту от инфекций грудное вскармливание не может.
В грудном молоке содержится IgA, который обеспечивает местную защиту от антигенов, проникающих через слизистую оболочку кишечника. Этот факт доказывается тем, что дети, находящиеся на грудном вскармливании, те не менее, являются восприимчивыми к инфекционным заболеваниям. Что уж говорить про тех детей, кто и этого не имеет, а с рождения находится на искусственном вскармливании?
Т.о., даже при условии наличия у матери иммунитета (естественного или поствакцинального) к инфекционным заболеваниям ее ребенок может быть защищен только в первые несколько недель своей жизни. Однако именно в течение первого года жизни ребенок в силу своих морфофункциональных особенностей наиболее уязвим для инфекций, протекающих в этой возрастной группе с наибольшим количеством осложнений и неблагоприятных исходов.
Возвращаясь к способности детей первых месяцев жизни к полноценному иммунному ответу на вакцинацию, следует отметить, что все педиатрические вакцины специально разрабатываются с учетом особенностей иммунной системы детей первых месяцев жизни.
Любая вакцина проходит клинические исследования эффективности и безопасности именно в тех возрастных группах, в которых планируется ее применение.
Без предъявления результатов этих исследований ни одна вакцина никогда не будет допущена к использованию.
В качестве примера можно привести пневмококковые вакцины, применяемые с 2-месячного возраста. Все они являются коньюгированными (конъюгированне — технология, заключающаяся в соединении полисахаридов пневмококка с белком-носителем), что дает возможность активации системы Т лимфоцитов и образовании клеток иммунологической памяти. В связи с этой особенностью конъюгированные вакцины, в отличие от полисахаридных, способны вызывать прочный и длительный иммунный ответ у детей первых месяцев жизни.
Иммунитет при вакцинации и при натуральной инфекции: что лучше
Иммунитет, развившийся в результате инфекции, называют естественным, а в результате вакцинации — искусственным. Но искусственный — совсем не означает “поддельный”, он означает “искусственно смоделированный”.
Вакцинация (активная иммунизация) — это искусственное воспроизведение иммунного ответа путем введения вакцины с целью создания невосприимчивости к инфекциям.
Вакцины — это препараты, содержащие специфический антиген — ослабленный или инактивированный (неживой) возбудитель, или его отдельные частицы.
При контакте с возбудителем инфекции или с вакцинным антигеном организм включает одни и те же механизмы иммунного ответа.
При введении инактивированной вакцины антигена немного и он не размножается. Поэтому после первого введения такая вакцина не создает прочного иммунного ответа, и ее необходимо вводить несколько раз. Чем ребенок младше, тем большее число введений необходимо. Нужное число введений устанавливается в исследованиях, и при незаконченной вакцинации невозможно гарантировать хорошего защитного эффекта.
Длительность постпрививочного иммунитета зависит от свойств вакцины. В большинстве случаев иммунитет после прививки и перенесенной инфекции имеет одинаковую продолжительность. Например, у людей, получивших прививку от кори более 40 лет назад, до сих пор в крови определяются антитела в защитных концентрациях. Что дает основание предполагать, что иммунитет пожизненный. То же самое можно сказать в отношении других ослабленных живых вакцин — против паротита, краснухи, ветряной оспы и полиомиелита.
Отдельно надо остановится на такой инфекции как столбняк. Иммунитет при естественной инфекции не формируется, из-за малой дозы токсина, попадающего в организм, а при вакцинации формируется.
Меньшую длительность иммунитета по сравнению с естественной инфекцией дает коклюшная вакцина. Естественный иммунитет к коклюшу снижается с возрастом, но постпрививочный снижается быстрее, и к школьному возрасту дети от коклюша уже не защищены.
Это, бесспорно, отрицательный факт, однако ситуация к настоящему времени исправлена: создана вакцина для защиты школьников от коклюша Адасель, которая введена в Национальные календари прививок во многих странах.
Еще одна инфекция, при которой пост прививочный иммунитет ослабевает быстрее, чем естественный — это клещевой энцефалит. Однако тяжесть и исходы его таковы, что лозунг “Лучше переболеть, чем привиться” в отношении данного заболевания даже ярыми противниками вакцинации обычно не используются.
На прием иногда приходят родители с требованием “определить иммунитет ребенка до прививки”, т.е. посредством опроса, удается выяснить, что они хотят выяснить хорошо ли работает иммунная система и есть ли у ребенка антитела к инфекциям, против которых его собираются прививать. Причем присылает родителей врачи неврологи, педиатры и другие специалисты.
Хочется напомнить коллегам, что показатели иммунограммы не могут служить доказательством “ослабления” или “повышения” иммунитета, если они не сопровождаются соответствующими клиническими проявлениями, например высокая инфекционная заболеваемость.
Безусловно, часто и длительно болеющие дети, с кучой проблем в здоровье, не отвечающие на стандартное лечение, в первую очередь нуждаются в обследовании (для установления правильного диагноза), а не в вакцинации. Здоровым детям иммунологическое обследование не нужно.
Иногда приходится сталкиваться с родителями, которые хотят выяснить, есть ли у ребенка аллергия и просят определить уровень общего иммуноглобулина (IgE) Е, что не имеет никакой рациональной основы.
1. Для поствакцинальных аллергических реакций имеет роль только предшествующая сенсибилизация антигенами, входящими в вакцину.
2. Даже при отсутствии в организме высокого уровня специфических IgE сохраняется риск анафилактоидных реакций (предшествующая сенсибилизация не нужна).
3. Тщательный сбор аллергологического анамнеза вполне может заменить определение IgE.
Без сомнения, бывают ситуации, когда ребенка с аллергией необходимо обследовать перед прививкой.
Вывод из всего этого: нет никакого смысла массово исследовать иммунный статус или уровень общего IgE здоровым детям (перед вакцинацией необходимо сдать клинический анализ крови и общий анализ мочи), такая необходимость возникает в отношении детей с хроническими заболеваниями, сопровождающимися патологией иммунной системы.
Нужна ли она вообще, особенно, если мы живем в городе, где нет опасных инфекций?
На самом деле опасные инфекции, такие как дифтерия и полиомиелит встречаются не так часто. Так может быть и вакцинопрофилактика, нужная раньше, сегодня стала неактуальной?
Раньше на нашей планете свирепствовали инфекции: оспа, полиомиелит, дифтерия и корь убивали людей тысячами и миллионами. Но сейчас у нас нормальные бытовые условия, дети живут в чистоте.
Опасные инфекции — это пережиток прошлого и в основном эти инфекции встречаются в отсталых странах Африки, Азии. Так обычно думает пришедшая на прием мама, подписывающая отказ от вакцинации. Так ли это?
Отчасти да. В нашей стране еще сохраняется приличный охват вакцинацией, ситуация с инфекциями достаточно благополучна. Но люди путешествуют, переезжают из страны в страну, из города в в город.
Для наглядности это напоминает коммунальную квартиру: мы живем в отдельной комнате этой квартиры, жители которой все время перемещаются по ней. В одной комнате — чистота и уют, а в других опасные инфекции. И даже если вы из своей комнаты не выходите никуда, эти инфекции вам доставят на дом те, кто между комнатами перемещается, а их не мало. И случается вспышка, а в худшем случае эпидемия, например кори.
С 2008г. в Европе распространилась эпидемия кори, причиной которой стали низкий охват вакцинацией и накопление в обществе большой доли неиммунных лиц.
Источником инфекции стали иммигранты, туристы, посещающие неблагополучные по заболеваемости страны. Наибольшему риску оказались подвержены дети 1-го года жизни, которые еще не успели ее получить, дети-дошкольники, не получившие ревакцинацию, непривитые взрослые.
Только в Европе за 1 год заболело корью более 37 тыс.человек, были летальные исходы и случаи коревого энцефалита, а также подострого склерозирующего панэнцефалита — тяжелого прогрессирующего заболевания нервной системы, заканчивающегося летально (позднее осложнение кори).
Вакцинации детей и взрослых с аллергическими заболеваниями насколько это нужно?
Бытует мнение, что прививать можно только здоровых, “крепких” детей. Их, конечно, нужно прививать, но в первую очередь вакцинировать надо ослабленных, с хроническими заболеваниями детей и взрослых, т.к. они наиболее тяжело переносят инфекционные заболевания.
В последние годы в России появились импортные вакцины, у отечественных вакцин улучшилось качество. Проведены масштабные исследования, которые показали, что пациенты с аллергическими заболеваниями (БА, АР, АД, пищевая аллергия и др.) хорошо вырабатывают специфический иммунитет в отношении возбудителей инфекций при вакцинации, при этом утяжеления заболевания у них не наблюдается.
Но у людей с аллергией есть противопоказания к вакцинации, о которых вы должны знать:
- реакция на антибиотики — амигликозиды (гентамицин, канамицин, неомицин, амикацин) – живые вакцины;
- пищевая аллергия на куриные яйца, в частности на куриный белок, если таковой присутствует в вакцине (импортная вакцина корь, паротит, краснуха);
- временное противопоказание — острая инфекция или обострение аллергического заболевания.
Поэтому я остановлюсь на моментах, что вы, как родители или взрослые пациенты сами, может сделать, чтобы легче перенести прививку.
-
Прививка
делается
во время ремиссии аллергического заболевания.
- Если проводится базисная терапия, то вакцинация проводится на фоне данного лечения.
- Если врач рекомендует на время вакцинации увеличить дозу какого-то препарата из базисной терапии, необходимо это сделать. И самое главное, нельзя отменять базисную терапию на время вакцинации, даже если вы хорошо себя чувствуете.
- Важно не контактировать с больными ОРВИ.
- Если у вас пищевая аллергия, необходимо соблюдать диету.
- После вакцинации надо посидеть 30 минут в медицинском учреждении. Это время за которое может проявиться острая аллергическая реакция и потребуется помощь врача.
Может ли вакцинация оказаться неэффективной? Может ли человек заболеть, несмотря на прививку?
Иногда может. Есть несколько причин, почему болеют привитые люди (и привитые дети).
Причина1. Не существует вакцин с абсолютной эффективностью, как не существует инфекционных болезней, одинаково контагиозных для всех людей.
Любое, даже заразное инфекционное заболевание не имеет абсолютной контагиозности; любая даже самая эффективная вакцина не обладает абсолютной защитой.
Причина 2. Только для живых вакцин — гибель вакцинного штамма.
Живые вакцины могут оказаться неэффективными в связи с неправильным их хранением и гибелью вакцинного штамма, или в связи с уничтожением вакцинных вирусов в организме до выработки антител.
Причина 3. Послепрививочный иммунитет имеет различную продолжительность.
Есть вакцины (живые), одно введение которых обеспечивает продолжительный, возможно, пожизненный иммунитет. Есть вакцины, которые создают иммунитет напряженный, но кратковременный. Например, коклюшная вакцина обеспечивает иммунитет в течение 5 лет. Последнее введение вакцины от коклюша проводится детям в 1,5 года. Т.е. школьники по документам все привиты, но на самом деле не имеют иммунитета против коклюша, и не могут считаться защищенными.
Причина 4. Вакцина защищает только от той инфекции, от которой она предназначена.
Возьмем такую распространенную инфекцию, как грипп. Большинство взрослых переносит его за зиму 3 и более раз. Я думаю, что вы знаете, что не всякий насморк — грипп по сути, и что вакцина против гриппа защищает только от грипп, а не от всей группы респираторных инфекций.
Причина 5. Для того, чтобы вакцина начала защищать, должно пройти время.
Это время для каждой вакцины различное. Есть вакцины с быстрой выработкой антител (коревая), и она защитит, даже если введена в первые дни после контакта. И есть вакцины с медленной выработкой антител через 2-4 недели после введения. Привили и заболел. Иногда это значит, что привили слишком поздно.
Прививочный коллективный иммунитет (КИ) — он миф или реальность?
КИ формируется в популяции, когда значительная доля населения является иммунной (привитой или переболевшей): при этом прерывается передача инфекции и снижается уровень носительства соответствующего возбудителя.
Таким образом, КИ обуславливает блок путей передачи возбудителя; это понятие относится только к инфекционным заболеваниям, которые передаются от человека к человеку.
Рассмотрим несколько неправильных представлений о КИ.
1. Все вакцины создают КИ (неверно).
КИ создается вакцинацией только в случае, когда источником инфекции является человек. Например, вакцинация против столбняка, бешенства, клещевого энцефалита может обеспечить только индивидуальную защиту привитого человека.
2. КИ развивается только в результате вакцинации (неверно).
КИ может сформироваться не только при вакцинации, но и в результате массовых инфекционных заболеваний (в случае, если инфекция вызывает формирование стойкого иммунитета!)
3. КИ не существует вообще, это выдумка, чтобы оправдать необходимость охвата прививками (неверно).
Чем больше переболевших (иммунных) людей, тем меньше шансов возникнуть новым случаям заболевания. Со временем доля иммунных лиц снижается (рождаются дети, приезжают непривитые люди, снижается иммунитет у переболевших) и возникает подъем заболеваемости. Вакцинопрофилактика формирует КИ без возникновения инфекционного заболевания.
4. Почему мы должны заботиться о КИ? Каждый отвечает за себя и своего ребенка! Пусть кому надо, тот и прививает! (неверно).
Формируя КИ (иммунную прослойку), мы защищаем людей, которые в силу различных причин не могут быть привиты (маленькие дети, не достигшие возраста вакцинации, взрослые и дети с противопоказаниями, пожилые люди, у них иммунитете снижается с возрастом и заболевания протекают тяжело).
Защита детей первых месяцев жизни зависит от иммунной прослойки в семье. Детей заражают старшие братья и сестры, родители, бабушки, няни и к сожалению некоторые случаи заканчиваются неблагоприятными исходами.
Правда ли, что если ребенок переболеет инфекционным заболеванием, то он приобретет пожизненный иммунитет, а при вакцинации иммунитет недолговечный, поэтому прививки все время повторяют?
Длительность послепрививочного иммунитета в первую очередь зависит от свойств примененной вакцины. В большинстве случаев иммунитет после прививки или после перенесенной инфекции имеет одинаковую продолжительность, хотя бывают отклонения как в ту, так и в другую сторону.
Наиболее длительный иммунитет создается при введении живых вакцин, когда прививочный вирус размножается в организме хозяина (как и при естественной инфекции).
Например, у людей, получивших прививку от кори более 40 лет назад, до сих пор определяются в крови антитела в защитных титрах, т.е. послепрививочный иммунитет к кори — пожизненный. То же самое и в отношении других живых вакцин —паротит, краснуха, полиомиелит и ветряной оспы.
В отношении бактериальных вакцин (гемофильной, пневмококковой) увеличение длительности иммунитета обеспечивается коньюгацией, соединением со специальным белком-носителем, который обеспечивает образование клеток памяти.
Отдельно хотелось бы поговорить о столбняке. Иммунитет при естественной инфекции не формируется,т.к. доза столбнячного анатоксина, попадающего в организм, очень мала. При вакцинации против столбняка используется анатоксин (инактивированный токсин), который можно вводить в большом количестве и получать иммунный ответ.
Естественный иммунитет к коклюшу снижается с возрастом, но послепрививочный снижается быстрее, и к школе дети уже не защищены (хотя и привиты в раннем детстве). Однако ситуация уже исправлена и создана комбинированная вакцина для ревакцинации детей и взрослых, которая содержит в своем составе вакцину против коклюша.
Клещевой энцефалит — при данной инфекции послепрививочный иммунитет ослабевает быстрее, чем естественный. Однако тяжесть и исходы его таковы, что лозунг “Лучше переболеть, чем привиться” в отношении этого заболевания не используется.
Может ли случиться, что вчера привили ребенка от гриппа, а сегодня он гриппом заболел?
Начало действия различных вакцин различаются. Существуют вакцины с быстрым нарастанием антител, и поэтому, с быстрым защитным эффектом. А есть — с медленным.
К вакцинам с медленным нарастанием уровня антител относятся, например, дифтерийный и столбнячный анатоксины, коклюшная вакцина.
К вакцинам с быстрым нарастанием антител — коревая, паротитная, гриппозная, против полиомиелита, гепатита А, ветряной оспы. Эти вакцины могут эффективно защитить, даже если их ввели после того, как контакт с инфекционным больным уже состоялся (в первые 3 дня после контакта).
Родители, приходящие с ребенком на прививку, должны очень хорошо понимать, что непосредственно с момента введения вакцины ребенок еще не защищен. После вакцинации должно пройти определенное время, чтобы начали вырабатываться антитела и накопились до защитного уровня, поэтому в первые дни после прививки желательно ограждать ребенка от контактов с больными людьми.
При этом вакцины, для которых график вакцинации предусматривает несколько введений, начинают защищать уже через 2-3 недели после первой прививки. Однако в этом случае антитела сохраняются на высоком уровне недолго, иммунный ответ должен стимулироваться последующим введением антигена (бустер-эффект).
Важным является и соблюдение графика вакцинации. При удлинении интервалов между введениями вакцины уровень антител может снизиться ниже защитного, и ребенок будет подвержен инфекции.
Периодически на прием приходят родители и просят определить иммунитет ребенка до прививки, т.е. путем расспроса удается выяснить, что родители желают:
- узнать хорошо ли работает иммунитет ребенка;
- выявить нет ли у ребенка антител к инфекциям, против которых его собираются прививать.
Интернет-сообщество усиленно дискутирует тему, стоит ли ребенку делать иммунограмму перед прививками?
Основные показатели неспецифического иммунитета, которые включены в иммунограмму, являются чрезвычайно вариабельными, и индивидуальная норма здесь, как нигде, имеет огромное значение (колебание показателей от приема пищи, физических нагрузок, временем суток и т.д.).
В связи с этим при диагностике заболеваний иммунной системы решающую роль играют клинические данные, а показатели иммунограммы имеют лишь вспомогательное значение.
Показатели иммунограммы не могут служить доказательством “напряженности иммунитета” или его “ослабления”, если они не сопровождаются соответствующими клиническими проявлениями, например, в виде повышенной инфекционной заболеваемости.
Нет никакого смысла массово исследовать иммунный статус здоровым детям, в первую очередь такая необходимость возникает в отношении детей, рожденных от ВИЧ-инфицированных матерей, и детей с хроническими заболеваниями , сопровождающимися патологией иммунной системы.
Что касается специфического иммунитета, то определение у ребенка перед прививкой уровня специфических антител бессмысленно. Сами по себе антитела к инфекциям у ребенка появиться не могут: их либо получают от переболевшей или привитой матери, либо они образуются при естественной иммунизации (болезни). Продолжительность жизни материнских антител – 2-3 месяца.
Вопреки распространенному заблуждению, грудное вскармливание не обеспечивает поступление специфических антител матери в кровь ребенка: антитела имеют белковую природу и не способны попасть в кровь через кишечник в неизмененном виде и в большой концентрации.
Сколько вакцин можно вводить одновременно?
В настоящее время ребенок 1 года жизни получает, согласно национальному календарю, вакцинацию от 7 инфекций. Помимо этого, детям из групп риска (а по желанию родителей и всем остальным) проводится вакцинация от гемофильной и ротавирусной инфекции, от клещевого энцефалита и гриппа м. б. проведена с 6 мес. возраста.
Вакцина против менингококка применяется у детей с 9 мес. Все вышеперечисленные инфекции, к сожалению, актуальны именно у детей младшей возрастной группы в связи с большой частотой развития, тяжелым течением и частыми неблагоприятными исходами и осложнениями.
Как же вместить такое количество введений вакцины в первый год жизни ребенка
Варианта два — либо одновременное введение нескольких вакцин, либо комбинированные вакцины.
Оба эти варианта имеют свои положительные стороны, оба имеют право на существование. Однако оба варианта вызывают беспокойство среди родителей:
«Не будет ли перегрузки иммунной системы?»
Ответ однозначный: «Не будет». ⠀ Организм постоянно сталкивается с огромным числом антигенов, обеспечивая защиту внутренней среды.
Сразу после рождения ребенок встречается одновременно с сотнями тысяч чужеродных антигенов, и его иммунная система хорошо справляется с этим.
Миллионы веществ попадают к ребенку, появившемуся на свет, через кожу, с током вдыхаемого воздуха, с молоком матери… и все дети успешно справляются с этим!
При проникновении микроорганизмов во внутреннюю среду иммунная система может обеспечить ответ специфическими антителами на 109 -1011 антигенов. Подсчитано, что для формирования ответа на одну вакцину, содержащую около 102 эпитопов, необходимо около 107 В клеток (примерно столько их содержится в 1 мл крови), и если младенцу одновременно назначить 11 вакцин, то будет задействована всего 0,1 % потенциала иммунной системы. Расчеты показывают, что индивид может ответить на 105 вакцин одномоментно.
Часто ли после вакцинации развиваются осложнения?
Осложнения при вакцинации развиваются редко. Серьезные осложнения крайне редко: реже,чем при применении других лекарственных препаратов, и намного реже, чем при инфекционных заболеваниях.
Следует отметить, что частота осложнений при заболеваниях может варьировать во время вспышек разных лет и в различных странах. Она также зависит от возраста и состояния здоровья пациента. Наиболее серьезные осложнения как при заболеваниях, так и после вакцинации встречаются у иммунокомпроментированных лиц.
Пример:
Столбняк: летальность при заболевании — 25-70%, осложнения (ранние и поздние) — очень часто.
Ацеллюлярные вакцины АКДС:
Легкие реакции: лихорадка, покраснение и припухлость в месте инъекции, болезненность в месте инъекции, беспокойство, вялость, плохой аппетит —у 1 из 10.
Среднетяжелые реакции: судороги, высокая лихорадка (выше 40) – у 1 из 14 000. Тяжелые реакции: серьезные аллергические реакции менее чем 1 на 1 000 000 доз.
Корь: от 0,3% (США) до 28% (в развивающихся странах), у лиц с иммунодефицитом — 30%.
Осложнения (диарея, отиты, пневмония, энцефалит, слепота) — 30%.
Подострый склерозирующий панэнцефалит — от 1 на 10 000 до 1 на 2 000.
Вакцинация от кори: всего не более 6% (температура 2%, кашель 1%, насморк 2%).
Анафилактический шок:
Вакцины —1 случай на 1 000 000 доз.
Лекарственные средства: антибиотики (пенициллины и цефалоспорины) — 1 случай на 5 000 доз.
Ренгенконтрастные вещества — 0,9 случаев на 100 000 доз.
Таким образом, неблагоприятные реакции, связанные с прививками, развиваются в несколько раз реже, чем при соответствующих инфекционных заболеваниях, и существенно реже, чем при использовании лекарственных средств.
Правда и мифы про прививки
На прием пришла мама с 3-х месячной дочкой. На вопрос мой:
«Чем я могу Вам помочь?»
Услышала ответ:
«Убедите меня, что прививки не опасны и какие лучше делать?»
и выгрузила на стол блокнот с записями. Как потом выяснилось, что все свободное время она проводила в интернете, читая сайты про негативные действия вакцин. И данный блокнот был выжимкой всего того, что она читала. ⠀
Так как же рождаются мифы о вакцинации?
Это связано как раз с успехом программ вакцинации. Это известный факт — случаи заболевания в связи с массовой иммунизацией почти исчезают, люди думают, что опасности нет и можно не прививаться.
Но это не так: мы защищены только потому, что массово прививаемся. Высокий охват вакцинацией необходим для предотвращения инфекций. Как показывает опыт, вспышки дифтерии, кори и полиомиелита вернулись из-за отказа людей прививаться.
Как и любое лекарственное средство, вакцины при введении могут вызывать побочные реакции. Большинство из них — незначительные и быстро проходящие, например, боль в месте укола или незначительное повышение температуры тела. Очень серьезные побочные эффекты встречаются крайне редко, о них сообщают в контролирующие органы (Роспотребнадзор, Росздравнадзор), где эти случаи тщательно разбирают.
Осложнения инфекций, от которых защищают вакцины, гораздо более тяжелые, чем обычные реакции на введение вакцины. Например, полиомиелит может вызвать паралич, корь может вызвать энцефалит и слепоту, многие вакциноуправляемые инфекции могут даже привести к смерти (поэтому и разработаны прививки против них).
Преимущества вакцинации значительно перевешивают риски, без вакцинации опасные инфекции быстро вернутся.
В статье представлены результаты исследования, посвященного анализу напряженности популяционного иммунитета к вирусу кори, краснухи, эпидемического паротита и ветряной оспы у взрослых.
Введение
Антропонозные вирусные инфекции с аэрозольным механизмом передачи составляют большую группу заболеваний в инфекционной патологии. К ним относят такие инфекции, как корь, краснуха, эпидемический паротит и ветряная оспа. Издавна они считаются детскими инфекциями и инфекциями организованных коллективов. В настоящее время отмечается их «повзросление», они все чаще встречаются среди взрослого населения. Этими инфекциями болеют повсеместно на всей территории Российской Федерации и дети, и взрослые.
Начиная с 1994 г. наблюдалось снижение заболеваемости корью. В 2005–2012 гг. уровень заболеваемости корью на территории России не превышал 1 случай на 100 тыс. населения. Однако в 2012 г. отмечен подъем заболеваемости кори как в Европейском регионе, так и на территории Российской Федерации. Подъем заболеваемости достиг пика в 2014 г. (3,23 на 100 тыс. населения). К 2016 г. показатели заболеваемости снизились и составили 0,12 на 100 тыс. населения. В 2017 г. на территории Российской Федерации зарегистрировано 725 случаев кори. Заболеваемость совокупного населения корью в России в 2017 г. составила 0,50 на 100 тыс. населения. Заболеваемость детского населения до 17 лет составила 1,63 на 100 тыс. населения (в 2016 г. — 0,35 на 100 тыс.). Заболеваемость корью на территории России в 2018 г. возросла в 4,5 раза по сравнению с аналогичным периодом предыдущего года. Наиболее высокая заболеваемость отмечалась среди детей раннего возраста, в возрастной группе 1–2 года — 4,9 на 100 тыс. детей данного возраста (189 случаев) [1].
Ситуация по кори в мире и в странах Европы остается неблагополучной. В 2017 г. отмечен многократный рост заболеваемости в Европейском регионе. Так, в январе 2017 г. в европейских странах (Германия, Италия, Польша, Румыния, Франция, Швейцария) зарегистрировано 474 случая кори. Кроме того, крупные вспышки кори зарегистрированы в Италии и Румынии [1, 2]. Учитывая усилия, предпринимающиеся по ликвидации кори согласно программе ВОЗ, ситуацию нельзя считать благополучной. Одним из основных мероприятий по профилактике кори является вакцинация с применением живой коревой вакцины (первая вакцинация в возрасте 12 мес., ревакцинация в 6–7 лет). Подлежат вакцинации дети от 1 года до 18 лет (включительно) и взрослые до 35 лет (включительно), неболевшие, непривитые, привитые однократно, а также не имеющие сведений о прививках против кори. Лица, которые относятся к группам риска, подлежат вакцинации до 55 лет. По рекомендациям ВОЗ охват прививками населения должен составлять более 95% от вакциноуправляемых инфекций [3, 4].
Ветряная оспа — самая распространенная детская инфекция и по количеству случаев уступает лишь острым респираторным инфекциям. Ветряная оспа вызывается вирусом Varicella zoster (VZV), который относится к типу 3 вирусов герпеса и вызывает два заболевания: ветряную оспу и опоясывающий герпес. После перенесенной в детстве инфекции в ганглиях задних корешков спинного мозга формируется пожизненное носительство вируса в дремлющем состоянии. В момент ослабления клеточного звена иммунной системы под влиянием факторов внешней среды, психоэмоциональной перегрузки происходит реактивация вируса, которая клинически проявляется в виде опоясывающего герпеса. Кроме того, ветряная оспа может представлять опасность для лиц, составляющих группу риска (беременные, недоношенные и маловесные дети со стойкими иммунологическими дефектами, а также лица с ВИЧ-инфекцией). Дети с онкологическими заболеваниями наиболее предрасположены к заболеванию ветряной оспой [5, 6]. Показатель заболеваемости ветряной оспой на территории России в 2017 г. составил 585,21 на 100 тыс. населения (в 2016 г. — 544,59 на 100 тыс. населения). Среди детского населения в 2017 г. зарегистрировано 2831,61 случая на 100 тыс. населения (в 2016 г. — 2673,31 на 100 тыс.). Показатель заболеваемости ветряной оспой среди взрослого и детского населения в 2017 г. на территории России увеличился на 7,7% и 5,9% соответственно. За 2017 г. было зарегистрировано 4 случая смерти от ветряной оспы, из них 3 случая — дети [7].
Показатель заболеваемости эпидемическим паротитом в 2017 г. составил 3,03 на 100 тыс. населения. По сравнению с 2016 г. (0,76 на 100 тыс. населения) заболеваемость возросла в 4 раза. Среди детского населения (возраст до 17 лет) заболеваемость эпидемическим паротитом увеличилась в 3,3 раза. Эпидемический паротит распространен повсеместно. К данному заболеванию восприимчивы как дети, так и взрослые. Вирус поражает околоушные железы. По данным литературы, у 61,9% больных отмечается двустороннее поражение желез. Тяжелое течение заболевания может привести к таким осложнениям, как орхит, панкреатит и менингит. Кроме того, перенесенный в детстве паротит может вызвать развитие сахарного диабета [5, 8].
На данный период времени эпидемическая обстановка по краснухе благоприятная. В 2017 г. было зарегистрировано пять случаев краснухи среди совокупного населения России. Синдрома врожденной краснухи на территории России не зарегистрировано.
Единственным эффективным средством профилактики против кори, краснухи, эпидемического паротита и ветряной оспы является вакцинация как детей, так и взрослых. Вакцинация против кори, краснухи и эпидемического паротита внесена в национальный календарь профилактических прививок. В соответствии с приказом Минздрава России от 21 марта 2014 г. № 125н «Об утверждении национального календаря профилактических прививок и календаря прививок по эпидемическим показаниям» вакцинация против ветряной оспы проводится только по эпидемическим показаниям. В 2009 г. вакцинация против ветряной оспы внесена в региональный календарь прививок г. Москвы и Свердловской области.
Вирусные инфекции, особенно вовлекающие в патологический процесс кожу, могут послужить триггером для запуска или фактором обострения аллергопатологии, тогда как вовремя и правильно проведенная вакцинация живыми вирусными вакцинами практически не дает таких последствий [9].
Цель исследования: проанализировать напряженность популяционного иммунитета к вирусу кори, краснухи, эпидемического паротита и ветряной оспы на примере 93 здоровых взрослых в возрасте 18–30 лет.
Материал и методы
Материалом для исследования напряженности иммунитета против кори, краснухи, эпидемического паротита и ветряной оспы послужила сыворотка крови 93 случайно выбранных условно здоровых человек в возрасте 18–30 лет. Дополнительно у всех был собран прививочный анамнез.
Сведения о вакцинации получены из личных медицинских книжек. Так, у 61 человека не было сведений о прививках против кори, у 29 — такие сведения имелись, из них у 21 — прививка проводилась в возрасте 6–7 лет, у 4 — в возрасте 1 года. У 3 человек было лишь указано, что они привиты по возрасту от кори, но без указания даты вакцинации.
У 66 человек прививочный статус в отношении краснухи был неизвестен. У 27 человек такие сведения имелись, из них у 12 — о вакцинации в возрасте 11–12 лет, у 7 — о вакцинации по возрасту без указания даты.
У 65 обследованных прививочный статус относительно эпидемического паротита был неизвестен. У 28 человек такие сведения имелись, из них у 4 — сведения о первой прививке в возрасте 1 года, у 15 — в возрасте 6–7 лет и только у 7 — о прививках по возрасту без указания даты.
Относительно ветряной оспы у 83 человек прививочный статус был неизвестен. У 10 человек такие сведения имелись, из них у 5 — сведения о вакцинации в возрасте от 3 до 5 лет. Один человек привит в возрасте 14 лет, и 4 человека привиты по возрасту без указания даты вакцинации.
Забор крови осуществляли из локтевой вены в количестве 4 мл. Сыворотку крови, полученную для определения специфического иммунитета, разливали в пробирки типа «эппендорф», замораживали и хранили до использования при температуре -70 °С. Специфические иммуноглобулины класса G (IgG) к антигенам вирусов кори, краснухи, эпидемического паротита и ветряной оспы в сыворотке крови определяли методом иммуноферментного анализа (ИФА) с помощью тест-систем (Россия) в соответствии с прилагаемой инструкцией производителя. Защитным уровнем IgG для кори считали показатель 0,2 МЕ/мл, для краснухи — 25 МЕ/мл [10]. Для оценки уровня специфических антител к вирусам эпидемического паротита и ветряной оспы рассчитывали коэффициент позитивности, равный отношению полученного для каждой сыворотки значения в единицах оптической плотности к уровню cut off.
Полученные результаты были подвергнуты статистической обработке с вычислением медианы, первого и третьего квартиля (пакет статистических программ Microsoft Office Excel 2010).
Результаты и обсуждение
По результатам ИФА получили процентное выражение защищенности в зависимости от уровня специфических IgG к антигенам вирусов кори, краснухи, эпидемического паротита и ветряной оспы, которое представлено на рисунке 1.
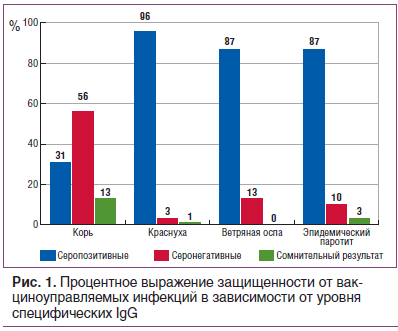
Специфические IgG к вирусу ветряной оспы были обнаружены у 87% обследованных, что может свидетельствовать о перенесенной инфекции в раннем возрасте. Кроме того, отмечен высокий уровень защиты против краснухи — 96% и эпидемического паротита — 87%, что свидетельствует о наличии специфического иммунитета в результате вакцинации или перенесенной инфекции. У 43% обследованных отмечены высокие уровни антител к вирусу краснухи, что может говорить о перенесенной ранее инфекции (у данных пациентов уровень антител был 300 Ме/мл и выше, что возникает именно в случае перенесенной инфекции). В таблице 1 представлены средние уровни противовирусных антител к вирусам рассматриваемых инфекций. Средний уровень антител к вирусу краснухи, эпидемического паротита и ветряной оспы в индикаторной группе (18–30 лет) превышает защитный уровень. Критерием эпидемиологического благополучия по краснухе считается выявление в обследованной группе не более 7% серонегативных лиц, для эпидемического паротита — 5%. Доля восприимчивых к инфекции краснухи составила 3%, к паротиту — 10%, что соответствует критериям эпидемиологического благополучия по данным инфекциям.
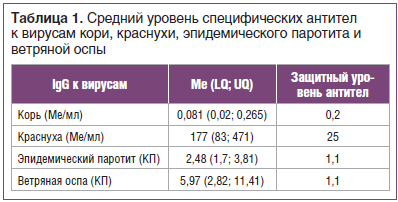
По полученным результатам можно сказать, что обследованная группа имеет низкую восприимчивость к вирусу краснухи и вирусу эпидемического паротита. Аналогичные результаты получены в отношении вируса ветряной оспы (13% серонегативных) преимущественно за счет перенесенного заболевания, т. к. только 10 человек из обследованной группы были привиты против ветряной оспы.
Другая ситуация складывается с корью: доля серонегативных составила 56% (52 человека) из 93 обследованных. Следы специфических антител (но ниже защитного уровня) имели 13% из обследованных. И лишь 31% имели защитные уровни в результате вакцинации. Один человек был выявлен с титром антител 2,10 МЕ/мл, что может свидетельствовать о перенесенной инфекции. Средний уровень противокоревых антител оказался ниже защитного уровня. Критерием эпидемического благополучия по кори считается выявление в обследуемой группе не более 7% серонегативных лиц. В нашем случае 69% обследованных оказались не защищенными от вируса кори. Таким образом, эти лица составляют группу высокого риска инфицирования и распространения инфекции кори.
При анализе прививочного статуса было выявлено, что у большинства обследованных отсутствовали сведения о прививках. Причины этого могут быть различными: небрежное оформление документов и утеря медицинских документов, отказ от прививок, медицинские отводы. Часть обследованных имеют сведения о вакцинации, но по результатам серологического мониторинга титр специфических антител IgG у них ниже защитного уровня. Причинами этого несоответствия могут быть нарушение «холодовой цепи» в пути транспортировки вакцины от изготовителя до вакцинируемого или нарушение сроков вакцинации. Такие люди считаются привитыми, но не имеют защитного титра.
Заключение
С 2011 г. отмечается рост заболеваемости корью в Российской Федерации, одна из причин ухудшения ситуации — накопление в популяции восприимчивых (неиммунных) лиц на фоне выраженной миграции населения. Одним из достоверных методов оценки иммунной прослойки населения является серомониторинг (определение IgG у здоровых лиц). Результаты серологических исследований показывают, был ли человек привит, или не привит, или перенес инфекцию ранее. Такой метод дает достоверный материал для анализа напряженности коллективного иммунитета на популяционном уровне, кроме того, позволяет прогнозировать дальнейшую эпидемическую ситуацию в стране [10, 11]. На сегодня растет количество отказов родителей от профилактических прививок. По данным проведенных исследований выявлено, что лишь 80% детей привиты в возрасте до 2 лет [3]. Правильно и вовремя сделанная прививка живыми вирусными вакцинами не вызывает обострения имеющейся аллергопатологии и не провоцирует формирование новой [9]. В то же время вирусные инфекции, вовлекающие в воспалительный процесс кожу и респираторный тракт, могут послужить как фактором обострения аллергопатологии, так и непосредственным триггером, запускающим аллергический процесс. Необходимо повышать информированность родителей по вопросам вакцинопрофилактики путем проведения разъяснительных работ, а медицинского персонала — путем образовательных семинаров и лекций.
