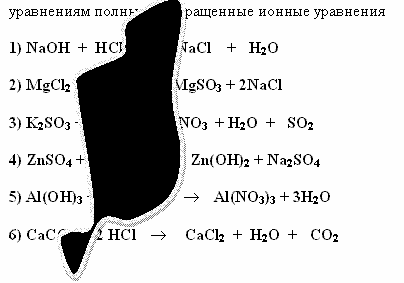Как составлять ионные уравнения. Задача 31 на ЕГЭ по химии
Достаточно часто школьникам и студентам приходится составлять т. н. ионные уравнения реакций. В частности, именно этой теме посвящена задача 31, предлагаемая на ЕГЭ по химии. В данной статье мы подробно обсудим алгоритм написания кратких и полных ионных уравнений, разберем много примеров разного уровня сложности.
Зачем нужны ионные уравнения
Напомню, что при растворении многих веществ в воде (и не только в воде!) происходит процесс диссоциации – вещества распадаются на ионы. Например, молекулы HCl в водной среде диссоциируют на катионы водорода (H + , точнее, H 3 O + ) и анионы хлора (Cl – ). Бромид натрия (NaBr) находится в водном растворе не в виде молекул, а в виде гидратированных ионов Na + и Br – (кстати, в твердом бромиде натрия тоже присутствуют ионы).
Записывая “обычные” (молекулярные) уравнения, мы не учитываем, что в реакцию вступают не молекулы, а ионы. Вот, например, как выглядит уравнение реакции между соляной кислотой и гидроксидом натрия:
HCl + NaOH = NaCl + H 2 O. (1)
Разумеется, эта схема не совсем верно описывает процесс. Как мы уже сказали, в водном растворе практически нет молекул HCl, а есть ионы H + и Cl – . Так же обстоят дела и с NaOH. Правильнее было бы записать следующее:
H + + Cl – + Na + + OH – = Na + + Cl – + H 2 O. (2)
Это и есть полное ионное уравнение . Вместо “виртуальных” молекул мы видим частицы, которые реально присутствуют в растворе (катионы и анионы). Не будем пока останавливаться на вопросе, почему H 2 O мы записали в молекулярной форме. Чуть позже это будет объяснено. Как видите, нет ничего сложного: мы заменили молекулы ионами, которые образуются при их диссоциации.
Впрочем, даже полное ионное уравнение не является безупречным. Действительно, присмотритесь повнимательнее: и в левой, и в правой частях уравнения (2) присутствуют одинаковые частицы – катионы Na + и анионы Cl – . В процессе реакции эти ионы не изменяются. Зачем тогда они вообще нужны? Уберем их и получим краткое ионное уравнение:
H + + OH – = H 2 O. (3)
Как видите, все сводится к взаимодействию ионов H + и OH – c образованием воды (реакция нейтрализации).
Все, полное и краткое ионные уравнения записаны. Если бы мы решали задачу 31 на ЕГЭ по химии, то получили бы за нее максимальную оценку – 2 балла.
Итак, еще раз о терминологии:
- HCl + NaOH = NaCl + H 2 O – молекулярное уравнение (“обычное” уравнения, схематично отражающее суть реакции);
- H + + Cl – + Na + + OH – = Na + + Cl – + H 2 O – полное ионное уравнение (видны реальные частицы, находящиеся в растворе);
- H + + OH – = H 2 O – краткое ионное уравнение (мы убрали весь “мусор” – частицы, которые не участвуют в процессе).
Алгоритм написания ионных уравнений
- Составляем молекулярное уравнение реакции.
- Все частицы, диссоциирующие в растворе в ощутимой степени, записываем в виде ионов; вещества, не склонные к диссоциации, оставляем “в виде молекул”.
- Убираем из двух частей уравнения т. н. ионы-наблюдатели, т. е. частицы, которые не участвуют в процессе.
- Проверяем коэффициенты и получаем окончательный ответ – краткое ионное уравнение.
Пример 1 . Составьте полное и краткое ионные уравнения, описывающие взаимодействие водных растворов хлорида бария и сульфата натрия.
Решение . Будем действовать в соответствии с предложенным алгоритмом. Составим сначала молекулярное уравнение. Хлорид бария и сульфат натрия – это две соли. Заглянем в раздел справочника “Свойства неорганических соединений”. Видим, что соли могут взаимодействовать друг с другом, если в ходе реакции образуется осадок. Проверим:
BaCl 2 + Na 2 SO 4 = BaSO 4 ↓ + 2NaCl.
Таблица растворимости подсказывает нам, что BaSO 4 действительно не растворяется в воде (направленная вниз стрелка, напомню, символизирует, что данное вещество выпадает в осадок). Молекулярное уравнение готово, переходим к составлению полного ионного уравнения. Обе соли, присутствующие в левой части, записываем в ионной форме, а вот в правой части оставляем BaSO 4 в “молекулярной форме” (о причинах этого – чуть позже!) Получаем следующее:
Ba 2+ + 2Cl – + 2Na + + SO 4 2- = BaSO 4 ↓ + 2Cl – + 2Na + .
Осталось избавиться от балласта: убираем ионы-наблюдатели. В данном случае в процессе не участвуют катионы Na + и анионы Cl – . Стираем их и получаем краткое ионное уравнение:
Ba 2+ + SO 4 2- = BaSO 4 ↓.
А теперь поговорим подробнее о каждом шаге нашего алгоритма и разберем еще несколько примеров.
Как составить молекулярное уравнение реакции
Должен сразу вас разочаровать. В этом пункте не будет однозначных рецептов. Действительно, вряд ли можно рассчитывать, что я смогу разобрать здесь ВСЕ возможные уравнения реакций, которые могут встретиться вам на ЕГЭ или ОГЭ по химии.
Ваш помощник – раздел “Свойства неорганических соединений”. Если вы хорошо знакомы с четырьмя базовыми классами неорганических веществ (оксиды, основания, кислоты, соли), если вам известны химические свойства этих классов и методы их получения, можете на 95% быть уверены в том, что у вас не будет проблем на экзамене с написанием молекулярных уравнений.
Оставшиеся 5% – это некоторые “специфические” реакции, которые мы не сможем перечислить. Не будем лить слез по поводу этих 5%, а вспомним лучше номенклатуру и химические свойства базовых классов неорганических веществ. Три задания для самостоятельной работы:
Упражнение 1 . Напишите молекулярные формулы следующих веществ: оксид фосфора (V), нитрат цезия, сульфат хрома (III), бромоводородная кислота, карбонат аммония, гидроксид свинца (II), фосфат стронция, кремниевая кислота. Если при выполнении задания у вас возникнут проблемы, обратитесь к разделу справочника “Названия кислот и солей”.
Упражнение 2 . Дополните уравнения следующих реакций:
- KOH + H 2 SO 4 =
- H 3 PO 4 + Na 2 O=
- Ba(OH) 2 + CO 2 =
- NaOH + CuBr 2 =
- K 2 S + Hg(NO 3 ) 2 =
- Zn + FeCl 2 =
Упражнение 3 . Напишите молекулярные уравнения реакций (в водном растворе) между: а) карбонатом натрия и азотной кислотой, б) хлоридом никеля (II) и гидроксидом натрия, в) ортофосфорной кислотой и гидроксидом кальция, г) нитратом серебра и хлоридом калия, д) оксидом фосфора (V) и гидроксидом калия.
Искренне надеюсь, что у вас не возникло проблем с выполнением этих трех заданий. Если это не так, необходимо вернуться к теме “Химические свойства основных классов неорганических соединений”.
Как превратить молекулярное уравнение в полное ионное уравнение
Начинается самое интересное. Мы должны понять, какие вещества следует записывать в виде ионов, а какие – оставить в “молекулярной форме”. Придется запомнить следующее.
В виде ионов записывают:
- растворимые соли (подчеркиваю, только соли хорошо растворимые в воде);
- щелочи (напомню, что щелочами называют растворимые в воде основания, но не NH 4 OH);
- сильные кислоты (H 2 SO 4 , HNO 3 , HCl, HBr, HI, HClO 4 , HClO 3 , H 2 SeO 4 , . ).
Как видите, запомнить этот список совсем несложно: в него входят сильные кислоты и основания и все растворимые соли. Кстати, особо бдительным юным химикам, которых может возмутить тот факт, что сильные электролиты (нерастворимые соли) не вошли в этот перечень, могу сообщить следующее: НЕвключение нерастворимых солей в данный список вовсе не отвергает того, что они являются сильными электролитами.
Все остальные вещества должны присутствовать в ионных уравнениях в виде молекул. Тем требовательным читателям, которых не устраивает расплывчатый термин “все остальные вещества”, и которые, следуя примеру героя известного фильма, требуют “огласить полный список” даю следующую информацию.
В виде молекул записывают:
- все нерастворимые соли;
- все слабые основания (включая нерастворимые гидроксиды, NH 4 OH и сходные с ним вещества);
- все слабые кислоты (H 2 СO 3 , HNO 2 , H 2 S, H 2 SiO 3 , HCN, HClO, практически все органические кислоты . );
- вообще, все слабые электролиты (включая воду. );
- оксиды (всех типов);
- все газообразные соединения (в частности, H 2 , CO 2 , SO 2 , H 2 S, CO);
- простые вещества (металлы и неметаллы);
- практически все органические соединения (исключение – растворимые в воде соли органических кислот).
Уф-ф, кажется, я ничего не забыл! Хотя проще, по-моему, все же запомнить список N 1. Из принципиально важного в списке N 2 еще раз отмечу воду.
Пример 2 . Составьте полное ионное уравнение, описывающие взаимодействие гидроксида меди (II) и соляной кислоты.
Решение . Начнем, естественно, с молекулярного уравнения. Гидроксид меди (II) – нерастворимое основание. Все нерастворимые основания реагируют с сильными кислотами с образованием соли и воды:
Cu(OH) 2 + 2HCl = CuCl 2 + 2H 2 O.
А теперь выясняем, какие вещества записывать в виде ионов, а какие – в виде молекул. Нам помогут приведенные выше списки. Гидроксид меди (II) – нерастворимое основание (см. таблицу растворимости), слабый электролит. Нерастворимые основания записывают в молекулярной форме. HCl – сильная кислота, в растворе практически полностью диссоциирует на ионы. CuCl 2 – растворимая соль. Записываем в ионной форме. Вода – только в виде молекул! Получаем полное ионное уравнение:
Сu(OH) 2 + 2H + + 2Cl – = Cu 2+ + 2Cl – + 2H 2 O.
Пример 3 . Составьте полное ионное уравнение реакции диоксида углерода с водным раствором NaOH.
Решение . Диоксид углерода – типичный кислотный оксид, NaOH – щелочь. При взаимодействии кислотных оксидов с водными растворами щелочей образуются соль и вода. Составляем молекулярное уравнение реакции (не забывайте, кстати, о коэффициентах):
CO 2 + 2NaOH = Na 2 CO 3 + H 2 O.
CO 2 – оксид, газообразное соединение; сохраняем молекулярную форму. NaOH – сильное основание (щелочь); записываем в виде ионов. Na 2 CO 3 – растворимая соль; пишем в виде ионов. Вода – слабый электролит, практически не диссоциирует; оставляем в молекулярной форме. Получаем следующее:
СO 2 + 2Na + + 2OH – = Na 2+ + CO 3 2- + H 2 O.
Пример 4 . Сульфид натрия в водном растворе реагирует с хлоридом цинка с образованием осадка. Составьте полное ионное уравнение данной реакции.
Решение . Сульфид натрия и хлорид цинка – это соли. При взаимодействии этих солей выпадает осадок сульфида цинка:
Na 2 S + ZnCl 2 = ZnS↓ + 2NaCl.
Я сразу запишу полное ионное уравнение, а вы самостоятельно проанализируете его:
2Na + + S 2- + Zn 2+ + 2Cl – = ZnS↓ + 2Na + + 2Cl – .
Предлагаю вам несколько заданий для самостоятельной работы и небольшой тест.
Упражнение 4 . Составьте молекулярные и полные ионные уравнения следующих реакций:
- NaOH + HNO 3 =
- H 2 SO 4 + MgO =
- Ca(NO 3 ) 2 + Na 3 PO 4 =
- CoBr 2 + Ca(OH) 2 =
Упражнение 5 . Напишите полные ионные уравнения, описывающие взаимодействие: а) оксида азота (V) с водным раствором гидроксида бария, б) раствора гидроксида цезия с иодоводородной кислотой, в) водных растворов сульфата меди и сульфида калия, г) гидроксида кальция и водного раствора нитрата железа (III).
В следующей части статьи мы научимся составлять краткие ионные уравнения и разберем большое количество примеров. Кроме того, мы обсудим специфические особенности задания 31, которое вам предстоит решать на ЕГЭ по химии.
Реакции обмена и химические уравнения для них
О чем эта статья:
Что такое реакция ионного обмена
Чтобы дать определение понятию «реакция ионного обмена», разберем его на составные части:
обмен — значит, что у нас есть два сложных вещества, которые чем-то обмениваются между собой;
ионный — значит, что эти вещества обмениваются между собой ионами, то есть заряженными частицами.
Теперь соединим все вместе и получим, что реакция ионного обмена — это химическая реакция между двумя сложными веществами, которая приводит к обмену заряженными частицами (ионами), в результате чего образуются новые сложные соединения.
С определением разобрались, теперь нужно понять, есть ли какие-то условия, которые гарантируют нам протекание химической реакции. С этим нам поможет правило Бертолле.
А между какими соединениями протекают реакции ионного обмена? На самом деле все просто: это кислоты, гидроксиды (растворимые и нерастворимые) и соли.
Примеры реакций ионного обмена
Давайте рассмотрим примеры, которые характеризуют каждый из трех признаков протекания химической реакции:
Образование малодиссоциирующего вещества (воды):
NaOH + HCl = H2O + NaCl.
Составление уравнений обменных реакций
Химические уравнения реакций обмена можно записать:
в молекулярной форме:
в полной ионной форме — с указанием всех существующих в растворе ионов:
2Na + + 2Cl − + Pb 2+ + 2NO3 − = PbCl↓ + 2Na + + 2NO3 − .
в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов:
Pb 2+ + 2Cl − = PbCl↓.
Перейдем к правилам записи ионных уравнений:
Записываем уравнение в молекулярном виде и обязательно расставляем коэффициенты.
Далее с помощью таблицы растворимости определяем растворимость каждого химического соединения.
Составляем полное ионное уравнение с учетом коэффициентов и не забываем указывать заряды ионов.
Важно помнить, что мы не расписываем на ионы нерастворимые соединения, воду, оксиды, все слабые электролиты, анионы кислотных остатков кислых солей слабых кислот и катионы основных солей слабых оснований, а также комплексные катионы. Их следует оставить в молекулярной форме.
Находим одинаковые ионы в левой и правой частях полного ионного уравнения и сокращаем их.
Далее переписываем оставшихся участников ионного уравнения и получаем сокращенное ионное уравнение.
Практика
Чтобы новые знания лучше усвоились, немного попрактикуемся. Для проиллюстрированных химических реакций обмена нужно составить молекулярное, полное ионное и сокращенное ионное уравнения:
Решать задачки гораздо интереснее на интерактивной платформе с мгновенной проверкой. А опытный преподаватель тут же поможет разобраться, если ответ получился неправильным или что-то осталось непонятным. Все это ждет учеников на онлайн-курсах по химии в школе Skysmart.
Урок №10. Реакции ионного обмена и условия их протекания
РЕАКЦИИ ИОННОГО ОБМЕНА
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
5. При написании полных и кратких ионных уравнений используйте следующие памятку и алгоритм :
[spoiler title=”источники:”]
http://skysmart.ru/articles/chemistry/reakcii-obmena-i-himicheskie-uravneniya-dlya-nih
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/9-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%B2%D1%82%D0%BE%D1%80%D0%BE%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-10-%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8-%D0%B8%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE%D0%B1%D0%BC%D0%B5%D0%BD%D0%B0-%D0%B8-%D1%83%D1%81%D0%BB%D0%BE%D0%B2%D0%B8%D1%8F-%D0%B8%D1%85-%D0%BF%D1%80%D0%BE%D1%82%D0%B5%D0%BA%D0%B0%D0%BD%D0%B8%D1%8F
[/spoiler]
Реакции ионного обмена и условия их протекания
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
Примеры:
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
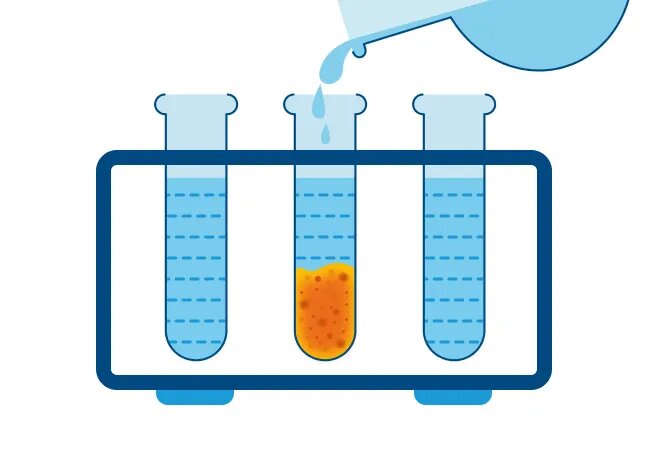
II. РИО, идущие с образованием осадка
Посмотрите видео-опыт: “Реакции ионного обмена, идущие с образованием ярко-окрашенных солей”
Запишем реакцию: CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
Правила написания уравнений реакций в ионном виде
Интерактивное объяснение алгоритма
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
5. Помните!
|
На ионы диссоциируют |
|
|
Реагенты (исходные вещества) |
Продукты реакции |
|
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания (включая Ca(OH)2 – M) |
Растворимые (P) в воде (см. ТР): 1. Соли 2. Кислоты 3. Основания Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду: H2CO3 ↔ H2O + CO2↑ H2SO3 ↔ H2O + SO2↑ NH4OH↔ H2O + NH3↑ H2S↑ (сероводород сам выделяется в виде газа) |
Р – растворимое вещество;
М – малорастворимое вещество;
ТР – таблица растворимости.
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
|
1) Записываем уравнение РИО в молекулярном виде: |
Взаимодействие сульфата меди (II) и гидроксида натрия: CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ |
|
2) Используя ТР указываем растворимость веществ воде: – Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓ – Если продукт является газом, справа от химической формулы ставим знак ↑ |
Р Р Р Н CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓ Молекулярный вид |
|
3) Записываем уравнение РИО в полном ионном виде. Какие вещества диссоциируют см. в таблице – ПАМЯТКЕ |
Cu2+ + SO42- + 2Na+ + 2OH– = 2Na+ + 2SO4 + Cu(OH)2↓ Полный ионный вид |
|
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции. Помните! РИО необратима и практически осуществима, если в продуктах образуются: газ, вода, осадок |
Cu2+ + 2OH+ = Cu(OH)2↓ Краткий ионный вид Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓ |
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
Al2(SO4)3 (р) + 3BaCl2 (р) = 3BaSO4↓ + 2AlCl3(р)
б) Полное ионное уравнение реакции:
2Al3+ + 3SO42- + 3Ba2+ + 6Cl– = 3BaSO4↓ + 2Al3+ + 6Cl–
в) Cокращенное ионное уравнение реакции:
SO42- + Ba2+ = BaSO4↓
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
Fe(OH)3 (н) + H3PO4 (р) = FePO4↓ + 3H2O
б) Полное ионное уравнение реакции:
Fe(OH)3 + 3H+ + PO43- = FePO4↓ + 3H2O.
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
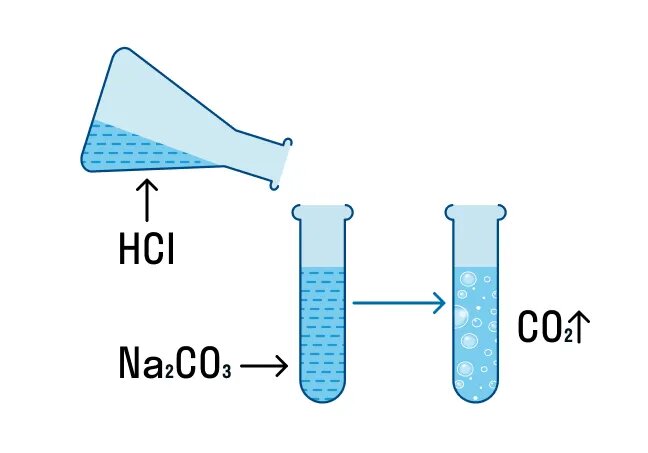
III. РИО, идущие с образованием газа
Посмотрите опыт: “Реакции ионного обмена, идущие с выделением газа”
Na2CO3 + 2HСl = 2NaCl + H2O + CO2↑
Полное ионное уравнение реакции:
2Na+ + CO32- + 2H+ + 2Cl– = 2Na+ + CO2↑ + H2O + 2Cl–
Cокращенное ионное уравнение реакции:
CO32- + 2H+ = CO2↑ + H2O
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
K2S + 2HCl = 2KCl + H2S↑
Полное ионное уравнение реакции:
2K+ + S2– + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S↑
Cокращенное ионное уравнение реакции:
S2– + 2H+ = H2S↑
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
3СaCO3 + 2H3РO4 = Са3(PO4)2↓ + 3H2O + 3CO2↑
Полное ионное уравнение реакции:
3СaCO3 + 6H+ + 2 РO43- = Са3(PO4)2↓ + 3H2O + 3CO2↑
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
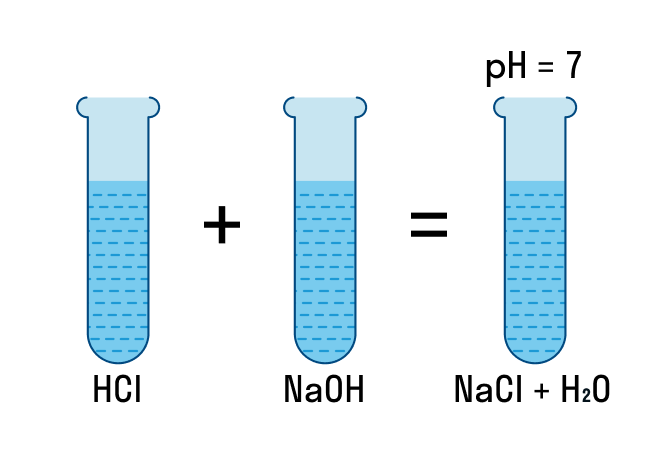
IV. РИО, идущие с образованием малодиссоциирующего вещества
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K+ + OH– + H+ + Cl– = K+ + Cl– + H2O
Cокращенное ионное уравнение реакции:
H+ + OH– = H2O
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
CaO (оксид) + 2HNO3 (р) = Ca(NO3)2 (р) + H2O (мд)
Полное ионное уравнение реакции:
CaO + 2H+ + 2NO3– = Ca2+ + 2NO3– + H2O
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
3Mg(OH)2 (н) + 2H3PO4 (р) = Mg3(PO4)2↓ + 6H2O (мд)
Полное ионное уравнение реакции:
3Mg(OH)2 + 6H+ + 2PO43- = Mg3(PO4)2↓ + 6H2O
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
Решение
– Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
KOH + NH4Cl = KCl + NH4OH
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
KOH (p) + NH4Cl (p) = KCl (p) + NH3 ↑+ H2O
– Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
K+ + OH– + NH4+ + Cl– = K+ + Cl– + NH3 ↑+ H2O
– Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
OH– + NH4+ = NH3 ↑+ H2O
– Делаем вывод:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Задание №2. Дана схема: 2H+ + CO32- = H2O + CO2↑
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
Решение
– Используя ТР подбираем реагенты – растворимые в воде вещества, содержащие ионы 2H+и CO32-.
Например, кислота – H3PO4 (p) и соль -K2CO3 (p).
– Составляем молекулярное уравнение РИО:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3H2CO3 (p)
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
2H3PO4 (p) +3 K2CO3 (p) -> 2K3PO4 (p) + 3CO2 ↑ + 3H2O
– Составляем полное ионное уравнение РИО:
6H+ +2PO43- + 6K+ + 3CO32- -> 6K++ 2PO43-+ 3CO2 ↑ + 3H2O
– Составляем краткое ионное уравнение РИО:
6H+ +3CO32- = 3CO2 ↑ + 3H2O
Сокращаем коэффициенты на три и получаем:
2H+ +CO32- = CO2 ↑ + H2O
– Делаем вывод:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
Решение
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
3Na2O (нэ) + 2H3PO4 (р) -> 2Na3PO4 (р) + 3H2O (мд), где нэ – неэлектролит, на ионы не диссоциирует,
мд – малодиссоциирующее вещество, на ионы не раскладываем, вода – признак необратимости реакции
2. Составляем полное ионное уравнение:
3Na2O + 6H+ + 2PO43- -> 6Na+ + 2PO43– + 3H2O
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
3Na2O + 6H+ -> 6Na+ + 3H2O
Сокращаем коэффициенты на три и получаем:
Na2O + 2H+ -> 2Na+ + H2O
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
“Взаимодействие карбоната натрия с серной кислотой”
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
ZnF2 + Ca(OH)2 ->
K2S + H3PO4 ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
“Осаждение сульфата бария”
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
Hg(NO3)2 + Na2S ->
K2SO3 + HCl ->
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
VII. Тренажеры
Тренажер №1: “Реакции ионного обмена”
Интерактивное задание LearningApps.org по теме: “Реакции между ионами”
ЦОРы
Видео-опыт: “Реакции ионного обмена, идущие с образованием ярко-окрашенных солей”
Видео-опыт: “Реакции ионного обмена, идущие с выделением газа”
Видео-опыт: “Реакция нейтрализации”
Учебник: Рудзитис Г.Е, Фельдман Ф.Г. Химия:
учебник для 9 класса общеобразовательных
учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – 12-е изд.
– М.: Просвещение, ОАО “Московские учебники”, 2009.
– 191 с.
Цель: сформировать представление учащихся о
реакциях, протекающих межу ионами, условий
протекания реакций ионного обмена до конца,
обратимых реакциях, полных и сокращенных ионных
уравнениях.
Задачи:
- способствовать систематизации понятийного
аппарата: ион, растворы, электролиты и
неэлектролиты, основные типы реакций в
неорганической химии, обратимые реакции, условия
протекания реакций ионного обмена до конца- “5” – обосновать, доказать;
- “4” – характеризовать, применить;
- “3” – рассказать;
- способствовать совершенствованию специальных
предметных умений: составлять полные и
сокращенные ионные уравнения; - способствовать формированию общеучебных
умений:- а) учебно-интеллектуальных (анализировать
факты, устанавливать причинно-следственные
связи; выдвигать гипотезу; сравнивать соли и
химические реакции, классифицировать, делать
выводы); - б) учебно-информационных (работать с текстом);
- в) учебно–организационных (понимать смысл
задания, распределять время для выполнения
заданий планировать работу по организации
работы, осуществлять самоконтроль);
- а) учебно-интеллектуальных (анализировать
- способствовать формированию критического
мышления учащихся (критически оценивать
собственные знания по теме и сопоставлять их с
научными);
Форма проведения: урок с использованием ИКТ,
включением парных, индивидуальных форм
организации учебно-познавательной деятельности
учащихся.
Продолжительность учебного занятия: 45 минут.
Использование педагогических технологий: метод
эвристического обучения, обучение в
сотрудничестве
Ход урока
I. Организационный момент – 1 мин: мобилизующее
начало (приветствие, проверка готовности к уроку,
организация внимания учащихся), информация о
цели и ходе урока, мотивация
Фронтальная беседа (3 мин)
- Что такое реакции обмена? (это реакции
между двумя сложными веществами, при которых они
обмениваются своими составными частями). - Что такое ионы? (это заряженные частицы, которые
отличаются от атомов числом электронов) - На какие группы делятся ионы? (катионы –
положительные ионы; анионы – отрицательные ионы) - Что такое электролитическая диссоциация?
(процесс распада молекул электролитов на ионы
при растворении в воде или расплавлении) - На какие ионы распадаются при
электролитической диссоциации кислоты (ионы
водорода и ионы кислотного остатка) - На какие ионы распадаются при
электролитической диссоциации растворимые
основания? (ионы металла и ионы ОН-1 групп) - На какие ионы распадаются при
электролитической диссоциации соли? (ионы
металла и ионы кислотного остатка) - Таким образом, какие ионы выделяют при
электролитической диссоциации? (Н+1, ОН-1,
Ме+n, кислотный остаток-n) - Именно эти ионы находятся в таблице
растворимости: (Работа с таблицей растворимости
– определение растворимых и нерастворимых
веществ)
II. Изучение нового материала. Объяснение
учителя. 15 мин.
Реакции обмена протекают между ионами, поэтому
называются реакции ионного обмена Выводится
определение (слайд 2):
Реакции ионного обмена идут до конца в трех
случаях:
- если образуется осадок – нерастворимое
вещество после реакции) - если выделяется газ
- если образуется вода
В остальных случаях реакции обмена являются
обратимыми
Разберем эти случаи поподробнее (случаи
разбираются на слайдах и на доске, проводится
фронтальная беседа: почему реакция идет, что и
почему образуется, как определить образование
осадка, газа, воды и т.п.):
1) Если образуется осадок (слайд 3):
а) CuSO4 + 2NaOH Na2SO4 + Cu(OH)2
б) 2AgNO3 + CaCl2 Ca(NO3)2 + 2AgCl
в) Na2CO3 + Ca(NO3)2 2NaNO3 + CaCO3
г) BaCl2 + K2SO4 2KCl + BaSO4
2) Если выделяется газ (слайд 4):
а) CaCO3 + 2HNO3 Ca(NO3)2 + H2CO3 (H2O
+ CO2 )
б) Na2SO3 + 2HCl 2NaCl + H2SO3 (H2O + SO2
)
в) CuS + 2HCl CuCl2
+ H2S
3) Если образуется вода (слайд 5):
а) CuO + H2SO4 CuSO4 + H2O
б) Fe(OH)3 + 3HCl FeCl3 + 3H2O
в) NaOH + HNO3 NaNO3 + H2O
4) Если НЕ образуются осадок, газ и вода, то
реакции являются обратимыми (слайд 6):
Определение:
Обратимые реакции – это реакции, которые при
одних и тех же условиях протекают в двух
противоположных направлениях
а) 2NaNO3 + CaCl2 Ca(NO3)2 + 2NaCl
б) K3PO4 + 3NaCl Na3PO4 + 3KCl
в) CuCl2 + Na2SO4 CuSO4 + 2NaCl
Ионные уравнения (слайды 7, 8, 9):
Для реакций ионного обмена составляют полные
и сокращенные ионные уравнения. При этом на ионы
никогда не раскладывают :
- нерастворимые вещества (см. таблицу
растворимости); - оксиды;
- воду;
- газы
1) Запишем молекулярное уравнение и
уравняем его:
CuSO4 + 2NaOH Na2SO4 + Cu(OH)2
2) Разложим на ионы все, что возможно и затем
сократим одинаковые ионы в обоих частях
уравнения:
Cu+2 + SO4-2 + 2Na+1 + 2OH-1 2Na+1 + SO4-2
+ Cu(OH)2 (полное ионное уравнение)
3) Запишем то, что получилось:
Cu+2 + 2OH-1 Cu(OH)2
(сокращенное ионное уравнение)
Другие примеры составления ионных уравнений
(разбираются с пояснениями):
Пример 2.
CaCO3 + 2HNO3 Ca(NO3)2 + H2CO3 (H2O
+ CO2)
CaCO3 + 2H+1 + 2NO3-1 Ca+2 + 2NO3-1
+ H2O + CO2
CaCO3 + 2H+1 Ca+2 + H2O + CO2
Пример 3.
CuS + 2HCl CuCl2
+ H2S
CuS + 2H+1 + 2Cl-1 Cu+2 + 2Cl-1 + H2S
CuS + 2H+1
Cu+2 + H2S
Пример 4.
NaOH + HNO3 NaNO3 + H2O
Na+1 + OH-1 + H+1 + NO3-1 Na+1 + NO3-1
+ H2O
OH-1 + H+1 H2O
Пример 5.
K3PO4 + 3NaCl Na3PO4 + 3KCl
3K+1 + PO4-3 + 3Na+1 + 3Cl-1 3Na+1 + PO4-3
+ 3K+1 + 3Cl-1
Вывод: сокращенного ионного уравнения
нет, следовательно, у обратимых реакций нет
сокращенных ионных уравнений
III. Закрепление изученного материала (20 мин)
Учащимся предлагается выполнить задания в
парах. Каждое задание предлагается на слайде и
проверяется на следующем слайде (слайдах).
Задание 1 (Слайд 10)
Саша и Алеша делали домашнее задание. Они
составили уравнения реакций, но случайно на
лист бумаги пролили чернила. Помогите ученикам
восстановить запись. Составьте к
восстановленным
Проверка задания 1 (слайды 11, 12).
1) NaOH + HCl NaCl +
H2O
Na+1 + OH-1 + H+1 + Cl-1 Na+1 + Cl-1
+ H2O
OH-1 + H+1 H2O
2) MgCl2 + Na2SO3 MgSO3
+ 2NaCl
Mg+2 + 2Cl-1 + 2Na+1 + SO3-2
MgSO3
+ 2Na+1
+2Cl-1
Mg+2 + SO3-2 MgSO3
3) K2SO3 + 2HNO3 2KNO3 + H2O + SO2
2K+1 + SO3-2 + 2H+1 + 2NO3-1
2K+1 + 2NO3-1
+ H2O + SO2
SO3-2 + 2H+1 H2O + SO2
4) ZnSO4 + 2NaOH Zn(OH)2
+ Na2SO4
Zn+2 + SO4-2 + 2Na+1 + 2OH-1 2Na+1 + SO4-2
+ Zn(OH)2
Zn+2 + 2OH-1 Zn(OH)2
5) Al(OH)3 + 3HNO3 Al(NO3)3 + 3H2O
Al(OH)3 + 3H+1 + 3NO3-1 Al+3 + 3NO3-1
+ 3H2O
Al(OH)3 + 3H+1 Al+3 + 3H2O
6) CaCO3 + 2 HCl CaCl2 + H2O + CO2
CaCO3 + 2H+1 + 2Cl-1 Ca+2 + 2Cl-1 + H2O
+ CO2
CaCO3 + 2H+1 Ca+2 + H2O + CO2
Задание 2. (слайд 13):
Полные и сокращенные ионные уравнения к
заданиям 2,3,4,5 дети должны будут сделать дома)
Колдунья с вороном отравили лечебный колодец, в
котором был раствор хлористого кальция, который
помогал целому городу. Он использовался
горожанами при отравлениях, кровотечениях,
аллергиях. Они превратили раствор СaCl2 в
нерастворимый известняк CaCO3. Помогите
жителям “расколдовать” колодец, если в вашем
распоряжении есть растворы NaCl, Na2CO3,
HCl, H2SO4, Zn(NO3)2.
Проверка задания 2 (слайд 14):
СаСО3 + 2HCl CaCl2 + H2O + CO2
Задание 3 (слайд 15):
Олененок спешит к друзьям. Он шел долгих 3 дня.
Ему осталось только перейти реку, но река
оказалась испорчена – она наполнена раствором
серной кислоты. Помогите Олененку
воссоединиться с друзьями, если в вашем
распоряжении есть растворы NaCl, Ba(OH)2 HCl, CuSO4,
Ba(NO3)2.
Проверка задания 3 (слайд 16):
H2SO4 + Ba(OH)2 BaSO4
+ 2H2O
Задание 4 (слайд 17):
Тигренок и крокодил поранились, а у доктора
Айболита закончились все лекарства. У него в
распоряжении есть некоторые химикаты: NaNO3,
CuOH)2 H2SO4, НCl, BaCl2. Он знает,
что раствор сульфата меди (II) может оказывать
антисептическое, вяжущее, ранозаживляющее
действие. Помогите доктору приготовить раствор и
вылечить тигренка и крокодила.
Проверка задания 4 (слайд 18):
Cu(OH)2 + H2SO4 CuSO4 + 2H2O
Задание 5 (слайд 19):
Однажды русалка заметила, что ее друзья рыбы
перестали с ней играть и уплывают подальше от ее
дома. Она не могла понять, в чем дело, ведь они не
ссорились… И тогда ее мама рассказала ей, что
рыбы уплывают, потому что около их дома почти нет
растений, и рыбам не хватает кислорода… Русалка
подумала, что можно посадить растения, но они
будут расти долго… А из старых мудрых книжек она
узнала, что можно насытить воду углекислым газом
– повышение концентрации СО2 в воде
приводит к значительному ускорению в росте
растений. В распоряжении русалки оказались: NaOH,
ВaCO3, K2SO4, НCl, Ba(NO3)2.
помогите русалке получить углекислый газ.
Проверка задания 5 (слайд 20):
BаСО3 + 2HCl BaCl2
+ H2O + CO2
IV. На следующем уроке мы продолжим
разбирать тему “Реакции ионного обмена” и
напишем небольшую проверочную работу, а сейчас ….
Домашнее задание (слайд 21):
Параграф 4 упр. 1, 2, 3 стр. 22 и … не забудьте
составить полные и сокращенные ионные уравнения
к заданиям 2, 3, 4, 5, решенным в классе, иначе Ваша
помощь сказочным персонажам не будет полной.
Загрузить PDF
Загрузить PDF
Ионные уравнения являются неотъемлемой частью химии. В них представлены лишь те компоненты, которые изменяются в ходе химической реакции. Чаще всего ионные уравнения используют для описания окислительно-восстановительных реакций, реакций обмена и нейтрализации.[1]
Чтобы записать ионное уравнение, необходимо выполнить три основных шага: сбалансировать молекулярное уравнение химической реакции, перевести его в полное ионное уравнение (то есть записать компоненты в том виде, в каком они существуют в растворе) и, наконец, записать краткое ионное уравнение.
-
1
Поймите разницу между молекулярными и ионными соединениями. Для записи ионного уравнения первым делом следует определить участвующие в реакции ионные соединения. Ионными называют те вещества, которые в водных растворах диссоциируют (распадаются) на заряженные ионы.[2]
Молекулярные соединения не распадаются на ионы. Они состоят из двух неметаллических элементов, и иногда их называют ковалентными соединениями.[3]
- Ионные соединения могут возникать между металлом и неметаллом, металлом и многоатомными ионами, либо между несколькими многоатомными ионами.
- Если вы сомневаетесь, к какой группе принадлежит то или иное соединение, посмотрите на свойства составляющих его элементов в таблице Менделеева.[4]
-
2
Определите растворимость соединения. Не все ионные соединения растворяются в водных растворах, то есть не все из них диссоциируют на отдельные ионы. Прежде чем приступить к записи уравнения, следует найти растворимость каждого соединения. Ниже приведены краткие правила растворимости. Более подробные сведения и исключения из правил можно найти в таблице растворимости.[5]
- Следуйте правилам в том порядке, в котором они приведены ниже:
- все соли Na+, K+ и NH4+ растворяются;
- все соли NO3–, C2H3O2–, ClO3– и ClO4– растворимы;
- все соли Ag+, Pb2+ и Hg22+ нерастворимы;
- все соли Cl–, Br– и I– растворяются;
- соли CO32-, O2-, S2-, OH–, PO43-, CrO42-, Cr2O72- и SO32- нерастворимы (за некоторыми исключениями);
- соли SO42- растворимы (за некоторыми исключениями).
-
3
Определите катион и анион соединения. Катионами называют положительно заряженные ионы (обычно это металлы). Анионы имеют отрицательный заряд, как правило это ионы неметаллов. Некоторые неметаллы могут образовывать не только анионы, но и катионы, в то время как атомы металлов всегда выступают в роли катионов.[6]
- Например, в соединении NaCl (поваренная соль) Na является положительно заряженным катионом, поскольку это металл, а Cl представляет собой отрицательно заряженный анион, так как это неметалл.
-
4
Определите участвующие в реакции многоатомные (сложные) ионы. Такие ионы представляют собой заряженные молекулы, между атомами которых существует такая сильная связь, что они не диссоциируют при химических реакциях.[7]
Необходимо выявить многоатомные ионы, поскольку они обладают своим зарядом и не распадаются на отдельные атомы. Многоатомные ионы могут иметь как положительный, так и отрицательный заряд.- При изучении общего курса химии вам, скорее всего, понадобится запомнить некоторые из наиболее распространенных многоатомных ионов.
- К наиболее распространенным многоатомным ионам относятся CO32-, NO3–, NO2–, SO42-, SO32-, ClO4– и ClO3–.[8]
- Существует множество других многоатомных ионов, которые можно найти в учебнике химии или интернете.[9]
Реклама
-
1
Сбалансируйте полное молекулярное уравнение. Прежде чем приступить к записи ионного уравнения, следует сбалансировать исходное молекулярное уравнение. Для этого необходимо расставить соответствующие коэффициенты перед соединениями, так чтобы число атомов каждого элемента в левой части равнялось их количеству в правой части уравнения.
- Запишите число атомов каждого элемента по обе стороны уравнения.
- Добавьте перед элементами (кроме кислорода и водорода) коэффициенты, так чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаковым.
- Сбалансируйте атомы водорода.
- Сбалансируйте атомы кислорода.
- Пересчитайте количество атомов каждого элемента по обе стороны уравнения и убедитесь, что оно одинаково.
- Например, после балансировки уравнения Cr + NiCl2 –> CrCl3 + Ni получаем 2Cr + 3NiCl2 –> 2CrCl3 + 3Ni.
-
2
Определите, в каком состоянии находится каждое вещество, которое участвует в реакции. Часто об этом можно судить по условию задачи. Есть определенные правила, которые помогают определить, в каком состоянии находится элемент или соединение.[10]
- Если в условии задачи не указано состояние того или иного элемента, используйте для его определения таблицу Менделеева.
- Если в условии сказано, что соединение находится в растворе, отметьте это (р-р).
- Если в уравнение входит вода, определите по таблице растворимости, диссоциирует ли данное ионное соединение.[11]
В случае высокой растворимости соединение диссоциирует в воде (р-р). Если соединение имеет низкую растворимость, оно останется в твердом виде (тв). - Если в реакции не участвует вода, ионное соединение останется в твердом виде (тв).
- Если в задаче фигурирует кислота или основание, они будут растворены в воде (р-р).
- В качестве примера рассмотрим реакцию 2Cr + 3NiCl2 –> 2CrCl3 + 3Ni. В чистом виде элементы Cr и Ni находятся в твердой фазе. NiCl2 и CrCl3 представляют собой растворимые ионные соединения, то есть они находятся в растворе. Таким образом, данное уравнение можно переписать в следующем виде: 2Cr(тв) + 3NiCl2(р-р) –> 2CrCl3(р-р) + 3Ni(тв).
-
3
Определите, какие соединения диссоциируют (разделяются на катионы и анионы) в растворе. При диссоциации соединение распадается на положительный (катион) и отрицательный (анион) компоненты. Эти компоненты затем войдут в ионное уравнение химической реакции.
- Не диссоциируют твердые тела, жидкости, газы, молекулярные соединения, ионные соединения с низкой растворимостью, многоатомные ионы и слабые кислоты.
- Полностью диссоциируют ионные соединения с высокой растворимостью (используйте таблицу растворимости) и сильные кислоты (HCl(р-р), HBr(р-р), HI(р-р), H2SO4(р-р), HClO4(р-р) и HNO3(р-р)).[12]
- Учтите, что хотя многоатомные ионы не диссоциируют, они могут входить в состав ионного соединения и отделиться от него в растворе.
-
4
Посчитайте заряд каждого диссоциировавшего иона. При этом помните, что металлы образуют положительно заряженные катионы, а атомы неметаллов превращаются в отрицательные анионы. Определите заряды элементов по таблице Менделеева. Необходимо также сбалансировать все заряды в нейтральных соединениях.
- В приведенном выше примере NiCl2 диссоциирует на Ni2+ и Cl–, а CrCl3 распадается на Cr3+ и Cl–.
- Ион никеля имеет заряд 2+, поскольку он соединен с двумя ионами хлора, каждый из которых имеет единичный отрицательный заряд. При этом один ион Ni должен сбалансировать два отрицательно заряженных иона Cl. Ион Cr имеет заряд 3+, так как он должен нейтрализовать три отрицательно заряженных иона Cl.
- Помните о том, что многоатомные ионы имеют свои собственные заряды.[13]
-
5
Перепишите уравнение так, чтобы все растворимые соединения были разделены на отдельные ионы. Все что диссоциирует или ионизируется (например, сильные кислоты) распадется на два отдельных иона. При этом вещество останется в растворенном состоянии (р-р). Проверьте, чтобы уравнение было сбалансировано.
- Твердые вещества, жидкости, газы, слабые кислоты и ионные соединения с низкой растворимостью не изменят своего состояния и не разделятся на ионы. Оставьте их в прежнем виде.
- Молекулярные соединения просто рассеются в растворе, и их состояние изменится на растворенное (р-р). Есть три молекулярных соединения, которые не перейдут в состояние (р-р), это CH4(г), C3H8(г) и C8H18(ж).
- Для рассматриваемой реакции полное ионное уравнение запишется в следующем виде: 2Cr(тв) + 3Ni2+(р-р) + 6Cl–(р-р) –> 2Cr3+(р-р) + 6Cl–(р-р) + 3Ni(тв). Если хлор не входит в состав соединения, он распадается на отдельные атомы, поэтому мы умножили количество ионов Cl на 6 с обеих сторон уравнения.
-
6
Сократите одинаковые ионы в левой и правой части уравнения. Можно вычеркнуть лишь те ионы, которые полностью идентичны с обеих сторон уравнения (имеют одинаковые заряды, нижние индексы и так далее). Перепишите уравнение без этих ионов.
- В нашем примере обе части уравнения содержат 6 ионов Cl–, которые можно вычеркнуть. Таким образом, получаем краткое ионное уравнение: 2Cr(тв) + 3Ni2+(р-р) –> 2Cr3+(р-р) + 3Ni(тв).
- Проверьте результат. Суммарные заряды левой и правой частей ионного уравнения должны быть равны.
Реклама
Советы
- Приучите себя всегда записывать агрегатное состояние всех компонентов во всех уравнениях химических реакций.
Реклама
Об этой статье
Эту страницу просматривали 71 727 раз.