Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
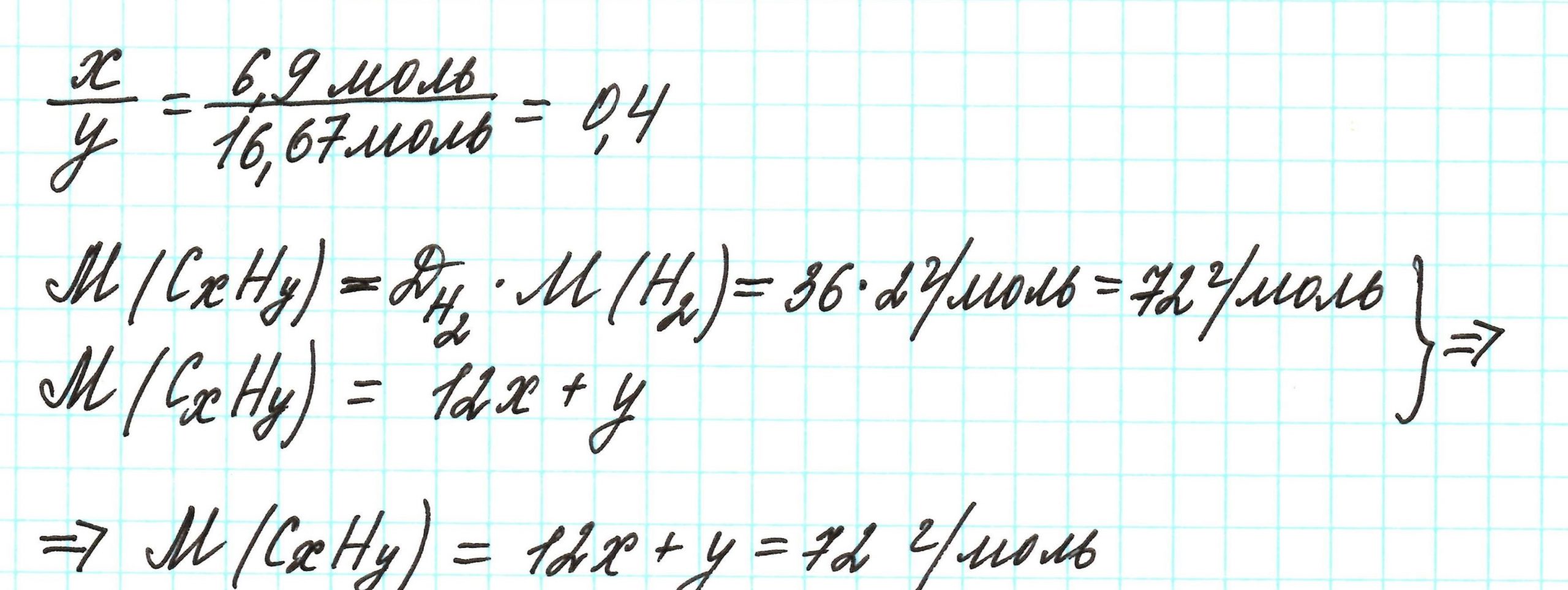
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
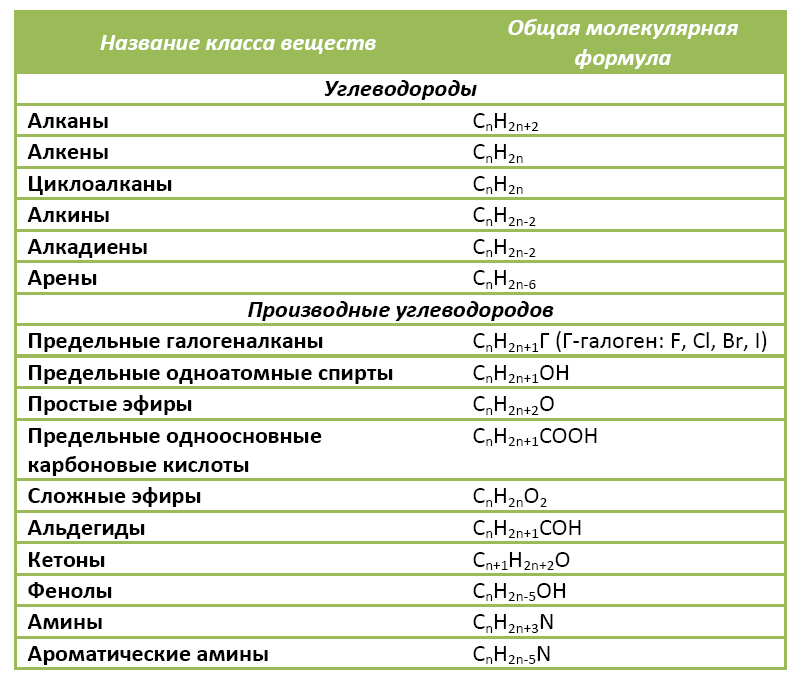
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
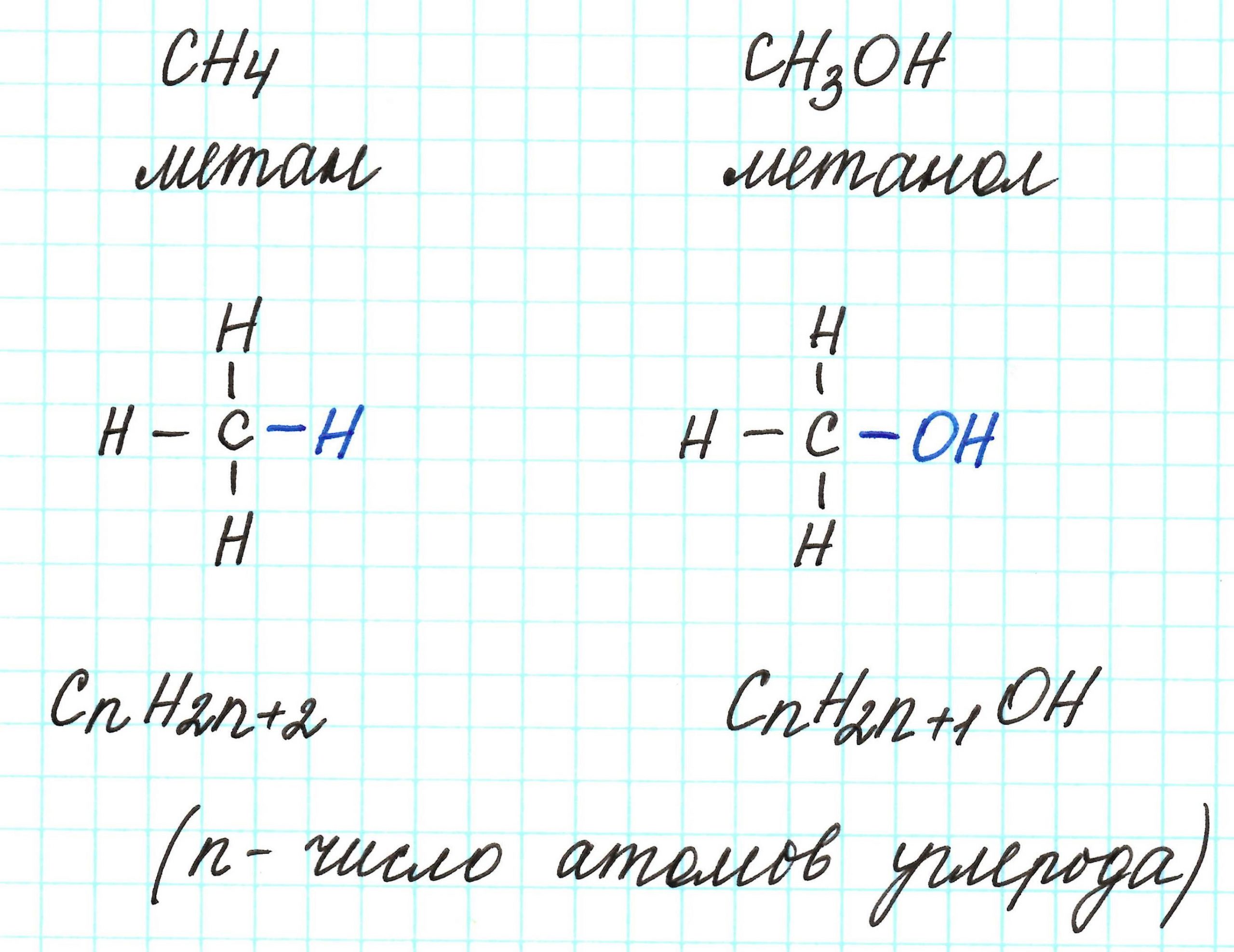
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
Установление формулы органического вещества
Установление строения химического соединения является предметом научного исследования. Сложность данной проблемы зависит от сложности строения соединения. Первым этапом исследования, как правило, является определение молекулярной формулы вещества. Рассмотрим некоторые способы установления формул органических веществ на достаточно простых примерах.
Пример 1. Более двух столетий назад химики уже умели определять качественный и количественный состав веществ. Например, было известно, что в состав одного из органических веществ входят углерод и водород, причём массовая доля углерода составляет 75 %, а водорода — 25 %. То есть в 100 г вещества содержится 75 г углерода и 25 г водорода. Используя эти данные, определите формулу органического вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его молекулярную формулу можно представить в виде CxHy. Таким образом, решение задачи сводится к нахождению индексов x и y в формуле вещества. Индексы x и y в формуле показывают количества атомов углерода и водорода в молекуле органического вещества, поэтому на первом этапе решения подобных задач необходимо найти простейшее целочисленное соотношение между количеством атомов углерода и водорода в неизвестном веществе:
x : y = n(C) : n(H).
По условию, масса атомов углерода равна 75 г, водорода — 25 г. Тогда:
Точность промежуточных вычислений должна соответствовать точности исходных данных, то есть промежуточные значения должны содержать не меньше значащих цифр, чем данные задачи.
Видно, что полученное соотношение не является целочисленным. Чтобы получить целочисленные значения индексов x и y, выполняют следующие действия: сначала все числа полученного соотношения делят на наименьшее (в одном случае уже будет единица), и при необходимости умножают полученные числа на натуральное число (2, 3 и т. д.) для получения целочисленного соотношения:
Тогда формула соединения — CH4. Это вещество нам хорошо известно, оно называется метан.
О т в е т: СН4.
Пример 2. Некоторое органическое вещество состоит из углерода и водорода. Массовая доля углерода в веществе составляет 82,8 %. Установите молекулярную формулу вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его формула — CxHy. В условии задачи даны массовые доли элементов в веществе. В таких случаях при решении задачи удобно рассмотреть определённую массу вещества, которую обычно принимают равной 100 г. В этом случае массовые доли элементов будут совпадать по величине с их массами. Тогда простейшее целочисленное соотношение индексов в формуле вещества:
Следовательно, простейшая формула органического вещества — С2Н5. Устойчивого органического вещества с такой формулой не существует. Действительно, формула С2Н5 соответствует этильному радикалу. Чтобы определить истинную формулу органического вещества, будем учитывать, что удвоение, утроение и т. д. индексов в формуле не изменяет соотношение между ними. Удвоив индексы в простейшей формуле С2Н5, получим формулу С4Н10. Эта формула соответствует углеводороду бутану. Таким образом, истинная формула вещества — С4Н10.
О т в е т: С4Н10.
В рассмотренных примерах для определения формулы органического вещества нам было достаточно знать лишь массовые доли элементов в веществе. В то же время, в некоторых случаях, зная лишь массовые доли элементов в веществе, можно определить только простейшую, но не истинную формулу. В таких случаях для установления истинной формулы необходимы дополнительные данные. Как правило, это сведения о молярной массе соединения.
Пример 3. Молярная масса углеводорода равна 42 г/моль. Массовая доля углерода в углеводороде составляет 85,7 %. Установите молекулярную формулу углеводорода.
Формула углеводорода — CxHy. Найдём простейшее целочисленное соотношение индексов в формуле вещества:
Следовательно, простейшая формула углеводорода — СН2. Удвоив индексы в простейшей формуле СН2, получим формулу С2Н4. Эта формула соответствует углеводороду этилену. Если утроить индексы в простейшей формуле СН2, то получится формула С3Н6. Данная формула соответствует углеводороду пропилену. То есть, найденному соотношению индексов соответствует множество веществ, поэтому в данном случае, используя лишь массовые доли элементов, невозможно установить истинную формулу вещества.
Для установления истинной формулы сравним молярную массу углеводорода с молярной массой простейшей формулы CH2:
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2 в 3 раза. Тогда истинная формула углеводорода — C3H6.
О т в е т: С3Н6.
В составе органических соединений, наряду с углеродом и водородом, часто присутствует кислород. Выведем молекулярную формулу кислородсодержащего соединения.
Пример 4. Установите простейшую формулу вещества, содержащего 37,50 % углерода, 12,50 % водорода и 50,00 % кислорода (по массе).
Простейшее целочисленное соотношение индексов в формуле вещества:
Простейшая формула вещества СН4О. Этой молекулярной формуле соответствует метиловый спирт .
О т в е т: СН4О или .
В рассмотренных примерах для установления формул мы использовали сведения о массовых долях элементов в веществе. Формулу органического вещества можно вывести также на основании данных эксперимента по сжиганию определённой массы органического вещества.
Пример 5. В результате сжигания 1,50 г органического вещества получено 2,20 г углекислого газа и 0,90 г воды. Молярная масса вещества равна 60 г/моль. Установите формулу вещества.
Поскольку при сжигании вещества образовались только углекислый газ и вода, то в состав вещества могли входить лишь атомы углерода, водорода и кислорода. Тогда формула вещества — CxHyOz. Соотношение индексов в формуле будем находить из условия:
x : y : z = n(C) : n(H) : n(O).
Составим схему реакции:
Из схемы реакции видно, что углерод из органического вещества переходит в CO2, водород — в H2O. Таким образом количества углерода и водорода в CO2 и H2O будут такими же, как в органическом веществе.
Найдём количество углерода в CO2:
В молекуле воды содержится два атома водорода, следовательно, количество (моль) водорода в два раза больше количества воды:
Определим количество (моль) атомов кислорода в веществе. Для этого рассчитаем массы углерода и водорода в данной порции вещества:
Рассчитаем массу и количество кислорода в веществе:
Простейшее целочисленное соотношение индексов в формуле вещества:
x : y : z = n(C) : n(H) : n(O) = 0,05 : 0,1 : 0,05 = 1 : 2 : 1.
Таким образом, простейшая формула органического вещества СН2O.
Для установления истинной формулы сравним молярную массу вещества с молярной массой простейшей формулы — CH2O:
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2O в два раза. Тогда истинная формула вещества — C2H4O2. Одним из веществ, имеющих такую молекулярную формулу, является уксусная кислота СН3 — СООН.
О т в е т: C2H4O2.
Обобщим вышеизложенное. Зная количества (моль) элементов в веществе можно установить простейшую формулу вещества. Для вывода истинной формулы зачастую необходимы дополнительные данные, например сведения о молярной массе вещества.
Вывод формулы органического вещества обычно состоит из следующих этапов:
а) вычисление количества (моль) элементов в веществе;
б) определение простейшего целочисленного соотношения между вычисленными количествами элементов — установление простейшей формулы вещества;
в) установление истинной формулы вещества.
Для установления простейшей формулы достаточно знать количества (моль) элементов в веществе.
Для определения истинной формулы часто требуются дополнительные данные, например сведения о молярной массе вещества.
определим молекулярную формулу углеводорода, в котором содержится (85,71)
%
углерода и (14,29)
%
водорода. Известно, что относительная плотность этого углеводорода по воздуху составляет (0,966).
Первый вариант решения
1. В веществе содержатся только атомы углерода и водорода, значит, его формулу можно записать так —
CxHy
. Индексы в формуле показывают отношение количеств атомов:
x:y=n(C):n(H).
По массовым долям определяем, что в (100) г углеводорода содержится (85,71) г углерода и (14,29) г водорода.
Найдём количества этих элементов:
x=m(C)Ar(C)=85,71 г12 г/моль=7,1425 моль;
y=m(H)Ar(H)=14,29г1г/моль=14,29моль;
x:y=7,1425:14,29=7,14257,1425:14,297,1425=1:2.
Значит, простейшая формула углеводорода —
CH2
.
2. Определим относительную молекулярную массу вещества и сравним её с массой
CH2
:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
Mr(CxHy)Mr(CH2)=2814=2.
Следовательно, молекулярная формула вещества
(CH2)2=C2H4.
Второй вариант решения
1. Определим относительную молекулярную массу углеводорода:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
2. Найдём число атомов углерода и водорода в молекуле:
x=Mr(C)⋅w(C)Ar(C)⋅100%=28⋅85,71%12⋅100%=2;
y=Mr(CxHy)⋅w(H)Ar(H)⋅100%=28⋅14,29%1⋅100%=4.
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите “Нет”.
НЕОБХОДИМЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ.
1. МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В ВЕЩЕСТВЕ.
Массовая доля элемента — это его содержание в веществе в процентах по массе.
3. МОЛЕКУЛЯРНАЯ И ПРОСТЕЙШАЯ ФОРМУЛА ВЕЩЕСТВА.
Молекулярная (истинная) формула — формула, в которой отражается реальное число атомов каждого вида, входящих в молекулу вещества.
Например, С6Н6 — истинная формула бензола.
Простейшая (эмпирическая) формула — показывает соотношение атомов в веществе.
Например, для бензола соотношение С:Н = 1:1, т.е. простейшая формула бензола — СН.
Молекулярная формула может совпадать с простейшей или быть кратной ей.
Если в задаче даны только массовые доли элементов, то в процессе
решения задачи можно вычислить только простейшую формулу вещества.
Для получения истинной формулы в задаче обычно даются ДОПОЛНИТЕЛЬНЫЕ ДАННЫЕ — молярная масса, относительная
или абсолютная плотность вещества или другие данные, с помощью которых можно
определить молярную массу вещества.
4. ОТНОСИТЕЛЬНАЯ ПЛОТНОСТЬ ГАЗА Х ПО ГАЗУ — DПОУ(Х).
Относительная плотность D — это величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её рассчитывают как отношение молярных масс газов Х и У.
Часто для расчетов используют относительные плотности газов по водороду и по воздуху.
Воздух — это смесь газов, поэтому для него можно рассчитать только среднюю молярную массу. Её величина принята за 29 г/моль (исходя из примерного усреднённого состава).
5. АБСОЛЮТНАЯ ПЛОТНОСТЬ ГАЗА ПРИ НОРМАЛЬНЫХ УСЛОВИЯХ.
Абсолютная плотность газа — это масса 1 л газа при нормальных условиях. Обычно для газов её измеряют в г/л.
АЛГОРИТМ 1
НАХОЖДЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА ПО МАССОВЫМ ДОЛЯМ ЭЛЕМЕНТОВ И ОТНОСИТЕЛЬНОЙ ПЛОТНОСТИ
1. Составить краткую запись условия задачи.
2. Отметить массу вещества за 100г и перевести массовые доли элементов массы. Зная массу по формуле найти количество каждого элемента.
3. Записать соотношение количеств элементов, выразить это отношение целыми числами (разделив на самое маленькое число).
4.Составить химическую формулу по полученным индексам – если плотность не дана, это и есть формула вещества.
5. Если дана плотность, найти молярную массу вещества.
6. Определить молярную массу вещества по относительной плотности вещества.
7. Разделить молярную массу по относительной плотности на молярную массу определённого вещества
8. На полученное целое число умножить все индексы определённого вещества – это и есть данное вещество.
АЛГОРИТМ 2
НАХОЖДЕНИЕ ФОРМУЛЫ ВЕЩЕСТВА ПО ПРОДУКТАМ СГОРАНИЯ И ОТНОСИТЕЛЬНОЙ ПЛОТНОСТИ
1. Условие задачи
2. Составить краткую запись условия задачи.
3.Определить молярные массы продуктов сгорания, количество углерода и водорода в продуктах сгорания.
4. Если дана масса сгоревшего вещества, вычислить массу кислорода или других элементов.
Далее задача решается, как предыдущая.
ОПРЕДЕЛЕНИЕ ФОРМУЛ ВЕЩЕСТВ ПО ФОРМУЛЕ И ХИМИЧЕСКИМ СВОЙСТВАМ.
40(В) Задачи ЕГЭ ФИПИ 2015 на нахождение молекулярной формулы вещества
Приложение №1 Общие формулы неорганических соединений
Подготовка к ЕГЭ:
-
выполнение заданий высокого уровня
сложности, задачи на вывод формул.
Задачи на вывод формул соединений –
это задания С5 из 3 части экзаменационной
работы ЕГЭ.
При выводе формул нужно различать
простейшую и
истинную
формулы.
Простейшая формула показывает соотношение
числа атомов каждого элемента.
Истинная формула показывает точный
количественный состав. Например,
простейшая формула бензола СН, она
показывает, что на один атом углерода
в молекуле бензола приходится один атом
водорода. Истинная формула бензола,
показывающая точный количественный
состав молекулы – С6Н6.
Чтобы установить истинную формулу,
нужно знать истинную молекулярную
(молярную) массу, она в целое число раз
больше массы, найденной по простейшей
формуле. На это число нужно умножить
индексы в простейшей формуле, чтобы
получить истинную формулу. Если в условии
задачи нет данных для нахождения истинной
молярной массы, а найденная простейшая
формула явно не соответствует истинной,
то полученные индексы нужно увеличить
в два раза. Например, получилась простейшая
формула С3Н7, значит истинная
будет С6Н14
При всём многообразии задач на вывод
формул можно выделить несколько основных
типов. Рассмотрим алгоритмы решений
этих задач наиболее простыми способами.
-
Написать формулу вещества, обозначив
индексы через x, y,
z. -
Если неизвестна массовая доля одного
из элементов, то её находят, отняв от
100 % известные массовые доли.
3. Найти соотношение индексов, для
этого массовую долю каждого элемента
(лучше в %) разделить на его атомную массу
(округлить до тысячных долей)
x : y: z
= ω1 / Ar1
: ω2 / Ar2
: ω3 / Ar3
4. Полученные числа
привести к целым. Для этого разделить
их на наименьшее из полученных чисел.
При необходимости (если опять получилось
дробное число) после этого домножить
до целого числа на 2, 3, 4 … .
5. Получится простейшая формула.
Для большинства неорганических веществ
она совпадает с истинной, для органических,
наоборот, не совпадает.
Задача № 1.
Массовая доля азота в оксиде азота равна
36,84 % . Найти формулу данного оксида.
Дано:
ω
(N)
= 36,84 % Решение:
1. Напишем формулу:
NxOy
М.Ф. = ? 2. Найдём
массовую долю кислорода:
ω(О) = 100 % – 36,84 % =
61,16 %
3. Найдём соотношение
индексов:
x : y
= 36,84 / 14 : 61,16 / 16 = 2,631: 3,948 =
2,631 / 2,631: 3,948 / 2,631 = 1:
1,5 =
= 1 ∙ 2 : 1,5 ∙ 2 = 2 : 3
N2O3
Ответ: N2O3.
Задача № 2.
Установите формулу неорганического
соединения, содержащего 20 % магния, 53,33
% кислорода и 26,67 % некоторого элемента.
Дано:
ω
(Mg)
= 20 % Решение:
ω(O) = 53,33 %
1. Напишем формулу: Mgx
Эy Оz.
ω(э) = 26,67 % 2. Найдём
соотношение индексов магния и кислорода:
х : у = 20 / 24 : 53,33 / 16 =
0,83 : 3,33 = 1 : 4.
М.Ф. = ? 3. Найдём молекулярную
массу вещества, исходя из значения
массовой доли магния:
ω(Mg) = Ar(Mg)
∙ индекс / Mr
Mr = Ar(Mg) ∙
индекс / ω
= 24 ∙ 1 / 0,2 = 120.
4. Найдём
атомную массу неизвестного элемента:
ω(Э) = Ar(Э)
∙ индекс / Mr
Ar(Э) ∙ индекс =
= ω(Э) ∙ Мr
= 0,2667 ∙ 120 = 32 элемент
– сера.
Ответ: MgSO4.
Задача № 3.
Массовая доля углерода в углеводороде
равна 83,72 %. Найти молекулярную формулу
углеводорода.
Д
ано:
Решение:
ω(С) = 83,72 % 1. Напишем формулу –
СхНу
2. Найдём массовую
долю водорода:
М.Ф. = ? ω(Н) = 100 % – 83,72 % = 16,28 %
3. Найдём соотношение
индексов:
х : у = 83,72 / 12 : 16,28 / 1
= 6,977 : 16,28 = 1 : 2,333 = 3 : 7
4. Простейшая
формула – С3Н7, но
она не соответствует истинной.
Выход – увеличить
индексы в 2 раза
С6Н14.
Ответ: С6Н14.
Задача № 4.
Массовая доля фосфора в его оксиде
равна 43,66 %. Какова формула оксида?
Ответ: Р2О5.
Задача № 5.
Определить формулу вторичного
амина, массовые доли углерода, водорода
и азота, в котором составляют 61; 15,3 и
23,7 % соответственно.
Ответ: CH3
– NH – C2H5.
Задача № 6.
Массовая доля углерода в диеновом
углеводороде составляет 88,89 %. Найти
молекулярную формулу диена.
Ответ: С4Н6.
II. Вывод формул
веществ по массовым долям элементов и
данным для нахождения истинной молярной
массы (плотности,
массе и объёму газа или относительной
плотности).
-
Найти истинную молярную массу:
-
если известна плотность:
= m / V = M
/ Vm
M
= ∙
Vm
= г/л
∙ 22,4 л/моль
если известна масса и объём
газа, молярную массу можно найти двумя
способами:
– через плотность
= m / V, M
= ∙ Vm;
– через количество вещества:
= V / Vm, M
= m / .
-
если известна относительная плотность
первого газа по другому:
D21
= M1
/ M2
M1
= D2
∙ M2
M =
DH2
∙ 2 M = DO2
∙ 32
M
= Dвозд. ∙
29 M = DN2
∙ 28 и т.д.
2. Найти простейшую формулу вещества
(см. предыдущий алгоритм) и его молярную
массу.
3. Сравнить истинную молярную массу
вещества с простейшей и увеличить
индексы в нужное число раз.
Задача № 1.
Найти формулу углеводорода, в котором
содержится 14,29 % водорода, а его
относительная плотность по азоту равна
2.
Дано:
ω
(Н)
= 14,29 % Решение:
D(N2)
= 2 1. Найдём истинную молярную
массу СхНу :
М = DN2
∙ 28 = 2 ∙ 28 = 56 г/моль.
М.Ф. = ? 2. Найдём массовую
долю углерода:
ω(С) = 100 % – 14,29 % = 85,71 %.
3. Найдём простейшую
формулу вещества и его молярную массу:
х : у = 85,7 / 12 : 14,29 / 1 = 7,142 : 14,29 = 1 :
2 СН2
М(СН2) = 12 + 1 ∙ 2 = 14 г/моль
4. Сравним молярные
массы:
М(СхНу)
/ М(СН2) = 56 / 14 = 4
истинная формула – С4Н8.
Ответ: С4Н8.
Задача № 2.
Массовая доля углерода в углеводороде
– 87,5 %, а относительная плотность
углеводорода по воздуху равна 3,31.
Определить формулу вещества.
Ответ: C7H12.
Задача № 3.
Определить молекулярную формулу амина,
массовые доли углерода, азота и водорода
в котором составляют 38,7; 45,15 и 16,15 %
соответственно. Относитель-
ная плотность его паров по воздуху равна
1,069.
Ответ: CH3NH2.
Задача № 4.
Определите формулу углеводорода,
массовая доля водорода в котором
составляет 14,3 %. Относительная плотность
этого вещества по водороду равна 21.
Ответ: С3Н6.
Задача № 5.
Относительная плотность паров
углеводорода по воздуху равна 3,31, а
массовая доля водорода в нём равна 12,5
%. Определите молекулярную формулу
углеводорода.
Ответ: С7Н12.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
12.02.2015398.43 Кб275.pdf
- #
- #
- #
- #
- #
- #
- #
- #
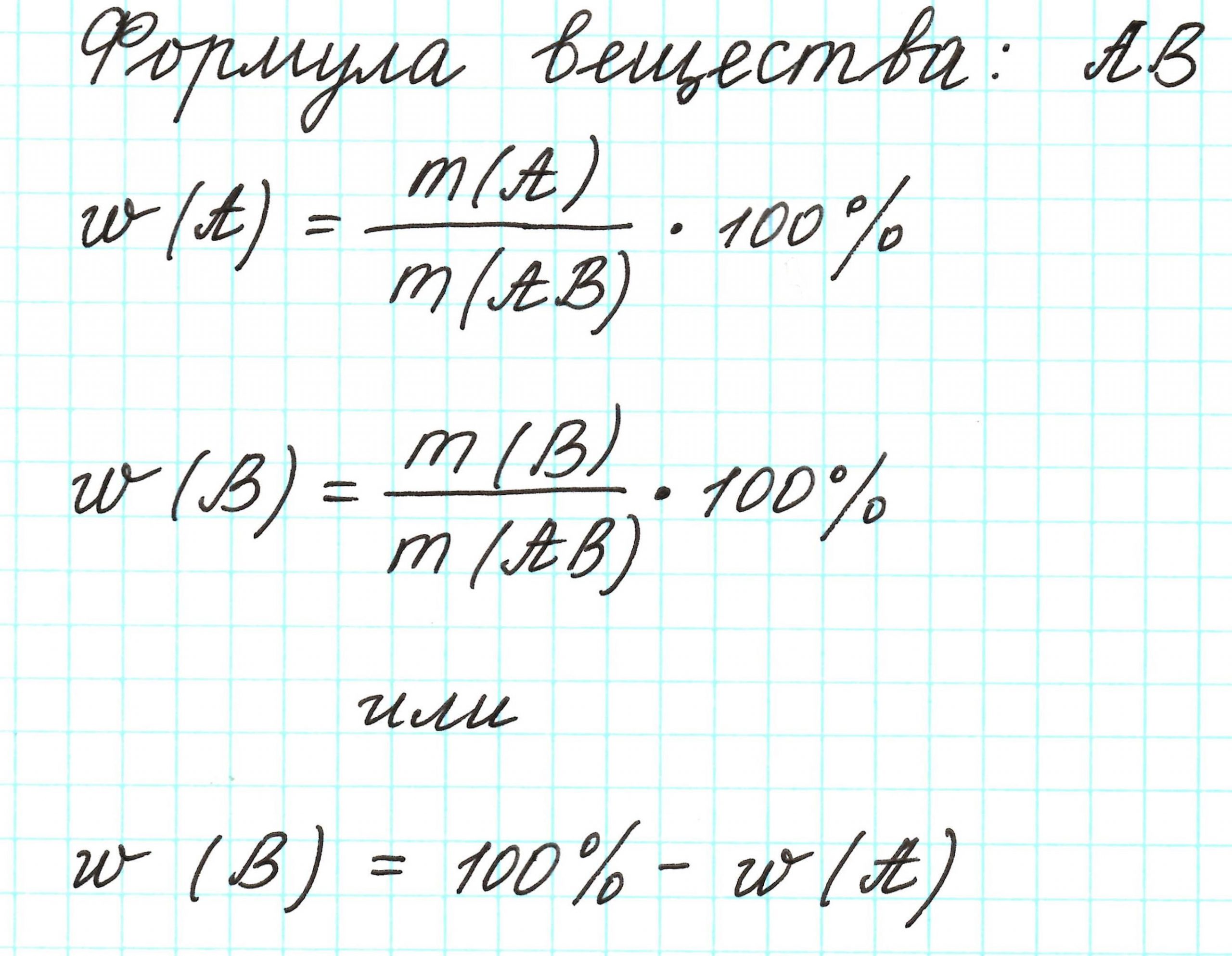
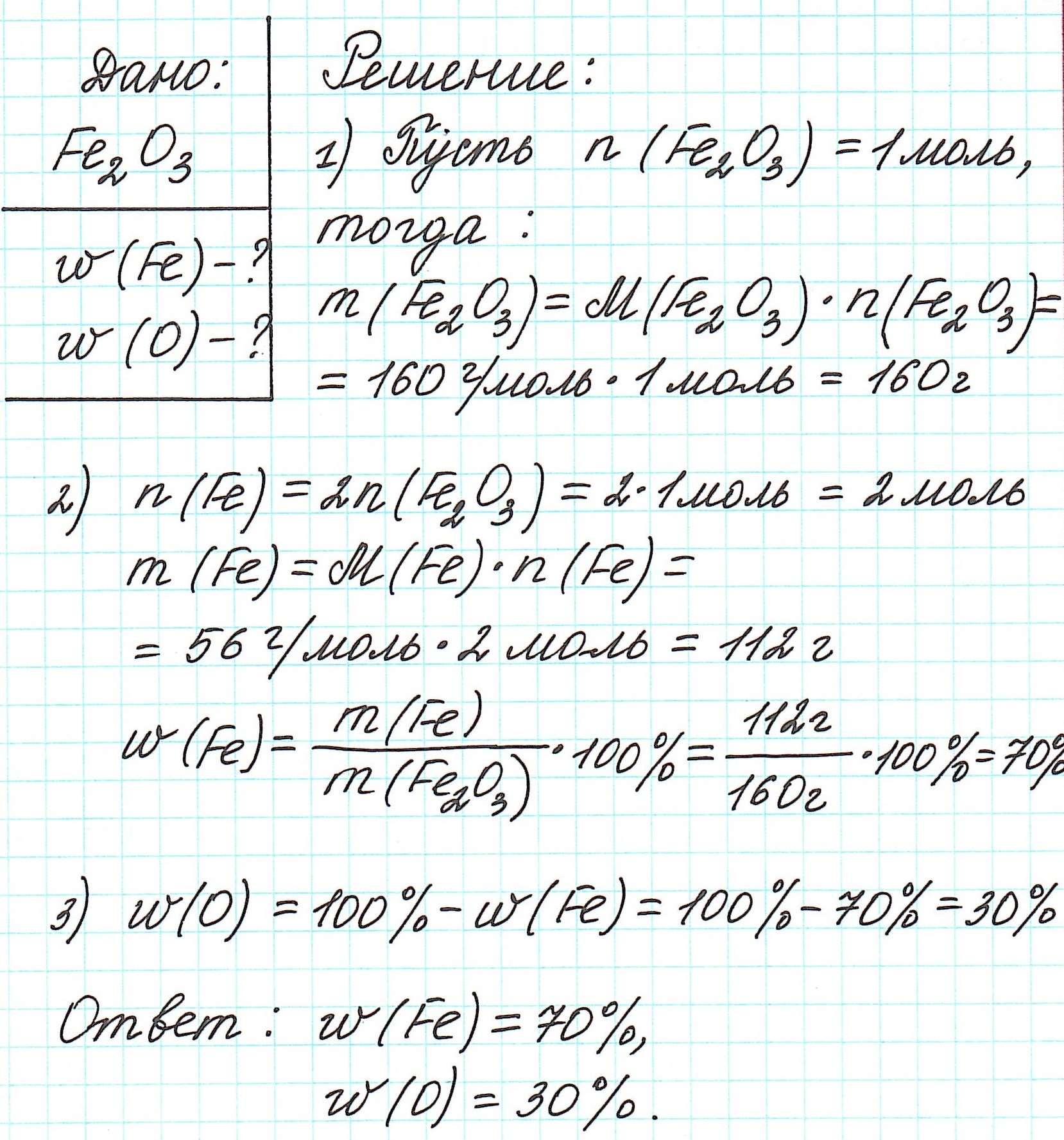
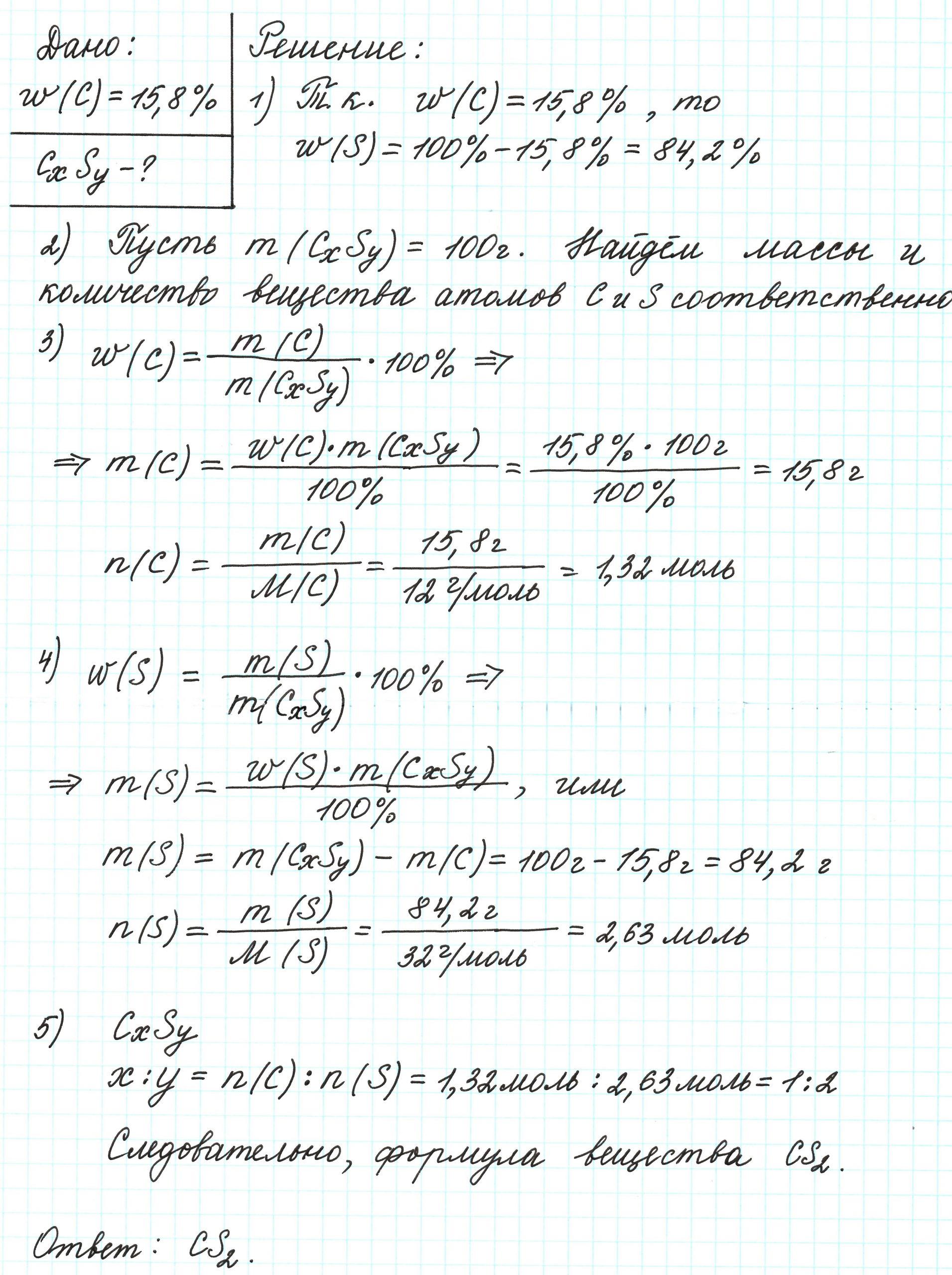


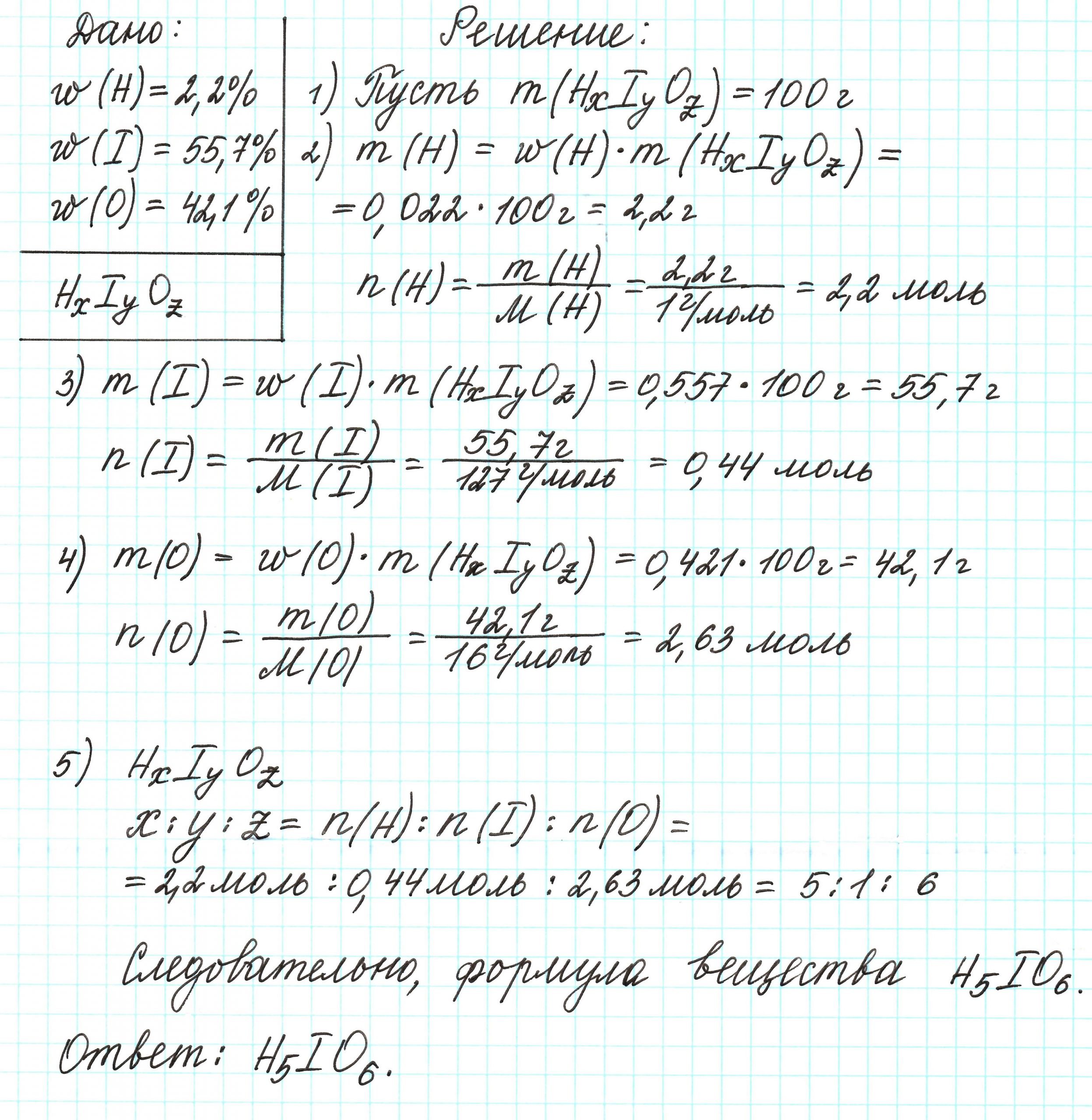


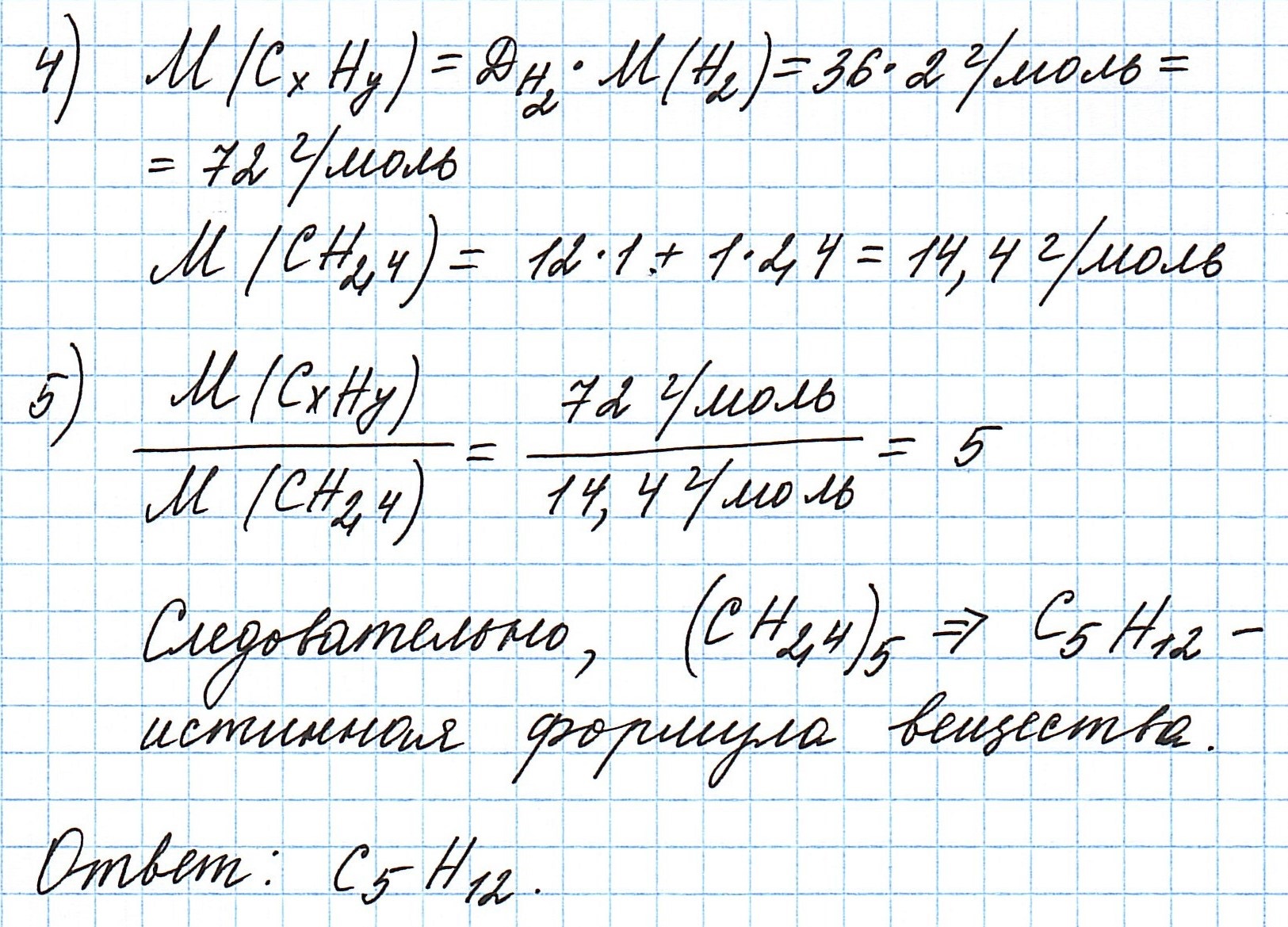









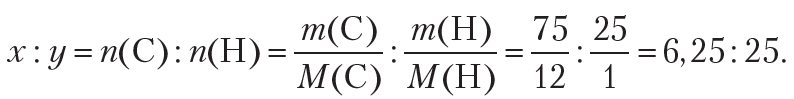
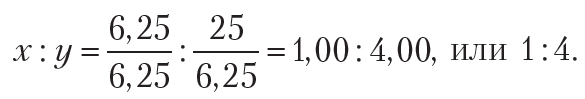
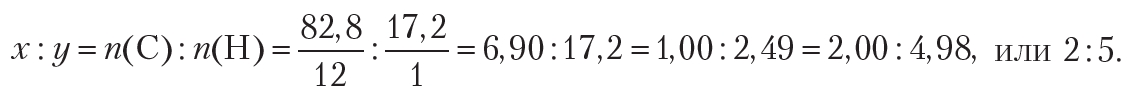
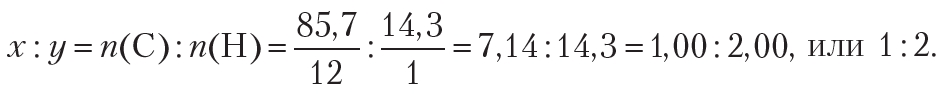
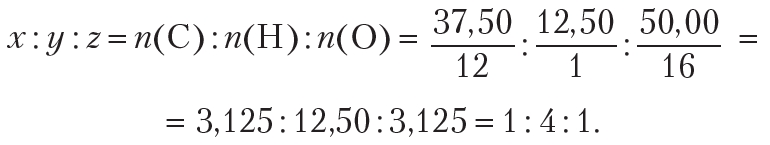

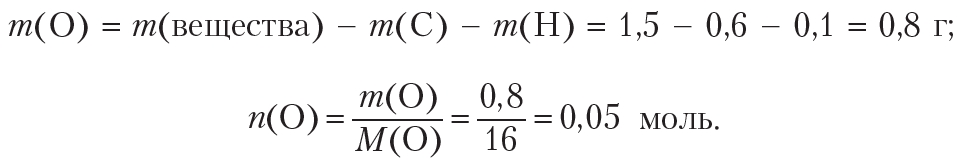
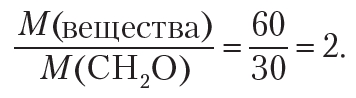
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)

















