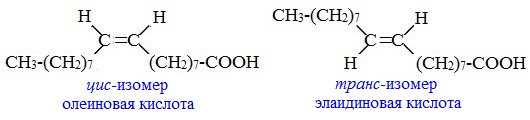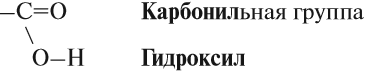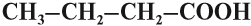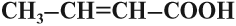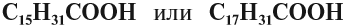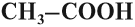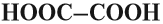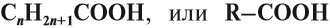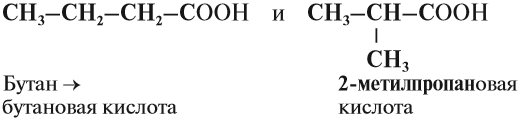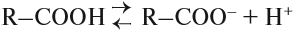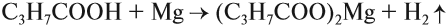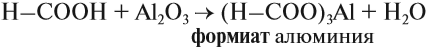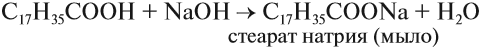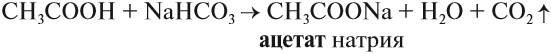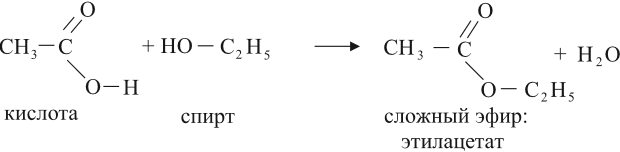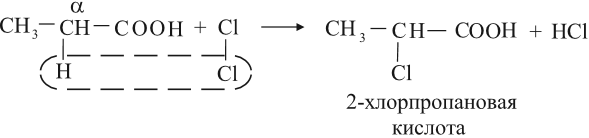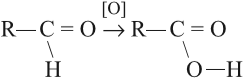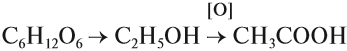Изомерия карбоновых кислот
Для карбоновых кислот характерна структурная и пространственная изомерия.
1. Структурная изомерия
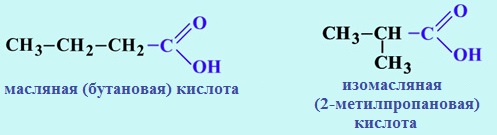
а) Изомерия углеродного скелета (начиная с C4)
Изомерия углеродного скелета начинается с бутановой кислоты С3Н7СООН, которая существует в виде двух изомеров:
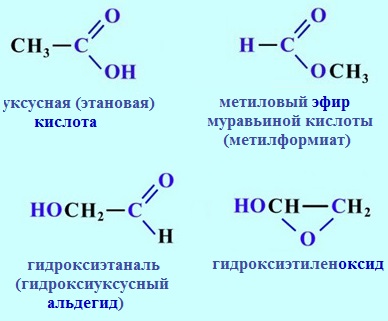
б) Межклассовая изомерия (начиная с C2)
Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений:
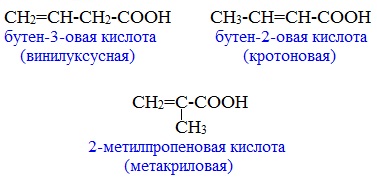
в) Изомерия положения кратной связи
Этот вид изомерии характерен для непредельных карбоновых кислот. Например, кротоновая кислота имеет три изомера:
Изомеры валериановой кислоты
2. Пространственная изомерия
а) Оптическая
Оптическую изомерию проявляют карбоновые кислоты, в молекулах которых присутствует асимметрический атом углерода (sp3-атом, связанный с 4-мя различными заместителями). Соединения, содержащие такой атом углерода, могут существовать в виде 2-х пространственных изомеров, которые называются оптическими изомерами.
Например, 2-метилбутановая кислота С2Н5СН(СН3)СООН существует в виде двух оптических изомеров:
б) Цис- транс – изомерия (геометрическая изомерия)
Этот вид изомерии характерен для непредельных карбоновых кислот. Так, для олеиновой кислоты С17Н33СООН существует два геометрических изомера:
Карбоновые кислоты
…
Изомерия карбоновых кислот
Для карбоновых кислот характерны структурная, геометрическая и оптическая виды изомерии.
А) Структурная изомерия
- Изомерия углеродного скелета (начиная с C4), например, валериановая и 2,2-диметилпропановая кислоты:
- Изомерия положения кратной связи (для ненасыщенных кислот), например, 2-бутеновая кислота и 2-метилпропеновая кислота:
- Изомерия положения заместителей или функциональных групп (для кислот, имеющих заместители и функциональные группы), например, молочная и гидракриловая кислоты (2- и 3- гидроксипропановые кислоты) и α- и β-аланин (α- и β-аминопропановые кислоты):
- Межклассовая изомерия со сложными эфирами карбоновых кислот (начиная с C2), например валериановая кислота и этиловый эфир пропановой кислоты:
Б) Пространственная изомерия
- Цис-, транс-изомерия характерна для непредельных кислот, например цис-2-бутеновая (изокротоновая) кислота и транс-2-бутеновая (кротоновая) кислота:
- Оптическая изомерия характерна для карбоновых кислот, имеющих асимметрический атом углерода, например D- и L- изомеры молочной кислоты:
Номенклатура карбоновых кислот
Карбоновым кислотам удобно давать названия, используя правила систематической номенклатуры ИЮПАК, также возможно использовать правила рациональной номенклатуры. Кроме этого некоторые кислоты имеют тривиальные названия. Тривиальные названия кислот приведены в разделе Изомерия и номенклатура органических соединений.
При составлении названий по рациональной номенклатуре изначально исходили из того, что все кислоты рассматривали, как производные уксусной кислоты, например, диметилуксусная кислота, диметилэтилуксусная кислота, фенилуксусная кислота. Позже было принято к названию углеводород радикала, прибавлть карбоновая кислота. Например, этанкарбоновая кислота, этиленкарбоновая кислота:
По систематической номенклатуре (ИЮПАК):
- Выбирать следует наиболее длинную цепь. За основу названия берут углеводород с тем же количеством атомов углерода, в конце прибавляют –овая кислота (для одноосновных кислот), диовая (для двухосновных кислот) и т.д.
- Нумерацию цепи начинают с карбоксильного углерода, если при этом используют арабские цифры. Если в названии используют латинские греческие буквы, то нумерацию начинают со следующего после карбоксильной группы атома углерода. Например, 2,3-диметилбутановая кислота и β-аминопропановая кислота:
- Если в молекуле имеются кратные связи, то выбирают цепь, включающую эти связи. При составлении названия указывают положение и число кратных связей, например, 2,3-диметил-3-пентеновая кислота:
- Если молекула кислоты включает функциональные группы, то выбирают цепь, содержащую все функциональные группы и в названии упоминают их в порядке старшинства. Например: β-окси-α-аминопроропионовая кислота:
Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
Классификация карбоновых кислот
По числу карбоксильных групп:
- одноосновные карбоновые кислоты — содержат одну карбоксильную группу -СООН. Общая формула CnH2n+1COOH или CnH2nO2.
Например, уксусная кислота
- многоосновные карбоновые кислоты — содержат две и более карбоксильные группы СООН. Например, общая формула двухосновных карбоновых кислот CnH2n(СОOH)2 или CnH2n-2O4.
Например, щавелевая кислота
Классификация по строению углеводородного радикала
- Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН2=СН–СООН.
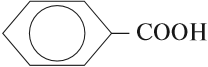
- Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С6Н5СООН.
- Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН.
Строение карбоновых кислот
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации, образует три σ-связи и одну π-связь.
Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Номенклатура карбоновых кислот
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
Таблица. Непредельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Акриловая | Пропеновая | Акрилат | CH2=CH–COOH |
| Метакриловая | 2-Метилпропеновая | Метакрилат | CH2=C(СH3)–COOH |
| Кротоновая | транс-2-Бутеновая | Кротонат | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеат | СН3(СН2)7СН=СН(СН2)7СООН |
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеат | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоат | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Таблица. Двухосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Щавелевая | Этандиовая | Оксалат | НООС – COOH |
| Малоновая | Пропандиовая | Малонат | НООС-СН2-СООН |
| Янтарная | Бутандиовая | Сукцинат | НООС-(СН2)2-СООН |
| Глутаровая | Пентандиовая | Глутарат | НООС-(СН2)3-СООН |
| Адипиновая | Гександиовая | Адипинат | НООС-(СН2)4-СООН |
| Малеиновая | цис-Бутендиовая | Малеинат | цис-НООССН=СНСООН |
| Фумаровая | транс-Бутендиовая | Фумарат | транс-НООССН=СНСООН |
Таблица. Ароматические карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат |  |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат |  |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат |  |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |  |
Изомерия предельных карбоновых кислот
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и спиртов, и простых эфиров — CnH2nО2.
Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
Содержание
- Определение
- Гомологический ряд, номенклатура, изомерия
- Строение молекул
- Свойства кислот
- Физические свойства
- Химические свойства
- Получение и применение кислот
- Выводы
Определение
Карбоновые кислоты — это производные углеводородов, в молекулах которых содержится одна или несколько карбоксильных групп:
Карбоксильная группа имеет сложный состав. Она состоит из карбонильной и гидроксильной (гидроксо) групп:
Карбоновые кислоты часто встречаются в природе, придавая ягодам и фруктам, а также некоторым другим продуктам питания кислый вкус. Их делят на различные группы (классы) по некоторым признакам:
- По строению (составу) углеводородного радикала кислоты делят на:
– Предельные
в углеводородном радикале только простые связи;
– Непредельные (в углеводородном радикале есть кратная связь);
в углеводородном радикале есть кратная связь;
– Ароматические
имеется бензольное кольцо.
Задание 24.1. Определите состав этих кислот.
Для того чтобы различить по составу предельные и непредельные кислоты, нужно умножить на два число атомов углерода в углеводородном радикале и сравнить полученную величину (С) с числом атомов водорода (В) в углеводородном радикале:
- у предельных кислот В > C, например для С3Н7СООН: В = 7, а С = 3 · 2 = 6;
- у непредельных кислот B < C, например для С3Н5СООН: В = 5, а С = 3 · 2 = 6.
Задание 24.2. Какая из следующих кислот является предельной:
- По числу карбоксильных групп кислоты делят на:
– Одноосновные
есть одна карбоксильная группа;
– Двухосновные
есть две карбоксильные группы.
Бывают кислоты, содержащие и большее число карбоксильных групп. Рассмотрим строение молекул и свойства карбоновых кислот на примере предельных одноосновных кислот.
Гомологический ряд, номенклатура, изомерия
Предельные одноосновные карбоновые кислоты образуют гомологический ряд с общей формулой:
Если
- n = 0, то Н–СООН метановая кислота (муравьиная)
- n = 1, то СН3–СООН этановая кислота (уксусная).
Вопрос. По какому принципу составляются названия кислот?
Для того чтобы составить название кислоты, нужно:
- подсчитать все атомы углерода (считая и атом углерода карбоксильной группы);
- назвать алкан, который имеет такое же число атомов углерода и то же строение;
- дописать к этому названию «овая» и слово «кислота».
Кроме того, для кислот чаще всего используют тривиальные названия (муравьиная, уксусная), которые указывают на происхождение кислоты или её отличительные признаки. Например, название муравьиная указывает, что эта кислота входит в состав жгучего сока муравьёв. А слово «уксусная» происходит от греческого слова «оксос», что означает «кислый». Запомните некоторые из этих названий:
- n = 2 CH3–СН2–СOОH С2Н5СООН пропионовая кислота,
- n = 3 СН3–СН2–CH2–СООН С3Н7СООН масляная кислота,
- ………….
- n = 17 C17H35COOH стеариновая кислота.
Задание 24.3. Назовите по ИЮПАК пропионовую и масляную кислоты.
Если вы выполнили вышеизложенные правила, у вас получилось: пропановая кислота, бутановая кислота.
Начиная с n = 3, у кислот появляются изомеры. Изомерия предельных кислот связана со строением углеводородного радикала:
Задание 24.4. Составьте молекулярные формулы этих кислот и убедитесь, что это изомеры.
Строение молекул
В состав карбоксильной группы входит гидроксогруппа ОН.
Вопрос. В каких соединениях встречается функциональная группа ОН?
Такая же группа входит в состав молекул спиртов. Спирты проявляют очень слабые кислотные свойства, могут вступать в реакции только с очень активными, щелочными металлами, не изменяют окраску индикатора, не реагируют с растворами щелочей.
Если в раствор карбоновой кислоты добавить индикатор (лакмус), то раствор окрасится в красный цвет. Это означает, что кислоты проявляют более кислые свойства, чем спирты. Почему? Потому что карбонильная группа, которая расположена рядом с гидроксогруппой, влияет на неё.
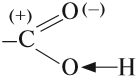
Карбонильная группа, которая входит в состав карбоксильной группы, имеет (+) на атоме углерода. За счёт этого небольшого положительного заряда происходит смещение общих электронных пар связей «С–О» и «О–Н», поэтому эти связи становятся более полярными:
Таким образом, карбонильная группа увеличивает полярность связи О–Н, делая её более полярной. Поэтому атом водорода карбоксильной группы становится очень подвижным. Он легко замещается на атом металла, способен отщепляться в растворах: кислоты диссоциируют:
Гидроксогруппа тоже влияет на карбонильную группу, делая ее неактивной, поэтому кислоты не участвуют в реакциях с разрывом π-связи карбонильной группы.
Карбоксильная группа влияет на углеводородный радикал, делая некоторые связи С–Н в нём более полярными, и кислоты могут участвовать в реакциях замещения атомов водорода радикала.
Свойства кислот
Физические свойства
Кислоты с небольшим числом атомов углерода (1–10) — жидкости с резким запахом. Вкус у них разный — уксусная кислота — кислая, а масляная — горькая. Низшие кислоты растворимы в воде, причём с увеличением длины радикала их растворимость ухудшается.
Например, уксусная кислота — бесцветная жидкость с резким запахом. Смешивается с водой в любых соотношениях. 60…90 %-ные растворы уксусной кислоты (уксусная эссенция) опасны для жизни, в то время как 6…8 %-ные растворы столового уксуса широко применяются при приготовлении пищи.
Высшие кислоты, например стеариновая кислота, твёрдые, нерастворимые в воде вещества, лишённые запаха. Смесь таких кислот называется «стеарин». Из стеарина делают свечи.
Химические свойства
Кислоты проявляют все свойства неорганических кислот.
Вопрос. Какие свойства кислот вам известны?
Кислоты реагируют с металлами, которые стоят в ряду напряжений до водорода:
При составлении таких реакций следует помнить, что
- кислотный остаток — это часть молекулы кислоты без подвижного атома водорода; в данном случае это: С3Н7СОО;
- валентность кислотного остатка равна числу замещённых атомов водорода, в данном случае замещается один атом водорода и валентность равна I;
- исходя из этого, нужно переписать после реакции кислотный остаток, взять его в скобки и за скобками поставить цифру, равную валентности металла, а затем записать символ самого металла.
В результате такой реакции образуется соль и выделяется водород.
Кислоты реагируют с основными и амфотерными оксидами:
В этом случае образуется соль и вода. Такие же продукты реакции образуются при взаимодействии кислоты и основания:
Большинство карбоновых кислот — слабые кислоты. Тем не менее они могут вытеснять более слабые кислоты из их солей:
Итак, во всех этих реакциях образуются соли. Названия солей происходят от латинских названий кислот. Запомните эти названия!
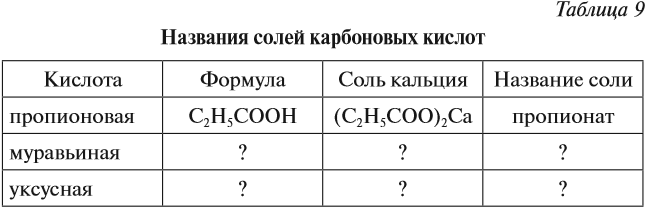
Задание 24.5. Составьте для известных Вам карбоновых кислот таблицу по схеме:
Названия солей см. выше (в уравнениях химических реакций).
Кислоты могут реагировать со спиртами, в результате получаются сложные эфиры:
Это реакция этерификации. Она происходит в присутствии концентрированной серной кислоты. (Подробнее о названиях и свойствах сложных эфиров см. урок 25.)
Кислоты могут реагировать с галогенами за счёт углеводородного радикала, при этом на атом галогена замещается атом водорода у ближайшего к карбоксильной группе атома углерода (это α-углеродный атом):
Получение и применение кислот
Кислоты можно получить при помощи окисления соответствующего альдегида:
Задание 24.6. Какой альдегид нужно взять для получения уксусной кислоты? 2-метилпропановой кислоты? Составьте уравнения реакций.
Вопрос. В каких условиях происходят процессы окисления альдегидов? Являются ли эти реакции качественными на альдегидную группу?
Кислоты применяются для получения душистых веществ, растворителей, входят в состав лекарств. Наибольшее применение получила ледяная (безводная) уксусная кислота, которая используется в технических целях (для получения лекарств, ацетатного шёлка, растворителей). В магазине можно купить и пищевую уксусную кислоту (70 %-ный раствор), и уксус (6 %-ный раствор). Концентрированная уксусная кислота — яд! Она вызывает тяжёлые ожоги внутренних органов, разрушает кровь. Её следует разбавлять водой до безопасных 5–7 % (примерно 1:10). Столовый уксус используют при приготовлении пищи. Его получают из глюкозы по схеме:
Некоторые (жирные) кислоты входят в состав жиров (см. урок 25).
Выводы
Кислоты — это производные углеводородов, содержащие карбоксильную группу. Для них характерны реакции:
- замещения атома Н карбоксильной группы (с металлами);
- обмена (с оксидами, гидроксидами, солями);
- этерификации (со спиртами);
- замещения атома Н радикала (с галогенами).
Кислоты входят в состав различных овощей, фруктов и других пищевых продуктов. Используются при приготовлении пищи, например уксус.
План урока:
Строение карбоновых кислот
Виды карбоновых кислот
Номенклатура карбоновых кислот
Гомологический ряд карбоновых кислот
Изомерия карбоновых кислот
Способы получения карбоновых кислот
Физические свойства карбоновых кислот
Химические свойства карбоновых кислот
Применение карбоновых кислот
Строение карбоновых кислот
Общая формула: СnH2n+1COOH
Карбоксил, или карбоксильная группа, – сложная функциональная группа, содержащая карбонильную С=О и гидроксильную – ОН группы. Электронная плотность в молекуле стягивается на кислородный атом. Для карбонильного углерода характерно состояние sp2-гибридизации. Он образует три σ-связи и одну π-связь.
Виды карбоновых кислот
Номенклатура карбоновых кислот
Согласно международной номенклатуре в карбоновых кислотах к названию углеводородного радикала прибавляется суффикс «-овая» и слово «кислота». Например, метанОВАЯ КИСЛОТА.
Алгоритм названия соединения
- Нахождение главной цепи.
- Нумерация углеродных атомов, включая углеродный атом функциональной группы.
- Название радикала.
- Прибавление к названию суффикса «-овая» при наличии одной карбоксильной группы, суффикса «-диовая» при наличии двух функциональных групп. В любом случае добавляется слово «кислота».
Схема названия карбоновой кислоты.
Гомологический ряд
Первое соединение гомологического ряда – метановая кислота. Она входит в состав выделений муравьев. Медведи после зимней спячки часто ложатся на муравейник, чтобы муравьи своей кислотой убивали паразитов, скопившихся в мехе за зиму.
Гомологический ряд карбоновых кислот.
Смесь капроновой, каприловой и каприновой кислот содержится в козьем молоке.
Виды изомерии карбоновых кислот
Для соединений этого класса свойственны оба вида изомерии.
Структурная изомерия
Для непредельных представителей класса характерна изомерия положения двойной или тройной связи.
Пространственная изомерия
Оптическая изомерия возможна при наличии ассиметричного атома углерода. Цис-транс-изомерия свойственна для соединений, содержащих двойную связь.
Методы получения карбоновых кислот
Представители класса нередко встречаются в природе, но также есть промышленные и лабораторные методы их получения.
Реакции окисления
Карбоновые кислоты получают путем окисления первичных спиртов. В этом случае окислителями могут выступать перманганат или дихромат калия.
5С2Н5ОН + 4КМnO4 + 6H2SO4→ 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
Также их синтезируют путем окисления альдегидов. Окислители – перманганат или дихромат калия.
CH3CHO + Ag2O (аммиачный раствор) → CH3COOH + Ag↓
Карбоновые кислоты могут быть синтезированы путем неполного окисления алканов. Данная реакция возможна только при высоких температурах и наличии катализатора.
2CH4 + 3O2 → 2HCOOH + 2H2O
С помощью окисления бутана в присутствии катализатора в промышленности синтезируют уксусную кислоту.
2C4H10 + 5O2 → 4CH3COOH + 2H2O
Из гомологов бензола получают бензойную кислоту.
Щелочной гидролиз тригалогенидов
Представителей класса получают взаимодействием водного раствора щелочи и тригалогеналкана, в котором атомы галогена расположены при одном углеродном атоме. При этой реакции галогены замещаются на гидроксильные группы.
Реакция соли и минеральной кислоты
Карбоновые кислоты получают действием минеральной кислоты на соли.
R-COOK + HCl→ R-COOH + KCl
Взаимодействие сложных кислот и воды
При наличии минеральной кислоты и при нагревании из сложных эфиров можно синтезировать карбоновые кислоты.
Синтез муравьиной кислоты путем взаимодействия щелочи и угарного газа
Реакция проводится при повышенном давлении.
Синтез карбоновых кислот с помощью реактивов Гриньяра
Из реактивов Гриньяра (алкилгалогенидов магния)при взаимодействии с углекислым газом и дальнейшем гидролизе получают карбоновые кислоты.
R-MgBr + CO2→ R-COO-MgBr
R-COO-MgBr + H2O →R-COOH + Mg(OH)Br
Физические свойства карбоновых кислот
Карбоновые кислоты с одним, двумя и тремя атомами углерода в цепи в нормальных условиях –легкоподвижные жидкости с резким запахом. Соединения с четырьмя-девятью атомами углерода в цепи – жидкости с неприятным запахом, а последующие по гомологическому ряду соединения – твердые вещества без запаха. Агрегатное состояние всех ненасыщенных карбоновых кислот в обычных условиях – жидкое, а дикарбоновых и ароматических – кристаллическое.
Первые три представителя гомологического ряда растворяются с водой в любых соотношениях. По мере увеличения углеродной цепи эта способность падает. Также по гомологическому ряду карбоновых кислот температура кипения и плавления увеличивается, а запах ослабевает. Наличие кратных связей характеризуется меньшими температурами плавления и кипения.
Высокие температуры плавления и кипения связаны с тем, что между молекулами формируются водородные связи. Такая связь более прочная, т.к. она образуется между водородом гидроксильной группы одного соединения и карбонильным кислородом другого.
Физические свойства представителей карбоновых кислот
Муравьиная кислота (НСООН) – прозрачная жидкость с характерным запахом. Температура кипения – +101˚С. Она содержится в выделениях муравьев, соке крапивы и хвое ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются и кислота проникает в организм. Муравьиная кислота оказывает раздражающее действие.
Молекула муравьиной кислоты
Пальмитиновая и стеариновая кислоты – твердые белые вещества. Они нерастворимы в воде, но немного растворимы в органических растворителях.
Молекулы пальмитиновой и стеариновой кислот
Бензойная кислота (С6Н5СООН) – ароматическая кислота, которая легко возгоняется, без превращения в жидкое состояние. Температура плавления – 122,4˚С. При понижении температуры ее пары преобразуются в кристаллы. Для бензойной кислоты характерна низкая растворимость в холодной воде, но высокая – в органических растворителях. Применяется для очистки веществ от примесей от загрязнений.
Молекула бензойной кислоты
Химические свойства карбоновых кислот
Для карбоновых кислот не свойственны реакции присоединения.
Кислотные свойства
- Взаимодействие с основаниями
CH3COOH + NaOH→CH3COONa + H2O
- Взаимодействие с металлами
2СН2СООН + Са → (СН3СОО)2Са + Н2↑
- Реакция с основными оксидами
2СН3СООН + ВаО→ (СН3СОО)2Ва + Н2О
- Реакция с солями более слабых кислот
2СН3СООН + СаСО3→(СН3СОО)2Са + Н2О + СО2↑
Реакция замещения гидроксильной группы карбоновой кислоты
- Образование галогенангидридов
СН3СООН + PCl5→CH3COOCl + HCl + POCl3
- Взаимодействие с аммиаком
R-COOH + NH3→R-COONH4
- Образование сложных эфиров
Для проведения реакции необходима минеральная кислота.
R1-COOH + R2-OH →R1-COOR2 + H2O
- Образование ангидридов
Замещение атома водорода при ближайшем к карбоксильной группе углеродном атоме
Для взаимодействия карбоновых кислот с галогенами необходим красный фосфор.
Применение карбоновых кислот
Для муравьиной кислоты характерны антибактериальные свойства, поэтому она применяется в промышленном производстве. Например, потребителям она известна как добавка Е236. Она используется в консервации кондитерских изделий, молочных продуктов, безалкогольной продукции.
Применение муравьиной кислоты
Уксусная кислота применяется при получении красителей, лекарственных препаратов, растворителей лаков. В пищевой промышленности она известна как добавка Е260. Часто она используется при консервации различной продукции.
Применение уксусной кислоты
Масляная (бутановая) кислота используется при лечении заболеваний ЖКТ. Она в кишечнике образует кислую среду, которая подавляет развитие патогенных бактерий. Соли бутановой кислоты применяются в качестве кормовых добавок для животных. Они улучшают иммунную систему, пищеварение, подавляют деятельность многих вредных кишечных микроорганизмов, уменьшают необходимость применения антибиотиков и лекарственных средств.
Молекула масляной кислоты
Щавелевая кислота – непредельная двухосновная карбоновая кислота. Она применяется в синтезе красителей, чернил, пластмасс и т.д. Обладает дезинфицирующими и отбеливающими свойствами, поэтому часто добавляется в синтетические моющие средства. Соли щавелевой кислоты можно синтезировать из листьев щавеля, кислицы, ревеня. В пищевой промышленности практически не используется, т.к. щавелевая кислоты образует в организме человека труднорастворимые соли, которые откладываются в виде камней в почках и мочевом пузыре.
Молекула щавелевой кислоты