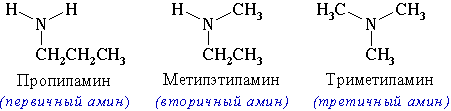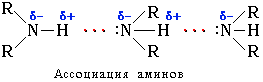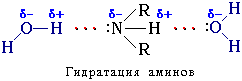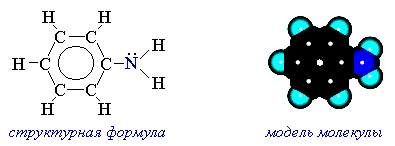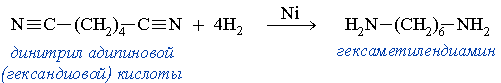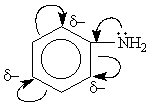Изомерия аминов
Структурная изомерия
- изомерия положения аминогруппы, начиная с С3H7NH2:
- изомерия углеродного скелета, начиная с С4H9NH2:
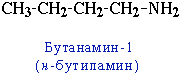

- изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, то есть между различными типами аминов (первичными, вторичными, третичными):
Пространственная изомерия
Амины, молекулы которых содержат асимметрический атом,Асимметрический атом — тетраэдрический sp3-атом, связанный с четырьмя различными заместителями. проявляют оптическую изомерию и существуют в виде пар зеркальных изомеров (оптических антиподов).
- Для вторичных и третичных аминов с асимметрическим атомом углерода (С*) этот вид стереоизомерии возможен, начиная с С4H9NH2 (втор-бутиламина СH3CH2CH(CH3)NH2):

АнимацияНесовместимость молекул в пространстве
- Оптическая изомерия характерна для аммониевых соединений с асимметрическим атомом азота (N*):
Пример: оптические изомеры хлорида метилфенилэтиламмония
- Амины с различными заместителями при атоме азота (RR’NH, RR’R”N) оптическую активность НЕ проявляют, хотя пирамидальная форма молекул допускает существование зеркальных изомеров.
Комментарий
Пространственное строение аминов
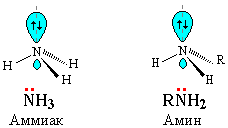
Атом азота в молекулах аммиака и аминов находится в sp3-гибридизованном состоянии с тетраэдрической геометрией расположения четырёх sp3-гибридных атомных орбиталей (АО).
Три sp3-АО образуют ковалентные связи с атомами водорода или с углеводородными радикалами. Четвертую АО занимает неподелённая пара электронов, определяющая пирамидальную форму
Пространственнон строение NH3 молекул.
Можно допустить, что вторичные и третичные амины с разными углеводородными радикалами (RR’NH, RR’R”N)существуют в виде оптических изомеров:
или
Однако до сих пор такие изомеры не выделены в индивидуальном виде. Это объясняется тем, что молекулы аммиака и аминов постоянно претерпевают пирамидальную инверсию, которую можно рассматривать как быстрое превращение одной формы в другую через тригональное переходное состояние (с sp2-атомом азота):
Инверсия осуществляется с частотой примерно 1011 раз в секунду.Таким образом, подобные соединения, несмотря на отсутствие симметрии, оптически не активны.
При наличии в молекулах аминов двойных связей C=C и C=N возможна цис-транс-изомерия.
Для аминов свойственна также поворотная (конформационная) изомерия за счет вращения по одинарным связям C–C и C–N.
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
R-NH2, R1-NH-R2, R1-N(R2)-R3
Строение аминов
Атом азота находится в состоянии sp3-гибридизации, поэтому молекула имеет форму треугольной пирамиды.
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные |
| Алифатические | Метиламин
CH3-NH2 |
Диметиламин
CH3-NH-CH3 |
Триметиламин
(CH3)3N |
| Ароматические | Фениламин
C6H5-NH2 |
Дифениламин
(C6H5)2NH |
Трифениламин
(C6H5)3N |
| Смешанные | Метилфениламин
CH3-NH-C6H5 |
Диметилфениламин
(CH3)2N-C6H5 |
Номенклатура аминов
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых радикалов используют приставки ди и три.
CH3-NH2 Метиламин
СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 Метилэтиламин
(CH3)2NH Диметиламин
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминогруппа указывается в названии приставкой амино-:
| 1-Аминопропан | 1,3-Диаминобутан |
| CH3-CH2-CH2-NH2 | NH2-CH2-CH2-CH(NH2) -CH3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин.
Например, N-метиланилин:
Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Изомерия аминов
Для аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов.
Изомерия углеродного скелета
Для аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Например. Формуле С4Н9NH2 соответствуют два амина-изомера углеродного скелета.
Изомерия положения аминогруппы
Для аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Например.Формуле С4Н11N соответствуют амины положения аминогруппы.
| 1-Аминобутан (н-бутиламин) |
2-Аминобутан (втор-бутиламин) |
 |
Изомерия между типами аминов
Например. Формуле С3Н9N соответствуют первичный, вторичный и третичный амины.
| Пропиламин
(первичный амин) |
Метилэтиламин (вторичный амин) | Триметиламин
(третичный амин) |
 |
 |
 |
Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Химические свойства аминов
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
|
Аммиак :NH3 |
Первичный амин R–:NH2 |
 |
 |
Поэтому амины и аммиак обладают свойствами оснований.
1. Основные свойства аминов
Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми.
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
Основные свойства аминов возрастают в ряду:
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II):
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
Это качественная реакция на первичные амины – выделение азота.
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется.
При 18 оС в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
Видеоопыт изучения среды раствора анилина можно посмотреть здесь.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу.
- Бензольное кольцо уменьшает основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком:
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
- Бензольное кольцо в анилине становится более активным в реакциях замещения, чем у бензола.
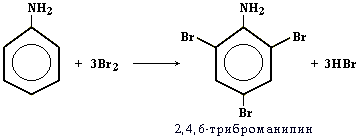
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓).
Видеоопыт бромирования анилина можно посмотреть здесь.
Получение аминов
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
- Гидрирование водородом:
- Восстановление сульфидом аммония:
- Алюминий в щелочной среде.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
- Металлами в кислой среде – железом, оловом или цинком в соляной кислоте.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
- Соли аминов — это твердые вещества без запаха, хорошо растворимые в воде, но не растворимые в органических растворителях (в отличие от аминов).
- При действии щелочей на соли аминов выделяются свободные амины:
Видеоопыт взаимодействия хлорида диметиламмония с щелочью с образованием диметиламина можно посмотреть здесь.
- Соли аминов вступают в обменные реакции в растворе:
- Взаимодействие с аминами.
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
Амины – органические соединения, продукты замещения атомов водорода в аммиаке NH3 различными углеводородными радикалами. Функциональная
группой аминов является аминогруппа – NH2.

Классификация аминов
По числу углеводородных радикалов амины подразделяются на первичные, вторичные и третичные.

Запомните, что основные свойства аминов выражены тем сильнее, чем больше электронной плотности присутствует на атоме азота. Однако, у третичных аминов три углеводородных радикала создают значительные затруднения для химических реакций.
Таким образом,
у третичных аминов основные свойства выражены слабее, чем у вторичных аминов. Основные свойства возрастают в ряду: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (основные свойства хорошо выражены).

Номенклатура и изомерия аминов
Названия аминов формируются путем добавления суффикса “амин” к названию соответствующего углеводородного радикала: метиламин, этиламин,
пропиламин, изопропиламин, бутиламин и т.д. В случае если радикалов несколько, их перечисляют в алфавитном порядке.
Общая формула предельных аминов CnH2n+3N. Атомы углерода находятся в sp3 гибридизации.

Для аминов характерна структурная изомерия: углеродного скелета, положения функциональной группы и изомерия аминогруппы.

Получение
- Нагревание галогеналканов с аммиаком
- Восстановление нитросоединений
- Восстановление амидов
- Восстановление нитрилов
- Реакция аммиака со спиртами
- Реакция галогеналканов с аминами
В основе этой реакции лежит замещение атома галогена в галогеналканах на аминогруппу, при этом образуются амин и соль аммония.

При такой реакции нитрогруппа превращается в аминогруппу, образуется вода.

Знаменитой является предложенная в 1842 году Н.Н. Зининым реакция получения аминов восстановления ароматических нитросоединений (анилина
и других). Она возможна в нескольких вариантах, главное, чтобы в начале реакции выделился водород.

Реакция сопровождается разрушением карбонильной группы и отщеплении ее от молекулы амида в виде воды.

Этим способом в промышленности получают гексаметилендиамин, используемый в изготовлении волокна – нейлон.

В промышленности амины получают реакцией аммиака со спиртами, в ходе которой происходит замещение гидроксогруппы на аминогруппу.

В ходе реакции галогеналканов с аммиаком, аминами, становится возможным получение первичных, вторичных и третичных аминов.


Химические свойства аминов
- Основные свойства
- Реакция с азотистой кислотой
- Конденсация аминов с альдегидами и кетонами
- Разложение солей аминов
- Горение аминов
Как и аммиак, амины обладают основными свойствами, их растворы окрашивают лакмусовую бумажку в синий цвет.
В реакции с водой амины образуют гидроксиды алкиламмония, которые аналогичны гидроксиду аммония. Анилин с водой не реагирует, так как является слабым основанием.

Как основания, амины вступают в реакции с различными кислотами и образуют соли алкиламмония.

Данная реакция помогает различить первичные, вторичные и третичные амины, которые по-разному с ней взаимодействуют.

При конденсации первичных аминов с альдегидами и кетонами получают основания Шиффа, соединения, которые содержат фрагмент “N=C”.

Соли аминов легко разлагаются щелочами (растворимыми основаниями). В результате образуется исходный амин, соль кислоты и вода.

При горении аминов азот чаще всего выделяется в молекулярном виде, так как для реакции азота с кислородом необходима очень высокая
температура. Выделение углекислого газа и воды обыкновенно при горении органических веществ.
4C2H5NH2 + 15O2 → 8CO2 + 14H2O + 2N2
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Изомерия аминов
1) углеродного
скелета, начиная
с С4H9NH2:
СН3-СН2–
СН2-СН2
–NH2
н-бутиламин
(1-аминобутан)
CH3-CH-
СН2-NH2
изо-бутиламин (1-амин-2-метилпропан)
│
СН3
2) положения аминогруппы,
начиная с С3H7NH2:
СН3-СН2–
СН2-СН2
–NH2
1-аминобутан
(н-бутиламин)
CH3-CH-
СН2-СH3
2-аминобутан (втор-бутиламин)
│
NН2
3)
изомерия между
типами аминов
– первичный,
вторичный, третичный:
ФИЗИЧЕСКИЕ
СВОЙСТВА АМИНОВ.
Первичные и вторичные
амины образуют слабые
межмолекулярные водородные связи:
Это объясняет
относительно более высокую температуру
кипения аминов по сравнению с алканами
с близкой молекулярной массой. Например:
|
Пропиламин |
Бутан (М=58) t |
Третичные амины не
образуют ассоциирующих водородных
связей (отсутствует группа N–H). Поэтому
их температуры кипения ниже, чем у
изомерных первичных и вторичных аминов:
|
Триэтиламин |
н-Гексиламин tкип |
По сравнению со
спиртами алифатические амины имеют
более низкие температуры кипения, т.к.
в спиртах
водородная связь более прочная:
|
Метиламин |
Метанол |
При обычной
температуре только низшие алифатические
амины CH3NH2,
(CH3)2NH
и (CH3)3N
– газы (с запахом аммиака), средние
гомологи – жидкости (с резким рыбным
запахом), высшие – твердые вещества без
запаха.
Ароматические
амины – бесцветные
высококипящие жидкости или твердые
вещества.
Амины способны к
образованию водородных
связей с водой:
Поэтому низшие
амины хорошо растворимы в воде.
С увеличением
числа и размеров углеводородных радикалов
растворимость аминов в воде уменьшается,
т.к. увеличиваются пространственные
препятствия образованию водородных
связей. Ароматические амины в воде
практически не растворяются.
Анилин:
С6H5-NH2
–
важнейший из ароматических аминов:
Он находит широкое
применение в качестве полупродукта в
производстве красителей, взрывчатых
веществ и лекарственных средств
(сульфаниламидные препараты).
Анилин – бесцветная
маслянистая жидкость с характерным
запахом. На воздухе окисляется и
приобретает красно-бурую окраску.
Ядовит.
ПОЛУЧЕНИЕ АМИНОВ.
|
1. а) |
|
б) Восстановление:
R-NO2
R-NO2 Восстановлением |
|
в) в кислой среде
R-NO2 Амины |
|
2.
СH3Br
CH3-NH2
│
C2H5 Возможно |
|
3.Восстановление
R–C
Этим способом в
|
|
4.
R-OH + NH3 |
ХИМИЧЕСКИЕ
СВОЙСТВА АМИНОВ.
Амины имеют сходное
с аммиаком строение и проявляют подобные
ему свойства.
Как в аммиаке, так и в
аминах атом азота имеет неподеленную
пару электронов:
амины и аммиак обладают свойствами
оснований.
|
1.
Будучи производными
Алифатические
Это объясняется
Фенильный
В |
|
2. Амины реагируют C6H5NH2
Cоли
При действии
[CH3NH3]Cl
Соли аминов вступают
[CH3NH3]Cl |
|
3. |
|
4.
4 |
|
5*.
а) Первичные б) |
|
6. Особенности
Для анилина
Особенности этих
– бензольное
– бензольное
|
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
наталия Богдановна врецена
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Алифатическими аминами называются производные алканов, в молекулах которых атомы водорода замещены аминогруппой $-NH_2$. Иx также рассматривают как производные аммиака $NH_3$, в котором атомы водорода замещены алкильными или другими углеводородными остатками. Из насыщенных соединений различают первичные, вторичные и третичные амины:
-
Первичные амины:
$CH_3CH_2CH_2NH_2$; $(CH_3)_2CHNH_2$; $(CH_3)_3CNH_2$
-
Вторичные амины:
$(CH_3CH_2CH_2)_2NH$; $(CH_3)_2CH-NH-CH_2CH_3$; $(CH_з)_зC-NH-CH_2CH_з$
-
Третичные амины:
$(CH_3)_3N$; $C_6H_{11}N(CH_3)_2$; $(CH_3)_3C-N(CH_3)_2$
Номенклатура аминов
По номенклатуре IUPAC названия аминов образуют присоединением окончания -амин к названию алкана с цифрой, которая показывает положение аминогруппы.
Рисунок 1.
По рациональной номенклатуре их рассматривают как производные аммиака.
Так простые амины по этой номенклатуре называют исходя из алкильных групп, связанных с атомом атома азота с добавлением к их названию суффикса амин:
Рисунок 2.
Вторичные и третичные амины по номенклатуре IUPAC называют таким образом, чтобы приставка в названии включала наибольший заместитель:
Рисунок 3.
Зарубежная номенклатура
С недавнего времени за рубежом введена новая, более удобная система названий для аминов, которая значительно отличается от номенклатуры, IUPAC.
«Амины. Номенклатура и строение аминов» 👇
В этой новой системе название аминов образуется аналогично названиям спиртов. К названию углеводородов, которые образуют амин прибавляется окончание “амин”:
Рисунок 4.
По этой номенклатуре вторичные и третичные аминов называются таким образом, что как основообразующим выбирается углеводород, с наиболее длинной цепью атомов углерода. А остальные углеводородные группы считаются заместителями и именуются приставками с префиксом $N-$.
Рисунок 5.
По этой номенклатуре, анилин становится бензоламином, а производные анилин именуются как его замещенные производные:
Рисунок 6.
Строение аминов
Как известно, аммиак имеет пирамидальное строение. Подобное же строение характерно и для всех типов аминов.
Рисунок 7.
Длины связей $N-H$ в метиламине равны равны 1,011 $Å$, а длины связей $C-N$ 1,474 $Å$. Валентный угол $H-N-H$ составляет 105,9$^circ$, угол $H-N-C$ – 112,9$^circ$. В триметиламине длины связей $C-N$ равны 1,47 $Å$, а валентный угол $C-N-C$ 108$^circ$.
Из-за пирамидального строения амины, имеющие три различные заместителя у атома азота, должны быть хиральны, поскольку четвертую вершину воображаемого тетраэдра занимает несвязывающая пара электронов.
Рисунок 8.
Изомерия аминов
Количество структурных изомеров для аминов возрастает вследствие появления вариантов замещения у атома азота. Так, для углеводородов брутто-формулы $C_4H_{10}$ существует два изомера, для спиртов брутто-формулы $C_4H_9OH$-четыре, а для аминов $C_4H_{11}N$ – уже восемь.
И начиная именно с $C_4H_9NH_2$ у аминов наблюдается структурная изомерия углеродного скелета
Рисунок 9.
Начиная с $C_3H_7NH_2$ у аминов наблюдается изомерия связанная с положением аминогруппы:
Рисунок 10.
Аминам также характерна изомерия между типами аминов:
Рисунок 11.
У аминов также возможна и оптическая изомерия, начиная с $C_4H_9NH_2$
Номенклатура аминасахаров
В основу номенклатуры аминасахаров положена номенклатура моносахаридов – соединений состава $C_n(H_2O)_n$ с прямой цепью углеродных атомов типа 1.1. Атомы $С$-цепи нумеруют таким образом, чтобы углерод карбонильной группы имел наименьший номер. Атомы кислорода, водорода и др., соединенные с определенным атомом углерода, приобретают тот же номер. В названиях производных углеводов кроме положения заместителя указывается также атом, с которым связан заместитель ($O$, $N$, $C$). Например, соединение 1.2 будет называться 2-амино-2-дезокси-4-О-метил-5-С-метилгексоза.
Рисунок 12.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме


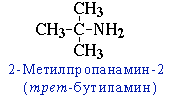







 или
или