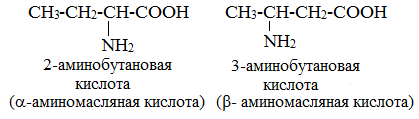Изомерия аминокислот
Для аминокислот известны два вида изомерии: структурная и пространственная (оптическая изомерия).
Структурная изомерия
Структурная изомерия связана с особенностями строения углеродного скелета и взаимным расположением функциональных групп.
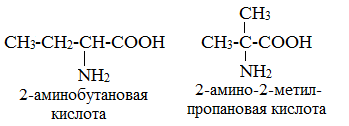
1. Изомерия углеродного скелета
2. Изомерия положения аминогруппы
Оптическая изомерия
Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат асимметрический атом углерода (a-атом) и могут существовать в виде оптических изомеров (зеркальных антиподов).
Оптическая изомерия природных α-аминокислот играет важную роль в процессах биосинтеза белка.
Аминокислоты
Аминокислотами называются органические вещества, содержащие в молекулах две функциональные группы — карбоксильную
−COOH
и аминогруппу
−NH2
.
Аминокислоты обладают свойствами кислот и аминов (органических оснований) и являются амфотерными соединениями.
Согласно систематической номенклатуре название аминокислоты образуется от названия соответствующей карбоновой кислоты, к которому добавляется приставка «амино». Углеродная цепь нумеруется, начиная с атома углерода карбоксильной группы. Примеры приведены в таблице:
|
C|3H2−C2H2−C1OOHNH2 |
(3)-амино- пропановая кислота |
|
C4H3−C|3H−C|2H−C1OOHCH3NH2 |
(2)-амино- (3)-метилбутановая кислота |
Используется также другой способ составления названий аминокислот — на основе тривиальных названий карбоновых кислот. Положение функциональных групп обозначается греческими буквами, причём буква
α
относится к соседнему с карбоксилом углеродному атому:
|
CγH3−CβH2−C|αH−COOHNH2 |
|
|
C|γH2−CβH2−CαH2−COOHNH2 |
Для природных белокобразующих
α
-аминокислот чаще используются тривиальные названия.
Пример:
— глицин;
H2N−CH(CH3)−COOH
— аланин.
Изомерия одноосновных насыщенных аминокислот
Общую формулу одноосновных насыщенных аминокислот можно записать так:
CnH2n+1NO2
. Для этих аминокислот возможна структурная и пространственная изомерия.
Виды структурной изомерии аминокислот:
- изомерия углеродной цепи;
- изомерия положения аминогруппы;
- межклассовая изомерия.
В таблице приведены примеры структурных изомеров разных видов, имеющих состав
C4H9NO2
:
|
C4H3−C3H2−C|2H−C1OOHNH2 (2)-аминобутановая кислота |
C|4H2−C3H2−C2H2−C1OOHNH2
(4)-аминобутановая кислота |
изомеры положения аминогруппы |
|
C4H3−C|3H−C2H2−C1OOHNH2 (3)-аминобутановая кислота |
C|3H2−C|2H−C1OOHNH2CH3 (3)-амино-(2)-метилпропановая кислота |
изомеры углеродного скелета |
|
C|3H2−C2H2−C1OO−CH3NH2 метиловый эфир (3)-аминопропановой кислоты |
C4H3−C3H2−C|2H−C1H3NO2 (2)-нитробутан |
межклассовые изомеры |
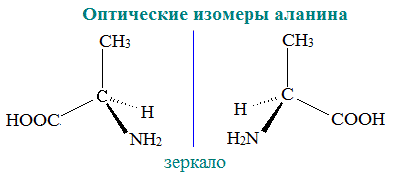
Пространственная изомерия аминокислот обусловлена наличием в их молекулах ассиметричного атома углерода. Такие молекулы существуют в виде двух энантиомеров (зеркальных изомеров). На рисунке показаны оптические изомеры
α
-аминопропионовой кислоты (аланина).
Рис. (1). Энантиомеры
Источники:
Рис. 1. Энантиомеры. Автор: NEUROtiker — собственная работа. Общественное достояние, https://commons.wikimedia.org/w/index.php?curid=4380401.
Аминокислоты
– это органические соединения, которые содержат карбоксильную группу – СООН и
аминогруппу – NH2.
То
есть аминокислоты – это бифункциональные соединения. Поэтому
аминокислоты можно рассматривать, как замещённые карбоновые кислоты, в
молекулах которых один или несколько атомов водорода замещены на аминогруппу.
В
зависимости от строения углеводородной цепи различают алифатические
(жирные) и ароматические аминокислоты. К алифатическим аминокислотам
относится, например, глицин. К ароматическим аминокислотам относится
парааминобензойная кислота.
По
происхождению аминокислоты делят на природные и синтетические.
Природные аминокислоты обнаружены в живых организмах. Насчитывают около 150 их
наименований, 20 из которых входят в состав белков.
В
зависимости от расположения амино- и карбоксильной групп аминокислоты делят на
α, β, γ, δ, ε и так далее. Так, к α-аминокислотам
относят 2-аминопропановую кислоту, так как аминогруппа отходит от
α-углеродного атома, к β-аминокислотам относится 3-аминопропановая
кислота, так как аминогруппа отходит от β-углеродного атома. К
ε-аминокислотам относится 6-аминокапроновая кислота, так как аминогруппа
отходит от ε-атома углерода.
В
зависимости от количества функциональных групп, аминокислоты делят на кислые,
у которых карбоксильных групп больше, чем аминогрупп. К таким аминокислотам
относится аспарагиновая кислота. К нейтральным аминокислотам относится
глицин, в молекуле которого 1 аминогруппа и 1 карбоксильная группа. К основным
аминокиcлотам
относится лизин, в молекуле которого 2 аминогруппы и 1 карбоксильная группа.
По
номенклатуре ИЮПАК названия аминокислот состоят из названий соответствующих
карбоновых кислот с добавлением префикса амино-, а нумерацию атомов
углерода начинают от атома углерода при карбоксильной группе. Расположение
аминогруппы обозначают цифрами или буквами греческого алфавита: α (альфа),
β (бета), γ (гамма) и так далее.
Назовём
следующие аминокислоты. Первая аминокислота называется α-аминопропановая
кислота, или 2-аминопропановая кислота. Вторая аминокиcлота называется
β-аминопропановая кислота, или 3-аминопропановая кислота.
Для α-аминокислот применяют также и тривиальные названия.
Например, глицин, аланин, фенилаланин, валин, лейцин, серин.
Организм человека не способен синтезировать 10 аминокислот,
поэтому эти кислоты называют незаменимыми, они должны поступать вместе с
пищей. К таким кислотам относятся: цистеин, валин, фенилаланин,
лизин и другие.
Если в аминокислоте 2 аминогруппы, то при её названии используют
приставку ди- амино-, если в аминокислоте 3 аминогруппы, то используют
приставку триамино-. Назовём аминокислоту. От второго и
третьего атома углерода отходит аминогруппа, всего в главной цепи три атома
углерода. Поэтому аминокислота называется 2, 3-диаминопропановая кислота.
Если в аминокислоте несколько карбоксильных групп, то в названии
это отражается суффиксами –диовая, или –триовая кислота.
Например, данная кислота называется 2-аминобутандиовая кислота.
Простейшим
представителем α-аминокислот является аминоуксусная кислота, или глицин,
её ещё называют 2-аминоэтановой кислотой.
Для
аминокислот характерна структурная изомерия, которая обусловлена различным
строением углеродной цепи и взаимным расположением амино- и
карбоксильной групп.
Составим
всевозможные изомеры аминокислот состава С4H9O2N. Так, между собой изомерами являются
2-аминобутановая кислота и 3-аминобутановая кислота, 4-аминобутановая кислота и
2-амино-2-метилпропановая кислота.
Все
α-аминокислоты, кроме глицина, содержат асимметрический атом углерода и
могут существовать в виде оптических изомеров (зеркальных антиподов).
Аминокислоты
имеют широкое применение. Во-первых, они широко распространены в природе.
Во-вторых, из аминокислот построены все растительные и животные белки, поэтому человек
и животные получают белки из пищи, в-третьих, аминокислоты используют в
медицине, так как их прописывают при сильном истощении, после тяжёлых операций.
Аминокислоты применяют в качестве лечебного средства при некоторых
заболеваниях. Так, глутаминовая кислота применяется при нервных заболеваниях, а
гистидин – при язве желудка. Некоторые аминокислоты используют для подкормки
животных. Аминокапроновая и аминоэнантовая кислоты используются в синтезе
синтетических волокон, таких, как капрон и энант.
Таким
образом, аминокислоты – это органические соединения, содержащие карбоксильную
группу и аминогруппу. Названия аминокислот состоят из названий соответствующих
карбоновых кислот с добавлением суффикса -амино. Для аминокислот характерна
структурная изомерия: углеродного скелета, положения аминогруппы, а также
оптическая изомерия. Аминокислоты имеют широкое применение.
Аминокислоты обладают изомерией
Изомерия аминокислот в зависимости от положения аминогруппы
В зависимости от положения аминогруппы относительно 2-го атома углерода выделяют α-, β-, γ- и другие аминокислоты.

α- и β- формы аланина
Для организма млекопитающих наиболее характерны α-аминокислоты.
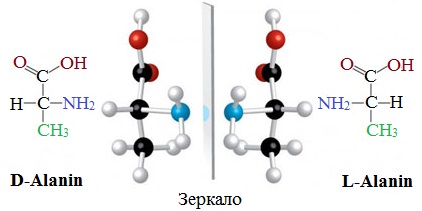
Изомерия по абсолютной конфигурации
По абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в α-положении. Имеется только два возможных расположения химических групп вокруг него.
В белке любого организма содержится только один стереоизомер, для млекопитающих это L-аминокислоты.

L- и D-формы аланина
Однако оптические изомеры могут претерпевать самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму.
Как известно, тетраэдр – это довольно жесткая структура, в которой невозможно произвольным образом передвинуть вершины.

Точно так же для молекул, построенных на основе атома углерода, − за эталон конфигурации принята структура молекулы глицеральдегида, установленная с помощью рентгеноструктурного анализа. Принято, что в качестве маркера используют наиболее сильно окисленный атом углерода (на схемах его располагают сверху), связанный с асимметричным атомом углерода. Таким окисленным атомом в молекуле глицеральдегида служит альдегидная группа, для аланина – СООН группа. Атом водорода в ассиметричном углероде располагают так же, как в глицеральдегиде.

В дентине, белке зубной эмали, скорость рацемизации L-аспартата равна 0,10% в год. При формировании зуба у детей используется только L-аспартат. Такая особенность позволяет при желании определять возраст долгожителей. Для ископаемых останков наряду с радиоизотопным методом также используют определение рацемизации аминокислот в белке.
Деление изомеров по оптической активности
По оптической активности аминокислоты делятся на право– и левовращающие.
Наличие в аминокислоте ассиметричного α-атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры.
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.
Что такое изомерия аминокислот
Изомерия аминокислот — это такое явление, суть которого заключается в том, что существуют одинаковые по химическому составу и молекулярной массе химические соединения. При этом, различаются они строением и свойствами.
Аминокислоты — это составляющие белков: они являются их мономерами. Насчитывается 20 заменимых и незаменимых аминокислот.
Изомерия аминокислот бывает двух типов. Выделяют:
- структурную изомерию;
- оптическую изомерию аминокислот.
Структурная изомерия, в свою очередь, бывает изомерией углеродного скелета и изомерией положения аминогруппы.
Типы изомерии
Если говорить про оптическую изомерию и ее примеры, то стоит отметить, что все ɑ-аминокислоты (за исключением глицина H₂N-CH₂-COOH) включают атом углерода асимметрической структуры. По этой причине такие аминокислоты могут быть представлены в виде зеркального антипода.
Такому типу изомерии отводится важная роль в процессе биосинтеза белка — благодаря ему процесс становится точнее, а нарушения исключаются. Исходя из критерия оптической активности, изомеры бывают лево- и правовращающимися.
Формирование такой изомерии основано на наличии в аминокислоте асимметричного ɑ-атома углерода, который выступает в роли хирального центра и обеспечивает расположение вокруг себя химических групп только в виде двух конфигураций.
Как результат — возникает изменение направленности вращения плоского поляризованного света, проходящего через раствор. Происходит оценка угла его поворота.
Биосинтез белка представляет собой процесс образования белковых молекул в клетке на основе ДНК-матрицы.
Биосинтез белка осуществляется на рибосомах шероховатой эндоплазматической сети.
Образование изомеров аминокислотами может происходить на основе положения аминогруппы по отношению ко второму атому углерода. Здесь выделяют ɑ- β- γ- и прочие аминокислоты. Для них характерна довольно высокая степень функциональной активности. Также эти аминокислоты играют важную роль в клетках, поскольку обуславливают их жизнедеятельность.
В зависимости от функциональной активности можно обозначить следующие конфигурации молекул: D- и L-формы. Здесь в основе различий между изомерами лежит расположение замещающих групп: всего их насчитывается четыре. Располагаются они на верхушке воображаемого тетраэдра с центром в виде атома углерода в положении ɑ.
Когда обе формы аминокислоты смешиваются, то происходит образование рацемической смеси — ей не свойственна оптическая активность.
Рацемическая смесь представляет собой смесь различных форм изомеров без оптической активности.
При этом, важно отметить, что разделение аминокислот на основе конфигурации не соответствует оптическому делению. Это значит, что у одним аминокислот L-форма может правовращающей, а для других — левовращающей.
К примеру, L-аланин будет правовращающим, а L-фенилаланин — левовращающим. Кстати, смесь обеих форм или рацемат не будет обладать оптической активностью.
Как видно, изомерия показывает на особенность строения аминокислот и позволяет оценить их химическую структуру и биологическую клеточную роль.