Изомерия сложных эфиров
Для сложных эфиров характерны три вида изомерии:
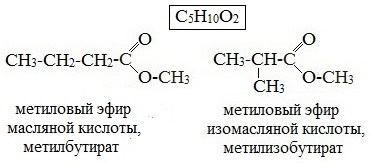
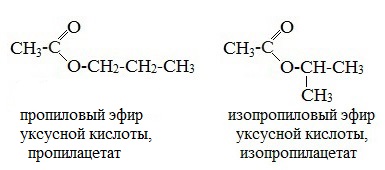
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку – с пропилового спирта, например, метилбутирату изомерны метилизобутират, пропилацетат и изопропилацетат.
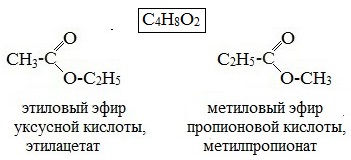
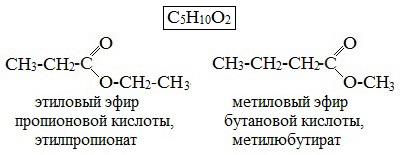
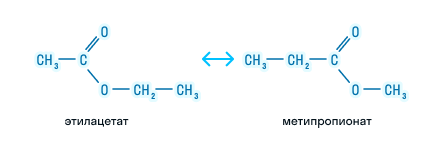
2. Изомерия положения сложноэфирной группировки –СО–О–. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат, этилпропионат и метилбутират.
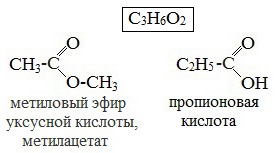
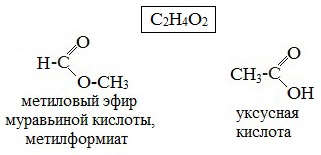
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота, а метилформиату уксусная кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис- , транс-изомерия.
Сложные эфиры
…
Сложные эфиры карбоновых кислот: Строение
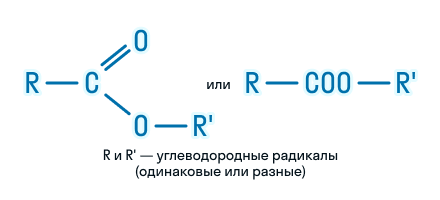
Сложные эфиры являются производными карбоновых кислот, в молекулах которых группа -ОН (в карбоксильной группе) замещена на спиртовый остаток –O-R:
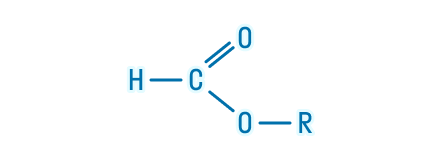
Общая формула сложных эфиров карбоновых кислот R–COOR’, где R и R’ — углеводородные радикалы. В сложных эфирах муравьиной кислоты R – это атом водорода.
Общая формула сложных эфиров предельных одноосновных карбоновых кислот, имеющих в качестве спиртового остатка предельные одноатомные спирты совпадает с общей формулой карбоновых кислот: CnH2nO2 или СnH2n+1-COO-СnH2n+1
Например, молекула метилацетата выглядит следующим образом:
Сложные эфиры карбоновых кислот: Классификация
Сложные эфиры карбоновых кислот можно разделить на три группы.
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами. Например, этилацетат, метилпропионат, пропилформиат:
- Сложные эфиры, образованные высшими карбоновыми кислотами и высшими одноосновными спиртами (воски).
Воски делятся на:
- Растительные, например, пальмовый воск, японский воск
- Животные, например, пчелиный воск, шерстяной (шерстный) воск –
ланолин, кожное сало, ушная сера. - Ископаемые, например, торфяной
воск, буроугольный воск (монтан-воск) горный, воск (озокерит). - Синтетические, например, канифоль — хрупкая стекловидная прозрачная масса.
Например, пчелиный воск – сложный эфир пальмитиновой кислоты и мирицилового спирта; кашалотовый воск (спермацет) сложный эфир пальмитиновой кислоты и цетилового спирта:
- Сложные эфиры, образованные трехатомным спиртом глицерином и высшими карбоновыми кислотами (жиры). См. раздел Жиры: Строение, получение, химические свойства
Сложные эфиры карбоновых кислот: Изомерия и номенклатура
Изомерия сложных эфиров карбоновых кислот
Для сложных эфиров характерны изомерия углеродной цепи, положения сложноэфирной группировки, и межклассовая виды изомерии. Для сложных эфиров, образованных непредельной кислотой или непредельным спиртом, возможна пространственная изомерия (цис- , транс-изомерия) и изомерия положения кратной связи.
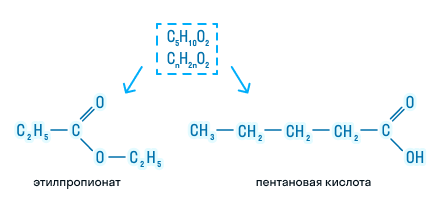
- Изомерия углеродной цепи может наблюдаться по кислотному остатку, начиная с бутановой кислоты, и по спиртовому остатку, начиная с пропилового спирта. Например, сложный эфир с брутто формулой С5H10O2 может иметь такие изомеры, как: метиловый эфир бутановой (масляной) кислоты, бутирату, метиловый эфир изобутановой (изомасляной) кислоты, пропиловый эфир уксусной кислоты и изопропиловый эфир уксусной кислоты изомерны метилизобутират, пропилацетат и изопропилацетат.
- Изомерия положения сложноэфирной группировки наблюдается у сложных эфиров, состоящих не мене чем из 4 атомов углерода, например этиловый эфир пропановой кислоты и метиловый эфир бутановой (масляной) кислоты.
- Межклассовая изомерия. Сложные эфиры изомерны карбоновым кислотам, например, изомерами являются метиловый эфир уксусной кислоты (метилацетат) и пропановая кислота.
- Изомерия положения кратной связи. Например, метиловый эфир 2-пентеновой кислоты и метиловый эфир 3-пентеновой кислоты:
- Пространственная цис-, транс-изомерия. Например, метиловый эфир цис-2-бутеновой кислоты и метиловый эфир транс-2-бутеновой кислоты:
Номенклатура сложных эфиров карбоновых кислот
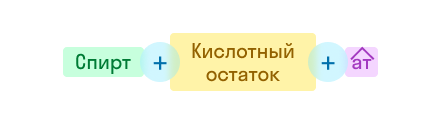
Согласно систематической номенклатуры ИЮПАК названия сложных эфиров строятся исходя из названий двух остатков: спиртового и кислотного. К названию спиртового остатка прибавляют название кислотного остатка и суффикс –оaт, например:
Согласно тривиальной номенклатуры названия сложных эфиров строятся исходя из названий образующих его кислот и спиртов с добавлением слова эфир. Например:
Кроме этого, название сложного эфира может быть построено из названий кислотной и спиртовой частей, добавляя окончание «ый» и слово «эфир». Например, приведенное в примере соединение по этому правилу можно назвать маслянопропиловый эфир.
Примеры названий сложных эфиров карбоновых кислот:
Сложные эфиры представляют собой функциональные производные карбоновых кислот, в молекулах которых атом водорода гидроксильной группы замещён на углеводородный радикал.
Рис. (1). Строение молекулы сложного эфира
Таким образом, в молекуле сложного эфира содержатся два углеводородных радикала (за исключением эфиров муравьиной кислоты), которые могут быть одинаковыми или разными.
Следовательно, сложные эфиры имеют общую формулу: R−COO−R1.
В молекулах насыщенных эфиров соотношение атомов углерода и водорода равно (1 : 2), следовательно, их общая формула имеет вид CnH2nO2.
Номенклатура сложных эфиров
Названия сложных эфиров происходят от названий кислот и спиртов, остатки которых участвуют в их образовании.
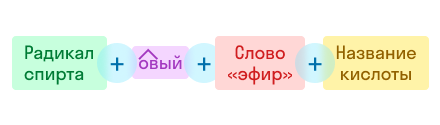
Согласно систематической номенклатуре названия сложных эфиров образуются следующим образом: к названию радикала спирта добавляют название кислоты, образующей этот эфир, с изменением суффикса и окончания «-овая» на суффикс «-ат». Также применяется сокращённый вариант, в котором используются названия ионов соответствующих карбоновых кислот.
В соответствии с тривиальной номенклатурой вначале указывается радикал спирта с добавлением «-овый эфир», а затем название карбоновой кислоты.
Обрати внимание!
Названия большинства сложных эфиров образованы от тривиальных названий соответствующих им карбоновых кислот.
Пример:
номенклатура наиболее распространённых сложных эфиров
|
Формула вещества |
Систематическое название |
Тривиальное название |
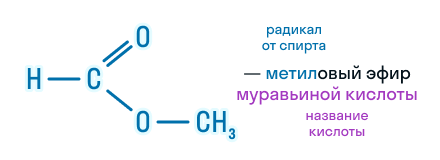
| HCOOCH3 | метилформиат | метиловый эфир муравьиной кислоты |
| CH3COOCH3 | метилацетат | метиловый эфир уксусной кислоты |
| CH3COOC2H5 | этилацетат | этиловый эфир уксусной кислоты |
| C6H5COOCH3 | метилбензоат | метиловый эфир бензойной кислоты |
| HCOOC6H5 |
фенилформиат |
фениловый эфир муравьиной кислоты |
Для сложных эфиров возможны все виды структурной изомерии:
-
изомерия углеродной цепи;
-
изомерия положения функциональной группы
−COO−
;
-
межклассовая изомерия (с карбоновыми кислотами).
Пример:
рассмотрим структурную изомерию сложных эфиров на примере веществ, имеющих состав
C5H10O2
.
|
Формула изомера |
Название |
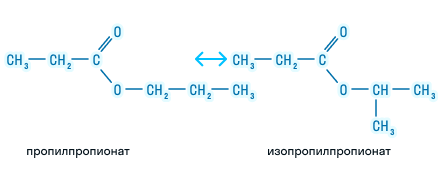
| CH3−COO−CH2−CH2−CH3 | пропилацетат |
| CH3−COO−CHCH32 | изопропилацетат |
| C2H5−COO−C2H5 | этилпропионат |
| CH3−CH2−CH2−COO−CH3 | метилбутират |
| CH3−CH2−CH2−CH2−COOH | пентановая кислота |
Источники:
Рис. 1. Строение молекулы сложного эфира. Общественное достояние, https://commons.wikimedia.org/w/index.php?curid=1623926, дата обращения: 20.01.2022.
Для начала дадим определение и разберемся, почему эти эфиры — сложные.
Сложные эфиры или эсте́ры (от древнегреческого αἰθήρ — «эфир») — это класс соединений на основе неорганических (минеральных) или органических (карбоновых) одно- или многоосновных кислот, у которых атом водорода в гидроксогруппе замещен на радикал. Эпитет «сложные» они получили для того, чтобы их не путали с простыми эфирами — производными спиртов.
Общая формула сложных эфиров выглядит так:
Однако представители сложных эфиров муравьиной кислоты выглядят иначе. Для них общая формула приобретает такой вид:
Номенклатура сложных эфиров
Теперь поговорим о том, как называть представителей данного класса. Различают два способа, позволяющие назвать сложные эфиры: по систематической номенклатуре (ИЮПАК) или по рациональной номенклатуре. Рассмотрим оба варианта.
-
По номенклатуре ИЮПАК название строится следующим образом:
Например:
-
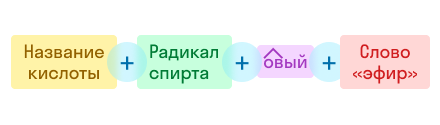
По рациональной номенклатуре название строится так:
Например:
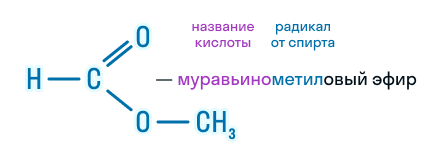
По этой же номенклатуре эфиры можно называть, используя четыре слова: радикал спирта + слово «эфир» + название кислоты + слово «кислота». Например, муравьинометиловый эфир можно иначе назвать метиловый эфир муравьиной кислоты:
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Изомерия сложных эфиров
Возможна ли изомерия для сложных эфиров? Давайте разбираться.
-
Возможна изомерия углеродного скелета у радикала кислоты и радикала спирта при наличии трех и более углеродных атомов.
-
Изомерия положения функциональной группы:
-
Межклассовая изомерия также определяется общей формулой органических соединений. Например:
Физические свойства сложных эфиров
Агрегатное состояние сложного эфира напрямую зависит от молекулярной массы образующих его кислоты и спирта. Так, например, сложные эфиры низших и средних гомологов являются летучими жидкостями с характерным запахом. Чаще всего у них фруктовые или плодовые ароматы. Сложные эфиры хуже растворяются в воде, чем образующие их кислоты и спирты. Чем больше атомов углерода в составе сложного эфира, тем хуже его растворимость в воде.
Эфиры высших карбоновых кислот и высших одноатомных первичных спиртов — основа природного воска. Например, известный пчелиный воск — это сложный эфир пальмитиновой кислоты (C15H31COOH) и мирицилового спирта (С31H63OH).
Химические свойства сложных эфиров
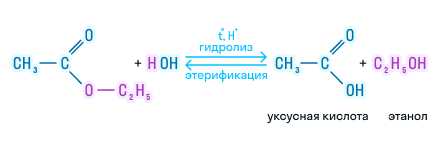
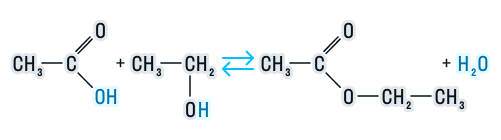
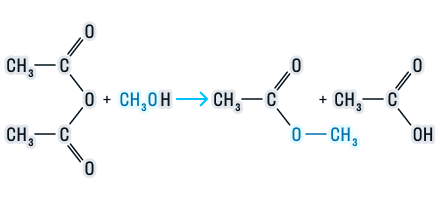
Сложные эфиры подвергаются гидролизу (разложению под действием воды), который бывает двух видов: в кислой среде и в щелочной. Рассмотрим каждый из этих видов.
-
В кислой среде реакция протекает следующим образом:
Эта реакция обратима, так как образующиеся в процессе кислота и спирт подвергаются взаимодействию с образованием этого же сложного эфира. Обратная реакция имеет название реакция этерификации.
-
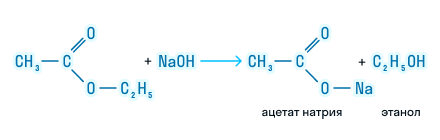
Щелочной гидролиз или реакция омыления:
Этот вид гидролиза протекает необратимо, так как образовавшаяся в ходе реакции соль не может реагировать со спиртом.
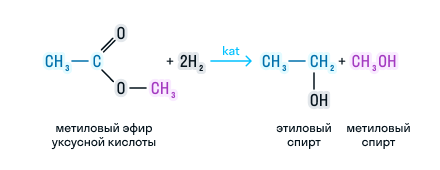
Сложные эфиры можно восстановить водородом в присутствии катализатора до двух спиртов. Причем один из спиртов будет иметь в составе столько атомов углерода, сколько было в кислоте, а во втором спирте количество углерода будет соответствовать исходному спирту. Рассмотрим на примере:
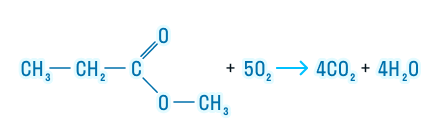
Эфиры подвергаются полному окислению, то есть горят с образованием углекислого газа и воды:
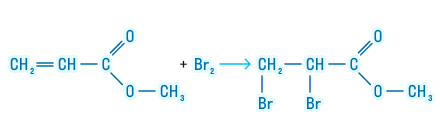
Следующее химическое свойство относится только к тем сложным эфирам, которые образованы непредельной карбоновой кислотой. Сложные эфиры таких кислот могут подвергаться галогенированию. Посмотрим, как происходит эта реакция:
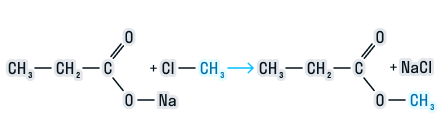
Способы получения сложных эфиров
-
Реакция этерификации.
Реакция обратимая, поэтому требуется либо избыток одного из реагентов, либо отгонка образующегося сложного эфира, чтобы предотвратить обратную реакцию гидролиза.
-
Взаимодействие ангидрида карбоновой кислоты со спиртом с образованием сложного эфира и карбоновой кислоты.
-
Взаимодействие солей карбоновых кислот с галогеналканами.
Нахождение сложных эфиров в природе и применение
Сложные эфиры широко представлены в природе, но их количество минимально. Они участвуют в процессах, которые протекают в живых организмах, а также являются компонентами аромата ряда растений.
Некоторые эфиры получают искусственным способом. Например, за грушевый вкус в лимонаде отвечает уксусноизоамиловый эфир, а за яблочный — изовалерианоэтиловый эфир.
Помимо пищевой промышленности, сложные эфиры применяют в качестве растворителей для приготовления лаков, а также как пластификаторы для приготовления пластических масс.
Сложные эфиры на основе ароматических спиртов нашли применение в парфюмерной промышленности.
Среди
функциональных производных карбоновых
кислот особое место занимают сложные
эфиры – соединения, представляющие
карбоновые кислоты, у которых атом
водорода в карбоксильной группе заменен
углеводородным радикалом. Общая формула
сложных эфиров

Молекула
сложного эфира состоит из остатка
кислоты (1) и остатка спирта (2).
Названия
сложных эфиров производят от названия
углеводородного радикала и названия
кислоты, в котором вместо окончания
«-овая кислота» используют суффикс
«ат», например:

Часто
сложные эфиры называют по тем остаткам
кислот и спиртов, из которых они
состоят. Так, рассмотренные выше сложные
эфиры могут быть названы: уксусноэтиловый
эфир, кротоновометиловый эфир.
Для
сложных эфиров характерны три вида
изомерии: 1. Изомерия углеродной цепи,
начинается по кислотному остатку с
бутановой кислоты, по спиртовому остатку
– с пропилового спирта, например:

2.
Изомерия положения сложноэфирной
группировки –СО–О–. Этот вид изомерии
начинается со сложных эфиров, в
молекулах которых содержится не
менее 4 атомов углерода, например:
3.
Межклассовая изомерия, например:
Для
сложных эфиров, содержащих непредельную
кислоту или непредельный спирт, возможны
еще два вида изомерии: изомерия положения
кратной связи и цис-транс- изомерия.
Физические свойства
Сложные
эфиры низших карбоновых кислот и
спиртов представляют собой летучие,
малорастворимые или практически
нерастворимые в воде жидкости. Многие
из них имеют приятный запах. Так,
например, HCOOC2H5
– запах рома, HCOOC5H11
– вишни, HCOOC5H11-изо
– сливы, СН3СООС5Н11-изо
– груши, С3Н7СООС2Н5
– абрикоса, С3Н7СООС4Н9
– ананаса, С4Н9СООС5Н11
– яблок и т.д
Сложные
эфиры имеют, как правило, более низкую
температуру кипения, чем соответствующие
им кислоты. Например, стеариновая кислота
кипит при 232 °С, а метилстеарат – при
215°С. Объясняется это тем, что между
молекулами сложных эфиров отсутствуют
водородные связи.
Сложные
эфиры высших жирных кислот и спиртов –
воскообразные вещества, не имеют
запаха, в воде не растворимы, хорошо
растворимы в органических растворителях.
Например, пчелиный воск представляет
собой в основном мирицилпальмитат
(С15Н31COOC31Н63)
Химические свойства
1.
Реакция гидролиза или омыления.
Реакция
этерификации является обратимой,
поэтому в присутствии кислот будет
протекать обратная реакция, называемая
гидролизом, в результате которой
образуются исходные жирные кислоты и
спирт:
Реакция
гидролиза ускоряется под действием
щелочей; в этом случае гидролиз необратим:
так
как получающаяся карбоновая кислота
со щелочью образует соль:
2.
Реакция присоединения.
Сложные
эфиры, имеющие в своем составе непредельную
кислоту или спирт, способны к реакциям
присоединения. Например, при каталитическом
гидрировании они присоединяют водород.
3.
Реакция восстановления.
Восстановление
сложных эфиров водородом приводит к
образованию двух спиртов:
4.
Реакция образования амидов.
Под
действием аммиака сложные эфиры
превращаются в амиды кислот и спирты:
Механизм
протекания реакции этерификации.
Рассмотрим в качестве примера получение
этилового эфира бензойной кислоты:

Каталитическое
действие серной кислоты состоит в
том, что она активирует молекулу
карбоновой кислоты. Бензойная кислота
протонируется по атому кислорода
карбонильной группы (атом кислорода
имеет неподеленную пару электронов, за
счет которой присоединяется протон).
Протонирование приводит к превращению
частичного положительного заряда на
атоме углерода карбоксильной группы
в полный, к увеличению его электрофильности.
Резонансные структуры (в квадратных
скобках) показывают делокализацию
положительного заряда в образовавшемся
катионе. Молекула спирта за счет своей
неподеленной пары электронов присоединяется
к активированной молекуле кислоты.
Протон от остатка спирта перемещается
к гидроксильной группе, которая при
этом превращается в «хорошо уходящую»
группу Н2О. После этого отщепляется
молекула воды с одновременным выбросом
протона (возврат катализатора).

Этерификация
– обратимый процесс. Прямая
реакция – образование сложного
эфира, обратная – его кислотный гидролиз.
Для того чтобы сдвинуть равновесие
вправо, необходимо удалять из реакционной
смеси воду.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #