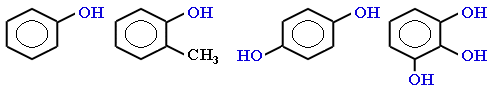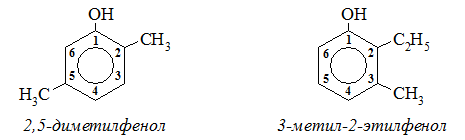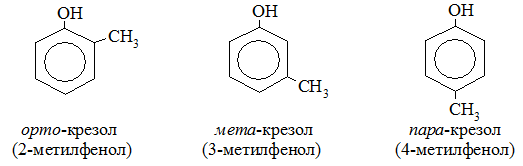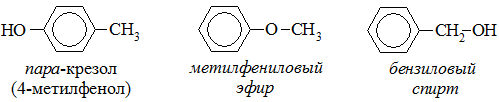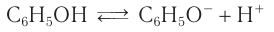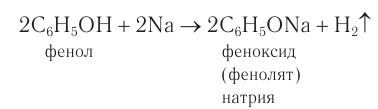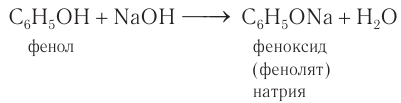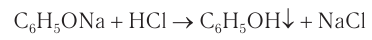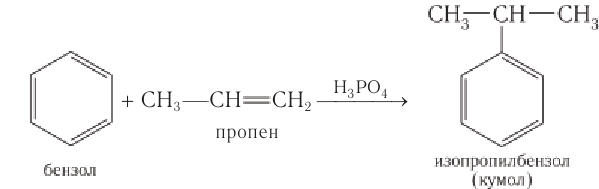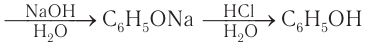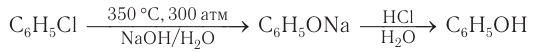Фенолы – это производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп (- ОН), непосредственно соединенных с бензольным кольцом.
Фенолы – это гидроксильные производные бензола.
Общая формула Ar-ОН, где Ar – арил.
Простейшим и наиболее известным представителем этого класса соединений является фенол.
Молекулярная формула фенола С6Н5ОН.
Радикал фенола С6Н5 называется фенил.
Классификация фенолов
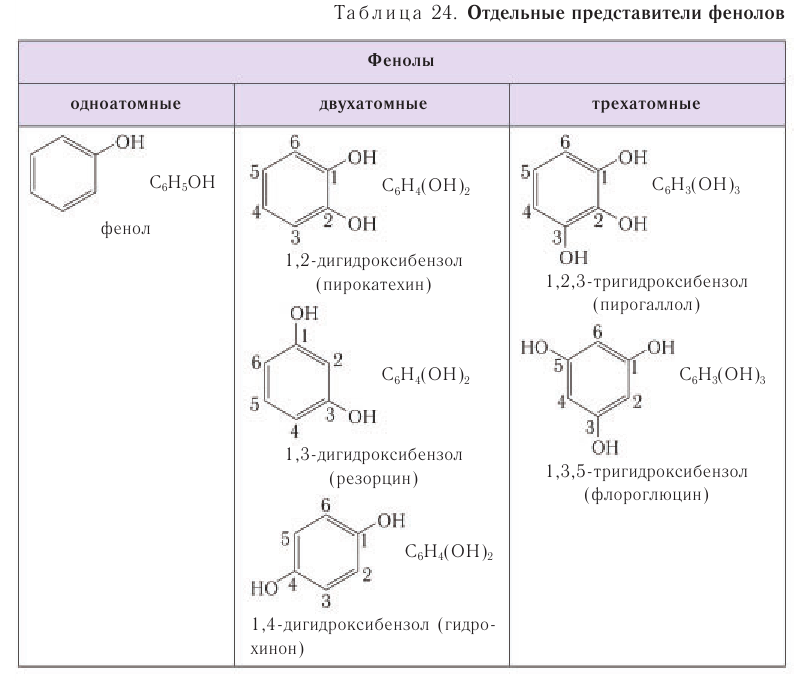
В зависимости от числа ОН-групп в молекуле различают одно- , двух- , трехатомные фенолы.
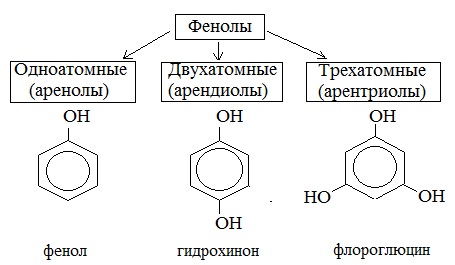
Существуют фенолы и большей атомности.
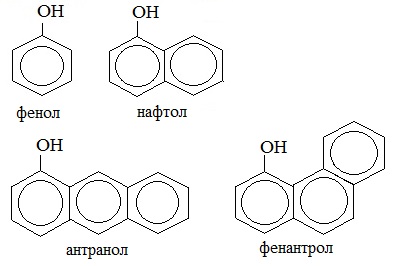
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы.
Номенклатура фенолов
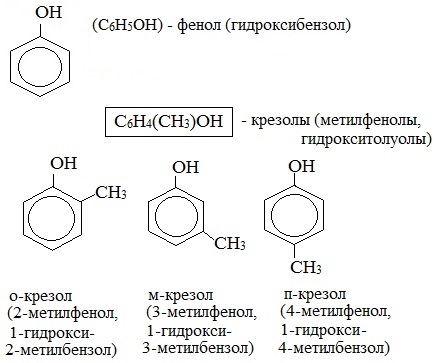
Для фенолов широко используют тривиальные названия, сложившиеся исторически: фенол, гидрохинон, резорцин и др. В названиях замещенных моноядерных фенолов используются также приставки орто- , мета- и пара- , употребляемые в номенклатуре ароматических соединений.
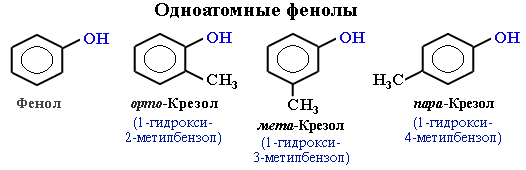
Простейшие одноатомные фенолы
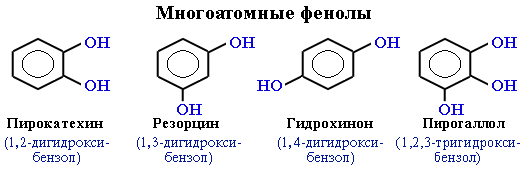
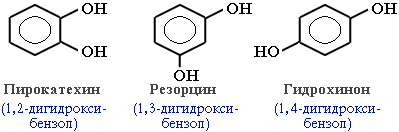
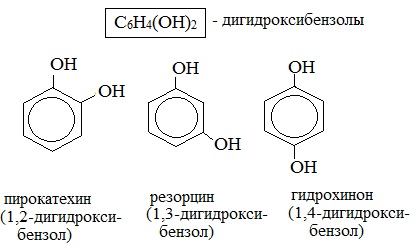
Простейшие двухатомные фенолы
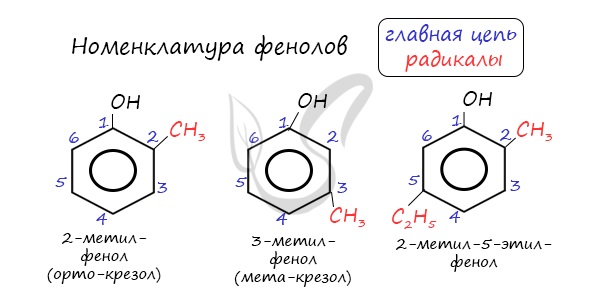
Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей.
При построении номенклатуры фенолов атомы углерода в бензольном кольце обозначают цифрами от 1 до 6, начиная с атома углерода, связанного с гидроксильной группой.
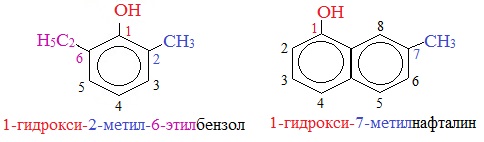
Изомерия фенолов
Для фенолов характерно несколько видов изомерии.
1. Изомерия положения заместителей в бензольном кольце
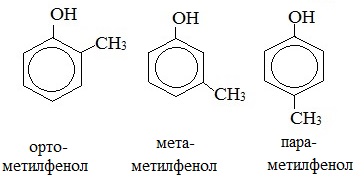
2. Изомерия положения групп –ОН в многоатомных спиртах
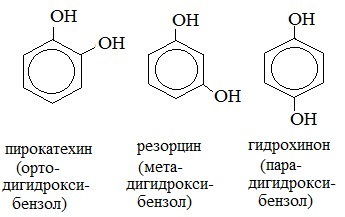
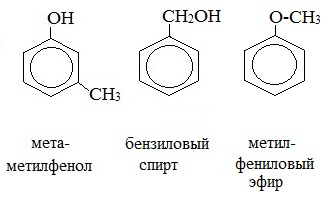
3. Межклассовая изомерия с ароматическими спиртами, простыми эфирами
Электронное строение молекулы фенола
Физические свойства фенолов
Токсические свойства фенола
Химические свойства фенолов
Получение фенолов
Применение фенолов
ФЕНОЛЫ
Фенолы – производные ароматических углеводородов, в которых один или несколько атомов водорода бензольного кольца замещены на гидроксильную группу –ОН.
В отличие от спиртового гидроксила, связанного с sp3-углеродным атомом,
фенольная ОН-группа находится при sp2-атоме углерода ароматического ядра.
Многие фенолы и их производные широко распространены в растительном мире (пигменты, дубильные вещества, компоненты древесины).
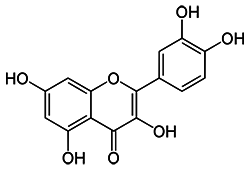
К растительным полифенолам относятся флавоноиды, объединенные общностью путей биосинтеза в растениях. Представителем этой группы является кверцетин
Кверцетин (от лат. Quercus – дуб) выделен из коры дуба, обнаружен также в хмеле, чае, кожуре лука, гречке, цветках мать-и-мачехи и др., относится к группе витаминов P, обладает капилляроукрепляю-щим действием..
Значительные количества фенольных соединений содержат угли (продукты разложения древесных и растительных остатков). Фенолы применяются в производстве полимеров, красителей, лекарств, душистых веществ, средств защиты растений.
Классификация. По числу гидроксильных групп фенолы, как и спирты, подразделяются на:
- одноатомные (одна ОН-группа)
- многоатомные (обычно две или три ОН-группы)
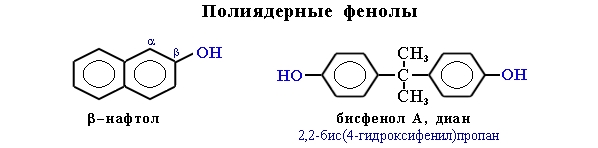
- полиядерные фенолы (соединения, содержащие 2 и более бензольных колец)
β-нафтол — сильный антисептик, антиоксидант каучуков, наряду с α-изомером используется в синтезе азокрасителей; бисфенол А — важнейший полупродукт в производстве эпоксидных смол и поликарбонатов.
Общая формула одноатомных фенолов Ar–OH, где Ar – ароматический радикал (C6H5–, CH3C6H4– и т.п.).
Простейший представитель — фенол С6Н5–ОН (гидроксибензол).
Среди многоатомных фенолов наиболее распространены двухатомные:
Производные пирокатехина, резорцина и гидрохинона входят в состав различных природных соединений. Исходя из пирокатехина, был получен адреналин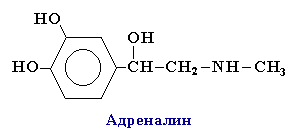
Номенклатура. Для большинства фенолов используются тривиальные названия, принятые номенклатурой ИЮПАК: фенол, крезол, пирокатехин, резорцин, гидрохинон и др.
Одноатомные фенолы называются как производные первого члена этого ряда – фенола. Название строят, исходя из нумерации бензольного кольца, которую начинают от атома углерода, связанного с ОН-группой. При этом набор номеров заместителей должен быть наименьшим, а названия заместителей указаны в алфавитном порядке. Например:
В названиях монозамещенных фенолов часто используются приставки орто-, мета- и пара- (примечаниеДля запоминания положения замести-телей в бензольном кольце используется мнемоническое правило: орто – “около”, пара – “против”, мета – “между”.). Например, три изомерных крезола (метилфенола) называют орто-, мета- и пара-крезолами:
Изомерия. Для фенолов характерна структурная изомерия:
- изомерия положения гидроксигруппы (например, орто-, мета- и пара-крезолы);
- изомерия бокового заместителя, начиная с HO–C6H4–C3H7
- межклассовая изомерия алкилфенолов с простыми эфирами (алкоксибензолами) и ароматическими спиртами:
План урока
Строение молекулы фенола и классификация
Номенклатура и изомерия фенолов
Методы получения фенола
Физические свойства фенолов
Химические свойства фенолов
Области применения фенолов
Строение молекулы фенола и классификация
Фенолы имеют полярную структуру. Кольцо – отрицательный конец диполя, а гидроксильная группа – положительный.
На атоме кислорода гидроксильной группы находится неподеленная пара электронов, участвующая в связывании с π-системой кольца. Это свойство отличает фенолы от другого кислородсодержащего класса – спиртов.
Строение фенола. Источник
По числу фенольных гидроксидов фенолы классифицируют на одноатомные и многоатомные.
Источник
Номенклатура и изомерия фенолов
Для фенолов характерно несколько типов изомерии:
- изомерия положения радикалов в кольце;
- изомерия боковой цепи.
Нумерация в кольце начинается таким образом, чтобы заместители имели самые меньшие номера. В основе лежит корень «фенол». Также в названии следует указывать положение гидроксильных групп в кольце.
Номенклатура фенолов. Источник
Методы получения фенола
Существует несколько реакций получения фенола.
Физические свойства фенолов
Агрегатное состояние фенолов– прозрачные токсичные кристаллы с отличительным запахом. Температура кипения фенолов – 181,84°С.Они малорастворимы в воде, но хорошо растворимы в органических растворителях. На воздухе быстро окисляются и темнеют.
Химические свойства фенолов
Реакции идут как внутри кольца, так и в боковой цепи.
Реакции по группе -ОН
Фенолу характерны слабые кислотные свойства. Он реагирует с щелочами и щелочными металлами, образуя соли – феноляты.
Реакции по кольцу
Фенолам свойственно электрофильное замещение. К ним относятся галогенирование, нитрование и сульфирование. Гидроксильная группа – ориентант I рода, поэтому реакционная способность кольца увеличивается и замещение направляется в орто- и параположения.
- Галогенирование
Это качественная реакция фенолов. В ее результате выпадает белый осадок.
- Нитрование
Нитрование может проводиться несколькими способами:
- нитрующей смесью
- разбавленной азотной кислотой
- последовательным добавлением концентрированной серной и разбавленной азотной кислотами
- Сульфирование
Реакцию фенола сконцентрированными серными кислотами проводят при нагревании.
- Гидрирование под действием катализатора
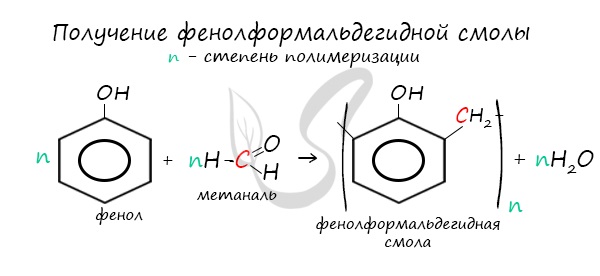
- Поликонденсация с альдегидами
В реакции синтезируется фенолформальдегидная смола, которая используется в промышленности.
Качественная реакция фенолов
Помимо галогенирования, качественной реакцией является взаимодействие с хлоридом железа (III). В ее результате трихлоридфенолят железа (III) фиолетового цвета.
Области применения фенолов
Раствор фенола изначально использовался как антисептик. Фенол применяют в производстве пластмассовых изделий, салициловой кислоты, красителей и взрывчаток. А также он входит в структуру многих белков живых организмов.
Содержание:
Фенолы:
К гидроксилпроизводным органическим соединениям, кроме спиртов, относятся фенолы.
Фенолами называют производные ароматических углеводородов, в молекулах которых один или несколько атомов водорода, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы.
Число гидроксильных групп в молекуле определяет атомность фенолов. Они могут содержать до шести гидроксильных групп в молекуле. По числу гидроксильных групп фенолы, как и спирты, классифицируют как одно- и многоатомные фенолы.
В таблице 24 для ознакомления приведены формулы и названия некоторых фенолов различной атомности.
В данном курсе органической химии вы познакомитесь со строением и свойствами одного представителя класса — фенолом
Строение фенола
Фенол 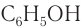
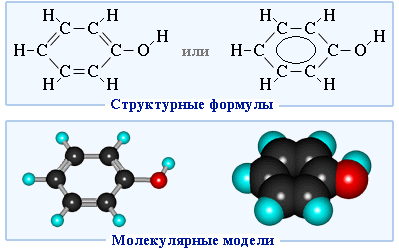
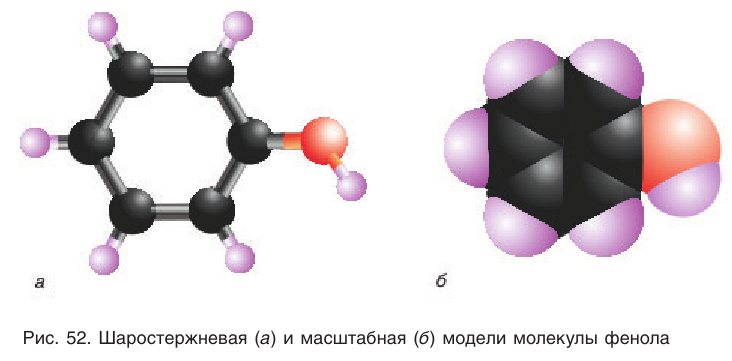
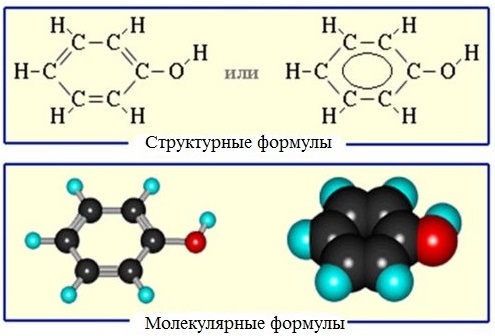
Шаростержневая и масштабная модели молекулы фенола приведены на рисунке 52.
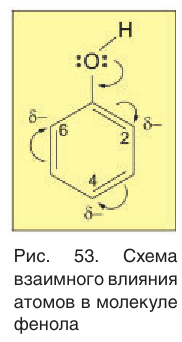
Рассмотрим электронное строение молекулы фенола. Одна из неподеленных электронных пар атома кислорода вступает в сопряжение с 
Сопряжение неподеленной электронной пары атома кислорода с 
Физические свойства фенола
Фенол — бесцветное кристаллическое вещество с резким характерным запахом. Кристаллическое состояние фенола обусловлено наличием прочных водородных связей между его молекулами. При обычной температуре фенол незначительно растворяется в воде, но хорошо раетворяетея в горячей воде. Фенол очень ядовит, при попадании на кожу вызывает cильнейшие ожоги, поэтому работать е ним в школьном химичееком кабинете запрещено.
Химические свойства фенола
Химические свойства фенола обусловлены наличием в молекуле функциональной группы —ОН и бензольного кольца, которые взаимно влияют друг на друга. В молекуле фенола бензольное кольцо влияет на гидроксильную группу, что проявляется в повышенной кислотности фенола по сравнению с насыщенными одноатомными спиртами. Влияние гидроксильной группы на бензольное кольцо обусловливает более легкое замещение в нем атомов водорода на какой-либо заместитель у атомов углерода в положениях 2, 4, 6.
Рассмотрим последовательно химические реакции, протекающие с участием гидроксильной группы и бензольного кольца.
1) Диссоциация в водных растворах. Молекулы фенола диссоциируют в водных растворах по кислотному типу:
Фенол является слабой кислотой (иногда его называют карболовой кислотой), что отличает его от спиртов, которые практически не диссоциируют в водных растворах.
2) Взаимодействие со щелочными металлами. Наличие в молекуле фенола гидроксильной группы, непосредственно связанной с бензольным кольцом, обусловливает определенное сходство по химическим свойствам с одноатомными спиртами. Если в расплавленный фенол поместить кусочек металлического натрия, то происходит реакция замещения атома водорода в гидроксильной группе. При этом образуется соединение, которое по номенклатуре ИЮПАК называют феноксид. Используется и другое название — фенолят, допускаемое номенклатурой ИЮПАК. В реакции со щелочными металлами фенол проявляет кислотные свойства:
3) Взаимодействие со щелочами. Кислотные свойства у фенола, как вам известно, выражены сильнее, чем у одноатомных насыщенных спиртов. Поэтому, в отличие от них, фенол реагирует не только со щелочными металлами, но и с водными растворами щелочей с образованием феноксидов (фенолятов):
Кислотные свойства у фенола выражены слабее, чем у неорганических кислот, даже таких слабых, как угольная. Поэтому добавление к водному раствору фенолята натрия соли угольной кислоты (кислотные свойства фенола примерно в три тысячи раз слабее, чем угольной кислоты) приводит к образованию фенола. Образуется фенол и при добавлении к водному раствору фенолята сильных минеральных кислот:
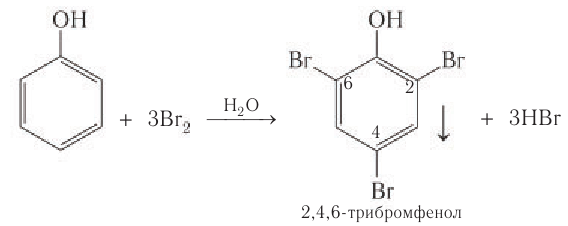
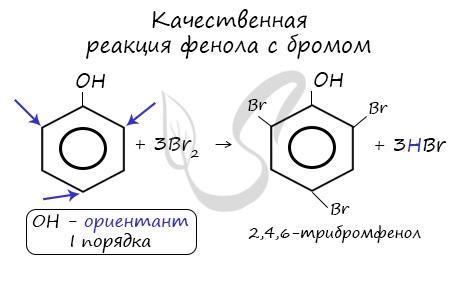
4) Галогенирование. Реакции галогенирования, в частности бромирования, протекают с замещением атомов водорода в бензольном кольце. В отличие от бензола для бромирования фенола не требуется катализатор, так как влияние гидроксильной группы значительно облегчает протекание реакций замещения в бензольном кольце. При действии на фенол раствора брома в воде образуется белый осадок 2,4,6-трибромфенола (рис 54).
Эта реакция часто используется для качественного обнаружения фенола.
Фенол дает характерное фиолетовое окрашивание с водным раствором хлорида железа(III) вследствие образования комплексной соли железа. Эту реакцию также используют для обнаружения фенола и относят к цветной качественной реакции.
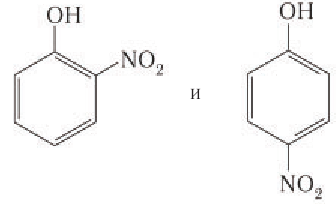
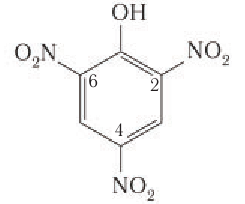
5) Нитрование. Фенол так же, как и бензол, взаимодействует е азотной кислотой, но нитрование фенола протекает легче, чем нитрование бензола. Реакция фенола с разбавленной азотной кислотой идет при комнатной температуре, и в результате образуется смесь изомеров нитрофенола:
2, 4, 5 – Тринитрофенол (пикриновую кислоту)
получают из фенола под действием сначала концентрированных серной, а затем азотной кислот. Наличие в молекуле пикриновой кислоты трех заместителей —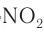
Фенолами называют производные ароматических углеводородов, в молекулах которых один или несколько атомов водорода, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы.
Фенол 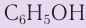
Для фенола характерны реакции гидроксильной группы (со щелочными металлами, щелочами) и бензольного кольца (галогенирование, нитрование).
Получение и применение фенола
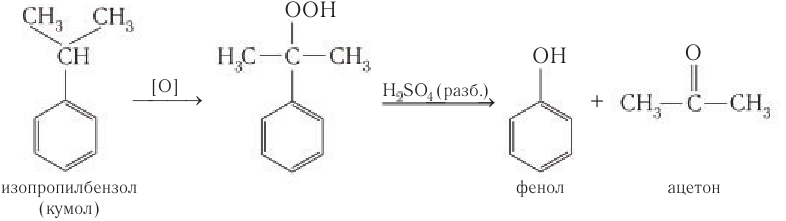
Получение: Одним из основных промышленных методов получения фенола является кумольный метод. Он был разработан в 40-е гг. XX в. в Советском Союзе Р. Ю. Удрисом, Б. Д. Кружаловым, П. С. Сергеевым, М. С. Немцовым и до наших дней не утратил своей эффективности. Для получения фенола используются экономически выгодные исходные вещества — бензол и пропей.
Упрощенно синтез фенола можно представить так. Сначала в реакции бензола с пропеном синтезируют изопропилбензол (кумол):
Затем кумол окисляют, продукт окисления кумола разлагают разбавленной серной кислотой и получают при этом фенол и ацетон 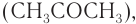
Схема получения из кумола фенола приведена для ознакомления и не требует запоминания.
Ранее фенол выделяли только из каменноугольной смолы, образующейся как побочный продукт коксохимического производства. Каменноугольную смолу обрабатывали щелочами, а, как вам известно, водные растворы щелочей взаимодействуют с фенолом с образованием фенолятов. Затем феноляты обрабатывали минеральными кислотами и получали фенол. Схематически процесс экстрагирования фенола из каменноугольной смолы можно представить так:
каменноугольная смола
Фенол можно получить, используя в качестве исходного вещества бензол. При хлорировании бензола сначала получают хлорбензол, затем хлорбензол под действием водного раствора гидроксида натрия дает фенолят натрия, который в реакции с минеральными кислотами превращается в фенол:
Этот способ получения фенола в настоящее время практически не используется как технически устаревший и экономически нецелесообразный. Однако знакомство с ним представляет интерес как пример генетической связи между углеводородами, галогенпроизводными и гидроксилпроизводными (фенолами).
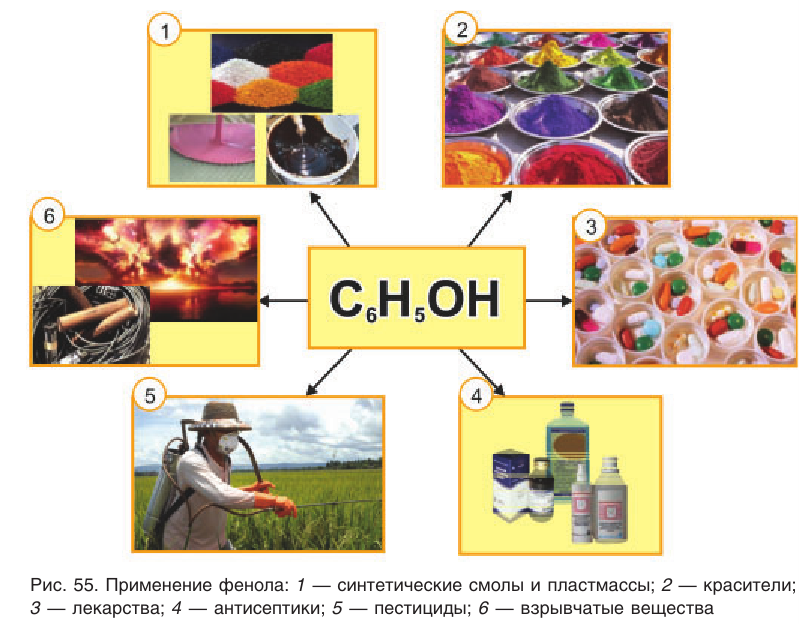
Применение: Фенол и продукты, получаемые на его основе, находят широкое применение (рис. 55). Практически половина производимого фенола расходуется на синтез фенолформальдегидных смол. Полимеры на основе этих смол применяются для изготовления лаков и красок, пластмассовых изделий, устойчивых к действию кислот и щелочей, нагреванию. Из пластмасс на основе фенолформальдегидных смол изготовляют важные детали электро- и радиоприборов, аппаратуры, используемой для работы при высокой температуре и в агрессивных средах. Клеи, полученные на основе фенолформальдегидных смол, надежно соединяют детали, изготовленные из самых различных веществ, сохраняя высокую прочность соединения.
Фенол служит исходным веществом для получения многих лекарственных препаратов, например аспирина, красителей, пестицидов, антисептиков. Он используется в генной инженерии и молекулярной биологии в качестве средства для очистки и выделения молекул ДНК.
Тринитрофенол (пикриновая кислота) находит применение в производстве взрывчатых веществ.
Гидрохинон применяется в фотографии в качестве проявителя, так как он очень легко окисляется.
Пирокатехин используется для получения адреналина — гормона, вырабатываемого надпочечниками.
Резорцин применяется наружно как антисептик при кожных заболеваниях в виде водных и спиртовых растворов; в производстве красителей, стабилизаторов и пластификаторов полимеров.
Фенол и его производные — ядовитые вещества, очень опасные для человека, животных и растительных организмов. Вдыхание паров фенола может привести к ожогам дыхательных путей и последующему отеку легких. При попадании фенола на кожу образуются химические ожоги. Фенол не теряет летучих свойств даже в составе пластмасс, вот поэтому во многих странах мира запрещено производство предметов быта и детских игрушек с использованием фенопластов, представляющих опасность для здоровья людей.
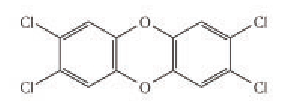
В составе отходов производства могут содержаться чрезвычайно ядовитые вещества, например диоксин:
Чтобы предотвратить их попадание в окружающую среду, применяются различные физические и химические методы очистки.
Фенол в основном получают в процессе органического синтеза кумольным методом.
Фенол и его производные применяются в качестве исходных веществ для производства синтетических смол и пластмасс, синтеза красителей, лекарств и многих других ценных продуктов.
- Альдегиды в химии
- Карбоновые кислоты в химии
- Сложные эфиры в химии
- Жиры в химии
- Насыщенные углеводороды
- Ненасыщенные углеводороды
- Ароматические углеводороды
- Спирты в химии
-
Предельные спирты
-
Фенолы
-
Альдегиды
-
Карбоновые кислоты
-
Жиры
-
Углеводы
Фенолы
Фенолы – кислородсодержащие ароматические соединения, в молекулах которых содержится одна или несколько гидроксильных
групп (OH), присоединенных к бензольному кольцу.
Номенклатура фенолов
Нумерацию атомов углерода в молекуле фенола начинают в такой последовательности, чтобы заместители получили наименьшие
номера (идут кратчайшим путем). В основе названия принято сохранять тривиальное название “фенол”.
Напомню, что гидроксильная группа является ориентантом I порядка (орто-, пара-ориентант). Поэтому реакции галогенирования,
нитрования протекают в орто- и пара-положениях.
Получение фенолов
- Гидролиз галогенбензолов
- Кумольный способ
При гидролизе галогенбензолов происходит обмен: гидроксогруппа встает на место атома галогена.

Этим способом получают 95% всего производимого фенола. В ходе этой реакции кумол (изопропилбензол) подвергают окислению,
в результате получается фенол и ацетон.

Химические свойства фенолов
- Кислотные свойства
- Галогенирование
- Реакции с кислотами
- Гидрирование
- Поликонденсация фенолов с формальдегидом
Щелочные металлы (Li, Na, K) способны вытеснять водород из фенолов с образованием солей – фенолятов.
В отличие от алифатических одноатомных спиртов, фенолы способны вступать в реакцию с щелочами (KOH, LiOH, NaOH)

Реакция фенола с бромной водой является качественной: в ходе нее выпадает белая взвесь – осадок
трибромфенола.
Реакция между фенолом и азотной кислотой происходит по типу замещения. В бензольном кольце появляется новый радикал –
нитрогруппа. Важно учитывать, что OH группа фенола является ориентантом I порядка: замещение идет в орто-, пара-положении.

При гидрировании разрываются двойные связи бензольного кольца, образуется циклогексанол.

В промышленности получила широкое распространение реакция поликонденсации фенола с формальдегидом, приводящая к образованию
смолообразных полимеров (фенолформальдегидные смолы) и воды.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Фенолы
1. В отличие от предельных одноатомных спиртов, фенолы реагируют с
Na
NaOH
CH3COOH
HCOOH
В отличие от предельных одноатомных спиртов, фенолы реагируют с щелочами, например NaOH.
2. Качественной реакцией на фенол является реакция с
Азотистой кислотой
Азотной кислотой
Натрием
Бромной водой
Качественной реакцией на фенол является реакция c бромной водой.
3. В результате кумольного синтеза фенола, помимо фенола, получают
Ацетон
Этан
Ацетилен
Пропадиен
В результате кумольного синтеза фенола, помимо фенола, получают ацетон (пропанон-2)
4. Гидроксогруппа в молекуле фенола вступает как
Ориентант II порядка
Ориентант I порядка
Гидроксогруппа в молекуле фенола вступает как ориентант I порядка.
5. Фенол с метаналем вступает в реакцию
Гидратации
Поликонденсации
Дегидрирования
Дегидратации
Фенол с метаналем вступает в реакцию поликонденсации, в результате которой получают фенолформальдегидную смолу.