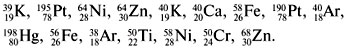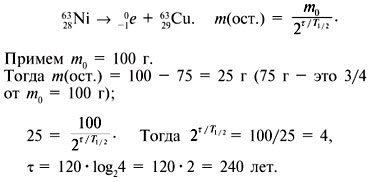В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
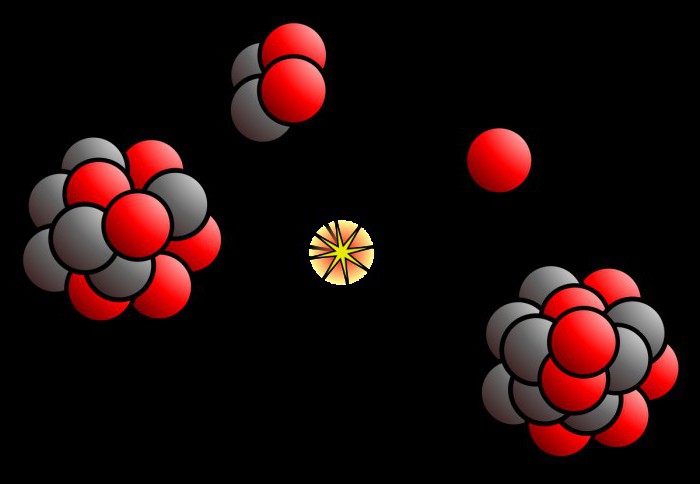
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Некоторые элементы имеют только один природный изотоп, а другие имеют два, три или более. Если вам необходимо различать различные изотопы элемента, вы можете представить каждый из них с помощью простого вида обозначения, в котором используются массовое число, атомный символ и атомный номер элемента. Это обозначение очень легко выучить, хотя немного практики никогда не повредит. Вот как можно написать изотопы для разных элементов.
-
Помните, что массовое число – это просто число протонов плюс количество нейтронов.
Найдите элемент, который вы хотите изучить, в периодической таблице и скопируйте его символ. Символом углерода, например, является заглавная буква C.
Найдите атомный номер или номер протона для вашего элемента. Это дает вам количество протонов в его ядре. Это важное число появляется непосредственно над символом для элемента, и оно всегда будет целым числом. Углерод, например, имеет атомный номер 6.
Напишите атомный номер как индекс, непосредственно предшествующий символу для вашего элемента. Нажмите на ссылку под разделом Ресурсы, если вы хотите увидеть, как это выглядит.
Запишите массовое число для вашего изотопа в виде верхнего индекса, непосредственно предшествующего символу для элемента. Другими словами, массовое число идет прямо над числом протонов.
подсказки
Все мы много раз слышали слово «изотоп», и у некоторых оно прочно ассоциируется с чем-то радиоактивным, применяемым в атомных бомбах. Между тем, довольно заумные объяснения во всяких научных изданиях ясности не добавляют. Поэтому попробуем объяснить что такое изотоп примитивным языком.
Ясное дело, химикам и физикам это лучше не читать. Объяснения в статье примитивные, со множеством допущений, рассчитанные на людей, далеких от науки.
Итак, изотоп. Лучше всего рассматривать его на примере водорода – самого распространенного во Вселенной элемента, занимающего первый атомный номер в периодической таблице.
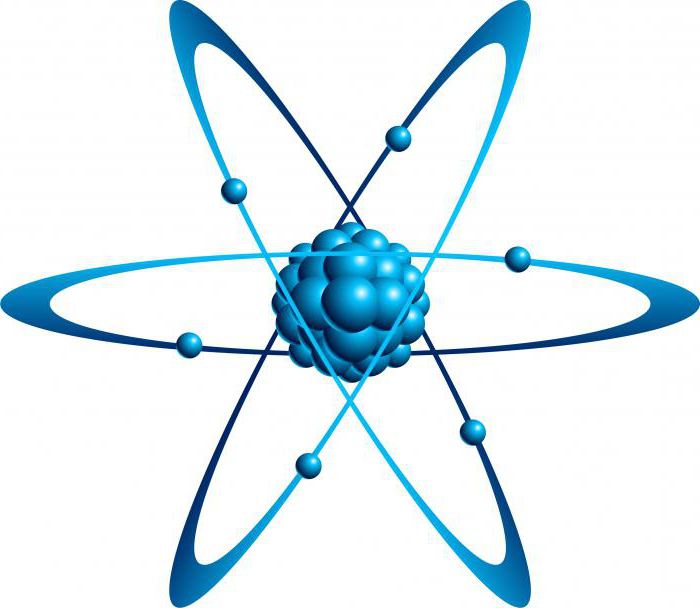
Когда-то давно атом считался неделимым элементом (атом в переводе с греческого и есть «неделимый»). Однако в конце XIX века учеными были обнаружены субатомные частицы. К ним относятся протоны, электроны и нейтроны. Было определено, что атом состоит из ядра, которое в свою очередь состоит из протонов и нейтронов, вокруг которого вращаются электроны (они, конечно, не вращаются, но мы объясняем просто). Атомный номер в периодической таблице показывает как раз число протонов. Выглядит атом вот так:
Протоны имеют положительный заряд, электроны – отрицательный, а нейтроны – нейтральны. Поэтому атом электрически нейтрален тогда, когда число протонов и электронов совпадает. В противном случае этот атом будет называться ионом. Протоны и нейтроны в ядре связаны сильным взаимодействием – одним из самых сильных в природе.
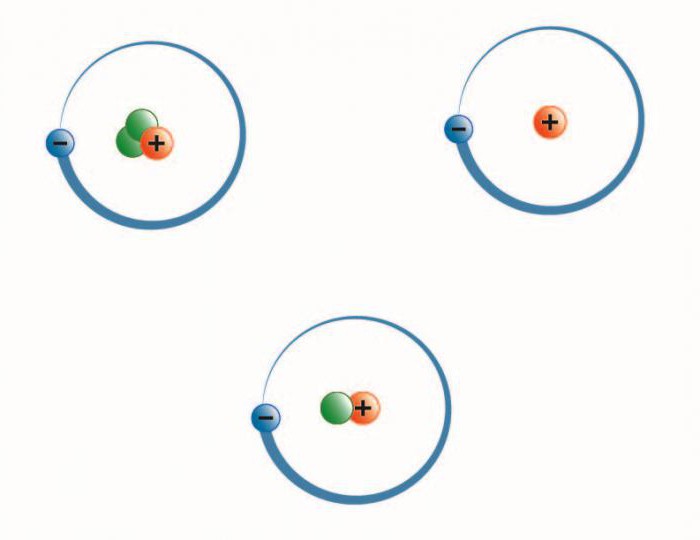
Мы договорились рассматривать изотопы на примере водорода. Водород выглядит намного проще, чем верхний рисунок: он имеет один-единственный протон, вокруг которого по орбите движется электрон (даже нейтрона у него нет):
Изотопы – это те вещества, у которых атомы имеют одинаковое число протонов и электронов, а отличаются лишь числом нейтронов. Атомный номер элемента при этом не меняется, ведь число протонов остается то же самое. Но меняется массовое число – так как нейтроны добавляют массу атому.
Давайте добавим к нашему простейшему водороду один нейтрон. Теперь водород выглядит так:
С точки зрения химика ничего не изменилось, остался прежний водород с его химическими свойствами. И остался этот наш водород по-прежнему в первой ячейки периодической системы. А вот с физической точки зрения есть большая разница: это самый настоящий изотоп. С точки зрения изотопов простейший водород (без нейтрона) также является изотопом и называется протием. Водород с одним нейтроном называется дейтерием, а с двумя нейтронами – тритием:
Тритий нестабилен и распадается в течение 12,3 лет. Изотопы водорода с большим количеством нейтронов (квадий, пентий и пр.) в природе устойчиво не существуют, так как распадаются за мельчайшие доли секунды.
Кроме водорода множество других химических элементов имеют изотопы. Они бывают радиоактивные (в которых ядра атомов крайне нестабильны и распадаются с испусканием частиц), а бывают стабильные, которые распадаются миллионы лет. На сегодня известно более 2000 нестабильных изотопов и около 270 стабильных. Атомное ядро не может содержать произвольное количество нейтронов, делающих вещество изотопом, поэтому количество изотопов не бесконечно.
Для чего нам нужны изотопы? Для огромного количества самых разных задач, в том числе биологических, агрохимических, медицинских, научных. Так, например, наверняка все слышали про радиоуглеродный анализ, позволяющий определить возраст биологических останков. Дело в том, что один из изотопов углерода 14С содержится в большом количестве в атмосфере, имеет период полураспада 5600 лет и активно участвует в углеродном обмене со всеми живыми организмами. После гибели организма данный изотоп начинает постепенно распадаться. Зная примерное содержание изотопа в организме и измерив его активность можно с большой точностью определить время смерти организма.
Широко применяются изотопы и в медицинских средствах инструментальной диагностики.
Разумеется, изотопы применяются в ядерном оружии. Например, в водородной бомбе происходит практически мгновенная реакция синтеза уже упомянутых дейтерия и трития в более тяжелые элементы.
Итак, что необходимо запомнить? Что изотопы – это вещества, в атомном ядре которого находится различное количество нейтронов.
Ещё древние философы высказывали предположение, что материя строится из атомов. Однако о том, что сами «кирпичики» мироздания состоят из мельчайших частиц, учёные начали догадываться лишь на стыке XIX и XX веков. Опыты, доказывающие это, произвели в науке в своё время настоящую революцию. Именно количественное соотношение составных частей отличает один химический элемент от другого. Каждому из них отведено своё место в Периодической системе Менделеева согласно порядковому номеру. Но существуют разновидности атомов, занимающие в таблице одни и те же клетки, несмотря на различие в массе и свойствах. Почему это так и о том, что такое изотопы в химии, будет рассказано далее.
Атом и его частицы
Исследуя структуру материи посредством бомбардировки альфа-частицами, Э. Резерфорд доказал в 1910 году, что основное пространство атома заполнено пустотой. И только в центре находится ядро. Вокруг него по орбиталям двигаются отрицательные электроны, составляя оболочку этой системы. Так была создана планетарная модель «кирпичиков» материи.
Что такое изотопы? Вспомните из курса химии, что ядро тоже имеет сложное строение. Оно состоит из положительных протонов и не имеющих заряда нейтронов. Количество первых определяет качественные характеристики химического элемента. Именно число протонов отличает вещества друг от друга, наделяя их ядра определённым зарядом. И по этому признаку им присваивается порядковый номер в таблице Менделеева. Но количество нейтронов у одного и того же химического элемента дифференцирует их на изотопы. Определение в химии данному понятию поэтому можно дать следующее. Это разновидности атомов, отличающиеся по составу ядра, обладающие одинаковым зарядом и порядковым номеров, но имеющие разные массовые числа, ввиду различий в количестве нейтронов.
Обозначения
Изучая химию в 9 классе и изотопы, школьники узнают о принятых условных обозначениях. Буквой Z отмечается заряд ядра. Это цифра совпадает с количеством протонов и поэтому является их показателем. Сумма этих элементов с нейтронами, отмечаемыми значком N, составляет А – массовое число. Семейство изотопов одного вещества, как правило, обозначается значком того химического элемента, которых в таблице Менделеева наделяется порядковым номером, совпадающим с числом протонов в нём. Левый верхний индекс, добавляемый к указанному значку соответствует массовому числу. К примеру, 238U. Заряд элемента (в данном случае урана, отмеченного порядковым номером 92) обозначается похожим индексом снизу.
Зная эти данные, легко можно подсчитать количество нейтронов у данного изотопа. Оно равно массовому числу за вычетом порядкового номера: 238 – 92 = 146. Количество нейтронов могло бы быть меньше, от этого данный химический элемент не перестал бы оставаться ураном. Следует заметить, что чаще всего у других, более простых, веществ число протонов и нейтронов приблизительно совпадает. Подобные сведения помогают понять, что такое изотоп в химии.
Нуклоны
Индивидуальностью определённый элемент наделяет именно число протонов, а количество нейтронов на неё никаким образом не влияет. Но атомная масса составляется из этих двух указанных элементов, имеющих общее наименование «нуклоны», представляя собой их сумму. Однако этот показатель не зависит от числа электронов, формирующих отрицательно заряженную оболочку атома. Почему? Стоит только сравнить.
Доля массы протона в атоме велика и составляет приблизительно 1 а. е. м. или 1,672 621 898(21)·10-27кг. Нейтрон близок к показателям этой частицы (1,674 927 471(21)·10-27кг). А вот масса электрона в тысячи раз меньше, считается ничтожной и не учитывается. Вот почему, зная верхний индекс элемента в химии, состав ядра изотопов узнать несложно.
Изотопы водорода
Изотопы некоторых элементов настолько известны и распространены в природе, что получили собственные наименования. Ярким и наиболее простым примером тому может служить водород. В естественных условиях он содержится в своей самой распространённой разновидности протия. Этот элемент имеет массовое число 1, а ядро его состоит из одного протона.
Так что такое изотопы водорода в химии? Как известно, атомы этого вещества имеют первый номер в таблице Менделеева и соответственно наделены в природе зарядовым числом 1. Но количество нейтронов в ядре атома у них различно. Дейтерий, являясь тяжёлым водородом, помимо протона имеет в составе ядра ещё одну частицу, то есть нейтрон. В результате это вещество проявляет собственные физические свойства, в отличие от протия, обладая собственным весом, температурой плавления и кипения.
Тритий
Сложнее всех устроен тритий. Это сверхтяжёлый водород. В соответствии с определением изотопов в химии, он имеет зарядовое число 1, но массовое число 3. Его часто называют тритоном, потому что помимо одного протона, он имеет в составе ядра два нейтрона, то есть состоит из трёх элементов. Наименование этого элемента, открытого в 1934 году Резерфордом, Олифантом и Хартеком, было предложено ещё до его выявления.
Это неустойчивое вещество, проявляющее радиоактивные свойства. Ядро его обладает способностью расщепляться с выделение бета-частицы и электронного антинейтрино. Энергия распада данного вещества не очень велика и составляет 18,59 кэВ. Поэтому подобная радиация не является для человека слишком опасной. От неё способна защитить обыкновенная одежда и хирургические перчатки. А получаемый с пищей этот радиоактивный элемент быстро выводится из организма.
Изотопы урана
Гораздо опаснее оказываются различные типы урана, которых на сегодняшний день науке известно 26. Поэтому, рассказывая о том, что такое изотопы в химии, невозможно не упомянуть об этом элементе. Несмотря на разнообразие видов урана, в природе его изотопов встречается всего три. К ним относятся 234U, 235U, 238U. Первый из них, обладая подходящими свойствами, активно применяется как топливо в ядерных реакторах. А последний – для производства плутония-239, который сам, в свою очередь, незаменим как ценнейшее топливо.
Каждый из радиоактивных элементов характеризуется собственным периодом полураспада. Это отрезок времени, в течение которого вещество расщепляется в отношении ½. То есть в результате этого процесса количество сохранившейся части вещества вдвое уменьшается. Этот отрезок времени для урана огромен. К примеру, для изотопа-234 он исчисляется в 270 тысячелетий, а для двух других указанных разновидностей он гораздо значительнее. Рекордный период полураспада – у урана-238, продолжающийся миллиарды лет.
Нуклиды
Не каждый из видов атома, характеризующихся собственным и строго определённым числом протонов и электронов, настолько стабилен, чтобы существовать хоть сколько-нибудь продолжительный период, достаточный для его изучения. Те из них, которые обладают относительной устойчивостью, называются нуклидами. Стабильные образования такого рода радиоактивному распаду не подвергаются. Нестабильные называются радионуклидами и тоже, в свою очередь, делятся на короткоживущие и долгожители. Как известно из уроков химии 11 класса о строении атомов изотопов, наибольшим числом радионуклидов обладают осмий и платина. По одному стабильному имеют кобальт и золото, а наибольшее количество устойчивых нуклидов у олова.
Вычисление порядкового номера изотопа
Теперь постараемся обобщить сведения, описанные ранее. Поняв, что такое изотопы в химии, пришло время выяснить, как можно использовать полученные знания. Рассмотрим это на конкретном примере. Допустим, известно, что некоторый химический элемент обладает массовым числом 181. При этом оболочка атома данного вещества содержит в себе 73 электрона. Как можно, воспользовавшись таблицей Менделеева, узнать название данного элемента, а также число протонов и нейтронов в составе его ядра?
Приступим к решению задачи. Определить наименование вещества можно, зная его порядковый номер, который соответствует количеству протонов. Так как число положительных и отрицательных зарядов в атоме равны, то оно составляет 73. Значит, это тантал. При том, общее количество нуклонов в сумме составляет 181, а значит, протонов у данного элемента 181 – 73 = 108. Достаточно просто.
Изотопы галлия
Элемент галлий в периодической системе имеет порядковый номер 71. В природе у этого вещества есть два изотопа – 69Ga и 71Ga. Как определить процентное соотношение разновидностей галлия?
Решение задач на изотопы по химии почти всегда связано с информаций, которую можно получить из таблицы Менделеева. В этот раз следует поступить аналогичным образом. Определим из указанного источника среднюю атомную массу. Она равна 69,72. Обозначив за x и y количественное соотношение первого и второго изотопа, примем сумму их равной 1. А значит, в виде уравнения это запишется: x + y = 1. Отсюда следует, что 69x + 71y = 69,72. Выразив y через x и подставив первое уравнение во второе, получаем, что x = 0,64, а y = 0,36. Это значит, что 69Ga содержится в природе 64 %, а процентное соотношение 71Ga составляет 34 %.
Превращения изотопов
Радиоактивное расщепление изотопов с трансформацией их в другие элементы разделяется на три основных типа. Первым из них является альфа-распад. Он происходит с испусканием частицы, представляющей собой ядро атома гелия. То есть это образование, состоящие из совокупности пар нейтронов и протонов. Поскольку количество последних определяет зарядовое число и номер атома вещества в периодической системе, то в результате этого процесса происходит качественное превращение одного элемента в другой, а в таблице он сдвигается влево на две клетки. При этом массовое число элемента уменьшается на 4 единицы. Это мы знаем из разделов химии о строении атомов изотопов.
При потере ядром атома бета-частицы, по сути представляющей собой электрон, меняется его состав. Один из нейтронов трансформируется в протон. Это значит, что качественные характеристики вещества вновь меняются, а элемент сдвигается в таблице на одну клетку вправо, практически не теряя при этом в массе. Обычно подобное превращение сопряжено с электромагнитным гамма-излучением.
Превращение изотопа радия
Вышеизложенные сведения и знания из химии 11 класса об изотопах снова помогают решать практические задачи. К примеру, следующие: 226Ra при распаде превращается в химический элемент IV группы, обладающий массовым числом 206. Сколько альфа- и бета-частиц при этом он должен потерять?
Учитывая изменения в массе и группу дочернего элемента, воспользовавшись таблицей Менделеева, легко определить, что образовавшимся при расщеплении изотопом будет свинец с зарядом 82 и массовым числом 206. А учитывая зарядовое число этого элемента и исходного радия, следует предположить, что ядро его потеряло пять альфа-частиц и четыре бета-частицы.
Использование радиоактивных изотопов
Всем прекрасно известно, какой вред живым организмам может нанести радиоактивное излучение. Однако свойства радиоактивных изотопов бывают для человека полезны. Они с успехом применяются во многих отраслях промышленности. С их помощью возможно обнаружить утечку в инженерных и строительных сооружениях, подземных трубопроводах и нефтепроводах, накопительных баках, теплообменниках на электростанциях.
Указанные свойства активно используются также в научных экспериментах. К примеру, муха цеце является переносчиком многих серьёзных заболеваний для человека, скота и домашних животных. В целях предотвращения подобного самцов этих насекомых стерилизуют посредством слабого радиоактивного излучения. Изотопы также бывают незаменимы при изучении механизмов некоторых химических реакций, ведь атомами данных элементов можно метить воду и другие вещества.
При биологических исследованиях часто также используются меченые изотопы. К примеру, именно таким образом было установлено, как фосфор влияет на почву, рост и развитие культурных растений. С успехом свойства изотопов применяются и в медицине, что позволило лечить раковые опухоли и другие тяжёлые заболевания, определять возраст биологических организмов.
И.В.ТРИГУБЧАК
Пособие-репетитор по химии
ЗАНЯТИЕ 5
10-й класс (первый год обучения)
Продолжение. Начало см. в № 22/2005; 1, 2, 3/2006
Периодический закон и система
химических элементов Д.И.Менделеева
План

История открытия периодического закона и
системы химических элементов Д.И.Менделеева.
2. Периодический закон в формулировке
Д.И.Менделеева.
3. Современная формулировка периодического
закона.
4. Значение периодического закона и системы
химических элементов Д.И.Менделеева.
5. Периодическая система химических элементов
– графическое отражение периодического закона.
Строение периодической системы: периоды, группы,
подгруппы.
6. Зависимость свойств химических элементов от
строения их атомов.
1 марта (по новому стилю) 1869 г. считается датой
открытия одного из важнейших законов химии –
периодического закона. В середине XIX в. было
известно 63 химических элемента, и возникла
потребность в их классификации. Попытки такой
классификации предпринимали многие ученые
(У.Одлинг и Дж.А.Р.Ньюлендс, Ж.Б.А.Дюма и
А.Э.Шанкуртуа, И.В.Деберейнер и Л.Ю.Мейер), но лишь
Д.И.Менделееву удалось увидеть определенную
закономерность, расположив элементы в порядке
возрастания их атомных масс. Эта закономерность
имеет периодический характер, поэтому Менделеев
сформулировал открытый им закон следующим
образом: свойства элементов, а также формы и
свойства их соединений находятся в
периодической зависимости от величины атомной
массы элемента.
 |
Д.И.Менделеев
|
В системе химических элементов,
предложенной Менделеевым, был ряд противоречий,
которые сам автор периодического закона
устранить не смог (аргон–калий, теллур–йод,
кобальт–никель). Лишь в начале XX в., после
открытия строения атома, был объяснен физический
смысл периодического закона и появилась его
современная формулировка: свойства элементов,
а также формы и свойства их соединений находятся
в периодической зависимости от величины заряда
ядер их атомов.
Такую формулировку подтверждает и наличие
изотопов, химические свойства которых одинаковы,
хотя атомные массы различны.
Периодический закон – один из основных законов
природы и важнейший закон химии. С открытия этого
закона начинается современный этап развития
химической науки. Хотя физический смысл
периодического закона стал понятен только после
создания теории строения атома, сама эта теория
развивалась на основе периодического закона и
системы химических элементов. Закон помогает
ученым создавать новые химические элементы и
новые соединения элементов, получать вещества с
нужными свойствами. Сам Менделеев предсказал
существование 12 элементов, которые в то время еще
не были открыты, и определил их положение в
периодической системе. Свойства трех из этих
элементов он подробно описал, и при жизни ученого
эти элементы были открыты («экабор» – галлий,
«экаалюминий» – скандий, «экасилиций» –
германий). Кроме того, периодический закон имеет
большое философское значение, подтверждая
наиболее общие законы развития природы.
Графическим отражением периодического закона
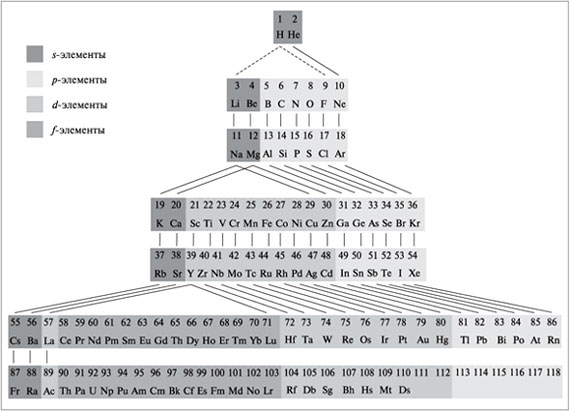
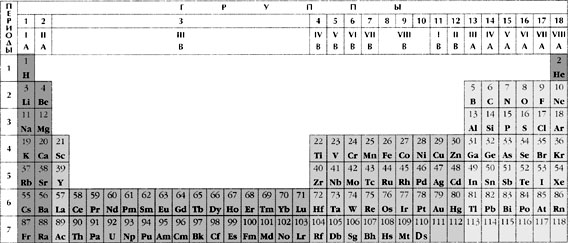
является периодическая система химических
элементов Менделеева. Существует несколько форм
периодической системы (короткая, длинная,
лестничная (предложена Н.Бором),
спиралеобразная). В России наибольшее
распространение получила короткая форма.
Современная периодическая система содержит 110
открытых на сегодняшний день химических
элементов, каждый из которых занимает
определенное место, имеет свой порядковый номер
и название. В таблице выделяют горизонтальные
ряды – периоды (1–3 – малые, состоят из одного
ряда; 4–6 – большие, состоят из двух рядов; 7-й
период – незавершенный). Кроме периодов выделяют
вертикальные ряды – группы, каждая из которых
подразделяется на две подгруппы (главную – а и
побочную – б). Побочные подгруппы содержат
элементы только больших периодов, все они
проявляют металлические свойства. Элементы
одной подгруппы имеют одинаковое строение
внешних электронных оболочек, что обусловливает
их схожие химические свойства.
 |
Лестничная форма периодической
|
Период – это последовательность
элементов (от щелочного металла до инертного
газа), атомы которых имеют одинаковое число
энергетических уровней, равное номеру периода.
 |
Длинная форма периодической системы
|
Главная подгруппа – это
вертикальный ряд элементов, атомы которых имеют
одинаковое число электронов на внешнем
энергетическом уровне. Это число равно номеру
группы (кроме водорода и гелия).
Все элементы в периодической системе
разделяются на 4 электронных семейства (s-, p-,
d-,
f-элементы) в зависимости от того, какой
подуровень в атоме элемента заполняется
последним.
Побочная подгруппа – это вертикальный ряд d-элементов,
имеющих одинаковое суммарное число электронов
на d-подуровне предвнешнего слоя и s-подуровне
внешнего слоя. Это число обычно равно номеру
группы.
Важнейшими свойствами химических элементов
являются металличность и неметалличность.
Металличность – это способность атомов
химического элемента отдавать электроны.
Количественной характеристикой металличности
является энергия ионизации.
Энергия ионизации атома – это количество
энергии, которое необходимо для отрыва электрона
от атома элемента, т. е. для превращения атома в
катион. Чем меньше энергия ионизации, тем легче
атом отдает электрон, тем сильнее металлические
свойства элемента.
Неметалличность – это способность атомов
химического элемента присоединять электроны.
Количественной характеристикой неметалличности
является сродство к электрону.
Сродство к электрону – это энергия, которая
выделяется при присоединении электрона к
нейтральному атому, т. е. при превращении атома в
анион. Чем больше сродство к электрону, тем легче
атом присоединяет электрон, тем сильнее
неметаллические свойства элемента.
Универсальной характеристикой металличности и
неметалличности является
электроотрицательность (ЭО) элемента.
ЭО элемента характеризует способность его
атомов притягивать к себе электроны, которые
участвуют в образовании химических связей с
другими атомами в молекуле.
Чем больше металличность, тем меньше ЭО.
Чем больше неметалличность, тем больше ЭО.
При определении значений относительной ЭО по
шкале Полинга за единицу принята ЭО атома лития
(ЭО(Li) = 1); самым электроотрицательным элементом
является фтор (ЭО(F) = 4).
В малых периодах от щелочного металла к
инертному газу:
• заряд ядер атомов увеличивается;
• число энергетических уровней не изменяется;
• число электронов на внешнем уровне
увеличивается от 1 до 8;• радиус атомов уменьшается;
• прочность связи электронов внешнего слоя с
ядром увеличивается;
• энергия ионизации увеличивается;
• сродство к электрону увеличивается;
• ЭО увеличивается;
• металличность элементов уменьшается;
• неметалличность элементов увеличивается.
Все d-элементы данного периода похожи по
своим свойствам – все они являются металлами,
имеют мало различающиеся радиусы атомов и
значения ЭО, поскольку содержат одинаковое число
электронов на внешнем уровне (например, в 4-м
периоде – кроме Cr и Cu).
В главных подгруппах сверху вниз:
• число энергетических уровней в атоме
увеличивается;• число электронов на внешнем уровне
одинаково;• радиус атомов увеличивается;
• прочность связи электронов внешнего уровня с
ядром уменьшается;• энергия ионизации уменьшается;
• сродство к электрону уменьшается;
• ЭО уменьшается;
• металличность элементов увеличивается;
• неметалличность элементов уменьшается.
Тест по теме
«Периодический закон и система химических
элементов Д.И.Менделеева»
(Возможно несколько правильных
ответов)

Среди всех элементов главной подгруппы I группы
элемент литий обладает:
а) наиболее выраженными металлическими
свойствами;б) самой маленькой плотностью;
в) самой большой относительной атомной массой;
г) наименьшим радиусом атома.
2. Гипотетическая формула высшего оксида
115-го элемента периодической системы может иметь
вид:
а) ЭО2; б) Э2О5; в) ЭО4; г) Э2О115.
3. Порядковый номер элемента с наибольшей
электроотрицательностью в 4 группе
периодической системы:
а) 6; б) 72; в) 82; г) 12.
4. Сколько энергетических уровней заполнено
электронами в ионе калия?
а) 4; б) 3; в) 6; г) 5.
5. При сгорании 1,86 г органического вещества
образовалось 3,96 г углекислого газа и 0,54 г воды.
Сколько всего атомов содержит молекула этого
соединения, если известно, что его молярная масса
меньше 200 г/моль?
а) 3; б) 2; в) 15; г) 13.
6. В каких рядах химические элементы
перечислены не в порядке уменьшения их атомных
радиусов?
а) Ca, Mg, Be; б) S, Cl, Br;
в) Li, Na, K; г) B, Be, Li.
7. В порядке возрастания энергии ионизации
расположены следующие элементы:
а) Na, Mg, Al, Si; б) Na, Mg, Ca, Si;
в) Na, Ca, Mg, Si; г) Si, Al, Mg, Na.
8. По происхождению (этимологии) названий
«лишним» в перечне элементов будет:
а) селен; б) теллур; в) ниобий; г) церий.
9. Одинаковое по абсолютной величине, но
разное по знаку значение степени окисления в
летучем водородном соединении и в высшем оксиде
имеет элемент:
а) бор; б) азот; в) сера; г) углерод.
10. Свойства высших оксидов элементов 3-го
периода изменяются следующим образом:
а) амфотерные, основные, кислотные;
б) основные, кислотные, амфотерные;
в) основные, амфотерные, кислотные;
г) кислотные, амфотерные, основные.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б, г | б | а | б | г | б, в, г | а, в | в | г | в |
Задачи на изотопы
Уровень А

Рассчитать изотопный состав (в %) водорода
(средняя относительная атомная масса Ar
= 1,008) и лития (Ar = 6,9), предполагая, что
каждый элемент состоит только из двух изотопов,
относительные атомные массы которых отличаются
на единицу.
Ответ. Водород: 1Н – 99,2% и 2Н
– 0,8%;
литий: 6Li – 10% и 7Li – 90%.
2. Относительная атомная масса природного
водорода составляет 1,00797. Этот водород является
смесью изотопов протия (Ar = 1,00782) и
дейтерия (Ar = 2,0141). Какой процент
дейтерия в природном водороде?
Ответ. 0,015%.
3. Среди приведенных символов элементов
укажите изотопы и изобары:
Ответ. У изотопов одинаковые
химические символы,
у изобаров одинаковые атомные массы.
4. Природный литий (Ar = 6,9) состоит
из изотопов с массовыми числами 6 и 7. Сколько
процентов первого изотопа* он
содержит?
Ответ. 10%.
5. Масса атома изотопа магния равна 4,15•10–23
г. Определите число нейтронов, которое содержит
ядро этого атома.
Ответ. 13.
6. Медь имеет два изотопа с массовыми
числами 63 и 65. Массовая доля их в природной меди составляет
соответственно 73% и 27%. На основании этих данных
рассчитайте среднюю относительную атомную массу
природной меди.
Дано:
(63Cu) = 73%,
(65Cu) = 27%.
Найти:
Ar(Cu).
Решение
Пусть m(образца) = 100 г, тогда m(63Cu) = 73
г; m(65Cu) = 27 г.
Ответ. 63,54.
7. Средняя относительная атомная масса
природного хлора равна 35,45. Вычислите массовые
доли двух его изотопов, имеющих массовые числа 35
и 37.
Ответ. 77,5% и 22,5%.
8. Определите относительную атомную массу
бора, если известны массовые доли его изотопов
(10В) = 19,6% и
(11В) = 80,4%.
Ответ. 10,804.
9. Литий состоит из двух природных изотопов
с массовыми числами 6 (1 = 7,52%) и
7 (2 = 92,48%).
Рассчитайте относительную атомную массу лития.
Ответ. 6,9248.
10. Рассчитайте относительную атомную массу
кобальта, если известно, что в природе существуют
два его изотопа: с массовыми числами 57 (1 = 0,17%) и 59 (
2 = 99,83%).
Ответ. 58,9966.
11. Относительная атомная масса бора
составляет 10,811. Определите процентное
содержание в природном боре изотопов с массовыми
числами 10 и 11.
Ответ. 18,9% и 81,1%.
12. Галлий имеет два природных изотопа с
массовыми числами 69 и 71. В каком количественном
соотношении находятся между собой числа атомов
этих изотопов, если относительная атомная масса
элемента 69,72.
Ответ. 1,78:1.
13. Природный бром имеет два изотопа с
массовыми числами 79 и 81. Относительная атомная
масса брома 79,904. Определите массовую долю
каждого из изотопов в природном броме.
Ответ. 54,8% и 45,2%.
Уровень Б
1. Кремний имеет три стабильных изотопа – 30Si
(3,05 %(мол.)), 29Si и 28Si. Вычислите
содержание (в %(мол.)) самого распространенного
изотопа кремния. Как будут отличаться молярные
массы диоксида кремния, имеющего разный
изотопный состав, если учесть, что кислород имеет
три стабильных изотопа с массовыми числами 16, 17 и
18?
Ответ. 94,55%;
18 видов молекул диоксида кремния.
2. Образец состоит из смеси двух изотопов
одного элемента; 30% составляет изотоп, в ядре
атома которого – 18 нейтронов; 70% составляет
изотоп, в ядре атома которого – 20 нейтронов.
Определите порядковый номер элемента, если
средняя относительная атомная масса элемента в
смеси изотопов составляет 36,4.
Ответ. 17.
3. Химический элемент состоит из двух
изотопов. В ядре атома первого изотопа – 10
протонов и 10 нейтронов. В ядре атома второго
изотопа – нейтронов на 2 больше. На 9 атомов более
легкого изотопа приходится один атом более
тяжелого изотопа. Вычислите среднюю
относительную атомную массу элемента.
Ответ. 20,2.
4. Изотоп 137Cs имеет период полураспада
29,7 лет. 1 г этого изотопа прореагировал со взрывом
с избытком воды. Каков период полураспада цезия в
образовавшемся соединении? Ответ обоснуйте.
Ответ. T1/2 = 29,7 лет.
5. Через сколько лет количество
радиоактивного стронция-90 (период полураспада 27
лет), выпавшего с радиоактивными осадками в
результате ядерного взрыва, станет менее 1,5% от
того количества, которое было обнаружено в
момент после ядерного взрыва?
Ответ. 163,35 лет.
6. В методе меченых атомов радиоактивные
изотопы используют для того, чтобы «проследить
маршрут» некоторого элемента в организме. Так,
пациенту с больной поджелудочной железой вводят
препарат радиоактивного изотопа йода-131
(претерпевает –-распад),
что позволяет врачу проследить за прохождением
йода по организму больного. Напишите уравнение
радиоактивного распада и рассчитайте, через
какое время количество радиоактивного йода,
введенного в организм, уменьшится в 10 раз (период
полураспада 8 сут).
Ответ.
7. Сколько времени потребуется для того,
чтобы три четверти никеля превратились в медь в
результате –-распада,
если период полураспада изотопа 6328Ni
составляет 120 лет?
Дано:
T1/2(6328Ni) = 120 лет.
Найти: .
Решение
Ответ. 240 лет.
8. Найдите массу изотопа 81Sr (период
полураспада 8,5 ч), оставшуюся после 25,5 ч хранения,
если первоначальная масса составляла 200 мг.
Ответ. 25 мг.
9. Вычислите процент атомов изотопа 128I
(период полураспада 25 мин), оставшихся
нераспавшимися после его хранения в течение 2,5 ч.
Ответ. 1,5625%.
10. Период полураспада –-радиоактивного изотопа 24Na
равен 14,8 ч. Напишите уравнение реакции распада и
вычислите, сколько граммов дочернего продукта
образуется из 24 г этого изотопа за 29,6 ч.
Ответ.
11. Изотоп 210Ро, излучающий -частицы, используется в
смеси с бериллием в нейтронных источниках. Через
какое время интенсивность таких источников
уменьшится в 32 раза? Период полураспада изотопа
равен 138 дням.
Статья подготовлена при поддержке сайта www.My-Psyholog.Com.Ua. Современный мир полон стрессов, это может стать причиной нервного срыва или психического расстройства. Помочь справиться с проблемой сможет психолог. Перейдя по ссылке «помощь психолога киев», вы сможете, не отходя от экрана монитора, записаться на прием к практикующему психологу по выгодной цене. Ирина Мельник – высококвалифицированный специалист, который всегда сможет помочь вам и вашему ребенку.
Ответ. 690 сут.
Упражнения на ядерные реакции
1. Сколько – и
–-частиц
должно было потерять ядро 226Ra для получения
дочернего элемента с массовым числом 206,
принадлежащего IV группе периодической системы
элементов? Назовите этот элемент.
Ответ. 5, 4
–,
20682Pb.
2. Ядро атома изотопа 23892U
в результате радиоактивного распада
превратилось в ядро 22688Ra.
Сколько – и
–-частиц
испустило при этом исходное ядро?
Ответ. 3, 2
–.
3. Изотоп 9Be, поглощая одну -частицу и испуская
нейтрон, превращается в изотоп другого элемента.
Какой элемент образуется? Напишите уравнение
ядерной реакции.
Ответ. Образуется изотоп 12С по
уравнению ядерной реакции:
4. Атомы 238U испускают -частицы. Получающиеся при этом
атомы другого элемента испускают
–-частицы,
при этом образуются атомы нового элемента,
испускающие –-частицы.
Определите, изотоп какого элемента образуется в
результате этих последовательных превращений.
Ответ. 23492U.
5. Первой в истории искусственной ядерной
реакцией была реакция изотопа 14N с -частицами,
получаемыми при распаде 210Po. В результате
ядерной реакции азот превратился в изотоп
кислорода 17О. Напишите уравнения
происходящих ядерных превращений.
Ответ. .
* В настоящее время в научной
литературе для обозначения вида атомов с
определенным числом в его ядре протонов и
нейтронов используется термин «нуклид». Нуклиды
одного элемента – это изотопы. Использовать
термин «изотоп» в единственном числе ИЮПАП и
ИЮПАК не рекомендуют. – Прим. ред.