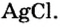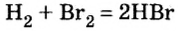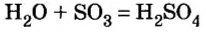Как составлять формулы кислот(по химии)?
Профи
(956),
закрыт
13 лет назад
Бася Барбара
Знаток
(258)
13 лет назад
Они все даны.. Их просто выучить… Соляная-HCl//
По содержанию кислорода
бескислородные (HCl, H2S);
кислородосодержащие (HNO3).
По основности — количество кислых атомов водорода
Одноосновные (HPO3);
Двухосновные (H2SeO4, Азелаиновая кислота) ;
Трёхосновные (H3PO4).
Четырёхосновные (H4СO4).
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH);
По летучести
Летучие (H2S, HCl);
Нелетучие (H2SO4) ;
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
Ирина
Гений
(88042)
13 лет назад
Их вообще-то учат. А состоят они из атомов водорода и кислотного остатка. Валентность водорода – 1. Например, H2SO4 – серная кислота
НЛО
Мыслитель
(9180)
13 лет назад
наименьшее общее кратное 2
H(+)2 SO4(2-)
раставляете сначала заряды ионов, затем находите наименьшее общее кратное и делите например в данном случае (2) разделить на 1 будет два и 2/2= 1 следовательно H2SO4
Алгоритмы составления химических формул
Составление
химических формул для соединений двух
химических элементов в тех случаях,
когда для каждого элемента существует
только одна стехиометрическая валентность.
|
Алгоритм |
Составление |
|
|
Установление |
Аl |
О |
|
Определение |
АIII |
ОII |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
О3 |
|
Составление |
Аl2О3 |
Составление
химических формул для соединений,
которые существуют в водном растворе
в виде ионов.
|
Алгоритм |
Составление |
|
|
Установление |
Аl3+ |
SО42– |
|
Определение |
3 |
2 |
|
Вычисление |
6 |
|
|
Определение |
2 |
3 |
|
Указание числового |
2 |
|
|
Указание |
Аl2 |
(SО4)3 |
|
Составление |
Аl2(SО4)3 |
Написание химических формул
Для
указания в химических формулах
стехиометрических индексов и зарядов
ионов существуют следующие правила.
1. Если
стехиометрический индекс относится к
группе атомов, обозначающие эту группу
химические символы ставятся в скобки:
С3Н5(ОН)3
– в молекуле глицерина содержатся 3
гидроксигруппы;
Ca(NО3)2
– в формульной единице нитрата кальция
содержатся ионы кальция и нитрат-ионы
в соотношении 1 : 2.
2.
Данные о заряде сложного многоатомного
иона в химической формуле относятся ко
всему иону:
SО42–
– сульфат-ион – имеет двухкратный
отрицательный заряд;
NН4+
– ион аммония – имеет одинарный
положительный заряд.
3.
Химическая формула комплексного иона
ставится в квадратные скобки, за которыми
указывается его заряд; она состоит из:
– химического
символа центрального атома;
– химической
формулы лиганда в круглых скобках;
– нижнего
индекса, указывающего число лигандов.
[Fe(CN)6]4–
– гексацианоферрат(II)-ион; в имеющем
четыре отрицательных заряда ионе шесть
лигандов СN–
(цианид-ион) связаны с центральным атомом
FеII
(катион железа Fe2+).
[Cu(NH3)4]2+
–
ион тетраамминмеди (II); в имеющем два
положи-тельных заряда ионе четыре
лиганда NH3
(молекула аммиака) связаны с центральным
атомом меди (ион Сu2+).
4.
Химическая формула воды в гидратах и
кристаллогидратах отделяется точкой
от химической формулы основного
вещества.
CuSO4
· 5H2O
– пентагидрат сульфата меди (II)
(медный купорос).
Классификация неорганических веществ и их свойства
Все
неорганические вещества делятся на
простые и сложные.
Простые
вещества подразделяются на металлы,
неметаллы и инертные газы.
Важнейшими
классами сложных неорганических веществ
являются: оксиды,
основания, кислоты, амфотерные гидрооксиды,
соли.
Оксиды
—
это соединения двух элементов, один из
которых кислород. Общая формула
оксидов:
ЭmOn
где
m
–
число
атомов элемента Э;
n
– число атомов кислорода.
Примеры
оксидов: К2О,
CaO,
SO2,
P2O5
Основания
– это сложные вещества, молекулы которых
состоят из атома металла и одной или
нескольких гидроксидных групп – ОН.
Общая формула оснований:
Me(ОН)y
где у
– число
гидроксидных групп, равное валентности
металла (Me).
Примеры
оснований: NaOH,
Ca(OH)2,
Со(ОН)3
Кислоты
—
это сложные вещества, содержащие атомы
водорода, которые могут замещаться
атомами металла.
Общая
формула кислот
НхАсу
где
Ас – кислотный остаток (от англ., acid
– кислота);
х
– число
атомов водорода, равное валентности
кислотного остатка.
Примеры
кислот: НС1, HNO3,
H2SO4,
H3PO4
Амфотерные
гидроксиды
– это сложные вещества, которые имеют
свойства кислот и свойства оснований.
Поэтому формулы амфотерных гидроксидов
можно записывать в форме оснований
и в форме кислот. Примеры амфотерных
гидроксидов:
Zn(OH)2
= H2ZnO2
Al(OH)3
= H3AlO3
форма
форма
оснований
кислот
Соли
– это сложные вещества, которые являются
продуктами замещения атомов водорода
в молекулах кислот атомами металла или
продуктами замещения гидроксидных
групп в молекулах оснований кислотными
остатками. Например:
|
НСl |
|
NаСl |
|
Са(ОН)2 |
|
Са(NО3)2 |
Состав
нормальных солей выражается общей
формулой:
Мех
(Ас)
у
где х
— число
атомов металла; у
—
число кислотных остатков.
Примеры
солей: K3PO4;
Mg
SO4;
Al2(SO)3;
FeCl3.
Оксиды
|
Название |
= |
“Оксид” |
+ |
Название (в |
+ |
Валентность |
Например:
СО – оксид углерода (II)
– (читается: “оксид углерода два”);
СО2
– оксид углерода (IV);
Fe2O3
– оксид железа (III).
Если
элемент имеет постоянную валентность,
ее в названии оксида не указывают.
Например: Nа2О
– оксид натрия; Аl2О3
– оксид алюминия.
Классификация
Все
оксиды делятся на солеобразующие и
несолеобразующие (или индифферентные).
Несолеобразующие
(индифферентные) оксиды
— это оксиды, которые не образуют
солей при взаимодействии с кислотами
и основаниями. Их немного. Запомните
четыре несолеобразующих оксида: СО,
SiO,
N2O,
NO.
Солеобразующие
оксиды
— это оксиды, которые образуют соли
при взаимодействии с кислотами или
основаниями. Например:
Na2O
+ 2НС1 = 2NaCl
+ Н 2О
оксид
кислота соль
|
SO3 |
+ |
2NaOH |
= |
Na2SO4 |
+ |
Н2О |
|
оксид |
основание |
соль |
Многие
солеобразующие оксиды взаимодействуют
с водой. Продукты взаимодействия оксидов
с водой называются гидратами оксидов
(или гидроксидами). Например:
|
Na2O |
= |
H2O |
+ |
2NaOH |
|
оксид |
гидроксид |
Некоторые
оксиды с водой не взаимодействуют, но
им соответствуют гидроксиды, которые
можно получить косвенным (непрямым)
путем. В зависимости от характера
соответствующих гидроксидов все
солеобразующие оксиды делятся на три
типа: основные, кислотные, амфотерные.
Основные
оксиды
— это оксиды, гидраты которых являются
основаниями. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные |
Основания |
Все
основные оксиды являются оксидами
металлов.
Кислотные
оксиды
— это оксиды, гидраты которых являются
кислотами. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
Кислотные |
Кислоты |
Большинство
кислотных оксидов являются оксидами
неметаллов. Кислотными оксидами
являются также оксиды некоторых металлов
с высокой валентностью. Например:

Амфотерные
оксиды
— это оксиды, которым соответствуют
амфотерные гидроксиды.
Все
амфотерные оксиды являются оксидами
металлов.
Следовательно,
неметаллы
образуют только кислотные
оксиды;
металлы
образуют
все основные,
все амфотерные
и некоторые кислотные
оксиды.
Все
оксиды одновалентных
металлов (Na2O,
K2O,
Cu2O
и др.) являются основными. Большинство
оксидов двухвалентных
металлов (CaO,
BaO,
FeO
и др.) также являются основными. Исключения:
BeO,
ZnO,
PbO,
SnO,
которые являются амфотерными. Большинство
оксидов трех-
и
четырехвалентных
металлов являются
амфотерными:



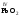
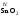
V,
VI,
VII
.являются
кислотными:
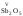


др.
Металлы
с переменной валентностью могут
образовывать оксиды всех трех типов.
Например:
СrО – основный оксид, Сr2О3
– амфотерный оксид, СrО3
– кислотный оксид.
Графические
формулы
В
молекуле оксида атом металла непосредственно
соединяется с атомами кислорода.
Соседние файлы в папке Химия(лабы+теория)
- #
- #
- #
CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
Содержание:
Понятие о кислотах:
Из курса природоведения вы знаете об уксусной кислоте, в 7 классе упоминалась серная кислота. Кислый вкус лимонам придает именно лимонная кислота. Обратите внимание, слово «кислота» есть в каждом из этих словосочетаний. Это потому, что эти вещества принадлежат к одной группе сложных веществ — кислотам. При этом, серная кислота — неорганическое вещество, а уксусная и лимонная — органические.
Что же представляют собой кислоты
Кислоты — сложные вещества. Подобно оксидам, они состоят из двух частей, а объединить их в одну группу позволяет наличие атомов водорода.
Ознакомимся с приведенными формулами кислот:
Качественный состав этих формул подтверждает наличие одного или нескольких атомов водорода.
Разделим формулы кислот черточкой на две части так, чтобы в первой были атомы водорода:
Оставшуюся часть называют кислотным остатком.
Вторая часть формул кислот отличается от первой части по составу.
Атомы водорода есть и в составе аммиака 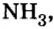
Кислоты — это сложные вещества, которые содержат атомы водорода, способные замещаться металлом, и кислотный остаток.
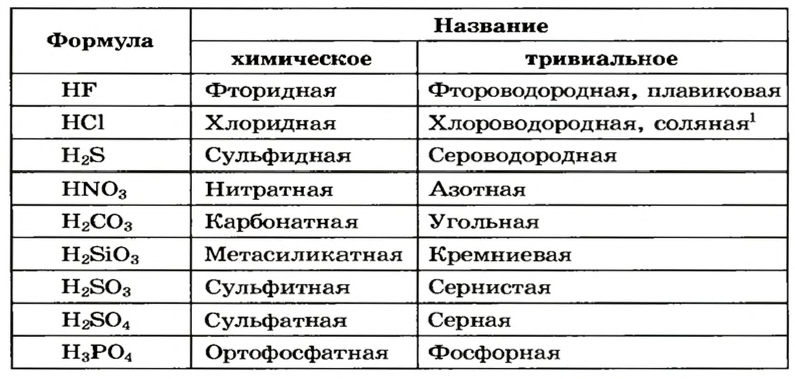
Названия кислот
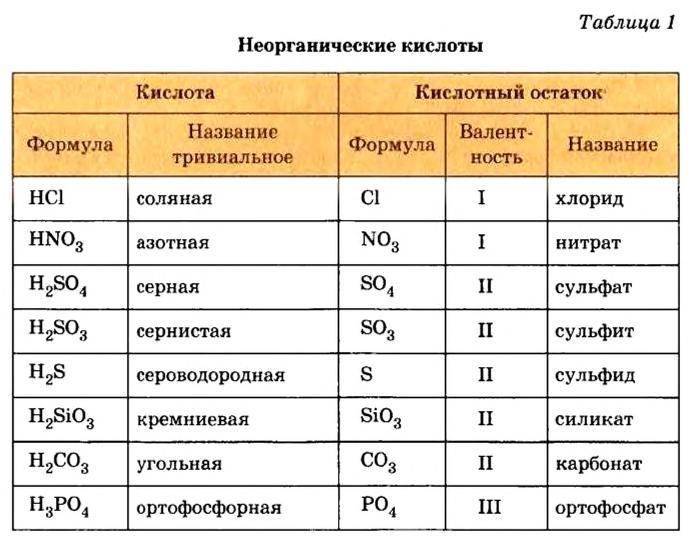
Ознакомьтесь с таблицей 1, в нее внесены неорганические кислоты, с которыми вы будете сталкиваться чаще всего.
До сих пор вы рассматривали валентность как способность атомов одного химического элемента соединяться или замещать определенное количество атомов другого элемента. Отныне ваши знания об этой физической характеристике атомов пополнятся информацией о валентности кислотных остатков. Оказывается, что кислотные остатки также способны совмещать определенное количество атомов или групп атомов.
Запись общей формулы кислот имеет такой вид:
Таким образом, валентность кислотного остатка равна количеству атомов водорода.
Физические свойства кислот
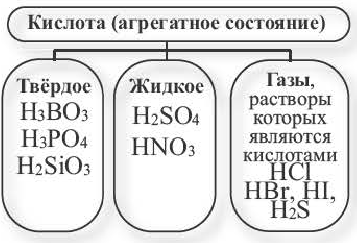
Неорганические кислоты, в основном, — жидкости. Среди них совсем мало твердых веществ (из приведенных в таблице 1 лишь ортофосфорная), нет газообразных.
Кислоты бесцветны, плотность всех кислот больше единицы. Они хорошо растворяются в воде (за исключением некоторых, в частности кремниевой).
И название класса соединений — кислоты, и восприятие вкусового ощущения — кислый — слова однокоренные. И это не случайно, ведь кислоты, в основном, кислые на вкус. Вы это знаете из собственного опыта, употребляя кисломолочные продукты (кефир, йогурт), фрукты, квашеные и свежие овощи (лимоны, яблоки и т. п.).
Запомните! В химическом кабинете ни в коем случае нельзя пробовать кислоты и любые другие вещества на вкус! Это очень опасно!
Кислоты повреждают слизистые оболочки органов пищеварения, при вдыхании паров раздражают слизистые оболочки органов дыхания, попадая на кожу, вызывают покраснения, болевые ощущения, а при большой концентрации — тяжелые ожоги. Кислоты портят одежду — на месте их попадания сразу или со временем появляется дыра. Некоторые кислоты имеют резкий неприятный запах, например соляная, серная, азотная.
Однако работа с кислотами в школьном химическом кабинете безопасна, так как учащиеся работают с разбавленными кислотами, а не с чистыми веществами. При этом нельзя допускать попадания кислот на одежду или тело и особенно в глаза.
Плотности всех кислот больше единицы, то есть они тяжелее воды. Существует правило приготовления растворов кислот: кислоту льют в воду (не наоборот!) небольшими порциями, помешивая стеклянной палочкой. Почему именно так? Имея плотность большую, чем плотность воды, кислота проходит сквозь толщу воды на дно сосуда и смешивается с водой. Если же сделать наоборот — воду лить в кислоту, — вода будет скапливаться на поверхности кислоты, от сильного разогревания (в результате химического взаимодействия) она закипит, а ее брызги могут попасть на тело или одежду. Если так приготовить раствор серной кислоты, то в результате сильного разогревания стеклянный сосуд может даже треснуть.
Однако кислоты не разрушают стекло (исключение — плавиковая кислота 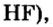
Запись состава кислот с помощью структурных формул
Как вы уже знаете, структурные формулы показывают не только количественный и качественный состав молекул, но и порядок соединения атомов в них. Как записывать структурные формулы кислот?
Пример 1. Записать структурную формулу соляной кислоты
Зная, что одна черточка в структурной формуле соответствует одной единице валентности, а водород и кислотный остаток этой кислоты одновалентны, записываем:
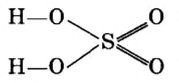
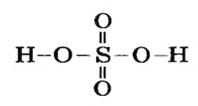
Пример 2. Записать структурную формулу серной кислоты.
Чтобы правильно записать структурную формулу кислоты, молекулярная формула которой 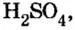
Итоги:
- Кислоты — класс неорганических соединений, молекулы которых состоят из атомов водорода, способных замещаться атомами металлов, и кислотного остатка.
- Валентность кислотного остатка определяется количеством атомов водорода, которые могут быть замещены атомами металла.
- Работая с кислотами, необходимо помнить об их химических свойствах и строго придерживаться правил безопасной работы с ними.
Тривиальные названия кислот (серная, соляная и др.) появились в последнем десятилетии XVIII ст., когда в 1792 году о них сообщил от имени своих коллег-химиков французский ученый Антуан Лавуазье на заседании Парижской академии. А до этого кислоты назывались произвольно. Среди нескольких названий серной кислоты было и название «купоросная», карбонатной — «воздушная».
Новая химическая номенклатура внедрялась медленно. В России к предложенным названиям обратились лишь через 100 лет. В частности, еще в 1875 г. в Петербургской академии наук обсуждалась возможность применения для кислоты 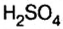
Способность металлов вытеснять водород из кислот
Вернемся к определению кислот как сложных веществ, в молекулах которых атомы водорода способны замещаться атомами металлов, и подтвердим это опытным путем.
Опыт 1. Поместим в пробирку немного магниевых опилок, дольем к ним воды и будем наблюдать. При комнатной температуре никаких изменений не происходит.
Опыт 2. Поместим в пробирку немного магниевых опилок, дольем к ним разбавленного раствора серной кислоты (1 часть кислоты и приблизительно 5 частей воды) и быстро закроем пробирку пробкой с газоотводной трубкой. При комнатной температуре магний активно взаимодействует с кислотой, о чем свидетельствует выделение пузырьков газообразного вещества.
Соберем газ способом вытеснения воды и испытаем его. Для этого наполненную газом пробирку закроем под водой стеклянной пластиной и извлечем пробирку из сосуда.
Выясним, какой газ мы собрали. Вам известно, что кислород поддерживает горение и в сосуде с ним горящая спичка или тлеющая щепка ярко загорятся. Наличие водорода также можно установить с помощью горящей спички — пламени ее достаточно, чтобы поджечь водород. Исходя из того, что в составе серной кислоты есть и атомы водорода, и атомы кислорода, проверим, какой газ — водород или кислород — мы собрали: поднеся зажженную спичку к отверстию пробирки, услышим приглушенный хлопок (взрыв). Окисление водорода спровоцировало небольшой взрыв, а яркого горения спички не наблюдалось.
Магний вытеснил из кислоты не кислород, а водород, о чем свидетельствует продукт реакции — водород:
Следовательно, в результате реакции образовалось простое газообразное вещество. Оно не имеет запаха и цвета, потому мы и обнаружили его только после сожжения образовавшегося водорода.
Проанализируйте состав другого продукта этой реакции и сделайте вывод, простое это вещество или сложное. Образованное вещество относится к классу неорганических соединений — солям. С представителем этого класса соединений — поваренной солью 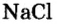
Продолжим исследование способности атомов металлических элементов замещать атомы водорода в молекулах кислот, но уже на примере других металлов, и проделаем опыт с соляной кислотой и цинком.
Опыт 3. Поместим (осторожно!) на дно пробирки несколько гранул металла цинка, дольем к ним разбавленную соляную кислоту и будем наблюдать. Довольно быстро поверхность гранул покроется пузырьками газообразного вещества. Подогреем содержимое пробирки, и газ станет выделяться активнее. (Вспомните, как определяется относительная плотность газов по воздуху. Вычислите плотность водорода по воздуху и предложите, как нужно правильно держать пробирку, чтобы она наполнилась водородом.) Расчеты подтверждают, что водород в 14,5 раза легче воздуха. Следовательно, чтобы наполнить пробирку водородом, ее нужно держать вверх дном. Соберем водород в сухую пробирку способом вытеснения воздуха и испытаем его.
Как и в предыдущем опыте, раздается приглушенный хлопок. Следовательно, цинк вытеснил атомы водорода из молекул соляной кислоты, из атомов образовались молекулы водорода, и опыт это только что подтвердил:
На стенках пробирки появились капельки воды — продукта окисления водорода:
Запомните! Реакция горения водорода сопровождается взрывом. Поэтому для безопасности ее проведения объем водорода не должен превышать 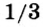
Опыт 4. К медным опилкам добавим разбавленную соляную кислоту. Наблюдение показывает, что реакции не происходит: цвет меди и раствора не изменился, образования газообразного вещества не наблюдается. Подогреем содержимое пробирки и еще раз убедимся в отсутствии каких-либо изменений, т. е. медь не вытесняет водород из кислоты.
Таким образом, опытным путем мы выяснили, что одни металлы способны вытеснять водород из кислот, другие — нет. Это свойство металлов исследовал русский ученый Николай Николаевич Бекетов и по способности металлов вытеснять водород из кислот составил в 1863 г. вытеснительный ряд металлов, или ряд активности металлов:
Николай Николаевич Бекетов (1827 — 1911) — известный ученый в области физики и химии, русский по происхождению. Много лет работал профессором Харьковского университета (в настоящее время Харьковский национальный университет имени В. Н. Каразина). Ученый стоял у истоков одной из отраслей химической науки — физической химии. Ему принадлежит открытие одного из способов добычи металлов из руд-оксидов — алюминотермия. При этом способе используют свойства алюминия при определенной температуре вступать в реакцию с оксидом металла с последующим окислением. В результате выделяется металл в виде простого вещества высокой степени чистоты. Так добывают высокой чистоты железо, хром, кобальт, никель, марганец.
В 1863 г. Бекетов составил вытеснительный ряд металлов (ряд активности металлов).
Все металлы, расположенные в ряду активности металлов слева от водорода, вытесняют водород из кислот. Эта способность металлов ослабевает от лития к свинцу. Металлы, расположенные в вытеснительном ряду после водорода, не вытесняют водород из кислот, т. е. не взаимодействуют с кислотами. Эта закономерность не распространяется на азотную кислоту, которая взаимодействует с металлами, расположенными не только до водорода, но и после него, однако одним из продуктов реакции является не водород, а вода. Аналогично реагирует с металлами и концентрированная серная кислота.
Наличие в ряду активности металлов водорода дает возможность сделать вывод о том, будет ли взаимодействовать металл с кислотой.
Следует также знать, что металлы 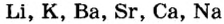
В проведенных нами опытах активность металлов изменялась так:
Выясним место металлов 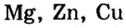
Понятие об индикаторах
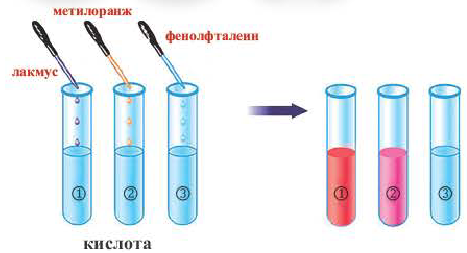
Индикаторами называют вещества или тела, с помощью которых обнаруживают конкретный признак другого вещества, тела или материала. Например, у электромонтеров есть прибор, который называется индикатором электрического тока. В химической лаборатории, а также лабораториях, где проверяют качество продуктов питания, также нужны индикаторы — вещества, с помощью которых определяют наличие кислот или оснований в растворе.
В школьной химической лаборатории пользуются в основном такими индикаторами: лакмусом, метиловым оранжевым (метилоранжем), фенолфталеином. Используют или их растворы, или индикаторные бумажные полоски (пропитанная индикатором бумага с последующим ее высушиванием).
На чем основывается применение индикаторов? Они приобретают различную окраску в воде, растворах кислот и оснований.
В воде лакмус приобретает фиолетовый цвет, метилоранж, — оранжевый, фенолфталеин — бесцветен.
Под воздействием кислот или оснований индикаторы изменяют свой цвет. При этом происходят сложные химические реакции, уравнения которых мы записывать не будем. А вот явлением, которое их сопровождает — изменением цвета, — воспользуемся уже при выполнении лабораторного опыта 1.
Итоги:
- Вытеснительный ряд металлов, или ряд активности металлов — это ряд, в котором металлы расположены по их способности вытеснять водород из кислот.
- Металлы, расположенные в ряду активности до водорода, вытесняют водород из кислот, металлы, расположенные в ряду активности после водорода,— не вытесняют.
- Качественной реакцией на водород является его взаимодействие с кислородом, во время которого слышится приглушенный хлопок — взрыв. Чтобы эта реакция состоялась, достаточно зажженную спичку поднести к отверстию пробирки с водородом.
- Кислоту в растворе можно обнаружить с помощью индикаторов лакмуса и метилового оранжевого.
Как было выяснено опытным путем, в растворах разных кислот все индикаторы имеют одинаковый цвет. Это свидетельствует о том, что к изменению цвета индикаторов причастен водород, потому что он входит в состав всех кислот, тогда как кислотные остатки у них разные. Действие на индикаторы оказывают не нейтральные атомы водорода, а его положительно заряженные ионы 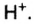
Стрелки в обоих направлениях вместо знака «равенства» означают, что происходит не только образование ионов, но и обратный процесс, — ионы объединяются в молекулы.
Обратите внимание: каким бы сложным не был кислотный остаток, он образует единый ион и сохраняет свою целостность.
Итак, с помощью лакмуса, метилового оранжевого, универсального бумажного индикатора можно определить присутствие в растворе катионов водорода, или созданную ими кислую среду.
Определение кислот
Прочитав название параграфа, кое-кто вспомнит вкус лимона или апельсина. В самом деле, такой вкус обусловливают соединения, общее название которых — кислоты (рис. 10).
Кислота — соединение, молекула которого содержит один или несколько атомов Гидрогена, способных при химических реакциях замещаться на атомы металлического элемента.
Состав кислот
Все кислоты имеют молекулярное строение. Для них существуют две общие формулы — 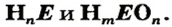
Примеры химических формул кислот:
При замещении атомов Гидрогена в молекулах кислот, например, на атомы Натрия, образуются соединения* с такими формулами:
Часть молекулы кислоты, соединенную с атомом (атомами) Гидрогена, называют кислотным остатком. Для кислоты с формулой 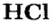
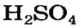
Количество атомов Гидрогена в молекуле кислоты определяет валентность кислотного остатка. Например, кислотный остаток 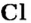
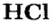
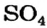
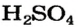
Элемент, который образует кислоту, называют кислотообразующим. Покажем, как можно определять значение его валентности в кислотах с общей формулой 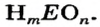
* — Общее название этих соединений — соли.
Запишем над символами Гидрогена и Оксигена значения валентности этих элементов:
Количество единиц валентности для 4-х атомов Оксигена составляет 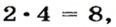
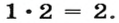
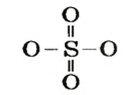
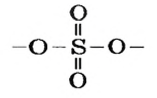
Поскольку кислоты — молекулярные соединения, то для них используют графические формулы. Составлять такие формулы для молекул кислот с общей формулой 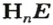
Пример №
Составить графические формулы молекулы кислоты 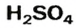
Решение
Способ 1. Мы только что выяснили, что элемент Сульфур в кислоте 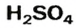
Все эти черточки (единицы валентности) должны также «принадлежать» 4-м двухвалентным атомам Оксигена. Размещаем атомы Оксигена вокруг атома Сульфура. Двум атомам Оксигена «выделяем» по две черточки, а для двух других остается по одной:
черточке (Оксиген — двухвалентный элемент). Записываем эти черточки и получаем графическую формулу кислотного остатка
Из этой формулы видно, что остаток кислоты двухвалентен. Дописываем слева и справа по атому Гидрогена и получаем графическую формулу молекулы кислоты
Способ 2. Записываем химическую формулу соединения, выделив в ней группы атомов 
Гидроксильная группа одновалентна: 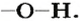

Поскольку атом Сульфура шестивалентный, размещаем вокруг него еще четыре черточки и к каждой их паре записываем по атому Оксигена:
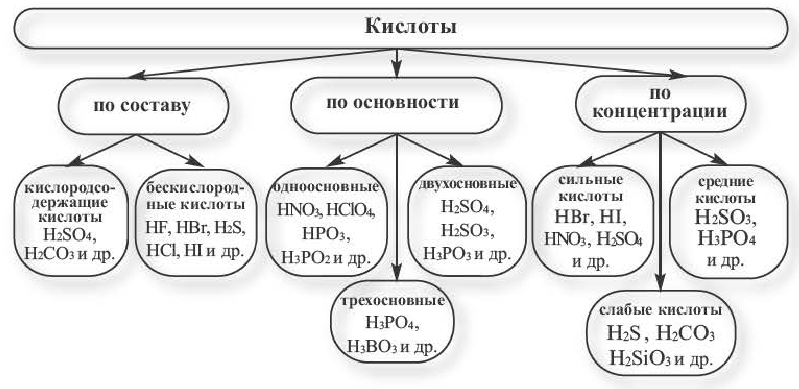
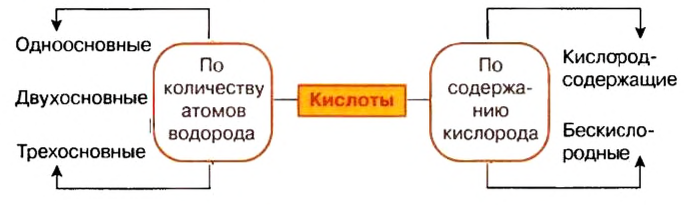
Классификация кислот
Кислоты отличаются друг от друга. Их делят на несколько групп. К каждой группе принадлежат кислоты, сходные по определенным признакам.
Существуют безоксигеновые и оксигенсодержащие кислоты. Названия этих групп кислот указывают на отсутствие или наличие в молекулах соединений атомов Оксигена.
Примеры кислот каждой группы:
Безоксигеновых кислот известно немного. Их общая формула — 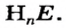
Оксигенсодержащих кислот намного больше. Они имеют общую формулу
Другой признак для классификации кислот — количество атомов Гидрогена в молекуле соединения. Соответствующую характеристику кислоты называют основностью. Существуют одно-, двух-, трехосновные кислоты, а также несколько кислот с более высокой основностью. Примеры кислот соответствующих групп:
По химической активности кислоты делят на сильные и слабые. Сильные кислоты, в отличие от слабых, активно взаимодействуют со многими веществами. Известны также несколько кислот средней силы. Примеры кислот различной активности (см. также форзац 2):
Названия кислот
Кислоты имеют химические и тривиальные названия. Формулы и названия важнейших кислот указаны в таблице 1.
Это интересно. Цианидная кислота HCN — безоксигеновая кислота, образованная тремя элементами. Она является сильным ядом.
Химические названия кислот состоят из двух слов. Второе слово во всех названиях — кислота. Корень первого слова происходит от названия элемента, который образует кислоту (хлоридная кислота — соединение Хлора). Первое слово названия безоксигеновой кислоты имеет суффикс «ид» (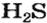
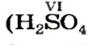
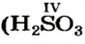
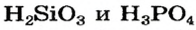
Важнейшие кислоты
Тривиальные названия большинства кислот происходят от названий простых веществ или соединений элементов с Гидрогеном.
Кислота 
Распространенность в природе
На нашей планете встречается немало кислот. Карбонатная кислота образуется в результате растворения в природной воде углекислого газа 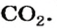
Растительный и животный мир богат на кислоты, которые принадлежат к органическим соединениям. Лимонная, яблочная, щавелевая кислоты содержатся в некоторых фруктах, ягодах, овощах (рис. 11), муравьиная кислота — в муравьях (поэтому их укусы ощутимы), пчелином яде, крапиве. При скисании молока, вина, фруктовых и ягодных соков образуются соответственно молочная и уксусная кислоты. Молочная кислота содержится также в квашеной капусте, силосе для скота; она накапливается в мышцах во время их работы. В желудочном соке есть неорганическая кислота — хлоридная.
Выводы:
Кислота — соединение,молекула которого содержит один или несколько атомов Гидрогена, способных в результате реакций замещаться на атомы металлического элемента. Для кислот существуют две общие формулы — 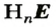
Часть молекулы кислоты, соединенную с атомом (атомами) Гидрогена, называют кислотным остатком.
Все кислоты имеют молекулярное строение.
Существуют безоксигеновые и оксигенсодержащие кислоты. По количеству атомов Гидрогена в молекуле различают одноосновные, двухосновные, трехосновные кислоты, а по химической активности — сильные и слабые.
Каждой оксигенсодержащей кислоте соответствует оксид, который называют кислотным. В оксиде и кислоте значение валентности кислотообразующего элемента одно и то же.
Кислоты имеют химические и тривиальные названия.
Кислоты распространены в природе.
Свойства и применение кислот
Физические свойства кислот: Молекулярное строение кислот обусловливает их физические свойства. Молекулы в кислоте притягиваются друг к другу слабо (в отличие от противоположно заряженных ионов в основном оксиде или основании). Поэтому кислоты имеют низкие температуры плавления, почти все в обычных условиях являются жидкостями. Они растворяются в воде (кроме кислоты 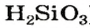
Вам известно, что безоксигеновые кислоты представляют собой водные растворы газов — соединений некоторых неметаллических элементов с Гидрогеном (например, 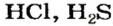
Летучей кислотой, т. е. такой, которая переходит в газообразное состояние при умеренном нагревании, является нитратная кислота 
Ортофосфатная кислота 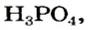
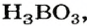
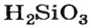
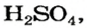
Карбонатная и сульфитная кислоты существуют лишь в водном растворе. Соответствующие им оксиды взаимодействуют с водой не полностью, а кислоты, которые образуются, частично разлагаются на оксиды и воду:
Большинство кислот токсичны. Они вызывают серьезные отравления, ожоги кожи. Поэтому работать с кислотами надо очень осторожно, соблюдая правила техники безопасности. При попадании раствора кислоты на руку следует сначала смыть его проточной водой, затем обработать кожу разбавленным раствором соды (для удаления остатков кислоты) и хорошо промыть руку водой.
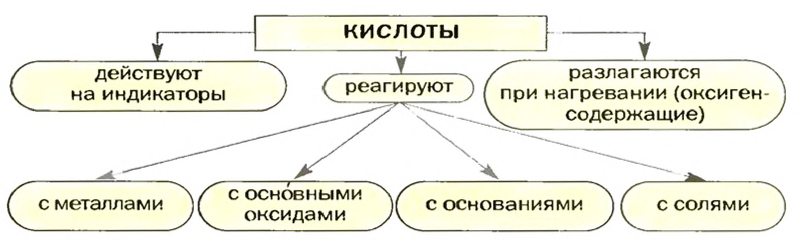
Химические свойства кислот: Способность кислот реагировать с другими веществами в значительной мере зависит от их устойчивости, летучести, растворимости в воде. Это необходимо учитывать, рассматривая химические свойства кислот.
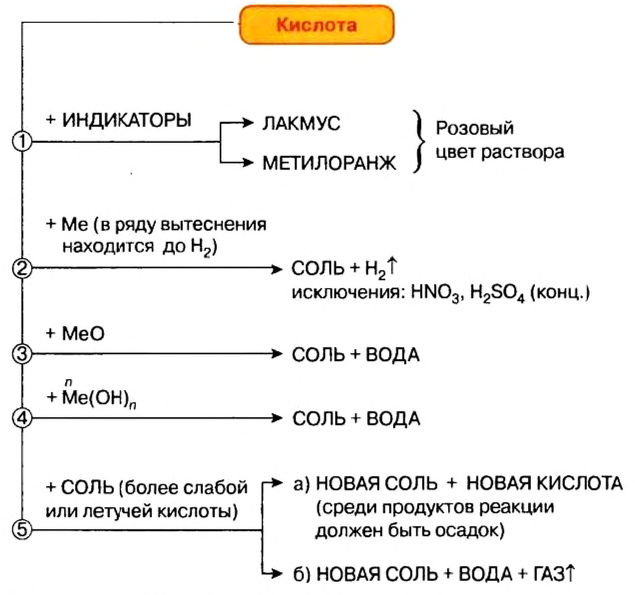
Действие па индикаторы: Кислоты в водных растворах изменяют окраску индикаторов (рис. 25), но не всех и не так, как щелочи.
Реакции с металлами
Большинство известных вам кислот реагируют с металлами с выделением водорода и образованием солей (рис. 26). Среди них — все безоксигеновые кислоты, сульфатная (в разбавленном растворе):
В этих реакциях атомы металлического элемента, которые содержатся в простом веществе, замещают атомы другого элемента (Гидрогена) в сложном веществе.
Реакцию между простым и сложным веществами, в результате которой образуются новые простое и сложное вещества, называют реакцией замещения.
С названными кислотами взаимодействуют не все металлы. Возможность осуществления реакции между металлом и кислотой можно определить, используя ряд активности металлов. Его составил отечественный химик Н. Н. Бекетов на основании результатов изучения многих реакций металлов с кислотами и солями. Приводим большую часть этого ряда в современном виде (см. также форзац 2):
Формула неметалла водорода делит ряд на две части. Металлы, размещенные в левой части ряда, взаимодействуют с названными выше кислотами (при этом выделяется водород), а размещенные справа — не реагируют с ними (рис. 27):
Николай Николаевич Бекетов (1827—1911)
Выдающийся русский и украинский химик, академик Петербургской академии наук. Исследовал реакции солей с металлами и водородом в водных растворах. Предложил вытеснительный ряд, или ряд активности металлов (1865). Дал формулировку закона действующих масс, сходную с современной. Открыл и описал металлотермию — один из методов получения металлов. Проводил термохимические исследования. Содействовал становлению физической химии — одной из важнейших химических наук. Работал профессором в Харьковском университете (1855—1887), впервые читал курс лекций по физической химии как самостоятельной научной дисциплине. Был президентом Русского физико-химического общества.
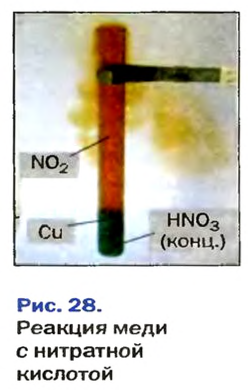
Во время реакций нитратной, а также концентрированного раствора сульфатной кислоты с металлами вместо водорода образуются другие вещества (рис. 28).
Реакции с основными оксидами и основаниями
Характерным свойством всех кислот является способность взаимодействовать с соединениями противоположного типа — основными оксидами и основаниями. Продуктами каждой реакции являются соль и вода. Эти химические превращения были рассмотрены в предыдущих параграфах. Примеры соответствующих химических уравнений:
Реакции с солями
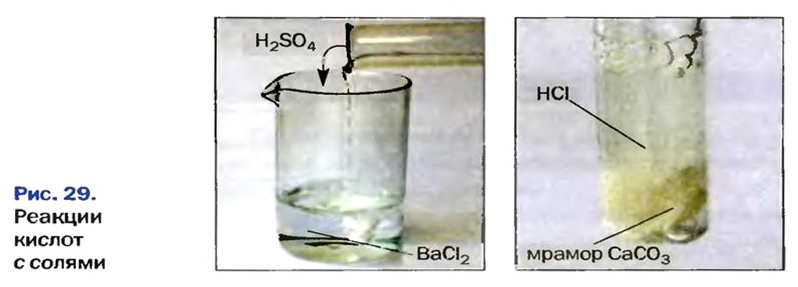
Реакции кислот с солями относят к реакциям обмена. Не все они возможны. Назовем случаи, когда эти реакции происходят (рис. 29).
• Продукт реакции — соль или кислота — выпадает в осадок (это выясняем по таблице растворимости):
• Кислота-продукт является летучей, происходит от газообразного соединения или разлагается с образованием газа:
(Сокращение «тв» означает «твердое вещество >>, а «конц» — «концентрированный раствор».)
• Кислота, которая вступает в реакцию, является сильной, а кислота, которая образуется, — слабой. Примерами могут служить три последние реакции.
Термическое разложение оксигенсодержащих кислот
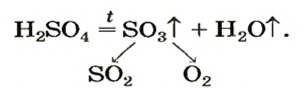
Оксигенсодержащие кислоты при нагревании, а карбонатная и сульфитная — в обычных условиях, разлагаются с образованием соответствующих кислотных оксидов и воды:
Одним из продуктов разложения сульфатной кислоты при умеренном нагревании является сульфур(VI) оксид, а при сильном нагревании этот оксид сам начинает разлагаться:
Реакция термического разложения нитратной кислоты имеет свою особенность. Это соединение разлагается на три вещества — нитроген(VI) оксид, кислород и воду (оксид 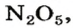
Изложенный материал обобщен в схеме 3.
Схема 3. Химические свойства кислот
Применение кислот:
Наибольшее применение получили сульфатная, хлоридная, нитратная и ортофосфатная кислоты (табл. 4). Их получают на химических заводах в большом количестве.
Наверное, в каждой семье в домашнем хозяйстве есть уксус. Это — разбавленный водный раствор уксусной кислоты
(Подготовьте рассказ о том, для чего используют уксус.) В быту, повседневной жизни применяются и другие кислоты. Лимонная кислота является пищевым продуктом и консервантом, аскорбиновая — витамином С. (Уксусная, лимонная и аскорбиновая кислоты — органические соединения.) Раствор борной кислоты применяют как дезинфицирующее средство, а раствор сульфатной кислоты заливают в аккумуляторы автомобилей.
Выводы:
Кислоты — молекулярные вещества, растворимые в воде. Они изменяют окраску индикаторов, но не так, как щелочи.
Кислоты взаимодействуют с большинством металлов с выделением водорода и образованием солей. Такие реакции называют реакциями замещения. Возможность их осуществления определяют с помощью ряда активности металлов.
Кислоты реагируют с основными оксидами и основаниями с образованием солей и воды, а также с солями (продукты реакции — другие кислота и соль). Оксигенсодержащие кислоты разлагаются при нагревании.
Кислоты находят широкое применение в различных сферах.
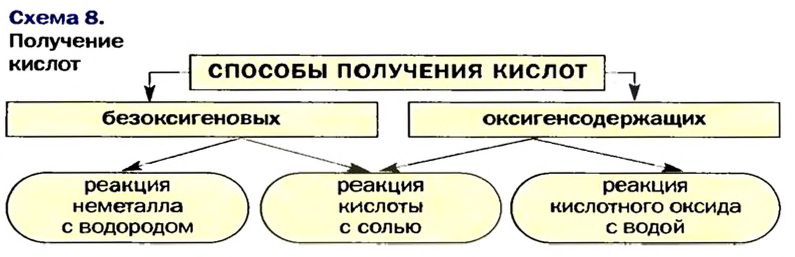
Способы получения кислот
Прежде чем выбрать способ получения кислоты, нужно выяснить, безоксигеновой или оксигенсодержащей она является, а также — сильной или слабой, летучей или нелетучей, растворимой или нерастворимой в воде.
Реакция между водородом и неметаллом
Это способ получения безоксигеновых кислот:
Продукты таких реакций — хлороводород, сероводород, другие газообразные соединения неметаллических элементов VI или VII группы с Гидрогеном — растворяют в воде и получают кислоты.
На взаимодействии хлора с водородом основано промышленное производство хлоридной кислоты.
Реакция между кислотным оксидом и водой
Такую реакцию используют для получения оксигенсодержащих кислот:
Первая реакция происходит на завершающей стадии производства сульфатной кислоты. Осуществлять аналогичную реакцию между оксидом 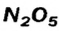
Реакция между солью и кислотой
На этой реакции основан общий способ получения кислот — и безоксигеновых, и оксигенсодержащих. Продуктами являются другие соль и кислота.
Такую реакцию обмена можно осуществить с использованием растворов соли и кислоты, если удовлетворяется одно из двух условий:
• продукт реакции — новая соль или новая кислота — нерастворим в воде (это определяем по таблице растворимости):
• кислота, которую нужно получить, является слабой, а кислота, которая вступает в реакцию, — сильной (соответствующая информация помещена в §7):
Для получения сильной и летучей кислоты (в том числе и безоксигеновой) реакцию проводят не в растворе, а между твердой солью и нелетучей кислотой. Взаимодействию веществ способствует нагревание:
Пример №
Можно ли получить хлоридную кислоту с помощью реакции между калий хлоридом и сульфатной кислотой? Если да, то в каких условиях?
Решение
Продуктами реакции должны быть новые соль и кислота:
По таблице растворимости определяем, что все соединения растворимы в воде. Сульфатная и хлоридная кислоты — сильные, но отличаются по физическим свойствам: первая — нелетучая, а вторая — летучая (это водный раствор газа хлороводорода).
Реакцию можно осуществить только в отсутствие воды. Тогда хлороводород будет выделяться из реакционной смеси.
Итак, для получения хлороводорода и хлоридной кислоты нужно взять твердый калий хлорид и чистую сульфатную кислоту или ее концентрированный раствор. Чтобы ускорить взаимодействие твердого и жидкого веществ, необходимо нагревание (в растворе реакции обмена происходят мгновенно).
Запишем соответствующее химическое уравнение, указав условия осуществления реакции (рис. 41):
Изложенное обобщено в схеме 8.
Выводы:
Безоксигеновые кислоты получают с помощью реакций водорода с неметаллами с последующим растворением продуктов в воде.
Оксигенсодержащие кислоты получают взаимодействием кислотных оксидов с водой. Общий метод получения кислот основан на реакции обмена между солью и кислотой.
Классификация кислот
Ваших знаний о кислотах вполне достаточно, чтобы рассмотреть классификацию соединений этого класса. Прежде всего существуют кислоты, кислотные остатки которых содержат кислород, а есть кислотные остатки без атомов кислорода. Это дало возможность разделить кислоты на кислородсодержащие (например: 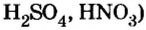
Кроме того, в составе молекул разных кислот может быть неодинаковое число атомов водорода, которые в реакциях с основаниями замещаются металлическим элементом. Это дало возможность классифицировать кислоты на одноосновные и многоосновные. (Подумайте и приведите примеры одноосновных и многоосновных кислот.)
Химические свойства кислот
Кислоты проявляют достаточно высокую химическую активность с металлами, оксидами металлов, гидроксидами, а во многих случаях и солями. При этом кислотный остаток выступает единым целым и в неизменном виде переходит из состава кислоты в состав образовавшейся соли.
Обобщим известные вам свойства кислот и дополним их новыми.
Действие растворов кислот на индикаторы
Как индикаторы кислой среды используются: лакмус (водный раствор), метиловый оранжевый (водный раствор), лакмусовые и универсальные бумажные индикаторы. Последние изготавливают способом пропитки специальной бумаги не одним, а несколькими чувствительными к кислой и щелочной средам веществами. Поэтому ими можно сразу обнаружить обе среды.
Ранее вы узнали о таком индикаторе, как фенолфталеин. Обратите внимание — это вещество не является индикатором кислой среды. Как известно, лакмус и метиловый оранжевый (метилоранж) в кислой среде имеют розово-красный цвет, универсальный индикатор — от оранжевого до темно-красного (зависит от содержания кислоты в растворе — если кислота очень разбавлена, то цвет оранжевый, если в растворе содержимое кислоты значительное, то — темно-красный или близкий к нему).
Заметим, что на индикаторы действуют, изменяя их цвет, лишь водные растворы кислот.
Взаимодействие кислот с металлами
Вы уже знакомы с опытами, которые подтверждают, что металлы, размешенные в вытеснительном ряду до водорода, замещают водород в молекулах кислот, в результате чего образуется соль и выделяется газообразное вещество водород. Тогда как металлы, размещенные в вытеснительном ряду после водорода, не замещают водород в молекулах кислот (вспомните, что азотная кислота является исключением):
В 7 классе вы узнали о реакциях замещения. Взаимодействие металлов с кислотами относится к этому типу реакций, ведь атомы металла, то есть простого вещества, замещают атомы водорода в молекуле кислоты, которая относится к сложным веществам.
Реакции замещения — это реакции, при которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
Схематически это можно записать так:
Взаимодействие кислот с оксидами металлов
Кислоты взаимодействуют с оксидами металлов (как с основными, так и с амфотерными), независимо от места расположения металла в вытеснительном ряду. В результате взаимодействия образуются соль и вода:
К какому типу реакций относится это взаимодействие?
Из уравнений реакций видно, что простых веществ нет, есть лишь сложные, которые при реакции обменялись своими составными частями. Следовательно, взаимодействие кислот с оксидами металлов относится к реакциям обмена.
Взаимодействие кислот с основаниями
Исследуем это взаимодействие, поскольку его вы еще не изучали.
Опыт 1. Нальем в химический стакан раствор гидроксида натрия и измерим его температуру. Прибавим к нему соляной кислоты (вполне понятно, что до реакции ее температура равна температуре раствора щелочи и температуре воздуха в комнате).
Видимых внешне изменений не наблюдается. Но измерив температуру раствора в химическом стакане, видим, что она возросла. То есть выделилось тепло, а это является одним из признаков химической реакции.
Запишем уравнение наблюдаемого химического явления:
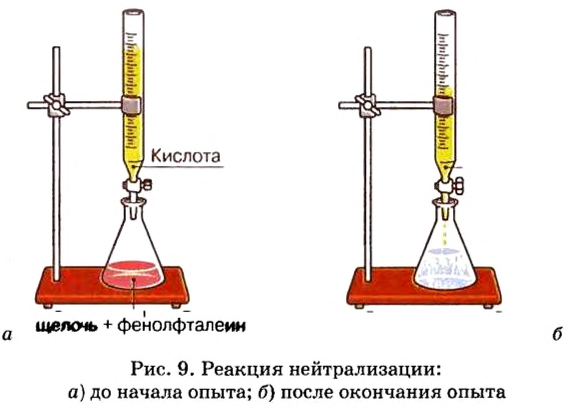
Опыт 2. Нальем в химический стакан раствор гидроксида калия и капнем несколько капель фенолфталеина (рис. 9, а). Раствор сразу стал малиновым. В закрепленной в штативе бюретке (рис. 9, б), наполненной раствором серной кислоты, откроем кран настолько, чтобы кислота не лилась струей, а падала отдельными каплями в стакан со щелочью, и понаблюдаем за тем, что будет происходить в стакане с гидроксидом калия. Вскоре отметим, что первоначальная ярко-малиновая окраска раствора в стакане становится менее яркой, а затем и вовсе исчезает.
Это доказывает, что щелочи в стакане не осталось. Запишем уравнение реакции и выясним, какие вещества образовались из гидроксида калия и серной кислоты:
Как и в первом опыте, щелочь и кислота обменялись составными частями, о чем свидетельствуют продукты реакции — сложные вещества соль и вода. Следовательно, реакции между основаниями и кислотами относятся к реакциям обмена.
До сих пор для проведения опытов мы использовали растворимые в воде основания — щелочи. Реагируют ли кислоты с нерастворимыми основаниями? Выясним это опытным путем.
Опыт 3. В две пробирки поместим немного гидроксида меди
Опытным путем мы установили, что кислоты вступают в реакцию обмена как с растворимыми основаниями (щелочами), так и с нерастворимыми.
Реакция между кислотой и основанием с образованием соли и волы называется реакцией нейтрализации.
«Нейтральный» значит — тот, который не принадлежит ни одному ни другому. Относительно реакции кислот с основаниями это означает, что после реакции не остается ни кислой, ни щелочной среды, а она становится нейтральной.
Взаимодействие кислот с солями
Кислоты взаимодействуют с солями, если среди продуктов реакции есть осадок или газ.
Опыт 4. В химический стакан нальем серной кислоты и прибавим раствор нитрата бария. Сразу же наблюдаем образование белого осадка. Запишем уравнение реакции и выясним, какой из продуктов реакции образовал осадок:
Соляная кислота не может быть осадком, а следовательно, в осадке находится сульфат бария. Проверим наше предположение по таблице растворимости солей, кислот и оснований в воде. Действительно, сульфат бария — это нерастворимая соль.
Опыт 5. В химический стакан положим кусочек мела и дольем азотной кислоты. Сразу же начинается реакция, которая сопровождается выделением газообразного вещества. (Какое это вещество?) Поскольку карбонат кальция — соль угольной кислоты, а ей отвечает оксид углерода
Рассмотрите уравнения реакций, которые происходили в опытах 4 и 5, и сделайте вывод, к какому типу реакций они относятся.
Итоги:
- Классификация кислот.
- Общие свойства кислот:
- В реакциях обмена кислотный остаток кислот переходит из состава кислоты в состав соли как единое целое.
В отличие от растворов других кислот, азотная кислота взаимодействует почти со всеми металлами, за исключением золота, платины. При этом образуется не два, а три продукта реакции. Для всех реакций общим является образование соли и воды. Что же касается третьего вещества, то в зависимости от активности металла и содержания кислоты в растворе это могут быть оксиды азота с разной его валентностью 
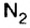
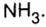
Характерно, что растворы со значительным содержимым азотной кислоты (свыше 60 %) не взаимодействуют с железом. Поэтому по железной дороге такую кислоту транспортируют в стальных цистернах.
Получение соляной кислоты и ее свойства
Изучая свойства оксидов, вы выяснили, что кислотные оксиды (за некоторым исключением, в частности оксид кремния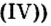
Но все это — кислородсодержащие кислоты. А как получают бескислородные кислоты, например соляную? Способы ее получения в промышленности и в лаборатории разные. Рассмотрим их.
Вы, наверное, обратили внимание, что в тексте учебника ни разу не было написано «раствор соляной кислоты», потому что эта кислота является ничем иным, как раствором газообразного хлорида водорода (хлороводорода) в воде. Поэтому, чтобы получить соляную кислоту, нужны хлороводород и вода-раство-ритель.
В промышленности хлороводород получают в специально построенных печах синтеза (от гр. синтез — составление, соединение), где происходит реакция соединения водорода с хлором, сопровождающаяся выделением света и тепла (вспомните, какое общее название имеют реакции с такими признаками):
Полученный таким способом газ растворяют в воде (точнее — в соляной кислоте с низким содержанием хлороводорода). Благодаря высокой растворимости хлороводорода в воде удается получить соляную кислоту с содержанием этого газа до 40 % по массе.
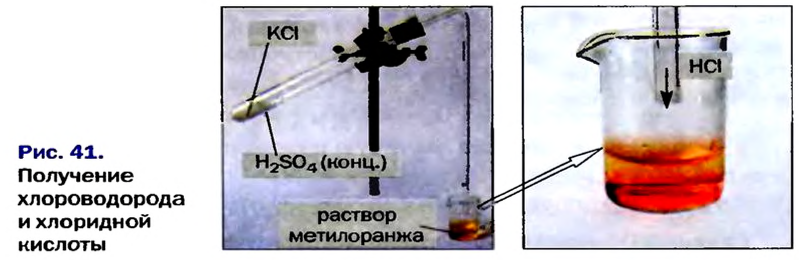
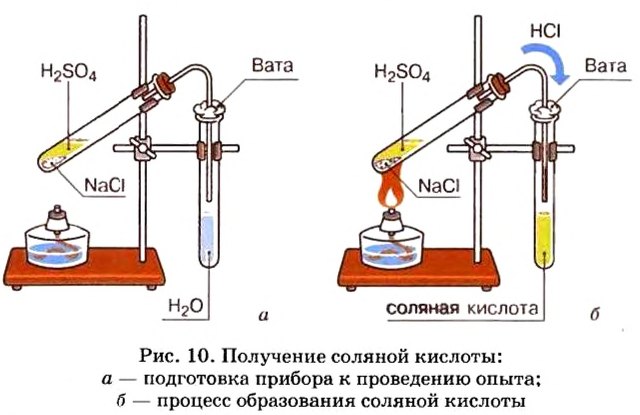
Существует лабораторный способ получения соляной кислоты. Получают ее в приборе, изображенном на рисунке 10, из твердой кристаллической соли хлорида натрия, действуя на нее раствором серной кислоты с высоким содержанием (60— 70 %) растворенного вещества. Такие растворы называют концентрированными. Растворы с низким содержанием растворенного вещества получили название разбавленных.
Реакцию проводят при нагревании:
Опыт 1. Заполним 1/4 объема пробирки хлоридом натрия и добавим серной кислоты столько, чтобы она смочила соль. Поскольку хлороводород — газообразное вещество, то благодаря нагреванию его молекулы активно двигаются, оставляют сосуд, где они образовались, и по газоотводной трубке попадают в пробирку, заполненную на 1/3 водой.
Обратите внимание, прибор собран так, что конец газоотводной трубки не касается воды. Поскольку 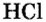
Хлороводород хорошо растворяется в воде, поэтому можно быстро получить соляную кислоту, необходимую для проведения последующих опытов.
Опыт 2. Отольем немного полученного раствора хлороводо-рода в чистую пробирку и испытаем его на наличие кислой среды с помощью индикатора, например метилового оранжевого. Раствор приобретает розовую окраску.
Воспользуемся полученной соляной кислотой для последующих опытов.
Опыт 3. К пробирке с кислотой и индикатором прибавим щелочь. Розовая окраска раствора изменяется на оранжевую. Следовательно, произошла нейтрализация кислоты щелочью:
Опыт 4. Поместим в пробирку немного карбоната натрия и прибавим к нему часть полученной соляной кислоты. Активное выделение газа свидетельствует о химическом явлении. Поднесенная к отверстию пробирки спичка гаснет. Следовательно, выделяется углекислый газ:
Опыт 5. К остальной кислоте прибавим раствор нитрата серебра 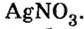
Образованный осадок не растворяется в воде и не взаимодействует с другими кислотами. На основании проведенных наблюдений делаем вывод.
С помощью раствора нитрата серебра можно отличить соляную кислоту от других кислот.
Взаимодействие соляной кислоты с металлами исследуйте самостоятельно, выполнив в классе лабораторный опыт 2, описанный в рубрике «Страница естествоиспытателя».
По рисункам 11 и 12 узнайте о распространенности кислот в природе и их применении.
– производство химических волокон, взрывчатых веществ, удобрений, моющих средств, красок, лекарственных препаратов, эфиров, сульфатов; в гальванических элементах и аккумуляторах.
– травление, паяние металлов, получение хлоридов, добыча металлов из руд
– производство удобрений, взрывчатых веществ, целлюлозы, получение разных солей
– получение ортофосфатов; изготовление полировочных смесей, катализаторов, лекарственных средств, безалкогольных напитков
Итоги:
- Соляная кислота — одноосновная бескислородная кислота, которая проявляет все общие свойства кислот.
- В промышленности соляную кислоту получают из водорода и хлора, растворяя образовавшийся газообразный продукт реакции хлороводород в воде.
- В лаборатории соляную кислоту получают взаимодействием кристаллического хлорида натрия и концентрированной серной кислоты.
- Наличие соляной кислоты можно обнаружить не только с помощью индикаторов, но и добавлением раствора нитрата серебра. Образуется нерастворимый в воде и других кислотах творожистый осадок белого цвета — хлорид серебра
В XV ст. кислота состава 
Справочный материал по кислотам
Бескислородные и кислородсодержащие кислоты получают соединением простых и сложных веществ.
1. При получении бескислородных кислот водород взаимодействует с неметаллом, а полученное газообразное вещество растворяется в воде:
2. Кислородсодержащие кислоты образуются в результате взаимодействия кислотного оксида и воды:
Классификация
| Кислота | Название кислоты | Кислотный остаток | Валентность кислотного остатка |
| H3PO4 | ? | ? | ? |
| ? | ? | 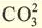 |
? |
| ? | Метакремниевая кислота | ? | ? |
Какие кислоты вы знаете? Приведите примеры кислотных остатков. Какие методы получения кислот вы знаете?
В VII классе при изучении темы водорода вы ознакомились с некоторыми представителями кислот (соляная и серная кислоты). Теперь же вы более подробно ознакомитесь со всеми представителями кислот.
Классификация: Атомы или группы атомов, соединенные с водородом в молекулах кислот, называются кислотными остатками. Заряд кислотного остатка всегда отрицательный ( ) и по своему числовому значению он равен основности кислоты.
Кислоты классифицируются по составу, основности и по силе.
Активность кислот определяется степенью концентрации ионов водорода, образовавшихся в их водных растворах (моль/л).
Число атомов водорода, способных замещаться атомами металла в молекуле кислоты, показывает основность кислоты и соответствует валентности кислотного остатка.
Количество атомов водорода, соединенных с атомом кислорода в кислородсодержащих кислотах, и количество атомов водорода, соединенных с атомами неметаллов в бескислородных кислотах, соответствует основности кислоты.
Номенклатура
Названия кислот заимствованы из латинского названия образующих их неметаллов. В бескислородных кислотах к окончанию названий элементов, образующих кислоты, добавляется суффикс «ид». Если в кислородсодержащих кислотах элемент, образующий кислоту, обладает высокой валентностью, то к его окончанию добавляется суффикс «ат», а если средней валентностью то суффикс «ит».
Если кислотообразующий элемент образует несколько кислот с одинаковой валентностью (степенью окисления), то к началу названия кислоты, у которой к одному атому данного элемента присоединено наибольшее количество атомов кислорода, добавляется приставка «орто», а при наименьшем количестве атомов кислорода приставка «мета». К названию же кислородсодержащих кислот, полученных путем нагревания этих кислот, добавляется приставка «пиро».
При образовании элементами более двух кислородсодержащих кислот пользуются названиями с добавлением суффиксов -н-, -ат-, -новат-, -ист-, -новагист-.
Графические формулы кислот
Последовательность расположения элементов в молекулах кислот можно проследить по их графическим формулам.
Линии между атомами в этих формулах выражают валентность элементов.
Получение
При непосредственном взаимодействии неметаллов с водородом
Кислотные оксиды, непосредственно взаимодействуя с водой, образуют соответствующую кислоту. SiO2 не вступает в реакцию с водой.
SO3 +H2O→ H2SO4 CO2 + H2O → H2CO3
При вступлении в реакцию с водой NO2 и P2Os, в зависимости от условий, образуются различные продукты.
При взаимодействии солей с кислотами
Наиболее часто применяемый способ получения кислот взаимодействие солей с кислотами.
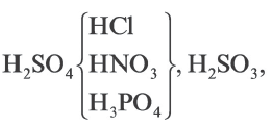
В этом ряду каждая кислота вытесняет из солей следующую за ней кислоту. Поскольку HCl, HNO3, Н3РО4 одинаково сильные кислоты, они не вытесняют друг друга.
При получении кислот подобным способом исходные вещества соль должна быть в твёрдом состоянии, а кислота более концентрированной и малолетучей. Серная кислота более сильная и малолетучая. Вот почему обычно при получении других кислот используют именно эту кислоту
2NaCl(тв.) + H2SO4(конц.) 
Ca3(PO4)2(тв.) + 3H2SO4 (конц.) 
Физические и химические свойства кислот
Определите типы химических реакций.
| Разложения | Обмена | Замещения | |
| 1. Fe+HCl→ |  |
 |
 |
| 2. Mg +H3PO4→ |  |
 |
 |
| 3. Pb(NO3)2 +HCl → |  |
 |
 |
4. H2SO3  |
 |
 |
 |
На основе какого правила был составлен ряд активности металлов? В получении какого простого вещества применяется реакция металлов с разбавленными кислотами (кромеразбавленного HNO3)?
Физические свойства:
По своему агрегатному состоянию кислоты классифицируются следующим образом. Кислоты хорошо растворяются в воде (кроме мегакремниевой кислоты).
Водные растворы газообразных хлорида водорода (хлороводорода), бромида водорода (бромоводорода) и йодида водорода (йодоводорода) образуют соответствующие кислоты. Водные растворы кислот имеют кислый вкус. Кислоты, как и щелочи, меняют цвет индикаторов.
Кислый вкус ряда употребляемых нами плодов (яблок, алычи, лимона и др.) и ягод объясняется наличием в их составе органических кислот. Зачастую эти кислоты носят названия тех плодов, в составе которых они содержатся. Например, яблочная кислота, лимонная кислота и др.
При хранении в открытом сосуде неустойчивых кислот (HNO3, H2CO3, H2SO3 и др.), а также кислот, полученных при растворении газов, их масса уменьшается или в результате разложения, или же за счет выделения газа из раствора. При хранении в отрытом сосуде растворов гигроскопических (водопоглощающих) кислот (например, H2SO4 (конц.) ,) их масса увеличивается.
Химические свойства и взаимодействие кислот с металлами
 |
Возьмите четыре пробирки. Поместите в каждую из пробирок по отдельному куску металлов Mg, Zn, Fe u Си и добавьте к ним немного 20% него раствора соляной кислоты. Что вы наблюдаете? Запишите уравнения реакций. |
В результате изучения взаимодействия кислот с металлами был составлен ряд активности металлов.
Li, К, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au
Химическая активность уменьшается
C уменьшением активности металлов уменьшается и скорость протекания их реакций с одной и той же кислотой. Металлы, расположенные в ряду активности до водорода, при вступлении в реакцию с разбавленными кислотами (кроме разбавленной HNО3) вытесняют из них водород. А металлы, расположенные в ряду активности после водорода, не вступают в реакцию с разбавленными кислотами (кроме разбавленной HNO3).
Cu + H2SO4(разб.) 
Взаимодействие кислот с неметаллами
C+4HNO3(конц.) 
ЗР + SHNO3(конц.) + 2H2O 
Взаимодействие кислот с аммиаком. Кислоты вступают с аммиаком в реакцию соединения. При вступлении в реакцию одноосновных кислот с аммиаком, независимо от соотношения молей, всегда получается нормальная соль.
NH3+ HNO3→ NH4NO3
В результате реакции соединения многоосновных кислот с аммиаком, в зависимости от соотношения молей, образуются разные соли.
2NH3 +H2SO4 → (NH4)2SO4
Разложение кислот. Некоторые кислоты разлагаются с выделением воды.
H2SiO3
- Соли в химии
- Хлор в химии
- Сера в химии
- Азот в химии
- Железо как химический элемент
- Озон как химический элемент
- Оксиды в химии
- Основания в химии


















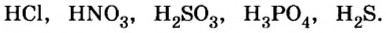
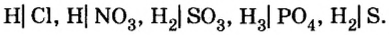

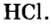
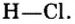
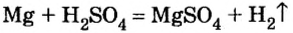
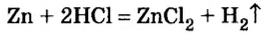
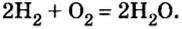
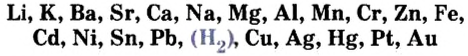

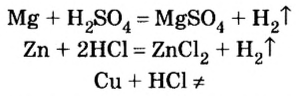
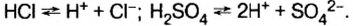

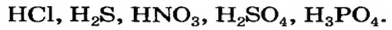
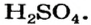
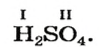
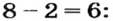
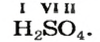
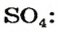
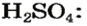
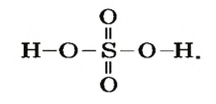
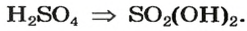
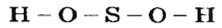
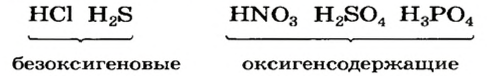
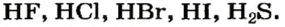
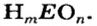
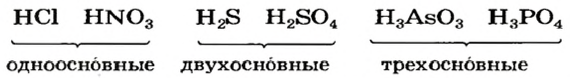
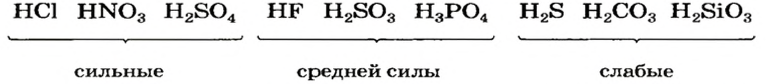
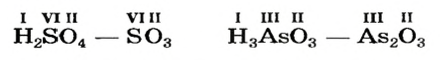

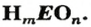

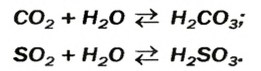
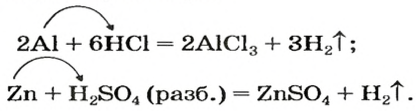

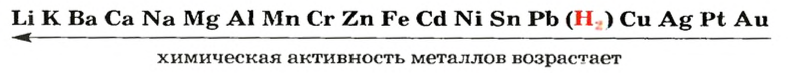
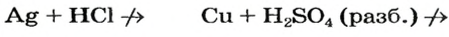


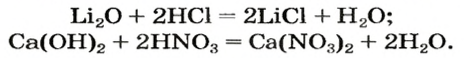
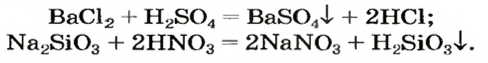
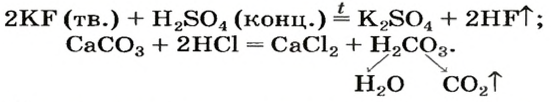
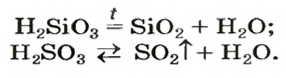
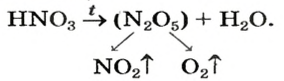
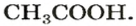

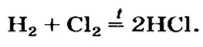
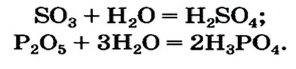
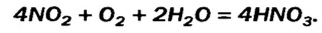
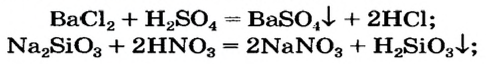
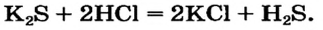
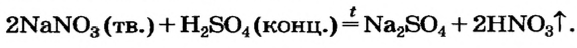
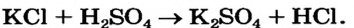
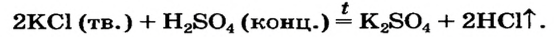
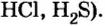
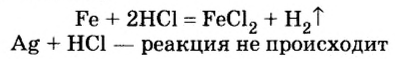
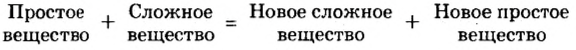
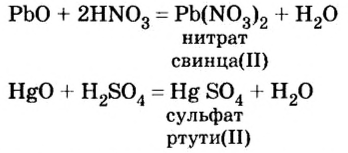
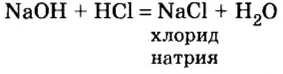
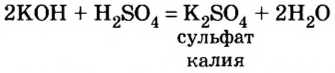
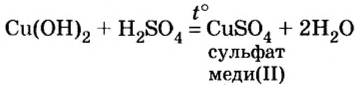
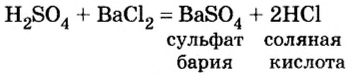
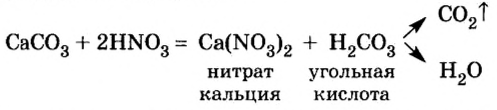
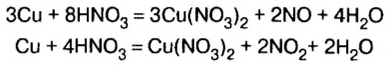
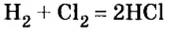
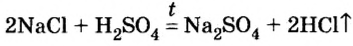
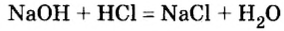
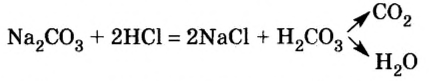
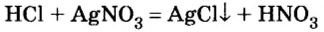


 – производство химических волокон, взрывчатых веществ, удобрений, моющих средств, красок, лекарственных препаратов, эфиров, сульфатов; в гальванических элементах и аккумуляторах.
– производство химических волокон, взрывчатых веществ, удобрений, моющих средств, красок, лекарственных препаратов, эфиров, сульфатов; в гальванических элементах и аккумуляторах. – травление, паяние металлов, получение хлоридов, добыча металлов из руд
– травление, паяние металлов, получение хлоридов, добыча металлов из руд – производство удобрений, взрывчатых веществ, целлюлозы, получение разных солей
– производство удобрений, взрывчатых веществ, целлюлозы, получение разных солей – получение ортофосфатов; изготовление полировочных смесей, катализаторов, лекарственных средств, безалкогольных напитков
– получение ортофосфатов; изготовление полировочных смесей, катализаторов, лекарственных средств, безалкогольных напитков