При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная H3PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная H2S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота H2SO3 – двухосновная (здесь два атома водорода), а фосфорная H3PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток – PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты H2SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты H2S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия H2S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота H2SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты H3PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Как составлять формулы кислот(по химии)?
Профи
(956),
закрыт
13 лет назад
Бася Барбара
Знаток
(258)
13 лет назад
Они все даны.. Их просто выучить… Соляная-HCl//
По содержанию кислорода
бескислородные (HCl, H2S);
кислородосодержащие (HNO3).
По основности — количество кислых атомов водорода
Одноосновные (HPO3);
Двухосновные (H2SeO4, Азелаиновая кислота) ;
Трёхосновные (H3PO4).
Четырёхосновные (H4СO4).
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH);
По летучести
Летучие (H2S, HCl);
Нелетучие (H2SO4) ;
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
Ирина
Гений
(88042)
13 лет назад
Их вообще-то учат. А состоят они из атомов водорода и кислотного остатка. Валентность водорода – 1. Например, H2SO4 – серная кислота
НЛО
Мыслитель
(9180)
13 лет назад
наименьшее общее кратное 2
H(+)2 SO4(2-)
раставляете сначала заряды ионов, затем находите наименьшее общее кратное и делите например в данном случае (2) разделить на 1 будет два и 2/2= 1 следовательно H2SO4
План урока:
Оксиды
Кислоты
Основания
Соли
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.

Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.

Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.

Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.

Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.

Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.

Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.

Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.

Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции – соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.

Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.


Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.

Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.

В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.

Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.

Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.

Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы – ОН.

Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.

Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.

Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
Na + OH →NaOH или H2 + SO4→ H2SO4
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.

Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.

Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.

Соли
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.

Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.

Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.

Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.

Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.

Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.

Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.

Источник
Теперь необходимо справиться с задачей дать название этому типу солей.

Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN−, равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.

Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.

В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.

Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.

1. Кислоты – это сложные вещества, состоящие из кислотных остатков и водорода, который может замещаться на атомы металлов.
2. Подчеркните кислотный остаток в молекулах кислот:
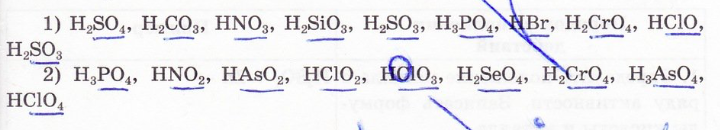
3. Валентность кислотного остатка равна числу атомов водорода, способных замещаться атомами металлов.
Определите валентность кислотных остатков следующих кислот:
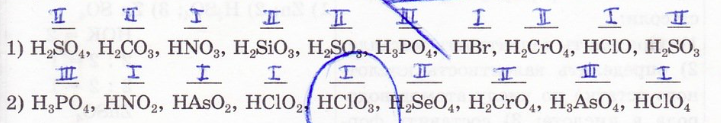
4. Составьте формулы кислот по известным кислотным остаткам:
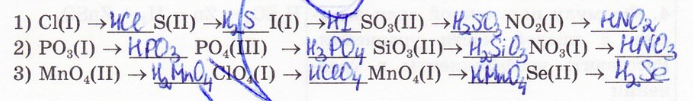
5. Составьте формулы кислот по следующим данным:

6. Составьте уравнения реакций между металлами и растворами кислот (в скобках указана валентность металла в образующейся соли):
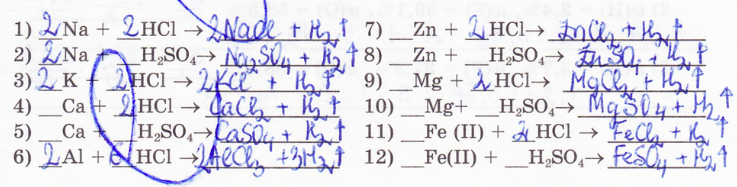
7. Составьте уравнения возможных реакций между металлами и арстворами кислот:

8. Составьте уравнения реакций между кислотами и основными оксидами. Запишите названия образующихся солей.
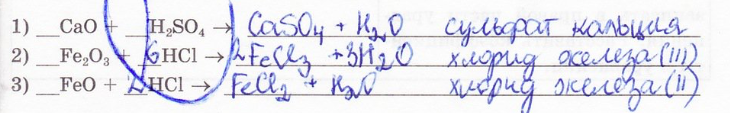
9. Составьте уравнения реакций нейтрализации. Запишие названия образующихся солей.

10. Составьте уравнения реакций по следующим даным:
1) Смесь цинка и оксида цинка растворили в соляной кислоте, а образовавшихся газ пропустили над раскаленным оксидом железа (3).

2) Применяемый как примочка при ушибах ацетат свинца (ядовит) по одному из способов приготовляется дейтсвием уксусной кислоты на оксид свинца (2).

3) При паянии употребляют так называемую травленную кислоту. Приготавливают ее действием цинка на соляную кислоту.

11. Задачи:
1) Вычислите массу образующейся соли, если в реакцию вступила серная кислота массой 0,98 г и гидроксид бария.
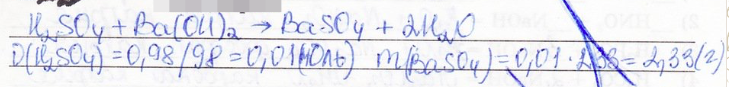
2) Вычислите массу оксида меди (2), способного вступить в реакцию с азотной кислотой массой 12,6 г.

3) Вычислите массу оксида железа (3) способного вступить в реакцию с соляной кислотой массой 1, 825 г.

4) В лаборатории потребовалось нейтрализовать раствор, содержащий серную кислоту. Сначала для нейтрализации был прибавлен раствор гидроксида натрия, а избыток кислоты нейтрализован раствором гидроксида калия. На операцию пошло 4 г гидроксида натрия и 0,56 г гидроксида калия. Определите массу килоты, содержавшейся в растворе.

Сохраните или поделитесь с одноклассниками:
Таблица кислот и кислотных остатков.
Таблица кислот и кислотных остатков (1 часть):
| Формула кислоты | Название кислоты | Формула кислотного остатка |
Название кислотного остатка |
| HN3 | Азотистоводородная (Азоимид, Азидоводород) | N3– | Азид |
| HNO2 | Азотистая | NO2– | Нитрит |
| HNO3 | Азотная | NO3– | Нитрат |
| HBrO2 | Бромистая | BrO2– | Бромит |
| HBrO3 | Бромноватая | BrO3– | Бромат |
| HBrO | Бромноватистая (Гипобромистая кислота) | BrO– | Гипобромит |
| HBr | Бромоводород (Бромистоводородная кислота) | Br– | Бромид |
| HVO3 | Ванадиевая | VO3– | Ванадат |
| H2WO4 | Вольфрамовая | WO42– | Вольфрамат |
| H4GeO4 или Ge(OH)4 | Германиевая кислота (Гидроксид германия (IV)) | GeO44– | Германат |
| H2S2O7 | Дисерная | S2O72– | Дисульфат |
| H4P2O7 | Дифосфорная | P2O74– | Пирофосфат или дифосфат (по номенклатуре IUPAC) |
| H2Cr2O7 | Дихромовая | Cr2O72– | Дихромат |
| HIO4 | Йодная | IO4– | Периодат |
| HIO | Йодноватистая | IO– | Гипоиодит |
| HI | Йодоводород (Йодоводородная кислота) | I– | Йодид |
| H2SiO3 | Кремниевая | SiO32– | Силикат |
| H2MnO4 | Марганцовистая | MnO42– | Манганат |
| HMnO4 | Марганцовая | MnO4– | Перманганат |
| HCOOH | Метановая (Муравьиная кислота) | HCOO– | Формиат |
| HBO | Метаборная | BO– | Метаборат |
| HAsO2 | Метамышьяковистая | AsO2– | Метаарсенит |
| H2TiO3 или TiO(OH)2 | Метатитановая (β-титановая кислота) | TiO32– | Титанат |
| HPO3 | Метафосфорная | PO3– | Метафосфат |
Таблица кислот и кислотных остатков (2 часть):
| H2MoO4 | Молибденовая | MoO42– | Молибдат |
| H3BO3 | Ортоборная (Борная кислота) | BO33– | Борат |
| H3AsO4 | Ортомышьяковая | AsO43– | Арсенат |
| H3AsO3 | Ортомышьяковистая | AsO33– | Ортоарсенит |
| H2PbO4 | Ортосвинцовая кислота | PbO42– | Ортоплюмбат или плюмбат |
| H3PO4 | Ортофосфорная (Фосфорная кислота) | PO43– | Фосфат |
| H2SO5 | Кислота Каро (пероксомоносерная кислота, мононадсерная кислота) | SO52– | Пероксомоносульфат или кароат |
| HNCS | Роданистоводородная (Тиоциановая кислота) | SCN– | Тиоцианат |
| C7H6O3 | Салициловая | C7H6O3– | Салицилат |
| H2SO4 | Серная | SO42– | Сульфат |
| H2SO3 | Сернистая | SO32– | Сульфит |
| H2S | Сероводород (Сероводородная кислота) | S2– | Сульфид |
| H2SO3S | Тиосерная | SO3S2– | Тиосульфат |
| H2CO3 | Угольная | CO32– | Карбонат |
| HF | Фтороводород (Плавиковая кислота) | F– | Фторид |
| HCl | Хлороводород (Соляная кислота) | Cl– | Хлорид |
| H2CrO4 | Хромовая | CrO42– | Хромат |
| HClO2 | Хлористая | ClO2– | Хлорит |
| HClO4 | Хлорная | ClO4– | Перхлорат |
| HClO3 | Хлорноватая | ClO3– | Хлорат |
| HClO | Хлорноватистая | ClO– | Гипохлорит |
| HCN | Циановодород (Синильная кислота) | CN— | Цианид |
| H2C2O4 | Этандиовая (Щавелевая кислота) | C2O42– | Оксалат |
| CH3COOH | Этановая (Уксусная кислота) | CH3COO– | Ацетат |
| C4H6O5 | Яблочная (Оксиянтарная, Гидроксибутандиовая кислота) | C4H4O52– | Малат |
Коэффициент востребованности
19 673
