Как производится метод электронного баланса?
Метод электронного баланса
Анонимный вопрос
21 декабря 2018 · 52,5 K
Получил математическое и богословское образование. Есть дети, соответсвенно и опыт их… · 12 янв 2019
Метод электронного баланса используется для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций. Суть метода заключается в том, что количество электронов, отданных восстановителями равно количеству электронов, принятых окислителями.
Алгоритм:
-
В схеме реакции определяем, какие вещества – окислители, а какие – восстановители.
-
Определяем, сколько электронов отдал каждый восстановитель, и сколько принял каждый окислитель.
-
Отдельно суммируем число отданных электронов и принятых.
-
Находим наименьшее общее кратное, и расставляем коэффициенты так, чтобы количество отданных электронов равнялось количеству принятых (учитываем количество атомов окислителей и восстановителей в веществах).
-
Перенеся коэффициенты в схему реакции, также уравниваем количество атомов тех элементов, которые не меняли степень окисления.
Пример (в скобках указано количество принятых или отданных электронов):
Дана реакция: FeS + O2 = Fe2O3 + SO2
-
Здесь железо и сера – окислители, кислород – восстановитель.
-
Fe(+2) – 1e = Fe (+3) , S(-2) – 6e = S(+4), т.е. железо отдаёт один электрон, сера отдаёт четыре.
O2 +4e = 2O(-2), кислород принимает четыре электрона. -
Получаем, что окислители отдали 7 электронов: Fe(+2) + S(-2) – 7e = Fe(+3) + S(+4), а восстановитель принял 4 электрона.
-
Наименьшее общее кратное для 7 и 4 – это 28, коэффициенты получаются такими:
4Fe(+2) + 4S(-2) + 7O2 = 4Fe(+3) + 4S(+4) + 14O(-2) -
Уравнение приобретает вид: 4FeS + 7O2 = 2Fe2O3 + 4SO2
55,3 K
Комментировать ответ…Комментировать…
в реакции меди с разбавленной азотной кислотой кислота расходуется на ОВР и на образование нитрата:
HNO3¯+Cu→Cu(NO3)2¯+NO¯+H2O.
1.
HN¯O3+5+Cu¯0→Cu¯(NO3)2+2+N¯O+4+H2O.
2. Составим электронный баланс:
Cu0−2e_→Cu+2|2|×3−окисление;N+5+3e_→N+2|3|×2−восстановление.
3. Переносим полученные коэффициенты в схему реакции: (3) — перед формулами меди и нитрата меди((II)), (2) — перед формулой оксида азота, (2 + 6 = 8) — перед формулой азотной кислоты ((6) молекул кислоты необходимы для образования соли):
8HNO3+3Cu→3Cu(NO3)2+2NO+H2O.
4. Определяем коэффициент перед формулой воды:
8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O.
Алгоритм метода:
Краткий алгоритм:
Шаг 1:
а) находим “простые” степени окисления
б) находим “сложные” степени окисления
Шаг 2:
Переписываем уравнение со степенями окисления. Подчеркиваем РОЗОВЫМ все элементы, которые меняют степень окисления ВО ВСЕХ СОЕДИНЕНИЯХ, где они присутствуют. Если видим, что элемент работает в двух ролях, дублируем в формуле соединения для каждой роли.
Шаг 3:
а) Рисуем “образец” картинки для Н2О
б) Рисуем картинку для текущей реакции. Определяем окислитель и восстановитель
в) Разрешаем все роли в реакции: ОКИСЛИТЕЛЬ, ВОССТАНОВИТЕЛЬ, НЕЙТРАЛЬНЫЙ ЭЛЕМЕНТ (если есть)
Шаг 4:
Составляем уравнения электронного балланса (с описанием роли в начале строки). подчеркиваем ВНУТРЕННИЕ коэффициенты
Шаг 5:
Отчеркиваем черту справа. Первая колонка – количество электронов в реакции. Вторая – общее число. Третья – приведенные коэффициенты
Шаг 6:
а) ставим коэффициенты около веществ, участвующих в роли окислителя и восстановителя, учитывая внутренние. Фиксируем эти коэффициенты.
б) Ставим коэффициенты у “простых” веществ: сначала у “необычных” веществ, потом у “минимальных” (Н, О).
в)
_____________________________
Пример 1
Даны компоненты реакции:
Ag + HNO3 → AgNO3 + NO + H2O
Шаг 1.
Определим известные степени окисления по правилам
Ag0 + H+1N O-23 → Ag N O-23 + N O-2 + H+12O-2
Используя правило 0 заряда молекул, найдем следующие степени окисления:
найдем степень оксиления N:
H+1N+5O-23 ,
Зная, что N+5
Найдем степень окисления Ag
Ag+1N+5O-23
Шаг 2.
Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции. Подчеркиваем ВСЕ элементы, которые меняют степени окисления, во ВСЕХ соединениях, чтобы их не терять
Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Видим, что N работает в двух ролях, поэтому разбиваем эти роли:
Ag0 + H+1N+5O-23 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Шаг 3.
Вспоминаем картинку для определения ролей:
Рисуем картинку для наших веществ, смотрим направление стрелок, вычисляем окислитель и восстановитель:
Определяем роли в формуле:
Ag0 + H+1N+5O-23 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Шаг 4:
Составляем уравнения электронного балланса:
Восстановитель: Ag0 – 1e = Ag+1
Окислитель: N+5 +3e = N+2
Шаг 5:
Отчеркиваем вертикальной чертой, и пишем количество электронов, находим наименьшее общее кратное:
Восстановитель: Ag0 – 1e = Ag+1 | 1 3
| 3
Окислитель: N+5 +3e = N+2 | 3 1
Убеждаемся, что внутри уравнений нет самостоятельных (оранжевых) коэффициентов!
Шаг 6:
Начинаем уравнивать. Сначала пишем 3 для Ag и 1 для N-окислителя:
3 Ag0 + 1 H+1N+5O-23 + H+1N+5O-23 → 3 Ag+1N+5O-23 + 1 N+2O-2 + H+12O-2
Далее мы можем трогать только те части, которые не задействованы в окислении – восстановлении
Справа больше N
3 Ag0 + 1 H+1N+5O-23 + 3 H+1N+5O-23 → 3 Ag+1N+5O-23 + 1 N+2O-2 + H+12O-2
Слева больше H
3 Ag0 + 1 H+1N+5O-23 + 3 H+1N+5O-23 → 3 Ag+1N+5O-23 + 1 N+2O-2 + 2 H+12O-2
Составляем таблицу с элементами:
| Элемент | Слева | Справа |
| Ag-восст | 3 | 3 |
| H+ | 1+3=4 | 2*2=4 |
| N-окисл | 1 | 1 |
| N+5 | 3 | 3 |
| О-2 | 3+3*3=12 | 3*3+1+2=12 |
Убеждаемся, что все совпало
Приводим реакцию в окончательный вид, складывая одинаковые вещества:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Проверяем, что все коэффициенты не имеют общего делителя!
_____________________________
Пример 2:
Дано уравнение
Cl2 + KOH = KCl + KClO3 + H2O
Шаг 1.
Определим известные степени окисления по правилам
Cl02 + KO-2H+1 → KCl + KClO-23 + H+12O-2
Найдем степень окисления K
K+1O-2H+1
Зная K+1
K+1Cl-1 и K+1Cl+5O-23
Cl02 + K+1O-2H+1 → K+1Cl-1 + K+1Cl+5O-23 + H+12O-2
Шаг 2.
Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции. Подчеркиваем ВСЕ элементы, которые меняют степени окисления, во ВСЕХ соединениях, чтобы их не терять
Cl02 + K+1O-2H+1 → K+1Cl-1 + K+1Cl+5O-23 + H+12O-2
Видим, что Cl работает в двух ролях, поэтому разбиваем эти роли:
Cl02 + Cl02 + K+1O-2H+1 → K+1Cl-1 + K+1Cl+5O-23 + H+12O-2
Шаг 3.
Вспоминаем картинку для определения ролей:
Рисуем картинку для наших веществ, смотрим направление стрелок, вычисляем окислитель и восстановитель:
Определяем роли в формуле:
Cl02 + Cl02 + K+1O-2H+1 → K+1Cl-1 + K+1Cl+5O-23 + H+12O-2
Шаг 4:
Составляем уравнения электронного балланса:
Окислитель: Cl20 + 2e— = 2 Cl—
Восстановитель: Cl20 – 10e— = 2 Cl+5
Шаг 5:
Отчеркиваем вертикальной чертой, и пишем количество электронов, находим наименьшее общее кратное:
Окислитель: Cl20 + 2e— = 2 Cl— | 2 5
| 10
Восстановитель: Cl20 – 10e— = 2 Cl+5 | 10 1
Шаг 6:
Начинаем уравнивать. Сначала пишем 1 для Cl-восстановителя и 5 для Сl-окислителя, не забывая домножения на оранжевые внутренние коэффициенты!!! :
5 Cl02 + 1 Cl02 + K+1O-2H+1 → 2*5 K+1Cl-1 + 2*1 K+1Cl+5O-23 + H+12O-2
Далее мы можем трогать только те части, которые не задействованы в окислении – восстановлении
Справа больше K
5 Cl02 + 1 Cl02 + 12 K+1O-2H+1 → 2*5 K+1Cl-1 + 2*1 K+1Cl+5O-23 + H+12O-2
Слева больше Н и О
5 Cl02 + 1 Cl02 + 12 K+1O-2H+1 → 2*5 K+1Cl-1 + 2*1 K+1Cl+5O-23 + 6 H+12O-2
Составляем таблицу с элементами:
| Элемент | Слева | Справа |
| Cl-восст | 5*2=10 | 2*5=10 |
| H+ | 12 | 6*2=12 |
| Cl-окисл | 1*2=2 | 2*1=2 |
| K+ | 12 | 2*5+2*1=12 |
| O-2 | 12 | 2*1*3+6=12 |
Убеждаемся, что все совпало
Складываем одинаковые вещества:
6 Cl2 + 12 KOH → 10 KCl + 2 KClO3 + 6 H2O
Проверяем, что все коэффициенты не имеют общего делителя!
Находим общий делитель – 2. Делим:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
источники примеров:
http://profmeter.com.ua/communication/learning/course/course6/lesson326/ – пример №1 (пр. А)
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-okislitelno-vosstanovitelnye-reakcii.html – пример №2 (из задачи 5)
Делаем на занятии
KClO3 = KCl + KClO4
Zn + HNO3 = Zn(NO3)2 + NH4NO3 + H2O
Zn + H2SO4(конц) = ZnSO4 + SO2 + H2O
(ответ http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-okislitelno-vosstanovitelnye-reakcii.html)
HCl + MnO2 Cl2 + MnCl2 + H2O
H2S + KMnO4 + H2SO4 S + MnSO4 + K2SO4 + H2O
(ответ http://www.alhimikov.net/elektronbuch/Page-28.html)
Метод электронного баланса в доступном изложении
Суть метода электронного баланса заключается в:
- Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
- Элементы, степень окисления которых в результате произошедшей реакции не изменяется – не принимаются во внимание
- Из остальных элементов, степень окисления которых изменилась – составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
- Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
- Найденное значение и есть базовые коэффициенты для составления уравнения.
Визуально алгоритм решения задачи с помощью метода электронного баланса представлен на диаграмме.
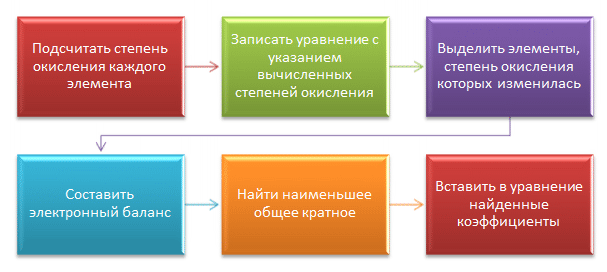
Как это выглядит на практике, рассмотрено на примере задач по шагам.
Задача.
Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
а) Ag + HNO3 → AgNO3 + NO + H2O
б) Ca +H2SO4 → CaSO4 + H2S + H2O
в) Be + HNO3 → Be(NO3)2 + NO + H2O
Решение.
Для решения данной задачи воспользуемся правилами определения степени окисления.
Применение метода электронного баланса по шагам. Пример “а”
Составим электронный баланс для каждого элемента реакции окисления Ag + HNO3 → AgNO3 + NO + H2O.
Шаг 1. Подсчитаем степени окисления для каждого элемента, входящего в химическую реакцию.
Ag. Серебро изначально нейтрально, то есть имеет степень окисления ноль.
Для HNO3 определим степень окисления, как сумму степеней окисления каждого из элементов.
Степень окисления водорода +1, кислорода -2, следовательно, степень окисления азота равна:
0 – (+1) – (-2)*3 = +5
(в сумме, опять же, получим ноль, как и должно быть)
Теперь перейдем ко второй части уравнения.
Для AgNO3 степень окисления серебра +1 кислорода -2, следовательно степень окисления азота равна:
0 – (+1) – (-2)*3 = +5
Для NO степень окисления кислорода -2, следовательно азота +2
Для H2O степень окисления водорода +1, кислорода -2
Шаг 2. Запишем уравнение в новом виде, с указанием степени окисления каждого из элементов, участвующих в химической реакции.
Ag0 + H+1N+5O-23 → Ag+1N+5O-23 + N+2O-2 + H+12O-2
Из полученного уравнения с указанными степенями окисления, мы видим несбалансированность по сумме положительных и отрицательных степеней окисления отдельных элементов.
Шаг 3. Запишем их отдельно в виде электронного баланса – какой элемент и сколько теряет или приобретает электронов:
(Необходимо принять во внимание, что элементы, степень окисления которых не изменилась – в данном расчете не участвуют)
Ag0 – 1e = Ag+1
N+5 +3e = N+2
Серебро теряет один электрон, азот приобретает три. Таким образом, мы видим, что для балансировки нужно применить коэффициент 3 для серебра и 1 для азота. Тогда число теряемых и приобретаемых электронов сравняется.
Шаг 4. Теперь на основании полученного коэффициента “3” для серебра, начинаем балансировать все уравнение с учетом количества атомов, участвующих в химической реакции.
- В первоначальном уравнении перед Ag ставим тройку, что потребует такого же коэффициента перед AgNO3
- Теперь у нас возник дисбаланс по количеству атомов азота. В правой части их четыре, в левой – один. Поэтому ставим перед HNO3 коэффициент 4
- Теперь остается уравнять 4 атома водорода слева и два – справа. Решаем это путем применения коэффииента 2 перед H2O
Ответ:
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O
Пример “б”
Составим электронный баланс для каждого элемента реакции окисления Ca +H2SO4 → CaSO4 + H2S + H2O
Для H2SO4 степень окисления водорода +1 кислорода -2 откуда степень окисления серы 0 – (+1)*2 – (-2)*4 = +6
Для CaSO4 степень окисления кальция равна +2 кислорода -2 откуда степень окисления серы 0 – (+2) – (-2)*4 = +6
Для H2S степень окисления водорода +1, соответственно серы -2
Ca0 +H+12S+6O-24 → Ca+2S+6O-24 + H+12S-2 + H+12O-2
Ca0 – 2e = Ca+2 (коэффициент 4)
S+6 + 8e = S-2
4Ca + 5H2SO4 = 4CaSO4 + H2S + 4H2O
Пример “в”
Составим электронный баланс для каждого элемента реакции окисления Be + HNO3 → Be(NO3)2 + NO + H2O
HNO3 см. выше
Для Be(NO3)2 степень окисления бериллия +2, кислорода -2, откуда степень окисления азота ( 0 – (+2) – (-2)*3*2 ) / 2 = +5
NO см. выше
H2O см. выше
Be0 + H+1N+5O-23 → Be+2(N+5O-23)2 + N+2O-2 + H+12O-2
Be0 – 2e = Be+2 (коэффициент 3)
N+5 +3e = N+2 (коэффициент 2)
3Be + 8HNO3 → 3Be(NO3)2 + 2NO + 4H2O
0
Полный список степеней окисления элементов |
Описание курса
| Тесты (2)




