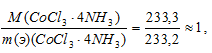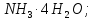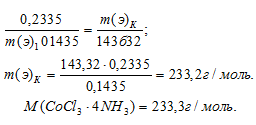Боже мой, зачем гуманитарию, да еще несчастному, координационные соединения? Или гуманитарий хочет стать Альфредом (кажется так его звали) Вернером?
Попробую, хотя никогда в жизни такое не приходилось делать :)). Но спасибо тов. Рипану и Четяну, учебник которых оказался под рукой.
- Ну, раз есть ответ 17, тогда просто: {Pt(NH3)4]Cl2 (не знаю, как тут подстрочные индексы сделать, но это не критично). Внутри сферы 4 молекулы аммиака, это 16 атомов + атом платины. Теперь назвать: хлорид тетраамминплатины(II) (помогло то, что это именная соль – основание Рейзе).
Второе вещество – H2[SiF6], гексафторокремниевая кислота?
- М-да :)). Прежде всего, это соль аммония. Аква – кристаллогидрат. Манганат(III) – в центре комплекса трехвалентный марганец. Пентахлор – пять (как в пентагоне 🙂 атомов хлора. Значит, [MnCl5] – заряд минус 2. Для нейтрализации нужно два катиона аммония: (NH4)2[MnCl5] – это 16 атомов, не хватает трех, значит, еще одна молекула Н2О: (NH4)2[MnCl5].Н2О. Уффф…
- Что такое 18 в ответе? Сумма коэффициентов? NaOH (избыток) + Cr2(SO4)3 = ? Тут могут образоваться разные гидроксохромиты, например,
12NaOH + Cr2(SO4)3 = 2Na3[Cr(OH)6] + 3Na2SO4. Ура: 18!!! Значит, угадал с продуктом: он гексагидроксохромит(III)натрия.
Константа? Наверное, для уравнения [Cr(OH)6]3- = Cr3+ + 6OH- K = в числителе произведение концентраций Cr3+ и ОН- (в 6-й степени), в знаменателе – концентрация комплексного иона (в он в левой части уравнения). Может быть, нужно поменять местами числитель и знаменатель- не помню, что такое константа нестойкости и константа устойчивости.
- Na2[Pb(OH)4] + K2SO4 = PbSO4(?) + 2NaOH(?)+ 2KOH. Наверное, правильно, раз получилось 7.
Координационная формула – комплексное соединение
Cтраница 1
Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурным методом. Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно.
[1]
Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурньш. Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно.
[3]
Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурным методом ( см. стр. Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно.
[5]
Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурным методом.
[6]
Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурным методом. Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно.
[7]
Координационная формула комплексных соединений может быть определена рядом методов, в том числе рентгеноструктурным – по молярной проводимости, реакциями двойного обмена. В случае использования метода двойного обмена при взаимодействии, например, раствора [ Р1 ( МНз) в ] С14 с раствором AgNOs весь содержащийся в нем хлор ( 4С1 -) осаждается в виде хлорида серебра; в соединении [ Pt ( МНз) 4С12 ] С12 AgNOs осаждается только два хлорид-иона ( 2С1 -); раствор [ Pt ( МНз) 2С14 ] не дает осадка с AgNOa. В анионном комплексе K2 [ PtCle ] нитрат серебра также не осаждает AgCl, но аналитически можно установить наличие в растворе ионов калия. Из полученных данных легко можно сделать вывод с подтверждением формул приведенных комплексов.
[8]
Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлен а путем определения взаимного положения атомов и молекул в кристалле реиттеноструктуриьш методом. Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно.
[9]
Координационная формула комплексного соединения, находящегося в кристаллическом состоянии, может быть непосредственно установлена путем определения взаимного положения атомов и молекул в кристалле рентгеноструктурным методом. Однако для этого требуется вырастить достаточно крупный и неискаженный кристалл комплексного соединения, что не всегда возможно.
[10]
Напишите координационную формулу комплексного соединения, состав которого выражается эмпирической формулой СоС1з – 6Н2О, если при действии нитрата серебра на раствор этой соли осаждается только две трети содержащегося в ней хлора.
[11]
Составьте координационную формулу комплексного соединения, имеющего эмпирическую формулу CoBrSOVSNHs, если при добавлении к нему на холоде нитрата серебра осадка не образуется, а при добавлении хлористого бария выпадает осадок.
[12]
Существует ряд методов установления координационных формул комплексных соединений.
[13]
Существует и ряд других физико-химических методов установления координационных формул комплексных соединений.
[14]
Написать координационную формулу комплексного соединения HgJ2 – 2KJ, учитывая, что двухвалентный ион ртути имеет координационное число, равное четырем.
[15]
Страницы:
1
2
«Природа
химической связи в комплексных
соединениях»
Пример 1. Номенклатура и классификация комплексных соединений
1.
Определите
заряды комплексообразователей и
лигандов, а также их координационное
число в комплексных соединениях

и [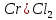
Решение.
Вначале следует определить величину
заряда координационной сферы. Это легко
установить по заряду частиц, не входящих
в комплексный ион. В первом соединении
с комплексным ионом связаны три катиона
натрия

следовательно, заряд комплексного иона
отрицательный (3-), в комплексном соединении
он – анион [
Во втором соединении с координационной
сферой взаимодействуют два иона хлора
следовательно, заряд комплексного иона
положительный (2+) и в комплексном
соединении он – катион [
Для
установления заряда центрального атома
следует определиться с зарядами лигандов.
Лигандом первого комплексного соединения
является анион
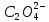
кислотный остаток щавелевой кислоты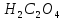
Алгебраическая сумма положительных и
отрицательных зарядов формирует общий
заряд комплекса, поэтому заряд
комплексообразователя – кобальта будет
равен трем [(-3) – 3·(-2)] или
Во втором соединении два лиганда,
нейтральная молекула воды и анион
Заряд комплексообразователя – хрома
равен трем [(2) – (5·0 – 1)], или
Координационное
число комплексообразователя определяется
суммой произведений количества каждого
из лигандов, входящих в координационную
сферу, на величину его заряда, взятую
по модулю. В случае нейтральных лигандов
используется только их количество.
Отсюда: к.ч. (Со) = 3·|-2| = 6; к.ч. (Cr)
= 5+1·|-1| = 6.
Ответ:
заряды комплексообразователей

к.ч. (
= 6; к.ч. (
= 6.
2.
Дайте
названия следующим комплексным
соединениям, используя общепринятую
рациональную номенклатуру:

[
[
Решение.

– комплексное соединение, в котором
координационная сфера является анионом.
Следовательно, название будет складываться
из трех слов с указанием в скобках
степени окисления центрального атома.
Это название – калия амминотрихлороплатинат
(4). В соединении [
катионом, и тогда наименование комплекса
– тетрааквадигидроксотитана (3) нитрат.
Соединение [
представляет собой нейтральную
координационную сферу с центральным
атомом меди, его наименование состоит
из одного слова – диамминодитиоцианомедь.
3.
Составьте координационные формулы
следующих соединений:



Определите, к какому типу комплексов
относится каждое из них.

Перед составлением формул комплексных
соединений следует вначале установить,
какой из атомов в сложной или двойной
соли будет являться центральным, т.е.
служить комплексообразователем
(вспомним, что ими являются, как правило,
d
или f
– элементы), а какие атомы или группы
атомов будут лигандами.
В
двойной соли

является переходнойd-металл
– золото (
лигандами будут служить анионы хлора
(
а катионы калияК+
сформируют внешнюю сферу. Следовательно,
этой соли соответствует комплексное
соединение монодентатного типа

– калия тетрахлороауррат (3).
В
двойной соли

только ионd-элемента
– железа (
а лигандами выступают два типа ионов
(

Катионы кальцияСа2+
формируют внешнюю координационную
сферу. Следовательно, соль является
комплексным соединением
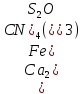
– кальция тетрацианотиоферрат (2). С
одной стороны, по количеству мест,
занимаемых в координационной сфере
одним лигандом, это соединение можно
отнести к смешанным – моно (
и бидентатным (
комплексам. С другой стороны, это
соединение, как и предыдущее, можно
отнести к ацидокомплексам, т.е. таким,
в которых лиганды являются анионами
соответствующих кислот
В
соединении

меди (
лигандами служат нейтральные молекулы
аммиака (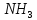
и ему соответствует монодентатное
комплексное соединение амминного типа
Ответ:

– монодентатный ацидокомплекс по типу
двойной соли;
– моно и бидентатный смешанный
ацидокомплекс по типу двойной соли;
4.
Напишите координационные формулы
следующих комплексных соединений:
тетраамминокарбонатохрома (3) сульфат;
магния трифторогидроксобериллат;
триаквафосфатожелезо; гексаамминокобальта
(3) гексацианохромат (3).
Решение.
В первом соединении – тетраамминокарбонатохрома
(3) сульфате – координационная сфера
является катионом, комплексообразователем
служит ион хрома (
лигандами – 4 молекулы аммиака (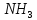
и карбонат-ион (
следовательно, формула комплексного
соединения
Во
втором соединении – магния
трифторогидроксобериллате –
координационная сфера является анионом,
комплексообразователем служит катион
бериллия (
лигандами – 3 аниона фтора (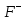
и гидроксид-ион (
следовательно, формула комплексного
соединения –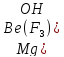
Третье
соединение – триаквафосфатожелезо –
является нейтральным комплексом, состоит
только из внутренней координационной
сферы, комплексообразователем служит
катион железа (
лигандами – 3 молекулы воды (
и фосфат-ион (
следовательно, его формула – [
Четвёртое
соединение – гексаамминокобальта (3)
гексацианохромат (3) – представляет
собой сложное комплексное соединение,
состоящее из двух координационных сфер,
в котором гексацианохромат (3) – анион,
а гексаамминокобальт (3) – катион. В анионе
центральным атомом является катион
хрома (
лигандами – 6 анионов цианистой кислоты
(
В катионе комплексообразователем служит
катион кобальта (
лигандами – 6 нейтральных молекул
аммиака (
Следовательно, искомая формула
комплексного соединения – [
Ответ:

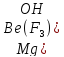
[
[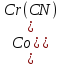
5.
Составьте координационные формулы
возможных изомеров комплексных соединений
общей эмпирической формулы

Объясните, какой тип изомерии иллюстрируют
эти комплексы. Координационное число
комплексообразователя может быть равным
4 и 6.
Решение.
Поскольку полярные молекулы аммиака

воды

плотностью, их вхождение в координационную
сферу комплексообразователя
постепенной заменой в координационной
сфере одних лигандов на другие. С учетом
природы лигандов такой тип изомерии
можно назватьсмешанным,
он включает в себя гидратную и ионизационную
между сферную изомерии. Многообразие
комплексных соединений одной и той же
эмпирической формулы обусловлено
неодинаковым
распределением молекул воды, аммиака
и анионов хлора

сферами соединений.
-
12
изомеров комплексных соединений с
координационным числом комплексообразователя
4 будут иметь следующие формулы:
[

[

[
[
[
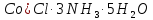
[

[
-
14
изомеров комплексных соединений с
координационным числом комплексообразователя
6 будут иметь следующее строение:
[

[

[

[

[

[
[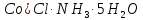


Ответ.
Если координационное число
комплексообразователя (кобальта) равно
4, то количество изомеров комплексных
соединений эмпирической формулы
равно 12; если же координационное число
комплексообразователя (кобальта) равно6,
то может образоваться 14 изомеров
комплексных соединений.
Все
изомеры иллюстрируют гидратный и
ионизационный между сферный тип изомерии.
6.
Определите тип изомерии в следующих
наборах комплексных соединений:
а)
[

б)
цис-

и транс-
Дайте
названия всем изомерам.
Решение.
В варианте а) приведены формулы двух
изомеров, отличающихся по типу
ионизационной между сферной изомерии.
Она заключается в неодинаковом
распределении лигандов во внутренней
и внешней координационных сферах
комплекса.
[
–тетраамминодихлороплатины
(4) амминохлорид.
В
варианте б) приведены формулы изомеров,
отличающихся по типу пространственной
внутри сферной изомерии октаэдрической
конфигурации. На плоскости их можно
изобразить следующим образом:
O2N
O2N
K
– Cl NO2 O2N
Cl
– K
Pt Pt
K
– Cl NO2 K
– Cl NO2
O2N цис-изомер
O2N транс-изомер
Калия
тетранитродихлороплатинат (4) .
Ответ.
В варианте а) пример ионизационной между
сферной изомерии, в варианте б) –
пространственной внутри сферной изомерии
октаэдрической конфигурации.
Соседние файлы в папке ИНЖА
- #
21.03.2015150.95 Кб9Деталь7.m3d
- #
21.03.201577.75 Кб10Деталь8.m3d
- #
21.03.201514.57 Кб10Лист Microsoft Office Excel.xlsx
- #
- #
- #
- #
21.03.201552.32 Кб9Сборка.a3d
- #
21.03.201572.36 Кб9Сборка.a3d.bak
- #
21.03.2015124.04 Кб9Сборка.cdw
- #
21.03.201596.8 Кб10Форматки.dwt
- #
Написание координационных формул солей и определение координационного числа металла
Задача 716.
Из раствора комплексной соли PtCl4 . 6NH3 нитрат серебра осаждает весь хлор в виде хлорида серебра, а из раствора соли PtCl4 . 3NH3 – только 1/4 часть входящего в ее состав хлора. Написать координационные формулы этих солей, определить координационное число платины в каждой из них.
Решение:
а) Отсутствие в растворе соли PtCl4 . 6NH3 ионов Pt4+ и свободного аммиака означает, что эти компоненты входят во внутреннюю сферу комплексного соединения. Так как все четыре хлорид-иона осаждаются AgNO3, то состав внутренней сферы комплексного соединения соответствует формуле [Pt(NH3)6]4+. Во внешней сфере находятся четыре хлорид-иона, компенсирующие заряд внутренней сферы, получим формулу комплексного соединения [Pt(NH3)6]Cl4.
Диссоциация комплексного соединения проходит по схеме:
[Pt(NH3)6]Cl4 ⇔ [Pt(NH3)6]4+ + 4Cl–
Координационное число центрального атома показывает общее число 
б) Отсутствие в растворе соли PtCl4 . 3NH3 ионов Pt4+ и свободного аммиака означает, что эти компоненты входят во внутреннюю сферу комплексного соединения. Кроме того, во внутреннюю сферу входят три хлорид-иона, не осаждаемые AgCl3. Следовательно, состав внутренней сферы соответствует формуле [Pt(NH3)3Cl3]+. Во внешней сфере находится один хлорид-ион, компенсирующий заряд внутренней сферы комплекса, получим формулу комплексного соединения [Pt(NH3)3Cl3]Cl.
Диссоциация комплексного соединения проходит по схеме:
[Pt(NH3)3Cl3]Cl3 ⇔ [Pt(NH3)3Cl3]3+ + Cl–
Координационное число центрального атома показывает общее число 
Задача 717.
Известны две комплексные соли кобальта, отвечающие одной и той же эмпирической формуле
CoBrSO4 . 5NH3. Различие между ними проявляется в том, что раствор одной соли дает с ВаСI2 осадок, но не образует осадка с AgNO3, раствор же другой соли, наоборот, дает осадок с AgNO3, но не дает осадка с ВаСI2. Написать координационные формулы обеих солей и уравнения их диссоциации на ноны.
Решение:
а) Так как соль CoBrSO4 . 5NH3 в растворе с ВаСI2 даёт осадок, то это означает, что в растворе присутствуют ионы SO42-, а ионы Br- входят в состав внутренней сферы, потому что не образуется осадок с AgNO3. Следовательно, состав внутренней сферы соответствует формуле [Co(NH3)Br]2+. Во внешней сфере находится ион SO42-, компенсирующий заряд внутренней сферы комплекса [Co(NH3)Br]SO4. Диссоциация комплекса в растворе соли протекает по схеме:
[Co(NH3)Br]SO4 ⇔ [Co(NH3)Br]2+ + SO42-
б) Так как соль CoBrSO4 . 5NH3 в растворе с ВаСI2 не даёт осадок, то ион SO42- входит в состав внутренней сферы комплексного иона, образование осадка с AgNO3 указывает на то, что бромид-ион входит в состав внешней сферы комплекса, получим формулу комплексного иона: [Co(NH3)SO4]+. Во внешней сфере находится ион Br-, компенсирующий заряд внутренней сферы комплекса [Co(NH3)SO4]Br.
Диссоциация комплекса в растворе протекает по схеме:
[Co(NH3)SO4]Br ⇔[Co(NH3)SO4]+ + Br–.
Задача 718.
К раствору, содержащему 0,2335 г комплексной соли CoCl3 . 4NH3, добавили в достаточном количестве раствор AgNO3. Масса осажденного АgСI составила 0,1435 г. Определить координационную формулу соли.
Решение:
Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 (относятся) прямо пропорциональны их молярным массам (объёмам) эквивалентов:
Подставив в данное соотношение массы реагирующих веществ и молярную массу эквивалента хлорида серебра (МЭ(AgNO3) = M/1 = 143,32 г/моль), рассчитаем молярную массу эквивалента комплексного соединения, получим:
Так как