Химия. Как составить формулу летучего водородного соединения с элементов ПСХЭ.
Ученик
(154),
закрыт
7 лет назад
Дополнен 10 лет назад
Химия. Как составить формулу летучего водородного соединения и с какими элементами можно а с какими нельзя
Глеб
Мастер
(1871)
10 лет назад
Летучие водородные соединения бывают только для элементов IVA, VA, VIA, VIIA групп.
Берете элемент из данных групп присоединяете к нему водород с учетом валентности.
Водород всегда I валентен (степень окисления в летучих водородных соединениях: +1).
Например: ЛВС (летучие водородное соединение) углерода: CH4, т. к углерод IV валентен, а водород одновалентен, работает правило “креста”, валентности крест-накрест. Второй пример: фосфин PH3, фосфор III валентен, водород одновалентен (крест-накрест) . Третий пример: сероводород H2S, сера двухвалентна, крест-накрест (единицы не пишутся, поэтому после серы нечего нет) . Четвертый пример: HBr, оба одновалентны поэтому не каких индексов нет.
Источник: головной мозг
Фосфин PH3 – соединение фосфора с водородом – бесцветный газ с
резким неприятным чесночным запахом, хорошо растворимый в воде
(химически с ней не взаимодействует), очень ядовит. На воздухе чистый и
сухой фосфин загорается при нагревании выше 100-140°С. Если фосфин
содержит примеси дифосфина Р2Н4, он самовоспламеняется на воздухе.
1. P – фосфор порядковый номер:
Z = N(p+) = N(e) = 15,
A = 31, N(n0) = A – Z = 31 – 15 = 16
Фосфор P находится в III периоде, V группе главной подгруппе. +15P 2e, 8e, 5e
2. P – неметалл
3. Неметаллические свойства N > P > As
4. Неметаллические свойства Si < P < S
5. Высший оксид P2O5 – кислотный
6.Высший гидроксид H4PO4 – кислотный
7.Летучее водородное соединение PH3 – фосфин
1. K – калий порядковый номер:
Z = N(p+) = N(e) = 19,
A = 39, N(n0) = A – Z = 39 – 19 = 20
Калий K находится в IV периоде, I группе главной подгруппе. +19K 2e, 8e, 8e, 1e
2. K – металл
3. Металлические свойства Na < K < Rb
4. Металлические свойства K > Ca
5. Высший оксид K2O – основный
6.Высший гидроксид KOH – основный
7.Летучего водородного соединения нет.
0 голосов
37 просмотров
Помогите плиз! Составить формулу летучего водорода соединения для неметаллов серы
- помогите
- составить
- формулу
- летучего
- водорода
- соединения
- 5 – 9 классы
- химия
Химия
CoCaine56_zn
13 Март, 18
|
37 просмотров
Дано ответов: 2
0 голосов
Правильный ответ
Летучее водородное соединения для элемента серы будет иметь вид: H2S
тайная_zn
13 Март, 18

0 голосов
Летучие водородные соединения – это бинарные соединения водорода являющиеся газом при нормальных условиях. В данном случае это сероводород Н2S.
Sawyerkа_zn
13 Март, 18

Обновлено: 22.05.2023
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
Проследим сначала, как изменяются свойства водородных соединений неметаллов в периодах слева направо. Так, например, рассмотрим свойства водородных соединений металлов 2-го периода – азота и фтора. Аммиак NH3 обладает основными свойствами, а фтороводород HF – кислотными. Такими же свойствами обладают водородные соединения элементов 3-го периода – фосфин PH3 и хлороводород HCl.
Следовательно, в периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливаются.
1. В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
2. В группах сверху вниз отрицательно заряженные анионы (например, F – , Cl – , Br – , I – ) всё слабее притягивают положительно заряженные ионы водорода H + . В связи с этим облегчается процесс отщепления ионов водорода H + и кислотные свойства водородных соединений увеличиваются.
3. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
4. Окислительная активность водородных соединений неметаллов в группах сверху вниз сильно увеличивается. Например, окислить фтор из водородного соединения HF химическим путём нельзя, окислить же хлор из водородного соединения HCl можно различными окислителями. Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.
3. Задача № 10. Решение.Первичные амины (СnH2n+1NH2) при взаимодействии с кислотами образуют соли алкиламмония:
СnH2n+1NH2 + HBr = [СnH2n+1NH3]+Br-.
К сожалению, по массе амина и образовавшейся соли мы не сможем найти их количества (поскольку неизвестны молярные массы). Пойдем по другому пути. Вспомним закон сохранения массы: m(амина) + m(HBr) = m(соли), следовательно, m(HBr) = m(соли) – m(амина) = 11,2 – 3,1 = 8,1.
По массе бромоводорода находим количество, n(HBr) = n(амина), M(амина) = 31 г/моль.
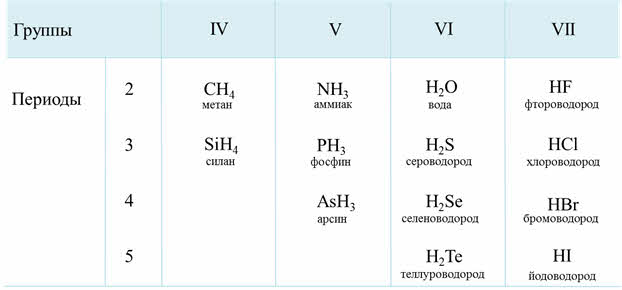
Общие формулы водородных соединений (гидридов)
| Общие формулы водородных соединений по группам | ||||||
| I | II | III | IV | V | VI | VII |
| R +1 H -1 | R +2 H2 -1 | R +3 H3 -1 | R -4 H4 +1 | R -3 H3 +1 | H2 +1 R -2 | H +1 R -1 |
| Нелетучие водородные соединения | Летучие водородные соединения |
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
Проследим сначала, как изменяются свойства водородных соединений неметаллов в периодах слева направо. Так, например, рассмотрим свойства водородных соединений металлов 2-го периода – азота и фтора. Аммиак NH3 обладает основными свойствами, а фтороводород HF – кислотными. Такими же свойствами обладают водородные соединения элементов 3-го периода – фосфин PH3 и хлороводород HCl.
Следовательно, в периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливаются.
1. В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
2. В группах сверху вниз отрицательно заряженные анионы (например, F – , Cl – , Br – , I – ) всё слабее притягивают положительно заряженные ионы водорода H + . В связи с этим облегчается процесс отщепления ионов водорода H + и кислотные свойства водородных соединений увеличиваются.
3. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
4. Окислительная активность водородных соединений неметаллов в группах сверху вниз сильно увеличивается. Например, окислить фтор из водородного соединения HF химическим путём нельзя, окислить же хлор из водородного соединения HCl можно различными окислителями. Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.

3. Задача № 10. Решение.Первичные амины (СnH2n+1NH2) при взаимодействии с кислотами образуют соли алкиламмония:
СnH2n+1NH2 + HBr = [СnH2n+1NH3]+Br-.
К сожалению, по массе амина и образовавшейся соли мы не сможем найти их количества (поскольку неизвестны молярные массы). Пойдем по другому пути. Вспомним закон сохранения массы: m(амина) + m(HBr) = m(соли), следовательно, m(HBr) = m(соли) – m(амина) = 11,2 – 3,1 = 8,1.
По массе бромоводорода находим количество, n(HBr) = n(амина), M(амина) = 31 г/моль.
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстроиспаряемые.
Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотерные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.
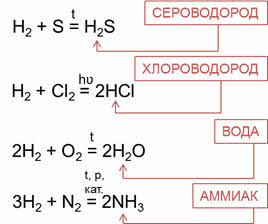
Так, углероду соответствует водородное соединение – метан, кремнию – силан, азоту – аммиак, фосфору – фосфин, мышьяку – арсин, кислороду – вода, сере – сероводород, селену – селеноводород, тэллуру – тэллуроводород, фтору – фтороводород, хлору – хлороводород, брому – бромоводород, йоду – йодоводород.
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
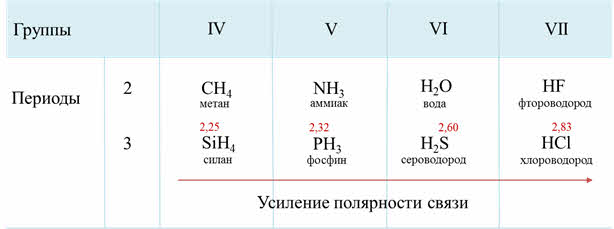
В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.
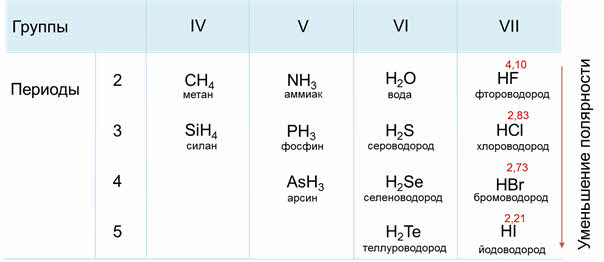
Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.
Если рассмотреть водородные соединения неметаллов третьего периода, то здесь можно проследить следующую закономерность: при растворении в воде силана не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность связи в молекулах возрастает, поэтому усиливаются кислотные свойства.
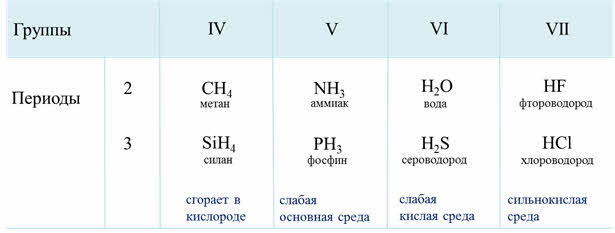
В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
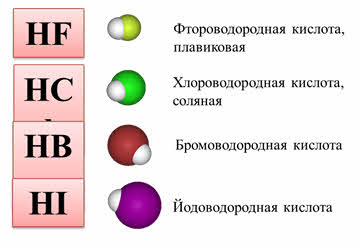
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.
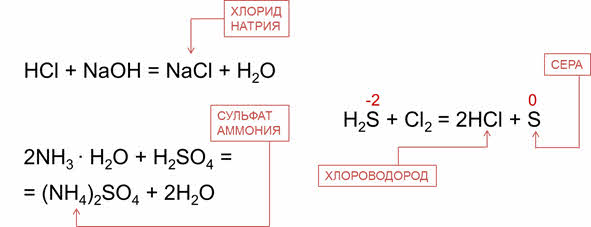
Например, водный раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Домашнее задание: выполните в тетрадь один из предложенных вариантов.
Цель: Рассмотрите строение метана и силана, особенности их свойств.
1. Строение молекулы метана.
а) определите тип химической связи, изобразите механизм образования химической связи в молекуле метана;
б) составьте электронную и структурную формулы метана;
в) охарактеризуйте пространственное строение метана;
г) исчерпаны ли валентные возможности атома углерода в молекуле метана;
д) метан (н.у.) устойчив на воздухе, а силан воспламеняется. Почему?
2. Химические свойства метана.
а) отношение к воде;
б) взаимодействие с галогенами, азотной и серной кислотами. Составьте УХР этих взаимодействий.
в) отношение к нагреванию без доступа кислорода воздуха. Составьте УХР разложения метана.
г) взаимодействие СН4 и SiH4 с кислородом. Составьте УХР горения метана и силана. Чем отличаются реакции взаимодействия с кислородом метана и силена?
Аммиак и фосфин.
Цель: Изучить строение и свойства водородных соединений азота и фосфора.
1. Строение молекул аммиака и фосфина.
а) определите тип химической связи в молекулах NH3 и PH3. Какой тип кристаллической решетки имеют вещества?
б) опишите физические свойства этих соединений.
в) составьте электронную формулу аммиака, охарактеризуйте пространственное строение аммиака.
2. Химические свойства аммиака.
а) отношение аммиака к воде и кислотам. Составьте УХР этих взаимодействий.
б) окислительно – восстановительные свойства аммиака. Составьте УХР следующих взаимодействий:
– взаимодействие с кислородом при различных условиях;
– взаимодействие с оксидом меди ( II );
– хлор и бром энергично окисляют аммиак до азота.
Чем в этих ОВР выступает аммиак?
Демонстрация: Получение аммиака и растворение его в воде.
Цель: Изучить строение молекулы воды и ее свойства.
1. Строение воды
а) Составьте электронную и структурную формулы молекулы воды;
б) Каково пространственное строение молекулы воды?
в) Исчерпаны ли валентные возможности воды?
г) Физические свойства воды.
2. Химические свойства воды.
а) отношение воды к неорганическим веществам:
– кислотным и основным оксидам;
Составить возможные УХР.
б) отношение к органическим веществам:
– сложным эфирам (жирам);
Составьте возможные УХР.
в) окислительно-восстановительные свойства воды:
– взаимодействие воды с натрием, углем.
Цель: Изучить строение и свойства сероводорода.
1. Строение молекулы сероводорода:
а) Составьте электронную и структурную формулы молекулы H2S
б) Особенности пространственного строения молекулы сероводорода.
2. Физические и химические свойства сероводорода:
а) особенности физических свойств;
б) химические свойства:
– кислотно-основные (приведите примеры УХР, где сероводород проявляет кислотные свойства);
Составить УХР горения H 2 S в кислороде. Закончите УХР взаимодействия сероводорода с раствором перманганата калия в кислой среде (уравнять методом полуреакций).
Цель: Рассмотреть строение и свойства галогеноводородов.
1. На примере хлороводорода рассмотрите электронное строение молекулы. Изобразите электронную и структурную формулы молекулы хлороводорода.
2. Как изменяется сила кислот в ряду HF-HCl-HBr-HI? Почему?
3. Химические свойства галогеноводородов на примере HCl.
– Какими свойствами обладают водные растворы галогеноводородов? Приведите примеры кислотно-основных свойств . Составьте возможные УХР.
– охарактеризуйте отношение водородных соединений галогенов к органическим веществам:

В этом видеоуроке учащиеся узнают об основных соединениях неметаллов (оксидах, гидроксидах, водородных соединениях), их свойствах, получении и применении.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока “Соединения неметаллов. Оксиды, гидроксиды, водородные соединения”
Оксиды неметаллов делят на несолеобразующие и солеобразующие. К несолеобразующим относят оксид кремния два, оксид азота один, оксид азота два, оксид углерода два.
Все остальные оксиды являются солеобразующими. Например, оксид фосфора пять, оксид хлора семь, оксид серы шесть, оксид серы четыре. Эти солеобразующие оксиды являются кислотными.
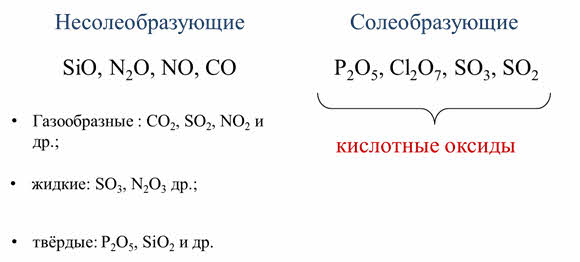
Среди них есть газообразные, как оксид углерода четыре, оксид серы четыре, оксид азота четыре и другие, а также жидкие, как оксид серы шесть, оксид азота три и другие; твёрдые, как оксид фосфора пять, оксид кремния четыре и другие.
Все кислотные оксиды – это ангидриды кислот. Например, оксид углерода четыре – ангидрид угольной кислоты, оксид фосфора пять – ангидрид фосфорной кислоты.
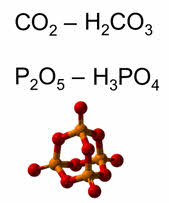
Все кислотные оксиды, кроме оксида кремния четыре, растворяются в воде с образованием гидроксидов, которые по характеру являются кислотами. При растворении оксида фосфора пять в воде образуется фосфорная кислота.
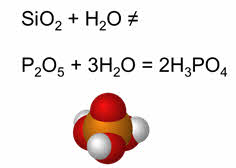
В оксидах неметаллов элемент-неметалл имеет положительные степени окисления, причём этих степеней окисления может быть несколько и тогда неметалл может образовывать несколько оксидов.
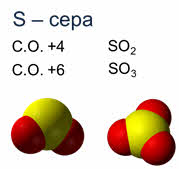
Например, сера в степени окисления плюс четыре образует оксид серы четыре, в степени окисления плюс шесть – оксид серы шесть, азот также имеет несколько степеней окисления.
Так, азот в степени окисления плюс один образует оксид азота один, азот в степени окисления плюс два образует оксид азота два, азот в степени окисления плюс три – оксид азота три, в степени окисления плюс четыре – оксид азота четыре, в степени окисления плюс пять – оксид азота пять.

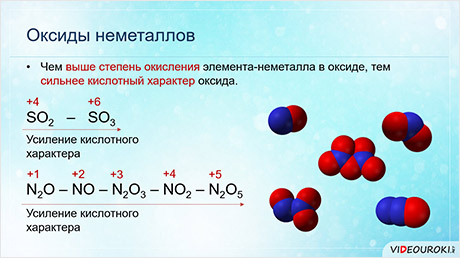
Чем выше степень окисления элемента-неметалла в оксиде, тем сильнее кислотный характер оксида. Так кислотные свойства оксида серы шесть выражены сильнее, чем оксида серы четыре.
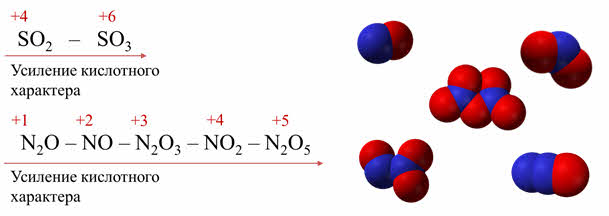
Тоже самое наблюдается в ряду оксидов азота: начиная с оксида азота один до оксида азота пять идёт усиление кислотных свойств оксидов, так как увеличивается степень окисления элемента-неметалла.
Оксиды неметаллов – это соединения с полярной ковалентной связью. Кристаллические решётки у этих оксидов могут быть молекулярные, как у оксида углерода четыре, оксида серы шесть, и атомные, как у оксида кремния четыре.
По периоду слева направо усиливается кислотный характер оксида. Так у оксида серы шесть кислотные свойства выражены сильнее, чем у оксида кремния четыре, так как по периоду также увеличивается высшая степень окисления элементов-неметаллов в соединениях.
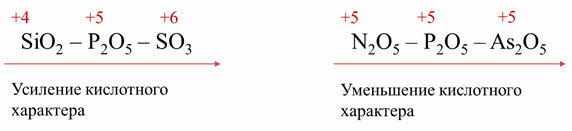
В группах главных подгруппах сверху вниз кислотный характер оксидов ослабевает, поэтому в пятой A группе кислотные свойства оксида азота пять будут выражены сильнее, чем у оксида мышьяка пять. Так как в группе сверху вниз увеличивается радиус иона неметалла, но степень окисления не изменяется.
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и его радиуса атома.
Оксидам неметаллов соответствуют гидроксиды – кислородсодержащие кислоты. Изменение силы кислоты зависит от степени окисления неметалла, радиуса атома.
Например, оксидам азота три и пять соответствуют кислоты – азотистая и азотная. Азотная кислота является более сильной, чем азотистая и-за того, что в азотной кислоте степень окисления азота плюс пять, а в азотистой плюс три.
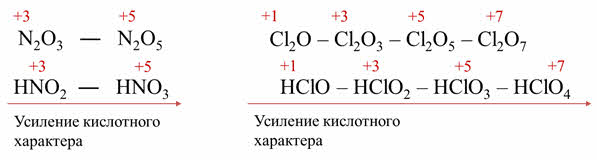
Кислотные свойства оксидов хлора также усиливаются с увеличение степени окисления атома хлора, поэтому и сила кислоты, которой соответствует данный оксид, также будет увеличиваться. Поэтому в ряду от хлорноватистой до хлорной кислоты идёт увеличение силы кислоты.
Таким образом, в периодах слева направо идёт увеличение заряда ядра атома неметалла, поэтому наблюдается усиление кислотных свойств гидроксидов, образованных оксидами неметаллов.

Например, хлорная кислота является более сильной, чем кремниевая, потому что степень окисления хлора в хлорной кислоте плюс семь, а кремния в кремниевой кислоте плюс четыре, а радиус иона неметалла уменьшается от кремниевой до хлорной кислоты.
В группах сверху вниз кислотный характер гидроксидов, образованных оксидами неметаллов, ослабевает. Например, серная кислота является более сильной, чем тэллуровая, так как радиус иона неметалла в этом ряду возрастает, а степень окисления неметалла не изменяется, и остаётся плюс шесть.

Все оксиды и гидроксиды, образованные элементами в максимальной степени окисления всегда окислители. Так, в реакции оксида серы шесть с сероводородом сера в степени окисления плюс шесть понижает свою степень окисления до плюс четырёх, поэтому оксид серы шесть выступает в роли окислителя, в реакции серной кислоты с медью, серная кислота также является окислителем, потому что сера понижает свою степень окисления с плюс шести до плюс четырёх.
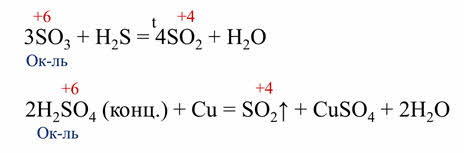
Если же в оксиде или гидроксиде элемент-неметалл проявляет промежуточную степень окисления, то эти соединения могут быть и окислителями, и восстановителями.
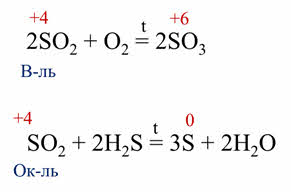
Так, в реакции оксида серы четыре с кислородом образуется оксид серы шесть. Оксид серы четыре в данной реакции является восстановителем, так как сера повышает свою степень окисления с плюс четырёх до плюс шести. В реакции оксида серы четыре с сероводородом, образуется сера и вода. В этой реакции оксид серы четыре является окислителем, так как сера понижает свою степень окисления с плюс четырёх до нуля.
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстроиспаряемые.

Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотэрные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.

Так, углероду соответствует водородное соединение цэ-аш-четыре – метан, кремнию – силан, азоту – аммиак, фосфору – фосфин, мышьяку – арсин, кислороду – вода, сере – сероводород, селену – селеноводород, тэллуру – тэллуроводород, фтору – фтороводород, хлору – хлороводород, брому – бромоводород, йоду – йодоводород.
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.

В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.

Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.

Если рассмотреть водородные соединения неметаллов третьего периода, то здесь можно проследить следующую закономерность: при растворении в воде силана не наблюдается проявление кислотно-основного характера соединения, он сразу сгорает в кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается, полярность связи в молекулах возрастает, поэтому усиливаются кислотные свойства.

В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.

Например, водный раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль – хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства, поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.

Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :

+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
вода H2O и др. летучие водородные соединения (HCl, HBr)
кислые соли (NaHCO3 и др.)
основания NaOH, Cu(OH)2
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Читайте также:
- Виды экскурсий в туризме кратко
- Всемирный банк страны с высоким средним и низким уровнем дохода кратко и понятно
- Хрущев и интеллигенция кратко
- Западноевропейская культура 17 века кратко
- Дружба печорина и вернера кратко
Само
название «водородные соединения» говорит о том, что в состав данных
соединений входит водород. К таким соединениям относятся гидриды и
летучие водородные соединения. Давайте разберемся, в чем их отличие.
Гидриды
– это бинарные соединения металлов I
и
II A
групп
с водородом. Например: CaH2,
NaH, BaH2,
LiH. Все эти гидриды твердые,
нелетучие, тугоплавкие вещества с ионным типом связи.
Летучие
водородные соединения – это бинарные соединения неметаллов с
водородом. Эти соединения могут быть как жидкостями (например, Н2О),
так и газами (HCl,
NH3).
Рассмотрим
свойства хлороводорода – HCl.
Это бесцветный газ, тяжелее воздуха, хорошо растворим в воде. В 1 объёме
воды растворяется 500 объёмов хлороводорода. Хлороводород «дымит» на
воздухе, т.е. он поглощает пары воды из воздуха, образуя при этом туманное
облако.
Раствор
хлороводорода в воде называют соляной кислотой. Это бесцветная
жидкость, «дымит» на воздухе, тяжелее воды. Соляная кислота содержится в
желудочном соке человека и некоторых животных.
Еще
одни важным летучим водородным соединением является метан – СН4.
Метан – бесцветный газ, плохо растворим в воде, легче воздуха, не имеет
запаха. Его еще называют болотным газом, т.к. он образуется на дне болот
и водоемов при разложении растительных остатков без доступа кислорода. Кроме
того, метан содержится в природном и попутном нефтяном газе.
Известным
и распространенным водородным соединением является аммиак – NH3.
Аммиак является бесцветным газом, имеет резкий запах, в 1 объёме воды растворяется
700 объёмов аммиака, он почти в 2 раза легче воздуха. Раствор аммиака в воде
называют нашатырным спиртом, который широко используют в медицине.
Сероводород
– H2S
– тоже известное летучее водородное соединение. Он является бесцветным газом,
имеет запах тухлых яиц, ядовит, в 1 объеме воды растворяется 3 объёма
сероводорода, он тяжелее воздуха.
Оксиды
Оксиды
–
это сложные вещества, состоящие из двух элементов, одним из которых является
кислород в степени окисления -2.
В
названии оксидов сначала указывают слово оксид в
именительном падеже (от лат. названия кислорода – «оксигениум»), а затем
название элемента в родительном падеже.
Например:
CaO – оксид
кальция, K2O
– оксид калия, Al2O3
– оксид алюминия. А если элемент имеет несколько степеней
окисления или переменную валентность, то после названия оксида в скобках
римскими цифрами указывают численное значение степени окисления. Например: Fe2O3
– оксид железа (III)
(читается:
«оксид железа три»), CuO
– оксид меди (II)
(читается: «оксид меди два»), CrO3
– оксид хрома (VI)
(читается: «оксид хрома шесть»).
По
агрегатному состоянию оксиды делят на твёрдые: к ним
относятся такие оксиды, как Al2O3,
SiO2,
Fe2O3 и
др., жидкие оксиды – это H2O,
SO3,
газообразными являются такие оксиды, как СО2, NO2,
SO2 и
др.
Познакомимся
с вами с наиболее важными оксидами.
Вода
– Н2О – самое распространенное и самое
необходимое вещество на планете. Почти ¾ поверхности земного шара
занято водой. Однако, это вода морей и океанов, которая является солёной.
Она непригодна для питья, для сельского хозяйства, для промышленности. Кроме
того, тело человека на 2/3 состоит из воды. Вода составляет до 80%
массы клетки и выполняет важные функции: защитную, транспортную и др. У
некоторых медуз вода занимает почти 99% от массы тела. Содержание воды в
огурцах и арбузах превышает 90%. Большинство реакций и процессов в различных
отраслях промышленности тоже протекают в растворах. Однако запасы пресной воды
малы, всего 3% от общего объёма, поэтому нужно беречь и экономить воду.
Без воды невозможно представить жизнь человека, который потребляет ее для
бытовых нужд.
В
природе постоянно происходит круговорот воды. Под влиянием солнечного
тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются
водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в
более крупные и выпадают на землю в виде осадков: снега, дождя, града.
Круговорот
воды в природе
Еще
одним известным оксидом является диоксид углерода, углекислый газ, или оксид
углерода (IV)
– CO2.
Это бесцветный газ, не имеет запаха, в 1,5 раза тяжелее воздуха. В 1
объёме воды растворяется 1 объем углекислого газа. В воздухе содержится
0,03% (по объему) диоксида углерода.
Большое
количество углекислого газа вызывает удушье. Например, в «Собачьей
пещере» вблизи Неаполя, известной еще из древности, заходившие сюда собаки
постоянно погибали из-за скопившегося газа, который стелется по дну пещеры
слоем до полуметра. Углекислый газ образуется при дыхании, сгорании топлива,
тлении и гниении различных организмов. Большое содержание углекислого газа
в минеральной воде «Нарзан», находящейся в Кисловодске. Углекислый газ
используют для получения газированных вод, а твердый диоксид углерода, или
«сухой лед» используют для хранения продуктов питания, в частности
мороженого. Т.к. углекислый газ не поддерживает горение, его используют
для тушения пожаров. В медицине углекислый газ используют для углекислотных
ванн.
Негашеная
известь, или СаО, является белым, тугоплавким веществом,
которое энергично реагирует с водой, при этом образуется гашеная известь.
Негашеная известь применяется для получения вяжущих строительных материалов.
Основная
часть литосферы – это оксид кремния (IV)
– SiO2.
Он входит в состав минералов и горных пород. Этот оксид образует кварц,
кварцевый песок, кремнезем, горный хрусталь и др. соединения.
Еще
одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3.
Он также входит в состав минералов и горных пород. Этот оксид образует
корунд, рубин, сапфир, каолин и др. соединения.
