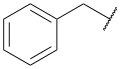
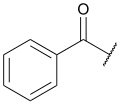
Углеводоро́дный радика́л (от лат. radix «корень»), также углеводоро́дный оста́ток в химии — группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но радикал и сам может содержать функциональные группы, поэтому с его «неизменностью» нужно быть осторожным: например, аминокислота аспарагиновая кислота содержит в той части молекулы, которая в общем виде рассматривается как остаток аминокислоты, ещё одну карбоксильную группу.
Часто углеводородный радикал называют просто радикал, что может вызвать путаницу с понятием свободного радикала. Некоторые углеводородные радикалы могут также являться функциональными группами, например, фенил (−C6H5), винил (−C2H3) и др. Углеводородными радикалами обычно являются остатки углеводородов, которые входят в состав многих органических соединений.
Номенклатура[править | править код]
Моновалентные углеводородные радикалы[править | править код]
Название углеводородного радикала образуется от корня названия углеводорода путём прибавления к нему суффикса -ил. Суффиксы «-ен» и «-ин» сохраняются, чтобы не потерять представление о насыщенности углеводородного радикала. В более сложных углеводородных радикалах, например, полициклических, суффикс «-ан» сохраняется[1], вероятно, ввиду большей благозвучности. Перед суффиксом «-ил» указывается порядковый номер того атома углерода от начала цепи углеродных атомов радикала, у которого есть свободная валентность — кроме случая, если свободной валентностью обладает первый атом в цепи. Нумерация цепи идёт от конца, ближайшего к свободной валентности. В случае, если в углеродной цепи с одной стороны атома со свободной(-ыми) валентностью(-ями) все атомы водорода замещены, то атом со свободными валентностями считается первым в цепи. Ранее использовался и в тривиальных названиях используется характер атома со свободной валентностью — первичный, вторичный (сек- или втор-), третичный (терц- или трет-) (см. далее). В тривиальных наименованиях используются также корни исторически сложившихся названий веществ или связанных с ними понятий. Например:
- −CH3 — метил (метан + -ил)
- −C2H5 — этил (этан + -ил)
- -CH2-CH=CH-CH3 — бут-2-енил

- Вверху изображён спиро[4.5]декан-8-ил.
— проп-2-ил или изопропил
- -CH2-CH(CH3)2 — 2-метилпропил или изобутил
- -CH(CH3)-CH2-CH3 — бут-2-ил или сек-бутил, или втор-бутил
- −C6H5 — фенил (фен[2] + -ил)
- -CH=CH2 — винил[3]
Поливалентные углеводородные радикалы[править | править код]
Если радикал способен присоединиться к атому углерода с образованием двойной или тройной связи или присоединиться сразу к нескольким атомам углерода (т. е., имеет несколько свободных валентностей), он называется поливалентным (в конкретном случае — би-, тривалентным, и т. д.). Названия таких радикалов строятся путём присоединения к корню названия углеводорода суффикса «-илиден» или «-илидин» соответственно. Ранее исключениями из этого правила были метилен и метин (но не теперь); впрочем, применяются и эти названия.
l-соглашение[править | править код]
Поливалентные углеводородные радикалы также могут быть поименованы согласно l-соглашению. В этом случае название строится по схеме: [заместитель при атоме со свободной валентностью] — [порядковый номер атома со свободной валентностью] ln — [название углеводорода, который получился бы при образовании на месте свободных валентностей связей с атомами водорода]. n здесь — количество свободных валентностей, которыми обладает атом.
Примеры[править | править код]
- >CH-CH3 — этилиден
- >C6H4 — фенилиден (есть 3 изомера: «1,2-», «1,3-» и «1,4-», или орто-, мета- и пара-)
- Справа внизу показан 6-аминил-бицикло[2.2.2]окт-4-ен-2-илиден или 6-аминил-2l2-бицикло[2.2.2]окт-4-ен
Обозначение в формулах[править | править код]
Если не принципиально, какой углеводородный радикал находится в молекуле, то часто его обозначают просто буквой R (например, общая формула гомологического ряда спиртов — R−OH). Иногда вместо R используют символ Org. Если соединение содержит несколько разных радикалов, их обозначают R, R’, R”, R4 и т. д.
Иногда необходимо разделить ароматические, гетероциклические и алкильные радикалы. Для этого вместо символа R используют:
- для алифатических (алкил) — Alk[4] или Ak[5]
- для ароматических (арил) — Ar[4][5][6]
- для гетероциклических (гетероарил) — Het[4] или Har[5]
В органической химии нередко применяют сокращенные обозначения:
- Насыщенные углеводородные радикалы:
- Метил — Me[5][6][7], например, метанол MeOH
- Этил — Et[5][6][7], например, диэтиловый эфир Et2O
- Пропил — Pr[5][6][7], например, (N,N-дипропил)-аминопропан (трипропиламин)
- Изопропил — i-Pr[5], например, изопропилбензол
- Бутил — Bu[5][6][7]
- трет-бутил — t-Bu[5]
- Пентил — Pe[5][7]
- Гексил — Hx[5][7]
- Гептил — Hp[7]
- Октил — Oc[5][7]
- Нонил — Nn[7]
- Ненасыщенные углеводородные радикалы:
- Аллил — All[4]
- Винил — Vin[4], Vi[5]
- Циклические углеводородные радикалы (циклоалкилы):
- Адамантил — Ad[8] или Adm[5]
- Циклогексил — Cy[6]
- Циклопентадиенил — Cp[6][8]
- Ароматические углеводородные радикалы (арилы):
- Фенил — Ph[5][6], например, фенол PhOH
- Фенилен — Pn[5]
- Бензил — Bn[6][8]
- Мезитил (2,4,6-триметилфенил) — Mes[6]
- Толил — Tol[8]
- Тритил (трифенилметил) — Tr[6][8]
- Полициклические ароматические углеводородные радикалы (полициклические арилы):
- Антраценил — An[5]
- Пиренил — Pyr[5]
- Периленил — Per[5]
- Тетраценил — Tet[5]
- Нафтил — Nh[5]
- Гетероциклические углеводородные радикалы (гетероарилы):
- Пиридил — Py[4][5]
- Тиенил — Tp[5]
- Фурил — Fr[5]
- Сульфонилы:
- Метилсульфонил (мезил) — Ms[6]
- Толилсульфонил (тозил) — Ts[4][6][8] или Tos
- Трифлил (то есть, трифторметилсульфонил
) — Tf[4][6][8]
- Карбонилы:
- Ацетил — Ac[4][6]
- Ацил — Acyl[7]
- Бензоил — Bz[4][6][8]
- Бензилоксикарбонил — Cbz[6]
- Гликолоил (гидроксиацетил) — Gc[7]
- Карбамоил — Cbm[4]
- Пропионил — Pp[7]
- трет-бутоксикарбонил — Boc[6][8]
- Формил — Fo (
)[7]
Иногда между обозначением характера радикала (t, i, s и др.) и остальной частью названия дефис не ставят: iPr, tBu[7]. Обозначения характера радикала принято писать курсивом.
Структурные формулы некоторых примеров изображены здесь:
-
-
Бензил
-
Бензоил
-
Трифторсульфонил
Применение[править | править код]
Тривиальные, не номенклатурные названия многих органических соединений состоят из названия углеводородного радикала и названия атомов или групп атомов, замещающих водород, например: СН3Сl — хлористый метил, C2H5Br — бромистый этил и т. д.
Первичные, вторичные, третичные и четвертичные атомы углерода[править | править код]
Тривиальные названия радикалов, как уже сказано выше, часто основаны на характере атомов углерода в радикале. Характер атома определяется так: первичный атом связан с одним атомом углерода, вторичный — с двумя и т. д. При названии радикалов используются латинские (sec-, tert-) или русские (втор-, трет-) приставки. Первичные атомы никак не обозначаются. Если на самом конце радикала есть третичный атом, добавляют приставку изо-. Радикалы с четверичными атомами имеют приставку нео-.
Разделение атомов углерода по таким критериям крайне важно при определении стабильности реагирующих органических частиц (карбкатионов, карбанионов и радикалов). Иногда этот признак обозначают символами 10, 20, 30 и 40 соответственно.
Примечания[править | править код]
- ↑ См. правила ИЮПАК на странице в Интернете. Дата обращения: 5 февраля 2009. Архивировано из оригинала 9 февраля 2015 года.
- ↑ Старое название бензола — «фен» (греч. phainō — освещаю)
- ↑ От лат. vinum (vini) — вино; винил генетически связан с винным спиртом — этанолом C2H5OH
- ↑ 1 2 3 4 5 6 7 8 9 10 11 Instructions to authors (англ.) // Chem. Heterocycl. Comp.. — 2008. — February (vol. 44, no. 2). — P. 235–241. — doi:10.1007/s10593-008-0019-3.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 Marvin Charton. Chapter 7. Effects of structural variation on organolithium сompounds // The Chemistry of Organolithium Compounds / Ed. by Z. Rappoport and I. Marek. — John Wiley & Sons, Ltd., 2004. — Т. 1. — С. 268. — 1400 с. — ISBN 0-470-84339-X.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 Guidelines for Authors (англ.). pubs.acs.org. The Journal of Organic Chemistry (2016). Дата обращения: 24 декабря 2016.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Nomenclature of Lipids. Appendixes A-C (англ.). http://www.chem.qmul.ac.uk. IUPAC. Дата обращения: 24 декабря 2016.
- ↑ 1 2 3 4 5 6 7 8 9 M.L. Waters, W.D. Wulff. Chapter 2. The Synthesis of Phenols and Quinones via Fischer Carbene Complexes // Organic Reactions / L. E. Overman (Editor-in-Chief). — John Wiley & Sons, Inc., 2008. — Т. 70. — С. 226. — 656 с. — ISBN 978-0-470-25453-0.
См. также[править | править код]
- Свободные радикалы
В этой статье мы разберем, как составлять молекулярные формулы основных классов органических соединений из информации об особенностях строения (наличие кратных связей, циклов, функциональных групп), и наоборот — как определять общую формулу гомологического ряда веществ с определенными функциональными группами, кратными связями или циклами.
Углеводороды
За основу берем формулу алканов — предельных нециклических углеводородов с одинарными связями между атомами углерода.
В молекуле линейных алканов на каждый атом углерода приходится по два атома водорода плюс по одному дополнительному атому водорода на концах углеродной цепи:
Таким образом, общая формула предельных нециклических углеводородов (алканов) — CnH2n+2.
В алкенах присутствует одна двойная связь. Двойная связь «отщипывает» от молекулы два атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна двойная связь (алкенов) CnH2n+2-2 — CnH2n.
Формулы алкенов отличаются от формул алканов с таким же количеством атомов углерода на 2 атома водорода:
C3H8 — C3H6 = 2H
Каждая пара атомов водорода определяет степень ненасыщенности молекулы. Степень ненасыщенности алкенов равна одному.
В алкинах присутствует одна тройная связь. Тройная связь «отщипывает» от молекулы уже четыре атома водорода:
| Ацетилен, этин | H-C≡C-H |
| Пропин | H-C≡C-СH3 |
| Бутин-1 | H-C≡C-СH2-СH3 |
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна тройная связь (алкинов): CnH2n+2-4 — CnH2n-2.
Формулы алкинов отличаются от формул алканов с таким же количеством атомов углерода на 4 водорода:
C3H8 — C3H4 = 4H
Степень ненасыщенности алкинов равна двум.
В алкадиенах присутствуют две двойные связи. Две двойные связи «отщипывают» от молекулы уже четыре атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть две двойные связи (алкадиенов): CnH2n+2-4 — CnH2n-2.
Степень ненасыщенности алкадиенов также равна двум.
В циклоалканах присутствуют только одинарные связи и атомы углерода образуют замкнутый цикл. Наличие цикла также уменьшает количество атомов водорода на два:
Таким образом, общая формула циклических углеводородов, в молекулах которых есть только одинарные связи (циклоалканов): CnH2n+2-2 — CnH2n.
В циклоалкенах присутствует одна одинарная связь и атомы углерода образуют замкнутый цикл. Наличие цикла и двойной связи уменьшает количество атомов водорода на четыре:
| Циклобутен |  |
Таким образом, общая формула циклических углеводородов, в молекулах которых есть одна двойная связь (циклоалкенов): CnH2n+2-4 — CnH2n-2.
Этот ряд можно продолжить и дальше:
Алкатриены — содержат три двойные связи, общая формула: CnH2n+2-6 = CnH2n-4
Алкенины — содержат одну двойную и одну тройную связь, общая формула:
CnH2n+2-6 = CnH2n-4
и так далее.
| Класс/группа | Тип связей и наличие цикла | Степень ненасыщенности | Общая формула |
| Алканы |
одинарные связи |
0 | CnH2n+2 |
| Алкены | двойная связь | 1 | CnH2n |
| Алкины | тройная связь | 2 | CnH2n-2 |
| Алкадиены | две двойные связи | 2 | CnH2n-2 |
| Циклоалканы | одинарные связи, цикл | 2 | CnH2n |
| Циклоалкены | двойная связь, цикл | 2 | CnH2n-2 |
| Циклоалкины | тройная связь, цикл | 6 | CnH2n-4 |
| Циклоалкадиены | две двойные связи, цикл | 6 | CnH2n-4 |
Определите молекулярную формулу и степень ненасыщенности гомологического ряда следующих классов органических веществ:
а) алкадиенины
б) циклоалкины
в) циклоалкатриены
г) алкендиины
а) CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
б) CnH2n-4, степень ненасыщенности 3, не хватает 6 атомов Н до алкана
в)CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
г) CnH2n-8, степень ненасыщенности 5, не хватает 10 атомов Н до алкана
Эта система работает и наоборот: знание молекулярной формулы можно определить возможный состав вещества.
Например, проанализируем формулу С3Н6.
До формулы алкана не хватает С3Н8 — С3Н6 = 2Н два атома водорода.
Степень непредельности равна одному. То есть в молекуле органического вещества есть либо цикл, либо двойная связь.
Определите возможную структуру (наличие кратных связей, циклов) молекул, которым соответствуют следующие формулы:
а) CnH2n-2
б) CnH2n-4
в) CnH2n-6
г) CnH2n-8
а) CnH2n-2, степень ненасыщенности 4, в молекуле либо две двойные связи, либо цикл и двойная связь, либо тройная связь
б) CnH2n-4, степень ненасыщенности 6, в молекуле либо три двойные связи; цикл и тройная связь; тройная связь и двойная связь и др.
в) CnH2n-6, степень ненасыщенности 8:
4 двойные связи; цикл и 3 двойные связи; две тройные связи; тройная связь и две двойные связи и др.
г) CnH2n-8, степень ненасыщенности 10:
5 двойных связей; цикл и 4 двойные связи и др.
Органическая химия радикалы таблица
Автор admin На чтение 1 мин Просмотров 1.9к. Опубликовано
| Формула | Структурная формула | Название |
| CH3 | HCH2– | Метил |
| C2H5 | CH3– CH2– | Этил |
| C3H7 | CH3– CH2– CH2– | Пропил |
| C4H9 | CH3– CH2– CH2– CH2– | Бутил |
| C5H11 | CH3– CH2– CH2– CH2– CH2– | Пентил |
| C6H13 | CH3– CH2– CH2– CH2– CH2– CH2– | Гексил |
| C7H15 | CH3– (CH2)5– CH2– | Гептил |
| C8H17 | CH3– (CH2)6– CH2– | Октил |
| C9H19 | CH3– (CH2)7– CH2– | Нонил |
| C10H21 | CH3– (CH2)8– CH2– | Декил |
Вам также может понравиться
Относительная плотность или удельный вес –
01.2к.
Растворимость – это свойство вещества растворяться
03.6к.
Индикация Оповещение Расшифровка Постоянно горит
06.9к.
Глютен, или клейковина – разновидность белка в семенах злаковых.
0269
Таблица степеней от 1 до 10 Xn 1 2 3 4 5 6 7 8 9 10
02.9к.
При назначении момента затяжки стандартизованного крепежа
0462
Таблица косинусов – значения косинусов углов записаны
02.6к.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Большинство органических соединений имеют молекулярное строение. Атомы в веществах с молекулярным типом строения всегда образуют только ковалентные связи друг с другом, что наблюдается и в случае органических соединений. Напомним, что ковалентным называется такой вид связи между атомами, который реализуется за счет того, что атомы обобществляют часть своих внешних электронов с целью приобретения электронной конфигурации благородного газа.
По количеству обобществлённых электронных пар ковалентные связи в органических веществах можно разделить на одинарные, двойные и тройные. Обозначаются данные типы связей в графической формуле соответственно одной, двумя или тремя чертами:
Кратность связи приводит к уменьшении ее длины, так одинарная С-С связь имеет длину 0,154 нм, двойная С=С связь – 0,134 нм, тройная С≡С связь – 0,120 нм.
Типы связей по способу перекрывания орбиталей
Как известно, орбитали могут иметь различную форму, так, например, s-орбитали имеют сферическую, а p-гантелеобразную форму. По этой причине связи также могут отличаться по способу перекрывания электронных орбиталей:
• ϭ-связи – образуются при перекрывании орбиталей таким образом, что область их перекрывания пересекается линией, соединяющей ядра. Примеры ϭ-связей:
• π-связи – образуются при перекрывании орбиталей, в двух областях – над и под линией соединяющей ядра атомов. Примеры π-связей:
Как узнать, когда в молекуле есть π- и ϭ-связи?
При ковалентном типе связи ϭ-связь между любыми двумя атомами есть всегда, а π-связь имеет только в случае кратных (двойных, тройных) связей. При этом:
- Одинарная связь – всегда является ϭ-связью
- Двойная связь всегда состоит из одной ϭ- и одной π-связи
- Тройная связь всегда образована одной ϭ- и двумя π-связями.
Укажем данные типы связей в молекуле бутин-3-овой кислоты:
Гибридизация орбиталей атома углерода
Гибридизацией орбиталей называют процесс, при котором орбитали, изначально имеющие разные формы и энергии смешиваются, образуя взамен такое же количество гибридных орбиталей, равных по форме и энергии.
Так, например, при смешении одной s- и трех p-орбиталей образуются четыре sp3-гибридных орбитали:
В случае атомов углерода в гибридизации всегда принимает участие s-орбиталь, а количество p-орбиталей, которые могут принимать участие в гибридизации варьируется от одной до трех p-орбиталей.
Как определить тип гибридизации атома углерода в органической молекуле?
В зависимости от того, со скольким числом других атомов связан какой-либо атом углерода, он находится либо в состоянии sp3, либо в состоянии sp2, либо в состоянии sp-гибридизации:
| Количество атомов, с которыми связан атом углерода | Тип гибридизации атома углерода | Примеры веществ |
| 4 атома | sp3 | CH4 – метан |
| 3 атома | sp2 | H2C=CH2 – этилен |
| 2 атома | sp | HC≡CH — ацетилен |
Потренируемся определять тип гибридизации атомов углерода на примере следующей органической молекулы:
- Первый атом углерода связан с двумя другими атомами (1H и 1C), значит он находится в состоянии sp-гибридизации.
- Второй атом углерода связан с двумя атомами – sp-гибридизация
- Третий атом углерода связан с четырьмя другими атомами (два С и два Н) – sp3-гибридизация
- Четвертый атом углерода связан с тремя другими атомами (2О и 1С) – sp2-гибридизация.
Радикал. Функциональная группа
Под термином радикал, чаще всего подразумевают углеводородный радикал, являющийся остатком молекулы какого-либо углеводорода без одного атома водорода.
Название углеводородного радикала формируется, исходя из названия соответствующего ему углеводорода заменой суффикса –ан на суффикс –ил.
| Формула углеводорода | Название углеводорода | Формула радикала | Название радикала |
| CH4 | метан | -CH3 | метил |
| C2H6 | этан | -С2Н5 | этил |
| C3H8 | пропан | -С3Н7 | пропил |
| СnН2n+2 | …ан | -СnН2n+1 | … ил |
Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), который отвечает за её конкретные химические свойства.
В зависимости того, какая из функциональных групп в молекуле вещества является старшей, соединение относят к тому или иному классу.
R – обозначение углеводородного заместителя (радикала).
Радикалы могут содержать кратные связи, которые тоже можно рассматривать как функциональные группы, поскольку кратные связи вносят вклад в химические свойства вещества.
Если в молекуле органического вещества содержится две или более функциональных группы, такие соединения называют полифункциональными.