В этой статье мы разберем, как составлять молекулярные формулы основных классов органических соединений из информации об особенностях строения (наличие кратных связей, циклов, функциональных групп), и наоборот — как определять общую формулу гомологического ряда веществ с определенными функциональными группами, кратными связями или циклами.
Углеводороды
За основу берем формулу алканов — предельных нециклических углеводородов с одинарными связями между атомами углерода.
В молекуле линейных алканов на каждый атом углерода приходится по два атома водорода плюс по одному дополнительному атому водорода на концах углеродной цепи:
Таким образом, общая формула предельных нециклических углеводородов (алканов) — CnH2n+2.
В алкенах присутствует одна двойная связь. Двойная связь «отщипывает» от молекулы два атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна двойная связь (алкенов) CnH2n+2-2 — CnH2n.
Формулы алкенов отличаются от формул алканов с таким же количеством атомов углерода на 2 атома водорода:
C3H8 — C3H6 = 2H
Каждая пара атомов водорода определяет степень ненасыщенности молекулы. Степень ненасыщенности алкенов равна одному.
В алкинах присутствует одна тройная связь. Тройная связь «отщипывает» от молекулы уже четыре атома водорода:
| Ацетилен, этин | H-C≡C-H |
| Пропин | H-C≡C-СH3 |
| Бутин-1 | H-C≡C-СH2-СH3 |
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна тройная связь (алкинов): CnH2n+2-4 — CnH2n-2.
Формулы алкинов отличаются от формул алканов с таким же количеством атомов углерода на 4 водорода:
C3H8 — C3H4 = 4H
Степень ненасыщенности алкинов равна двум.
В алкадиенах присутствуют две двойные связи. Две двойные связи «отщипывают» от молекулы уже четыре атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть две двойные связи (алкадиенов): CnH2n+2-4 — CnH2n-2.
Степень ненасыщенности алкадиенов также равна двум.
В циклоалканах присутствуют только одинарные связи и атомы углерода образуют замкнутый цикл. Наличие цикла также уменьшает количество атомов водорода на два:
Таким образом, общая формула циклических углеводородов, в молекулах которых есть только одинарные связи (циклоалканов): CnH2n+2-2 — CnH2n.
В циклоалкенах присутствует одна одинарная связь и атомы углерода образуют замкнутый цикл. Наличие цикла и двойной связи уменьшает количество атомов водорода на четыре:
| Циклобутен |  |
Таким образом, общая формула циклических углеводородов, в молекулах которых есть одна двойная связь (циклоалкенов): CnH2n+2-4 — CnH2n-2.
Этот ряд можно продолжить и дальше:
Алкатриены — содержат три двойные связи, общая формула: CnH2n+2-6 = CnH2n-4
Алкенины — содержат одну двойную и одну тройную связь, общая формула:
CnH2n+2-6 = CnH2n-4
и так далее.
| Класс/группа | Тип связей и наличие цикла | Степень ненасыщенности | Общая формула |
| Алканы |
одинарные связи |
0 | CnH2n+2 |
| Алкены | двойная связь | 1 | CnH2n |
| Алкины | тройная связь | 2 | CnH2n-2 |
| Алкадиены | две двойные связи | 2 | CnH2n-2 |
| Циклоалканы | одинарные связи, цикл | 2 | CnH2n |
| Циклоалкены | двойная связь, цикл | 2 | CnH2n-2 |
| Циклоалкины | тройная связь, цикл | 6 | CnH2n-4 |
| Циклоалкадиены | две двойные связи, цикл | 6 | CnH2n-4 |
Определите молекулярную формулу и степень ненасыщенности гомологического ряда следующих классов органических веществ:
а) алкадиенины
б) циклоалкины
в) циклоалкатриены
г) алкендиины
а) CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
б) CnH2n-4, степень ненасыщенности 3, не хватает 6 атомов Н до алкана
в)CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
г) CnH2n-8, степень ненасыщенности 5, не хватает 10 атомов Н до алкана
Эта система работает и наоборот: знание молекулярной формулы можно определить возможный состав вещества.
Например, проанализируем формулу С3Н6.
До формулы алкана не хватает С3Н8 — С3Н6 = 2Н два атома водорода.
Степень непредельности равна одному. То есть в молекуле органического вещества есть либо цикл, либо двойная связь.
Определите возможную структуру (наличие кратных связей, циклов) молекул, которым соответствуют следующие формулы:
а) CnH2n-2
б) CnH2n-4
в) CnH2n-6
г) CnH2n-8
а) CnH2n-2, степень ненасыщенности 4, в молекуле либо две двойные связи, либо цикл и двойная связь, либо тройная связь
б) CnH2n-4, степень ненасыщенности 6, в молекуле либо три двойные связи; цикл и тройная связь; тройная связь и двойная связь и др.
в) CnH2n-6, степень ненасыщенности 8:
4 двойные связи; цикл и 3 двойные связи; две тройные связи; тройная связь и две двойные связи и др.
г) CnH2n-8, степень ненасыщенности 10:
5 двойных связей; цикл и 4 двойные связи и др.
Как вывести молекулярную формулу углеводорода
Углеводород – это органическое вещество, в состав которого входят только два элемента: углерод и водород. Он может быть предельным, непредельным с двойной или тройной связью, циклическим и ароматическим.

Инструкция
Предположим, у вас есть такие данные: плотность углеводорода по водороду – 21, массовый процент водорода составляет 14,3%, массовый процент углерода составляет 85,7%. Определить формулу данного углеводорода.
Найдите молярную массу этого вещества, исходя из его плотности по водороду. Помните, что молекула водорода состоит из двух атомов. Таким образом, вы получите 21*2 = 42 г/моль.
Затем вычислите, какова массовая доля углерода и водорода в молярной массе. 42*0,857 = 35,994 г – для углерода, 42*0,143 = 6,006 г – для водорода. Округлив эти величины, получите: 36г и 6 г. Следовательно, в одной молекуле данного вещества содержится 36/12 = 3 атома углерода и 6/1 = 6 атомов водорода. Формула вещества: С3Н6 – это пропилен (пропен), непредельный углеводород.
Или вам даны такие условия: при окислении, то есть при сгорании газообразного углеводорода, плотность паров которого по воздуху равна 0,552, образовалось 10 г углекислого газа и 8,19 г водяного пара. Требуется вывести его молекулярную формулу.
Запишите общее уравнение окисления углеводорода: СnНm + O2 = CO2 + H2O.
Молярная масса углеводорода 0,552*29 = 16,008 г/моль. Собственно, уже на этом задачу можно было бы считать решенной, поскольку очевидно, что только один углеводород удовлетворяет этому условию – метан, СН4. Но доведите решение до конца:
В 10 г углекислого газа содержится 10*12/44 = 2,73 г углерода. Следовательно, это же количество углерода содержалось в исходном углеводороде. В 8,19 г водяного пара содержалось 8,19*2/18 = 0,91 г водорода. Следовательно, такое же количество водорода было в исходном веществе. А общая масса углеводорода составляет: 2,73 + 0,91 = 3,64 г.
Вычислите массовые проценты компонентов: 2,73/3,64 = 0,75 или 75% для углерода, 0,91/3,64 = 0,25 или 25% для водорода. Вы опять видите, что таким условиям удовлетворяет только одно вещество – метан. Задача решена.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
определим молекулярную формулу углеводорода, в котором содержится (85,71)
%
углерода и (14,29)
%
водорода. Известно, что относительная плотность этого углеводорода по воздуху составляет (0,966).
Первый вариант решения
1. В веществе содержатся только атомы углерода и водорода, значит, его формулу можно записать так —
CxHy
. Индексы в формуле показывают отношение количеств атомов:
x:y=n(C):n(H).
По массовым долям определяем, что в (100) г углеводорода содержится (85,71) г углерода и (14,29) г водорода.
Найдём количества этих элементов:
x=m(C)Ar(C)=85,71 г12 г/моль=7,1425 моль;
y=m(H)Ar(H)=14,29г1г/моль=14,29моль;
x:y=7,1425:14,29=7,14257,1425:14,297,1425=1:2.
Значит, простейшая формула углеводорода —
CH2
.
2. Определим относительную молекулярную массу вещества и сравним её с массой
CH2
:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
Mr(CxHy)Mr(CH2)=2814=2.
Следовательно, молекулярная формула вещества
(CH2)2=C2H4.
Второй вариант решения
1. Определим относительную молекулярную массу углеводорода:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
2. Найдём число атомов углерода и водорода в молекуле:
x=Mr(C)⋅w(C)Ar(C)⋅100%=28⋅85,71%12⋅100%=2;
y=Mr(CxHy)⋅w(H)Ar(H)⋅100%=28⋅14,29%1⋅100%=4.
Установление формулы органического вещества
Установление строения химического соединения является предметом научного исследования. Сложность данной проблемы зависит от сложности строения соединения. Первым этапом исследования, как правило, является определение молекулярной формулы вещества. Рассмотрим некоторые способы установления формул органических веществ на достаточно простых примерах.
Пример 1. Более двух столетий назад химики уже умели определять качественный и количественный состав веществ. Например, было известно, что в состав одного из органических веществ входят углерод и водород, причём массовая доля углерода составляет 75 %, а водорода — 25 %. То есть в 100 г вещества содержится 75 г углерода и 25 г водорода. Используя эти данные, определите формулу органического вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его молекулярную формулу можно представить в виде CxHy. Таким образом, решение задачи сводится к нахождению индексов x и y в формуле вещества. Индексы x и y в формуле показывают количества атомов углерода и водорода в молекуле органического вещества, поэтому на первом этапе решения подобных задач необходимо найти простейшее целочисленное соотношение между количеством атомов углерода и водорода в неизвестном веществе:
x : y = n(C) : n(H).
По условию, масса атомов углерода равна 75 г, водорода — 25 г. Тогда:
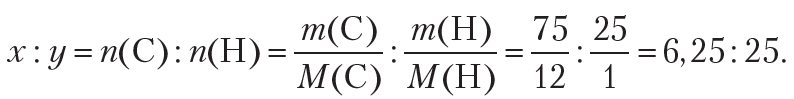
Точность промежуточных вычислений должна соответствовать точности исходных данных, то есть промежуточные значения должны содержать не меньше значащих цифр, чем данные задачи.
Видно, что полученное соотношение не является целочисленным. Чтобы получить целочисленные значения индексов x и y, выполняют следующие действия: сначала все числа полученного соотношения делят на наименьшее (в одном случае уже будет единица), и при необходимости умножают полученные числа на натуральное число (2, 3 и т. д.) для получения целочисленного соотношения:
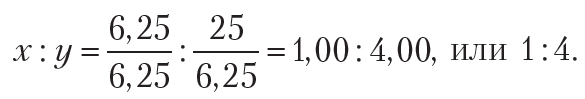
Тогда формула соединения — CH4. Это вещество нам хорошо известно, оно называется метан.
О т в е т: СН4.
Пример 2. Некоторое органическое вещество состоит из углерода и водорода. Массовая доля углерода в веществе составляет 82,8 %. Установите молекулярную формулу вещества.
Поскольку неизвестное органическое вещество состоит только из углерода и водорода, то его формула — CxHy. В условии задачи даны массовые доли элементов в веществе. В таких случаях при решении задачи удобно рассмотреть определённую массу вещества, которую обычно принимают равной 100 г. В этом случае массовые доли элементов будут совпадать по величине с их массами. Тогда простейшее целочисленное соотношение индексов в формуле вещества:
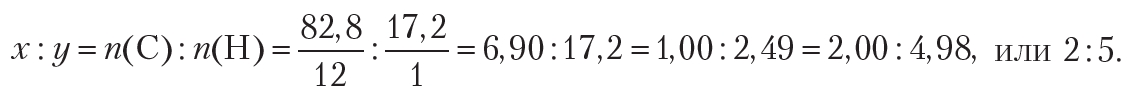
Следовательно, простейшая формула органического вещества — С2Н5. Устойчивого органического вещества с такой формулой не существует. Действительно, формула С2Н5 соответствует этильному радикалу. Чтобы определить истинную формулу органического вещества, будем учитывать, что удвоение, утроение и т. д. индексов в формуле не изменяет соотношение между ними. Удвоив индексы в простейшей формуле С2Н5, получим формулу С4Н10. Эта формула соответствует углеводороду бутану. Таким образом, истинная формула вещества — С4Н10.
О т в е т: С4Н10.
В рассмотренных примерах для определения формулы органического вещества нам было достаточно знать лишь массовые доли элементов в веществе. В то же время, в некоторых случаях, зная лишь массовые доли элементов в веществе, можно определить только простейшую, но не истинную формулу. В таких случаях для установления истинной формулы необходимы дополнительные данные. Как правило, это сведения о молярной массе соединения.
Пример 3. Молярная масса углеводорода равна 42 г/моль. Массовая доля углерода в углеводороде составляет 85,7 %. Установите молекулярную формулу углеводорода.
Формула углеводорода — CxHy. Найдём простейшее целочисленное соотношение индексов в формуле вещества:
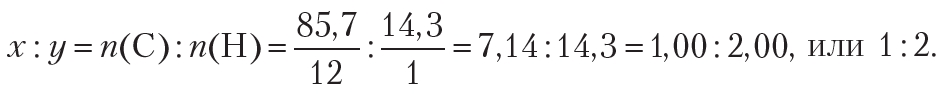
Следовательно, простейшая формула углеводорода — СН2. Удвоив индексы в простейшей формуле СН2, получим формулу С2Н4. Эта формула соответствует углеводороду этилену. Если утроить индексы в простейшей формуле СН2, то получится формула С3Н6. Данная формула соответствует углеводороду пропилену. То есть, найденному соотношению индексов соответствует множество веществ, поэтому в данном случае, используя лишь массовые доли элементов, невозможно установить истинную формулу вещества.
Для установления истинной формулы сравним молярную массу углеводорода с молярной массой простейшей формулы CH2:
![]()
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2 в 3 раза. Тогда истинная формула углеводорода — C3H6.
О т в е т: С3Н6.
В составе органических соединений, наряду с углеродом и водородом, часто присутствует кислород. Выведем молекулярную формулу кислородсодержащего соединения.
Пример 4. Установите простейшую формулу вещества, содержащего 37,50 % углерода, 12,50 % водорода и 50,00 % кислорода (по массе).
Простейшее целочисленное соотношение индексов в формуле вещества:
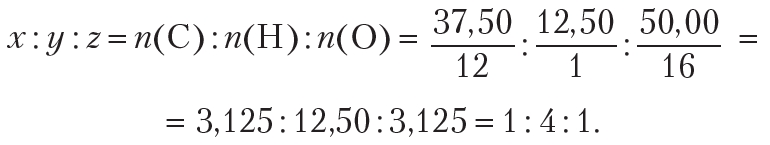
Простейшая формула вещества СН4О. Этой молекулярной формуле соответствует метиловый спирт ![]() .
.
О т в е т: СН4О или ![]() .
.
В рассмотренных примерах для установления формул мы использовали сведения о массовых долях элементов в веществе. Формулу органического вещества можно вывести также на основании данных эксперимента по сжиганию определённой массы органического вещества.
Пример 5. В результате сжигания 1,50 г органического вещества получено 2,20 г углекислого газа и 0,90 г воды. Молярная масса вещества равна 60 г/моль. Установите формулу вещества.
Поскольку при сжигании вещества образовались только углекислый газ и вода, то в состав вещества могли входить лишь атомы углерода, водорода и кислорода. Тогда формула вещества — CxHyOz. Соотношение индексов в формуле будем находить из условия:
x : y : z = n(C) : n(H) : n(O).
Составим схему реакции:
![]()
Из схемы реакции видно, что углерод из органического вещества переходит в CO2, водород — в H2O. Таким образом количества углерода и водорода в CO2 и H2O будут такими же, как в органическом веществе.
Найдём количество углерода в CO2:
![]()
В молекуле воды содержится два атома водорода, следовательно, количество (моль) водорода в два раза больше количества воды:
![]()
Определим количество (моль) атомов кислорода в веществе. Для этого рассчитаем массы углерода и водорода в данной порции вещества:

Рассчитаем массу и количество кислорода в веществе:
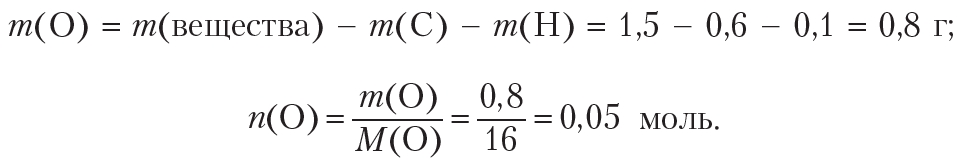
Простейшее целочисленное соотношение индексов в формуле вещества:
x : y : z = n(C) : n(H) : n(O) = 0,05 : 0,1 : 0,05 = 1 : 2 : 1.
Таким образом, простейшая формула органического вещества СН2O.
Для установления истинной формулы сравним молярную массу вещества с молярной массой простейшей формулы — CH2O:
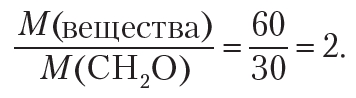
Следовательно, чтобы получить истинную формулу, необходимо увеличить индексы в простейшей формуле CH2O в два раза. Тогда истинная формула вещества — C2H4O2. Одним из веществ, имеющих такую молекулярную формулу, является уксусная кислота СН3 — СООН.
О т в е т: C2H4O2.
Обобщим вышеизложенное. Зная количества (моль) элементов в веществе можно установить простейшую формулу вещества. Для вывода истинной формулы зачастую необходимы дополнительные данные, например сведения о молярной массе вещества.
Вывод формулы органического вещества обычно состоит из следующих этапов:
а) вычисление количества (моль) элементов в веществе;
б) определение простейшего целочисленного соотношения между вычисленными количествами элементов — установление простейшей формулы вещества;
в) установление истинной формулы вещества.
Для установления простейшей формулы достаточно знать количества (моль) элементов в веществе.
Для определения истинной формулы часто требуются дополнительные данные, например сведения о молярной массе вещества.

CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
