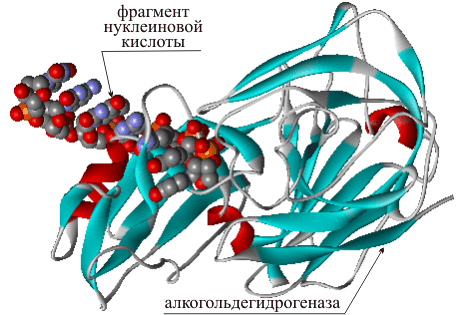
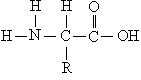У этого термина существуют и другие значения, см. Белки (значения).
Белки́ (протеи́ны, полипепти́ды[1]) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций создают молекулы белков с большим разнообразием свойств. Кроме того, аминокислотные остатки в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул разных белков образуют сложные комплексы, например фотосинтетический комплекс.
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферменты катализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют ключевую роль в сигнальных системах клеток, при иммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организмах не могут синтезироваться все незаменимые аминокислоты и часть должна поступать с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются для биосинтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принесло Фредерику Сенгеру Нобелевскую премию по химии в 1958 году.
Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракции рентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в конце 1950-х годов[2][3], за что в 1962 году они получили Нобелевскую премию по химии.
История изучения[править | править код]
Антуан Франсуа де Фуркруа, основоположник изучения белков
Впервые белок был получен (в виде клейковины) в 1728 г. итальянцем Якопо Бартоломео Беккари из пшеничной муки. Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана де Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот. В то время были исследованы такие белки, как альбумин («яичный белок»), фибрин (белок из крови) и глютен из зерна пшеницы.
В начале XIX века уже были получены некоторые сведения об элементарном составе белков, было известно, что при гидролизе белков образуются аминокислоты. Некоторые из этих аминокислот (например глицин и лейцин) уже были охарактеризованы. Голландский химик Геррит Мульдер на основе анализа химического состава белков выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. В 1836 году Мульдер предложил первую модель химического строения белков. Основываясь на теории радикалов, он после нескольких уточнений пришёл к выводу, что минимальная структурная единица белка обладает следующим составом: C40H62N10O12. Эту единицу он назвал «протеином» (Pr) (от греч. протос — первый, первичный), а теорию — «теорией протеина»[4]. Сам термин «протеин» был предложен ещё шведским химиком Якобом Берцелиусом[5]. Согласно представлениям Мульдера, каждый белок состоит из нескольких протеинных единиц, серы и фосфора. Например, он предложил записывать формулу фибрина как 10PrSP. Мульдер также исследовал продукты разрушения белков — аминокислоты и для одной из них (лейцина) с малой долей погрешности определил молекулярную массу — 131 дальтон. По мере накопления новых данных о белках теория протеина стала подвергаться критике, но, несмотря на это, до конца 1850-х всё ещё считалась общепризнанной.
К концу XIX века было исследовано большинство аминокислот, которые входят в состав белков. В конце 1880-х гг. русский учёный А. Я. Данилевский отметил существование пептидных групп (CO—NH) в молекуле белка[6][7]. В 1894 году немецкий физиолог Альбрехт Коссель выдвинул теорию, согласно которой именно аминокислоты являются основными структурными элементами белков[8]. В начале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединённых пептидными связями. Он же осуществил первый анализ аминокислотной последовательности белка и объяснил явление протеолиза.
Однако центральная роль белков в организмах не была признана до 1926 года, когда американский химик Джеймс Самнер (впоследствии — лауреат Нобелевской премии по химии) показал, что фермент уреаза является белком[9].
Сложность выделения чистых белков затрудняла их изучение. Поэтому первые исследования проводились с использованием тех полипептидов, которые легко могли быть очищены в большом количестве, то есть белков крови, куриных яиц, различных токсинов, а также пищеварительных/метаболических ферментов, выделяемых после забоя скота. В конце 1950-х годов компания Armour Hot Dog Co. смогла очистить килограмм бычьей панкреатической рибонуклеазы А, которая стала экспериментальным объектом для многих исследований.
Идея о том, что вторичная структура белков — результат образования водородных связей между аминокислотными остатками, была высказана Уильямом Астбери в 1933 году, но Лайнус Полинг считается первым учёным, который смог успешно предсказать вторичную структуру белков. Позднее Уолтер Каузман, опираясь на работы Кая Линнерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий. В конце 1940-х — начале 1950-х годов Фредерик Сенгер разработал метод секвенирования белков, с помощью которого он к 1955 году определил аминокислотную последовательность двух цепей инсулина[10][11][12], продемонстрировав, что белки — это линейные полимеры аминокислот, а не разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы. Первым белком, аминокислотную последовательность которого установили советские/российские учёные, стала в 1972 году аспартатаминотрансфераза[13][14].
Первые пространственные структуры белков, полученные методом дифракции рентгеновских лучей (рентгеноструктурного анализа) стали известны в конце 1950-х — начале 1960-х годов, а структуры, открытые с помощью ядерного магнитного резонанса — в 1980-х годах. В 2012 году Банк данных о белках (Protein Data Bank) содержал около 87 000 структур белков[15].
В XXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или целых организмов. Эта область биохимии называется протеомикой. С помощью методов биоинформатики стало возможно не только обработать данные рентгеноструктурного анализа, но и предсказать структуру белка, основываясь на его аминокислотной последовательности. В настоящее время криоэлектронная микроскопия крупных белковых комплексов и предсказание пространственных структур белковых доменов с помощью компьютерных программ приближаются к атомарной точности[16].
Свойства[править | править код]
Размер[править | править код]
Размер белка может измеряться в числе аминокислотных остатков или в дальтонах (молекулярная масса), но из-за относительно большой величины молекулы масса белка выражается в производных единицах — килодальтонах (кДа). Белки дрожжей, в среднем, состоят из 466 аминокислотных остатков и имеют молекулярную массу 53 кДа. Самый большой из известных в настоящее время белков — титин — является компонентом саркомеров мускулов; молекулярная масса его различных вариантов (изоформ) варьирует в интервале от 3000 до 3700 кДа. Титин камбаловидной мышцы (лат. soleus) человека состоит из 38 138 аминокислот[17].
Для определения молекулярной массы белков применяют такие методы, как гель-фильтрация, электрофорез в полиакриламидном геле, масс-спектрометрический анализ, седиментационный анализ и другие[18].
Физико-химические свойства[править | править код]
Амфотерность[править | править код]
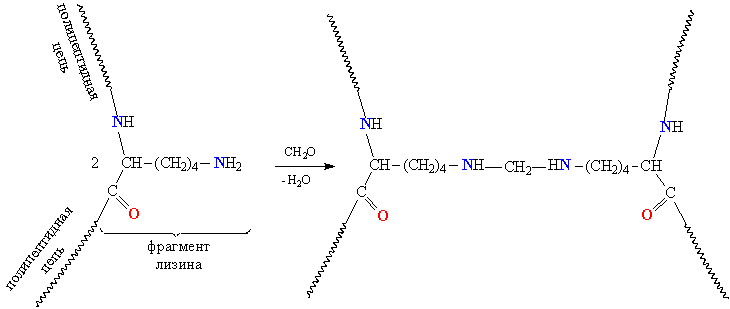
Белки обладают свойством амфотерности, то есть в зависимости от условий проявляют как кислотные, так и осно́вные свойства. В белках присутствуют несколько типов химических группировок, способных к ионизации в водном растворе: карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь, ε-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина, в несколько меньшей степени — имидазольный остаток гистидина). Каждый белок характеризуется изоэлектрической точкой (pI) — кислотностью среды (pH), при которой суммарный электрический заряд молекул данного белка равен нулю и, соответственно, они не перемещаются в электрическом поле (например при электрофорезе). В изоэлектрической точке гидратация и растворимость белка минимальны. Величина pI зависит от соотношения кислых и основных аминокислотных остатков в белке: у белков, содержащих много кислых аминокислотных остатков, изоэлектрические точки лежат в кислой области (такие белки называют кислыми), а у белков, содержащих больше основных остатков, — в щелочной (основные белки). Значение pI данного белка также может меняться в зависимости от ионной силы и типа буферного раствора, в котором он находится, так как нейтральные соли влияют на степень ионизации химических группировок белка. pI белка можно определить, например из кривой титрования или с помощью изоэлектрофокусирования[18].
В целом, pI белка зависит от выполняемой им функции: изоэлектрическая точка большинства белков тканей позвоночных лежит в пределах от 5,5 до 7,0, однако в некоторых случаях значения лежат в экстремальных областях: так, например, для пепсина — протеолитического фермента сильнокислого желудочного сока pI ~ 1[19], а для сальмина — белка-протамина молок лосося, особенностью которого является высокое содержание аргинина, — pI ~ 12. Белки, связывающиеся с нуклеиновыми кислотами за счёт электростатического взаимодействия с фосфатными группами, часто являются основными белками. Примером таких белков служат гистоны и протамины.
Растворимость[править | править код]
Белки различаются по степени растворимости в воде. Водорастворимые белки называются альбуминами, к ним относятся белки крови и молока. К нерастворимым, или склеропротеинам, относятся, например, кератин (белок, из которого состоят волосы, шерсть млекопитающих, перья птиц и т. п.) и фиброин, входящий в состав шёлка и паутины[20]. Растворимость белка определяется не только его структурой, но внешними факторами, такими как природа растворителя, ионная сила и pH раствора[18].
Белки также делятся на гидрофильные и гидрофобные. К гидрофильным относится большинство белков цитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относится большинство белков, входящих в состав биологических мембран, — интегральных мембранных белков, которые взаимодействуют с гидрофобными липидами мембраны[21] (у этих белков, как правило, есть и гидрофильные участки).
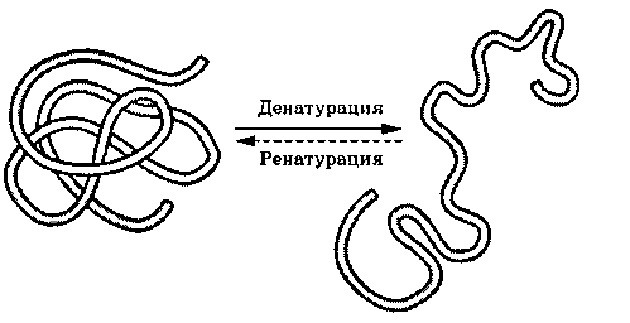
Денатурация[править | править код]
Деструкция белка куриного яйца под воздействием высокой температуры
Денатурацией белка называют любые изменения в его биологической активности и/или физико-химических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры (см. раздел «Структура белка»). Как правило, белки достаточно стабильны в тех условиях (температура, pH и др.), в которых они в норме функционируют в организме[9]. Резкое изменение этих условий приводит к денатурации белка. В зависимости от природы денатурирующего агента выделяют механическую (сильное перемешивание или встряхивание), физическую (нагревание, охлаждение, облучение, обработка ультразвуком) и химическую (кислоты и щёлочи, поверхностно-активные вещества, мочевина) денатурацию[18].
Денатурация белка может быть полной или частичной, обратимой или необратимой. Самый известный случай необратимой денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения водорастворимых белков с помощью солей аммония (метод высаливания), и этот метод используется как способ их очистки[22].
Структура[править | править код]
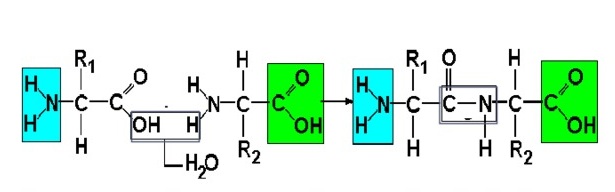
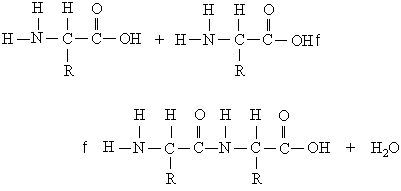
Схематическое изображение образования пептидной связи (справа). Подобная реакция происходит в молекулярной машине, синтезирующей белок, — рибосоме
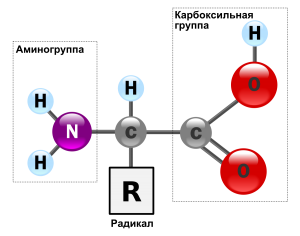
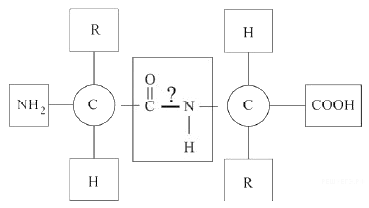
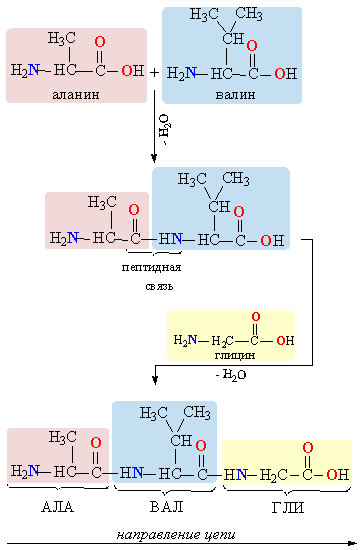
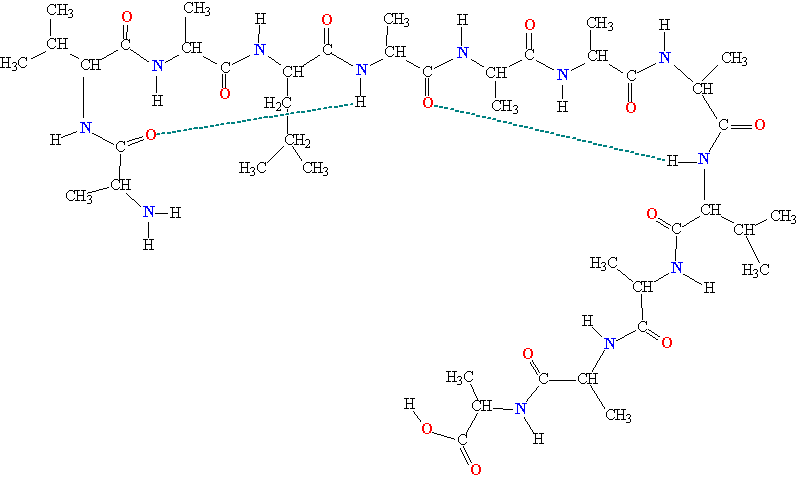
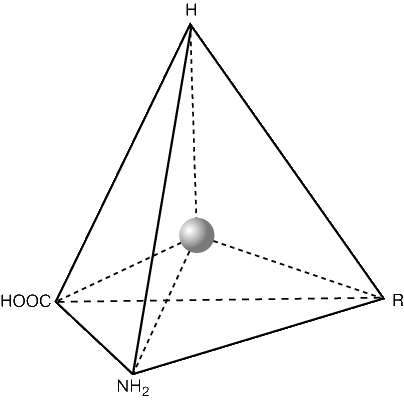
Молекулы белков представляют собой линейные полимеры, состоящие из остатков α-L-аминокислот (которые являются мономерами), также в состав белков могут входить модифицированные аминокислотные остатки и компоненты неаминокислотной природы. Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки из 5 аминокислотных остатков оно составляет уже более 3 миллионов, а цепочка из 100 аминокислотных остатков (небольшой белок) может быть представлена более чем в 10130 вариантах. Цепочки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
При образовании белка в результате взаимодействия α-карбоксильной группы (-COOH) одной аминокислоты с α-аминогруппой (-NH2) другой аминокислоты образуются пептидные связи. Концы белка называют N- и C-концом, в зависимости от того, какая из групп концевого аминокислотного остатка свободна: -NH2 или -COOH, соответственно. При синтезе белка на рибосоме первым (N-концевым) аминокислотным остатком обычно является остаток метионина, а последующие остатки присоединяются к C-концу предыдущего.
Уровни организации[править | править код]
Уровни структурной организации белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная
К. Линдстрём-Ланг предложил выделять 4 уровня структурной организации белков: первичную, вторичную, третичную и четвертичную структуры. Хотя такое деление несколько устарело, им продолжают пользоваться[4]. Первичная структура (последовательность аминокислотных остатков) полипептида определяется структурой его гена и генетическим кодом, а структуры более высоких порядков формируются в процессе сворачивания белка[23]. Хотя пространственная структура белка в целом определяется его аминокислотной последовательностью, она является довольно лабильной и может зависеть от внешних условий, поэтому более правильно говорить о предпочтительной или наиболее энергетически выгодной конформации белка[4].
Первичная структура[править | править код]
Пример выравнивания аминокислотных последовательностей белков (гемоглобинов) из разных организмов
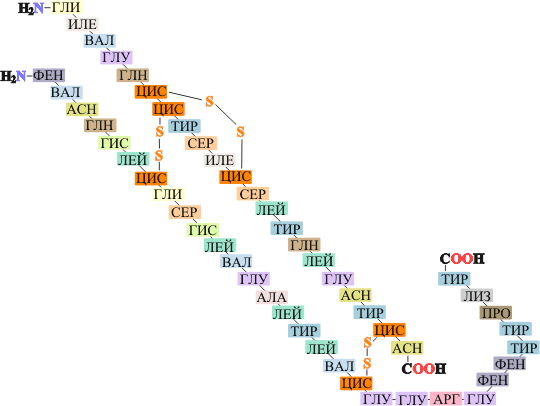
Первичная структура — последовательность аминокислотных остатков в полипептидной цепи. Первичную структуру белка, как правило, описывают, используя однобуквенные или трёхбуквенные обозначения для аминокислотных остатков.
Важными особенностями первичной структуры являются консервативные мотивы — устойчивые сочетания аминокислотных остатков, выполняющие определённую функцию и встречающиеся во многих белках. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка[24]. По степени гомологии (сходства) аминокислотных последовательностей белков разных организмов можно оценивать эволюционное расстояние между таксонами, к которым принадлежат эти организмы.
Первичную структуру белка можно определить методами секвенирования белков или по первичной структуре его мРНК, используя таблицу генетического кода.
Вторичная структура[править | править код]
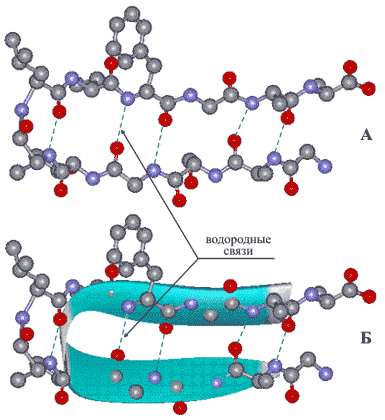
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков[23]:
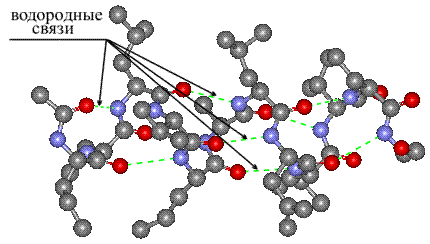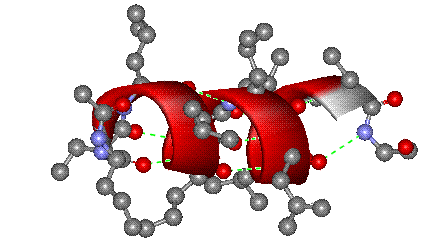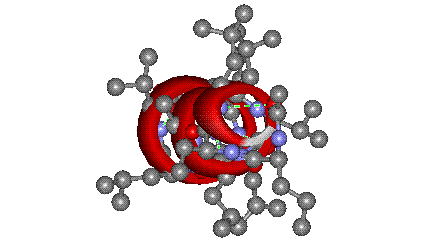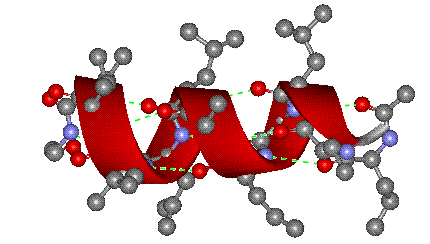
- α-спирали — плотные витки вокруг длинной оси молекулы. Один виток составляет 3,6 аминокислотных остатка, шаг спирали равен 0,54 нм[25] (на один аминокислотный остаток приходится 0,15 нм). Спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Хотя α-спираль может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывают изгиб цепи и тоже нарушают α-спирали;
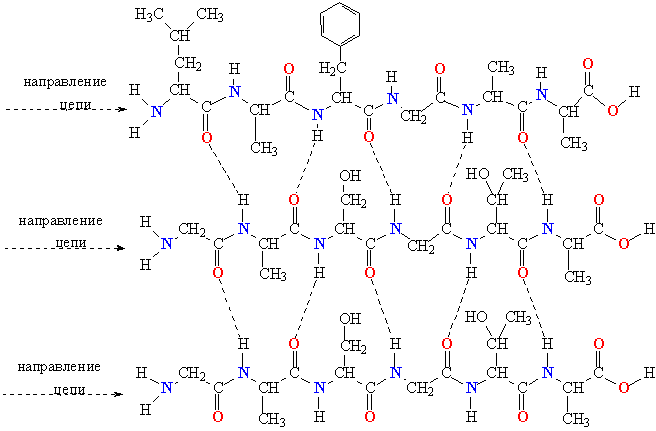
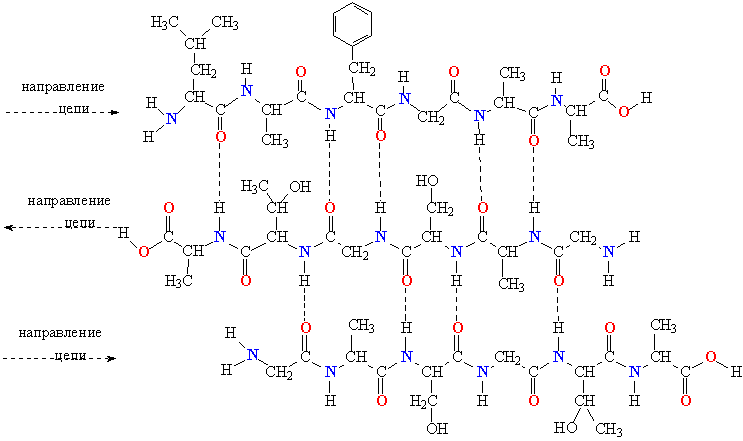
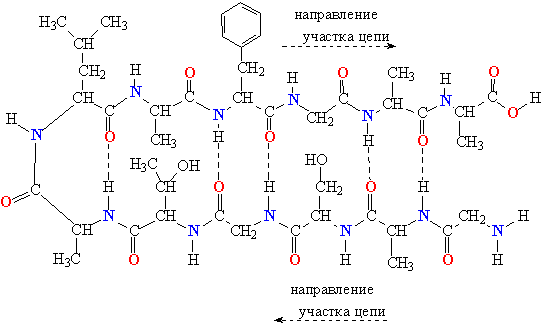
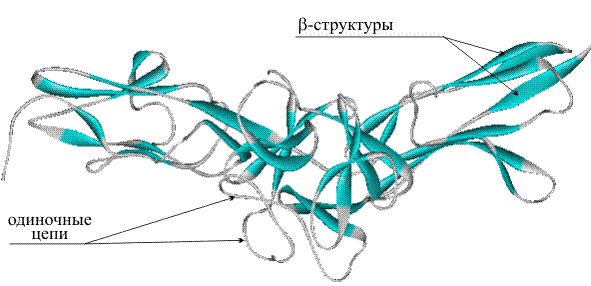
- β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,34 нм на аминокислотный остаток[26]) аминокислотами в первичной структуре или разными цепями белка (а не близко расположенными, как в α-спирали). Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация) или в одну сторону (параллельная β-структура). Также возможно существование смешанной β-структуры, состоящей из параллельной и антипараллельной β-структур[27]. Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин;
- π-спирали;
- 310-спирали;
- неупорядоченные фрагменты.
Третичная структура[править | править код]
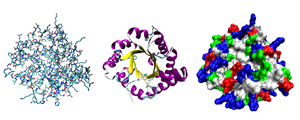
Разные способы изображения трёхмерной структуры белка на примере триозофосфатизомеразы. Слева — «стержневая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине — мотив укладки. Справа — контактная поверхность белка, построенная с учётом ван-дер-ваальсовых радиусов атомов; цветами показаны особенности активности участков
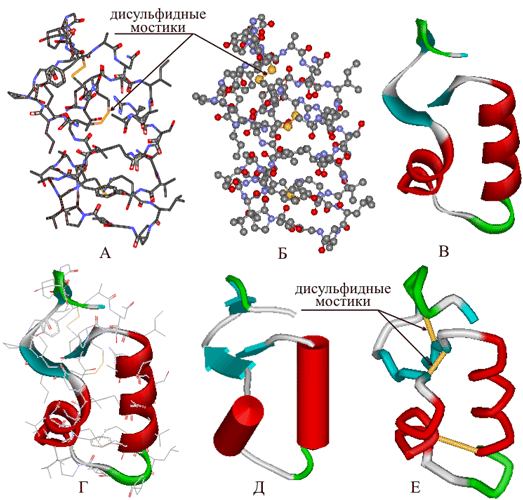
Третичная структура — пространственное строение полипептидной цепи. Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
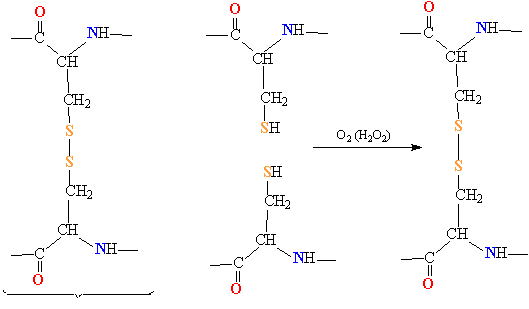
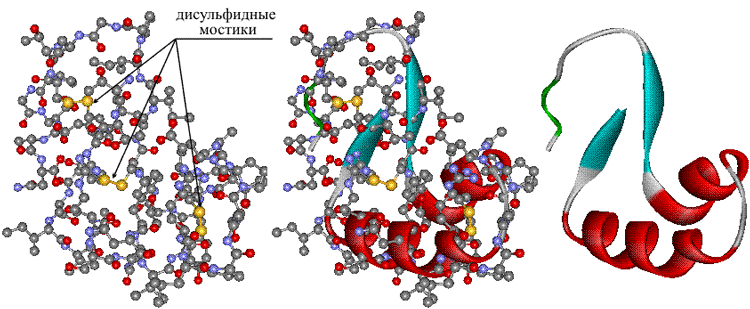
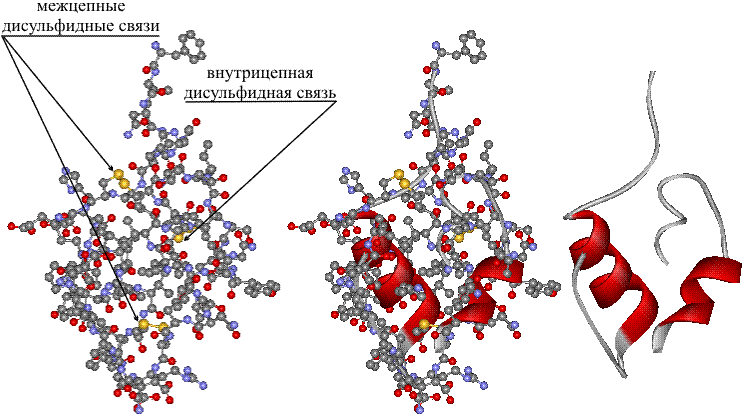
- ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
- ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
- водородные связи;
- гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула сворачивается так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
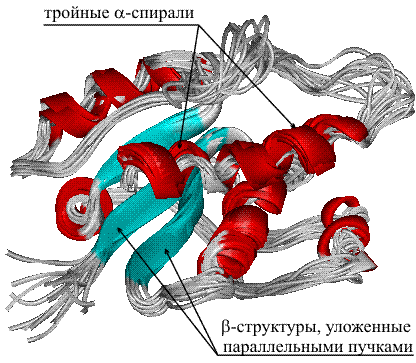
Исследования принципов укладки белков показали, что между уровнем вторичной структуры и атомарной пространственной структурой удобно выделять ещё один уровень — мотив укладки (архитектура, структурный мотив). Мотив укладки определяется взаимным расположением элементов вторичной структуры (α-спиралей и β-тяжей) в пределах белкового домена — компактной глобулы, которая может существовать или сама по себе или входить в состав более крупного белка наряду с другими доменами. Рассмотрим для примера один из характерных мотивов строения белков. Изображённый на рисунке справа глобулярный белок, триозофосфатизомераза, имеет мотив укладки, который называется α/β-цилиндр: 8 параллельных β-тяжей формируют β-цилиндр внутри ещё одного цилиндра, сложенного из 8 α-спиралей. Такой мотив обнаруживается примерно в 10 % белков[28].
Известно, что мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков (такой как CATH или SCOP)[28].
Для определения пространственной структуры белка применяют методы рентгеноструктурного анализа, ядерного магнитного резонанса и некоторые виды микроскопии.
Четвертичная структура[править | править код]
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Классификация по типу строения[править | править код]
По общему типу строения белки можно разбить на три группы:
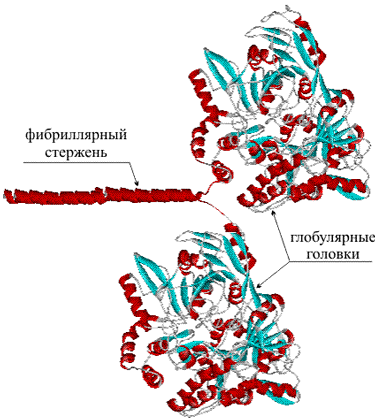
- Фибриллярные белки — образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. К фибриллярным белкам относятся кератин и коллаген.
- Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая.
- Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортёры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
Простые и сложные белки[править | править код]
Помимо пептидных цепей, в состав многих белков входят и неаминокислотные группы, и по этому критерию белки делят на две большие группы — простые и сложные белки (протеиды). Простые белки состоят только из полипептидных цепей, сложные белки содержат также неаминокислотные, или простетические, группы. В зависимости от химической природы простетических групп среди сложных белков выделяют следующие классы[20]:
- Гликопротеины, содержащие в качестве простетической группы ковалентно связанные углеводные остатки; гликопротеины, содержащие остатки мукополисахаридов относятся к подклассу протеогликанов. В образовании связи с углеводными остатками обычно участвуют гидроксильные группы серина или треонина. Большая часть внеклеточных белков, в частности, иммуноглобулины относится к гликопротеинам. В протеогликанах углеводная часть составляет ~95 % от общей массы молекулы белка, они являются основным компонентом межклеточного матрикса;
- Липопротеины, содержащие в качестве простетической части нековалентно связанные липиды. Липопротеины, образованные белками-аполипопротеинами и связывающимися с ними липидами, используются для транспорта липидов в крови;
- Металлопротеиды, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеидов есть белки, выполняющие депонирующие и транспортные функции (например железосодержащие ферритин и трансферрин) и ферменты (например цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в активных центрах ионы меди, марганца, железа и других металлов);
- Нуклеопротеиды, содержащие нековалентно связанные ДНК или РНК. К нуклеопротеидам относится хроматин, из которого состоят хромосомы;
- Фосфопротеины, содержащие в качестве простетической группы ковалентно связанные остатки фосфорной кислоты. В образовании сложноэфирной связи с фосфатом участвуют гидроксильные группы серина, треонина и тирозина. Фосфопротеином, в частности, является казеин молока[29];
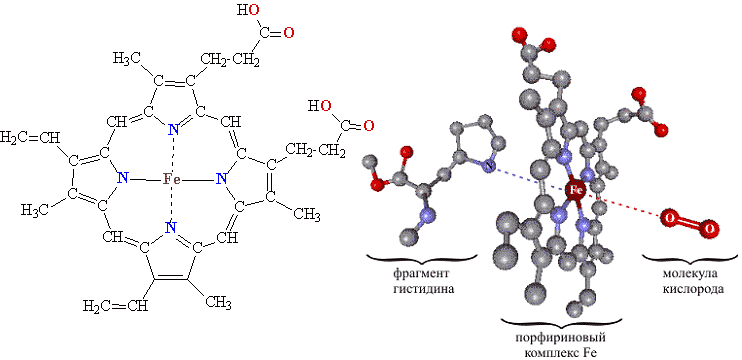
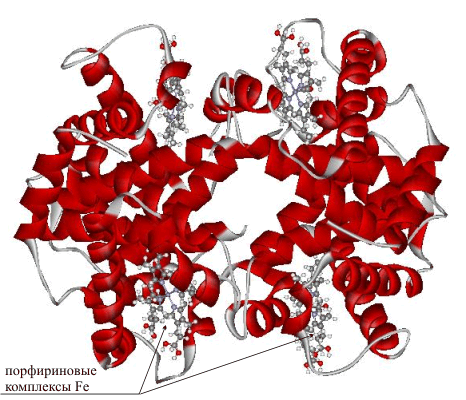
- Хромопротеиды, содержащие окрашенные простетические группы различной химической природы. К ним относится множество белков с металлсодержащей порфириновой простетической группой, выполняющие разнообразные функции: гемопротеины (белки, содержащие в качестве простетической группы гем, например гемоглобин и цитохромы), хлорофиллы, флавопротеиды с флавиновой группой и др.
Биофизика белка[править | править код]
Физические свойства белка в клетке с учётом водной оболочки и краудинга макромолекул (англ.) (рус. очень сложны. В пользу гипотезы о белке, как о упорядоченной «кристаллоподобной системе» — «апериодическом кристалле»[30][31] — свидетельствуют данные рентгеноструктурного анализа (вплоть до разрешения в 1 ангстрем)[32], высокая плотность упаковки[33], кооперативность процесса денатурации[34] и другие факты[35].
В пользу другой гипотезы, о жидкообразных свойствах белков в процессах внутриглобулярных движений (модель ограниченной прыжковой или непрерывной диффузии), свидетельствуют эксперименты по рассеянию нейтронов[36], мёссбауэровской спектроскопии[37][38].
Синтез[править | править код]
Схема синтеза белка рибосомой. Сверху вниз — инициация, элонгация и терминация трансляции
Биосинтез[править | править код]
Универсальный способ: рибосомный синтез[править | править код]
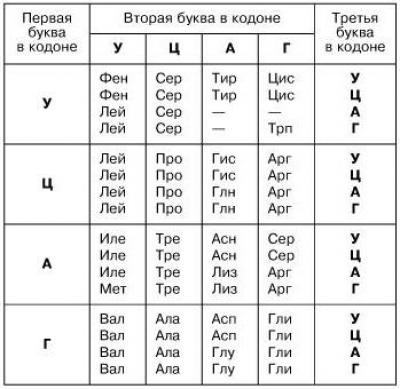
Белки синтезируются живыми организмами из аминокислот на основе информации, закодированной в генах. Каждый белок состоит из уникальной последовательности аминокислотных остатков, которая определяется нуклеотидной последовательностью гена, кодирующего данный белок. Генетический код представляет собой способ перевода нуклеотидной последовательности ДНК (через РНК) в аминокислотную последовательность полипептидной цепи. Этот код определяет соответствие трёхнуклеотидных участков РНК, называемых кодонами, и определённых аминокислот, которые включаются в состав белка: последовательность нуклеотидов АУГ, например, соответствует метионину. Поскольку ДНК состоит из четырёх типов нуклеотидов, то общее число возможных кодонов равно 64; а так как в белках используется 20 аминокислот, то многие аминокислоты определяются более чем одним кодоном. Три кодона являются незначащими: они служат сигналами остановки синтеза полипептидной цепи и называются терминаторными кодонами, или стоп-кодонами[39].
Гены, кодирующие белки, сначала транскрибируются в последовательность нуклеотидов матричной РНК (мРНК) ферментами РНК-полимеразами. В подавляющем большинстве случаев белки живых организмов синтезируются на рибосомах — многокомпонентных молекулярных машинах, присутствующих в цитоплазме клеток. Процесс синтеза полипептидной цепи рибосомой на матрице мРНК называется трансляцией[39].
Рибосомный синтез белков принципиально одинаков у прокариот и эукариот, но различается в некоторых деталях. Так, мРНК прокариот может считываться рибосомами в аминокислотную последовательность белков сразу после транскрипции или даже до её завершения[40]. У эукариот же первичный транскрипт сначала должен пройти серию модификаций и переместиться в цитоплазму (к месту локализации рибосом), прежде чем может начаться трансляция. Скорость синтеза белков выше у прокариот и может достигать 20 аминокислот в секунду[41].
Ещё до начала трансляции ферменты аминоацил-тРНК-синтетазы специфично присоединяют аминокислоты к соответствующим им транспортным РНК (тРНК). Участок тРНК, который называется антикодоном, может комплементарно спариваться с кодоном мРНК, обеспечивая тем самым включение присоединённого к тРНК аминокислотного остатка в полипептидную цепь в соответствии с генетическим кодом.
Во время начальной стадии трансляции, инициации, инициаторный (обычно метиониновый) кодон узнаётся малой субъединицей рибосомы, к которой при помощи белковых факторов инициации присоединена аминоацилированная метиониновая тРНК. После узнавания стартового кодона к малой субъединице рибосомы присоединяется большая субъединица, и начинается вторая стадия трансляции — элонгация. При каждом шаге рибосомы от 5′- к 3′-концу мРНК считывается один кодон путём образования водородных связей между ним и комплементарным ему антикодоном транспортной РНК, к которой присоединён соответствующий аминокислотный остаток. Образование пептидной связи между последним аминокислотным остатком растущего пептида и аминокислотным остатком, присоединённым к тРНК, катализируется рибосомальной РНК (рРНК), образующей пептидилтрансферазный центр рибосомы. Этот центр позиционирует атомы азота и углерода в положении, благоприятном для прохождения реакции. Третья и последняя стадия трансляции, терминация, происходит при достижении рибосомой стоп-кодона, после чего белковые факторы терминации гидролизуют связь между последней тРНК и полипептидной цепью, прекращая её синтез. В рибосомах белки всегда синтезируются от N- к C-концу[39].
Нерибосомный синтез[править | править код]
У низших грибов и некоторых бактерий известен дополнительный (нерибосомный, или мультиферментный) способ биосинтеза пептидов, как правило, небольших и необычной структуры. Синтез этих пептидов, обычно вторичных метаболитов, осуществляется высокомолекулярным белковым комплексом, NRS-синтазой, без непосредственного участия рибосом. NRS-синтаза обычно состоит из нескольких доменов или отдельных белков, осуществляющих селекцию аминокислот, образование пептидной связи и высвобождение синтезированного пептида. Вместе эти домены составляют модуль. Каждый модуль обеспечивает включение одной аминокислоты в синтезируемый пептид. NRS-синтазы, таким образом, могут состоять из одного или более модулей. Иногда в состав этих комплексов входит домен, способный изомеризовать L-аминокислоты (нормальная форма) в D-форму[42][43].
Химический синтез[править | править код]
Короткие белки могут быть синтезированы химическим путём с использованием методов органического синтеза, например, химического лигирования[44]. Чаще всего химический синтез пептида происходит в направлении от C-конца к N-концу, в противоположность биосинтезу на рибосомах. Методом химического синтеза получают короткие иммуногенные пептиды (эпитопы), которые затем инъецируют животным с целью получения специфичных антител или гибридо́м. Кроме того, этот способ также используется для получения ингибиторов некоторых ферментов[45]. Химический синтез позволяет вводить в состав белков аминокислотные остатки, не встречающиеся в обычных белках, например такие, к боковым цепям которых присоединены флюоресцентные метки. Химические методы синтеза белков имеют ряд ограничений: они неэффективны при длине белка более 300 аминокислотных остатков, искусственно синтезированные белки могут иметь неправильную третичную структуру и у них отсутствую характерные посттрансляционные модификации (см. ниже).
Посттрансляционная модификация[править | править код]
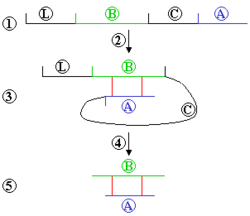
Посттрансляционные модификации инсулина. 1) Препроинсулин (L — лидерный пептид, B — участок 1, C — участок 2, А — участок 3) 2) Спонтанное сворачивание 3) Образование дисульфидного мостика между А и В 4) Лидерный и C-пептид отрезаются 5) Конечная молекула
После завершения трансляции большинство белков подвергается дальнейшим химическим модификациям, которые называются посттрансляционными модификациями[46]. Известно более двухсот вариантов посттрансляционных модификаций белков[47].
Посттрансляционные модификации могут регулировать продолжительность существования белков в клетке, их ферментативную активность и взаимодействия с другими белками. В ряде случаев посттрансляционные модификации являются обязательным этапом созревания белка, в противном случае он оказывается функционально неактивным. Например при созревании инсулина и некоторых других гормонов необходим ограниченный протеолиз полипептидной цепи, а при созревании белков плазматической мембраны — гликозилирование.
Посттрансляционные модификации могут быть как широко распространёнными, так и редкими, вплоть до уникальных. Примером универсальной модификации служит убиквитинирование (присоединение к белку цепи из нескольких молекул короткого белка убиквитина), которое служит сигналом к расщеплению этого белка протеасомой[48]. Другой распространённой модификацией является гликозилирование — считается, что около половины белков человека гликозилировано[49]. К редким модификациям относят тирозинирование/детирозинирование и полиглицилирование тубулина[50].
Один и тот же белок может подвергаться многочисленным модификациям. Так, гистоны (белки, входящие в состав хроматина у эукариот) в разных условиях могут подвергаться более чем 150 различным модификациям[51].
Посттрансляционные модификации делят на:
- модификации главной цепи;
- отщепление N-концевого остатка метионина;
- ограниченный протеолиз — удаление фрагмента белка, которое может происходить с концов (отщепление сигнальных последовательностей) или, в отдельных случаях, в середине молекулы (созревание инсулина);
- присоединение различных химических групп к свободным амино- и карбоксильной группам (N-ацилирование, миристоилирование и др.);
- модификации боковых цепей аминокислот;
- присоединение или отщепление небольших химических групп (гликозилирование, фосфорилирование и др.);
- присоединение липидов и углеводородов;
- изменение стандартных аминокислотных остатков на нестандартные (образование цитруллина);
- образование дисульфидных мостиков между остатками цистеина;
- присоединение небольших белков (сумоилирование и убиквитинирование).
Жизненный цикл[править | править код]
Внутриклеточный транспорт и сортировка[править | править код]
Синтезируемые в цитоплазме эукариотической клетки белки должны транспортироваться в разные органоиды клетки: ядро, митохондрии, эндоплазматический ретикулум (ЭПР), аппарат Гольджи, лизосомы и др., а некоторые белки должны попасть во внеклеточную среду[52]. Для попадания в определённый отдел клетки белок должен обладать специфической меткой. В большинстве случаев такой меткой является часть аминокислотной последовательности самого белка (лидерный пептид, или сигнальная последовательность белка), но в некоторых случаях меткой служат посттрансляционно присоединённые к белку олигосахариды[53].
Транспорт белков в ЭПР осуществляется по мере их синтеза, так как рибосомы, синтезирующие белки с сигнальной последовательностью для ЭПР, «садятся» на специальные белки на его внешней мембране[54]. Из ЭПР в аппарат Гольджи, а оттуда в лизосомы и на внешнюю мембрану или во внеклеточную среду белки попадают путём везикулярного транспорта. В ядро белки, обладающие сигналом ядерной локализации, попадают через ядерные поры. В митохондрии и хлоропласты белки, обладающие соответствующими сигнальными последовательностями, попадают через специфические белковые поры-транслокаторы при участии шаперонов.
Поддержание структуры и деградация[править | править код]
Поддержание правильной пространственной структуры белков принципиально для их нормального функционирования. Неправильное сворачивание белков, приводящее к их агрегации, может быть вызвано мутациями, окислением, стрессовыми условиями или глобальными изменениями в физиологии клетки. Агрегация белков является характерным признаком старения организма. Считается, что неправильное сворачивание белков является причиной или усугубляет такие заболевания, как муковисцидоз, лизосомная болезнь накопления (англ.) (рус., а также нейродегенеративные расстройства (болезни Альцгеймера, Хантингтона и Паркинсона)[55].
В процессе эволюции клетками было выработано четыре основных механизма для противодействия агрегации белков. Первые два — повторное сворачивание (переукладка) с помощью шаперонов и расщепление протеазами — встречаются как у бактерий, так и у высших организмов. Аутофагия и накопление неправильно свёрнутых белков в особых немембранных органеллах характерны для эукариотов[26][56].
Шапероны[править | править код]
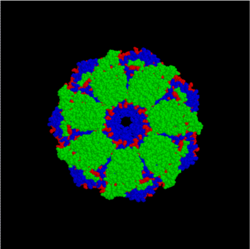
Модель комплекса бактериальных шаперонов GroES/GroEL (вид сверху). Часть агрегированного белка поступает в центральную полость комплекса, где в результате гидролиза АТФ происходит изменение его структуры
Способность белков восстанавливать правильную трёхмерную структуру после денатурации позволила выдвинуть гипотезу о том, что вся информация о конечной структуре белка содержится в его аминокислотной последовательности. В настоящее время общепризнана теория о том, что стабильная конформация белка обладает минимальной свободной энергией по сравнению с другими возможными конформациями этого полипептида[57].
В клетках существует группа белков, функция которых — обеспечение правильного сворачивания других белков после их синтеза на рибосоме, восстановление структуры белков после их повреждения, а также создание и диссоциация белковых комплексов. Эти белки называются шаперонами. Концентрация многих шаперонов в клетке возрастает при резком повышении температуры окружающей среды, поэтому они относятся к группе Hsp (англ. heat shock proteins — белки теплового шока)[58]. Важность нормальной работы шаперонов для функционирования организма может быть проиллюстрирована на примере шаперона α-кристаллина, входящего в состав хрусталика глаза человека. Мутации в этом белке приводят к помутнению хрусталика из-за агрегирования белков и, как результат, к катаракте[59].
Протеолиз[править | править код]
Если третичная структура белков не может быть восстановлена, они разрушаются клеткой. Ферменты, осуществляющие деградацию белков, называются протеазами. По месту атаки молекулы субстрата протеолитические ферменты делятся на эндопептидазы и экзопептидазы:
- Эндопептидазы, или протеиназы, расщепляют пептидные связи внутри пептидной цепи. Они узнают и связывают короткие пептидные последовательности субстратов и относительно специфично гидролизуют связи между определёнными аминокислотными остатками.
- Экзопептидазы гидролизуют пептиды с концов цепи: аминопептидазы — с N-конца, карбоксипептидазы — с С-конца. Наконец, дипептидазы расщепляют только дипептиды.
По механизму катализа Международный союз по биохимии и молекулярной биологии выделяет несколько классов протеаз, среди них сериновые протеазы, аспарагиновые протеазы, цистеиновые протеазы и металлопротеазы[60].
Особый тип протеазы — протеасома, крупная мультисубъединичная протеаза, присутствующая в ядре и в цитоплазме эукариот, архей и некоторых бактерий[61][62].
Для того, чтобы белок-мишень расщепился протеасомой, он должен быть помечен путём присоединения к нему маленького белка убиквитина. Реакция присоединения убиквитина катализируется ферментами убиквитинлигазами. Присоединение первой молекулы убиквитина к белку служит для лигаз сигналом для дальнейшего присоединения молекул убиквитина. В результате к белку оказывается присоединена полиубиквитиновая цепь, которая связывается с протеасомой и обеспечивает расщепление белка-мишени[61][62]. В целом, эта система получила название убиквитин-зависимой деградации белка. Деградация 80—90 % внутриклеточных белков происходит при участии протеасомы.
Деградация белка в пероксисомах важна для протекания многих клеточных процессов, включая клеточный цикл, регуляцию экспрессии генов и ответ на окислительный стресс.
Аутофагия[править | править код]
А: Образование аутофагосомы: изолирующая мембрана окружает клеточные структуры и создаёт аутофагосому (AP), которая сливается с лизосомой с образованием аутолизосомы (AL). В: Электронная микрофотография аутофагосом в жировом теле личинки дрозофилы. С: Помеченные флуоресцентной меткой аутофагосомы в клетках печени голодающей мыши
Аутофагия — это процесс деградации долгоживущих биомолекул, в частности, белков, а также органелл в лизосомах (у млекопитающих) или вакуолях (у дрожжей). Аутофагия сопровождает жизнедеятельность любой нормальной клетки, но стимулами к усилению процессов аутофагии в клетках могут служить нехватка питательных веществ, наличие в цитоплазме повреждённых органелл и, наконец, наличие в цитоплазме частично денатурированных белков и их агрегатов[63].
Различают три типа аутофагии: микроаутофагию, макроаутофагию и шаперон-зависимую аутофагию.
При микроаутофагии макромолекулы и обломки клеточных мембран захватываются лизосомой. Таким путём клетка может переваривать белки при нехватке энергии или строительного материала (например при голодании). Но процессы микроаутофагии происходят и при нормальных условиях и в целом неизбирательны. Иногда в ходе микроаутофагии перевариваются и органоиды; так, у дрожжей описана микроаутофагия пероксисом и частичная микроаутофагия ядер, при которой клетка сохраняет жизнеспособность[63].
При макроаутофагии участок цитоплазмы (часто содержащий какие-либо органоиды) окружается мембранным компартментом, похожим на цистерну эндоплазматического ретикулума. В результате этот участок отделяется от остальной цитоплазмы двумя мембранами. Такие двухмембранные органеллы называются аутофагосомами. Аутофагосомы сливаются с лизосомами, образуя аутофаголизосомы, в которых органеллы и остальное содержимое аутофагосом перевариваются. Видимо, макроаутофагия также неизбирательна, хотя часто подчёркивается, что с помощью неё клетка может избавляться от «отслуживших свой срок» органоидов (митохондрий, рибосом и др.)[63].
Третий тип аутофагии — шаперон-зависимая. При этом способе происходит направленный транспорт частично денатурированных белков из цитоплазмы сквозь мембрану лизосомы в её полость, где они перевариваются. Этот тип аутофагии, описанный только у млекопитающих, индуцируется стрессом[56].
Клетка, содержащая JUNQ и IPOD. Nucleus — ядро клетки, vacuole — вакуоль
JUNQ и IPOD[править | править код]
В условиях стресса, когда эукариотическая клетка не может справиться с накоплением большого числа денатурированных белков, они могут направляться в один из двух типов временных органелл — JUNQ и IPOD (англ.) (рус.[64].
JUNQ (англ. JUxta Nuclear Quality control compartment — околоядерный компартмент контроля качества белков) ассоциирован со внешней стороной ядерной мембраны и содержит убиквитинированные белки, которые могут быстро переходить в цитоплазму, а также шапероны и протеасомы. Предполагаемая функция JUNQ состоит в переукладке и/или деградации белков[26].
IPOD (англ. Insoluble Protein Deposit — место отложения нерастворимых белков) расположен около центральной вакуоли и содержит неподвижные агрегаты формирующих амилоиды белков. Накопление этих белков в IPOD может предотвращать их взаимодействие с нормальными клеточными структурами, поэтому предполагают, что это включение имеет защитную функцию[26].
Функции белков в организме[править | править код]
Так же как и другие биологические макромолекулы (полисахариды, липиды и нуклеиновые кислоты), белки являются необходимыми компонентами всех живых организмов и играют важную роль в жизнедеятельности клетки. Белки осуществляют процессы обмена веществ. Они входят в состав внутриклеточных структур — органелл и цитоскелета, секретируются во внеклеточное пространство, где могут выступать в качестве сигнала, передаваемого между клетками, участвовать в гидролизе пищи и образовании межклеточного вещества.
Классификация белков по их функциям является достаточно условной, так как один и тот же белок может выполнять несколько функций. Хорошо изученным примером такой многофункциональности служит лизил-тРНК-синтетаза — фермент из класса аминоацил-тРНК-синтетаз, которая не только присоединяет остаток лизина к тРНК, но и регулирует транскрипцию нескольких генов[65].
Многие функции белки выполняют благодаря своей ферментативной активности. Так, ферментами являются двигательный белок миозин, регуляторные белки протеинкиназы, транспортный белок натрий-калиевая аденозинтрифосфатаза и др.
Каталитическая функция[править | править код]
Наиболее хорошо известная функция белков в организме — катализ различных химических реакций. Ферменты — это белки, обладающие специфическими каталитическими свойствами, то есть каждый фермент катализирует одну или несколько сходных реакций. Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), в том числе репликацию и репарацию ДНК и матричный синтез РНК. К 2013 году было описано более 5000 ферментов[66][67]. Ускорение реакции в результате ферментативного катализа может быть огромным: реакция, катализируемая ферментом оротидин-5′-фосфатдекарбоксилазой, например, протекает в 10¹⁷ раз быстрее некатализируемой (период полуреакции декарбоксилирования оротовой кислоты составляет 78 миллионов лет без фермента и 18 миллисекунд с участием фермента)[68]. Молекулы, которые присоединяются к ферменту и изменяются в результате реакции, называются субстратами.
Хотя ферменты обычно состоят из сотен аминокислотных остатков, только небольшая часть из них взаимодействует с субстратом, и ещё меньшее количество — в среднем 3—4 аминокислотных остатка, часто расположенные далеко друг от друга в первичной структуре — напрямую участвуют в катализе[69]. Часть молекулы фермента, которая обеспечивает связывание субстрата и катализ, называется активным центром.
Международный союз биохимии и молекулярной биологии в 1992 году предложил окончательный вариант иерархической номенклатуры ферментов, основанной на типе катализируемых ими реакций[70]. Согласно этой номенклатуре названия ферментов всегда должны иметь окончание –аза и образовываться от названий катализируемых реакций и их субстратов. Каждому ферменту приписывается индивидуальный код, по которому легко определить его положение в иерархии ферментов. По типу катализируемых реакций все ферменты делят на 6 классов:
- КФ 1: Оксидоредуктазы, катализирующие окислительно-восстановительные реакции;
- КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую;
- КФ 3: Гидролазы, катализирующие гидролиз химических связей;
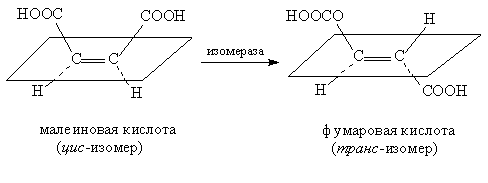
- КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов;
- КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата;
- КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счёт гидролиза дифосфатной связи АТФ или сходного трифосфата.
Структурная функция[править | править код]
Структурные белки цитоскелета, как своего рода арматура, придают форму клеткам и многим органоидам и участвуют в изменении формы клеток. Большинство структурных белков являются филаментозными: мономеры актина и тубулина это, например, глобулярные, растворимые белки, но после полимеризации они формируют длинные нити, из которых состоит цитоскелет, позволяющий клетке поддерживать форму[71]. Коллаген и эластин — основные компоненты межклеточного вещества соединительной ткани (например, хряща), а из другого структурного белка кератина состоят волосы, ногти, перья птиц и некоторые раковины.
Fab-фрагмент мышиного антитела в комплексе с антигеном (вверху)
Защитная функция[править | править код]
Существует несколько видов защитных функций белков:
- Физическая защита. Физическую защиту организма обеспечивают коллаген — белок, образующий основу межклеточного вещества соединительных тканей (в том числе костей, хряща, сухожилий и глубоких слоёв кожи (дермы)); кератин, составляющий основу роговых щитков, волос, перьев, рогов и др. производных эпидермиса. Обычно такие белки рассматривают как белки со структурной функцией. Примерами белков этой группы служат фибриногены и тромбины[72], участвующие в свёртывании крови.
- Химическая защита. Связывание токсинов белковыми молекулами может обеспечивать их детоксикацию. Особенно важную роль в детоксикации у человека играют ферменты печени, расщепляющие яды или переводящие их в растворимую форму, что способствует их быстрому выведению из организма[73].
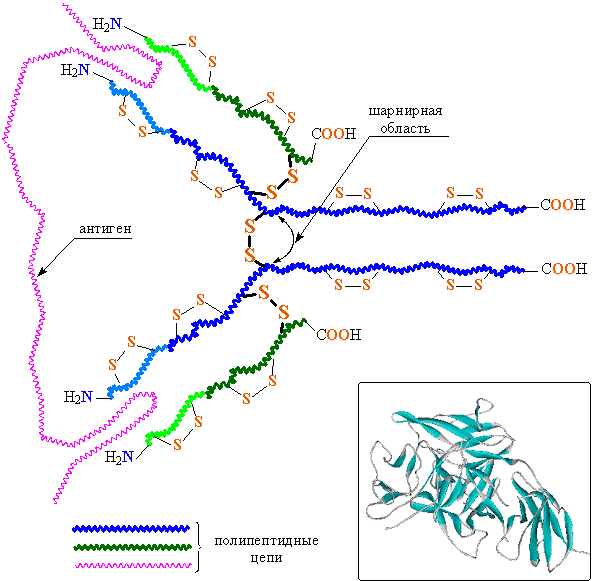
- Иммунная защита. Белки, входящие в состав крови и других биологических жидкостей, участвуют в защитном ответе организма как на повреждение, так и на атаку патогенов. Белки системы комплемента и антитела (иммуноглобулины) относятся к белкам второй группы; они нейтрализуют бактерии, вирусы или чужеродные белки. Антитела, входящие в состав адаптивной иммунной системы, присоединяются к чужеродным для данного организма веществам, антигенам, и тем самым нейтрализуют их, направляя к местам уничтожения. Антитела могут секретироваться в межклеточное пространство или закрепляться в мембранах специализированных В-лимфоцитов, которые называются плазмоцитами[74].
Регуляторная функция[править | править код]
Многие процессы внутри клеток регулируются белковыми молекулами, которые не служат ни источником энергии, ни строительным материалом для клетки. Эти белки регулируют продвижение клетки по клеточному циклу, транскрипцию, трансляцию, сплайсинг, активность других белков и многие другие процессы. Регуляторную функцию белки осуществляют либо за счёт ферментативной активности (например, протеинкиназы), либо за счёт специфичного связывания с другими молекулами. Так, факторы транскрипции, белки-активаторы и белки-репрессоры, могут регулировать интенсивность транскрипции генов, связываясь с их регуляторными последовательностями. На уровне трансляции считывание многих мРНК также регулируется присоединением белковых факторов[75].
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы и протеинфосфатазы — ферменты, которые активируют или подавляют активность других белков путём присоединения к ним или отщепления фосфатных групп.
Сигнальная функция[править | править код]
Сигнальная функция белков — способность белков служить сигнальными веществами, передавая сигналы между клетками, тканями, о́рганами и организмами. Часто сигнальную функцию объединяют с регуляторной, так как многие внутриклеточные регуляторные белки тоже осуществляют передачу сигналов.
Сигнальную функцию выполняют белки-гормоны, цитокины, факторы роста и др.
Гормоны переносятся кровью. Большинство гормонов животных — это белки или пептиды. Связывание гормона с его рецептором является сигналом, запускающим ответную реакцию клетки. Гормоны регулируют концентрации веществ в крови и клетках, рост, размножение и другие процессы. Примером таких белков служит инсулин, который регулирует концентрацию глюкозы в крови.
Клетки взаимодействуют друг с другом с помощью сигнальных белков, передаваемых через межклеточное вещество. К таким белкам относятся, например, цитокины и факторы роста.
Цитокины — пептидные сигнальные молекулы. Они регулируют взаимодействия между клетками, определяют их выживаемость, стимулируют или подавляют рост, дифференцировку, функциональную активность и апоптоз, обеспечивают согласованность действий иммунной, эндокринной и нервной систем. Примером цитокинов может служить фактор некроза опухоли, который передаёт сигналы воспаления между клетками организма[76].
Транспортная функция[править | править код]
Молекулярная модель кальциевого канала, вид сверху
Растворимые белки, участвующие в транспорте малых молекул, должны иметь высокое сродство (аффинность) к субстрату, когда он присутствует в высокой концентрации, и легко его высвобождать в местах низкой концентрации субстрата. Примером транспортных белков можно назвать гемоглобин, который переносит кислород из лёгких к остальным тканям и углекислый газ от тканей к лёгким, а также гомологичные ему белки, найденные во всех царствах живых организмов[77].
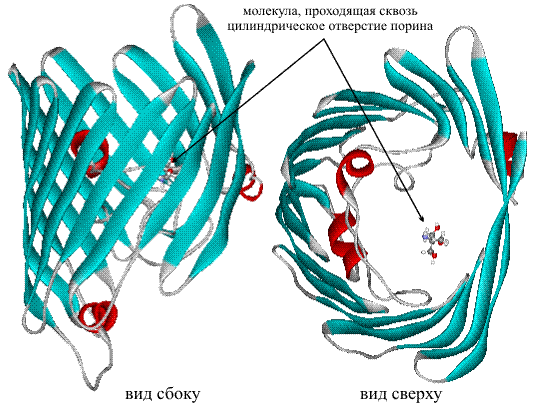
Некоторые мембранные белки участвуют в транспорте малых молекул через мембрану клетки, изменяя её проницаемость. Липидный компонент мембраны водонепроницаем (гидрофобен), что предотвращает диффузию полярных или заряженных (ионы) молекул. Мембранные транспортные белки принято подразделять на белки-каналы и белки-переносчики. Белки-каналы содержат внутренние заполненные водой поры, которые позволяют ионам (через ионные каналы) или молекулам воды (через белки-аквапорины) перемещаться через мембрану. Многие ионные каналы специализируются на транспорте только одного иона; так, калиевые и натриевые каналы часто различают эти сходные ионы и пропускают только один из них[78]. Белки-переносчики связывают, подобно ферментам, каждую переносимую молекулу или ион и, в отличие от каналов, могут осуществлять активный транспорт с использованием энергии АТФ. «Электростанция клетки» — АТФ-синтаза, которая осуществляет синтез АТФ за счёт протонного градиента, также может быть отнесена к мембранным транспортным белкам[79].
Запасная (резервная) функция[править | править код]
К таким белкам относятся так называемые резервные белки, которые запасаются в качестве источника энергии и вещества в семенах растений (например, глобулины 7S и 11S) и яйцеклетках животных[80]. Ряд других белков используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы метаболизма.
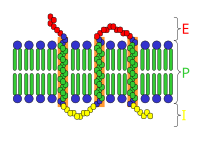
Схема трансмембранного рецептора: E — внеклеточное пространство; P — клеточная мембрана; I — внутриклеточное пространство
Рецепторная функция[править | править код]
Белковые рецепторы могут находиться как в цитоплазме, так и встраиваться в клеточную мембрану. Одна часть молекулы рецептора воспринимает сигнал, которым чаще всего служит химическое вещество, а в некоторых случаях — свет, механическое воздействие (например, растяжение) и другие стимулы. При воздействии сигнала на определённый участок молекулы — белок-рецептор — происходят её конформационные изменения. В результате меняется конформация другой части молекулы, осуществляющей передачу сигнала на другие клеточные компоненты. Существует несколько механизмов передачи сигнала. Некоторые рецепторы катализируют определённую химическую реакцию; другие служат ионными каналами, которые при действии сигнала открываются или закрываются; третьи специфически связывают внутриклеточные молекулы-посредники. У мембранных рецепторов часть молекулы, связывающаяся с сигнальной молекулой, находится на поверхности клетки, а домен, передающий сигнал, — внутри[81].
Моторная (двигательная) функция[править | править код]
Целый класс моторных белков обеспечивает движения организма, например, сокращение мышц, в том числе локомоцию (миозин), перемещение клеток внутри организма (например, амёбоидное движение лейкоцитов), движение ресничек и жгутиков, а также активный и направленный внутриклеточный транспорт (кинезин, динеин). Динеины и кинезины проводят транспортировку молекул вдоль микротрубочек с использованием гидролиза АТФ в качестве источника энергии. Динеины переносят молекулы и органоиды из периферических частей клетки по направлению к центросоме, кинезины — в противоположном направлении[82][83]. Динеины также отвечают за движение ресничек и жгутиков эукариот. Цитоплазматические варианты миозина могут принимать участие в транспорте молекул и органоидов по микрофиламентам.
Белки в обмене веществ[править | править код]
Большинство микроорганизмов и растений могут синтезировать 20 стандартных аминокислот, а также дополнительные (нестандартные) аминокислоты, например, цитруллин. Но если аминокислоты есть в окружающей среде, даже микроорганизмы сохраняют энергию путём транспорта аминокислот внутрь клеток и выключения их биосинтетических путей[84].
Аминокислоты, которые не могут быть синтезированы животными, называются незаменимыми. Основные ферменты в биосинтетических путях, например, аспартаткиназа, которая катализирует первый этап в образовании лизина, метионина и треонина из аспартата, отсутствуют у животных.
Животные, в основном, получают аминокислоты из белков, содержащихся в пище. Белки разрушаются в процессе пищеварения, который обычно начинается с денатурации белка путём помещения его в кислотную среду и гидролиза с помощью ферментов, называемых протеазами. Некоторые аминокислоты, полученные в результате пищеварения, используются для синтеза белков организма, а остальные превращаются в глюкозу в процессе глюконеогенеза или используются в цикле Кребса. Использование белка в качестве источника энергии особенно важно в условиях голодания, когда собственные белки организма, в особенности мускулов, служат источником энергии[85]. Аминокислоты также являются важным источником азота в питании организма.
Единых норм потребления белков человеком нет. Микрофлора толстого кишечника синтезирует аминокислоты, которые не учитываются при составлении белковых норм.
Методы изучения[править | править код]
Структуру и функции белков изучают как на очищенных препаратах in vitro, так и в их естественном окружении в живом организме, in vivo. Исследования чистых белков в контролируемых условиях полезны для определения их функций: кинетических особенностей каталитической активности ферментов, относительного сродства к различным субстратам и т. п. Исследования белков in vivo в клетках или в целых организмах предоставляют дополнительную информацию о том, где они функционируют и как регулируется их активность[86].
Молекулярной и клеточной биологии[править | править код]
Методы молекулярной и клеточной биологии обычно применяются для изучения синтеза и локализации белков в клетке. Широко применяется метод изучения локализации, основанный на синтезе в клетке химерного белка, состоящего из исследуемого белка, соединённого с «репортёром», например, зелёным флуоресцентным белком (GFP)[87]. Расположение такого белка в клетке можно увидеть с помощью флуоресцентного микроскопа[88]. Кроме того, белки можно визуализировать с помощью распознающих их антител, которые в свою очередь несут флуоресцентную метку. Часто одновременно с изучаемым белком визуализируют известные белки таких органелл, как эндоплазматический ретикулум, аппарат Гольджи, лизосомы и вакуоли, что позволяет более точно определить локализацию изучаемого белка[89].
Иммуногистохимические методы обычно используют антитела, которые конъюгированы с ферментами, катализирующими реакцию образования люминесцирующего или окрашенного продукта, что позволяет сравнить локализацию и количество изучаемого белка в образцах. Более редкой методикой определения расположения белков является равновесное ультрацентрифугирование клеточных фракций в градиенте сахарозы или хлорида цезия[90][91].
Наконец, один из классических методов — это иммуноэлектронная микроскопия, которая принципиально похожа на иммунофлуоресцентную микроскопию с тем отличием, что используется электронный микроскоп. Образец подготавливается для электронной микроскопии, а затем обрабатывается антителами к белку, которые соединены с электронно-плотным материалом, как правило, золотом[92].
С помощью сайт-направленного мутагенеза исследователи могут изменять аминокислотную последовательность белка и, следовательно, его пространственную структуру, расположение в клетке и регуляцию его активности. С помощью этого метода, используя модифицированные тРНК[93], можно также ввести в белок искусственные аминокислоты, и сконструировать белки с новыми свойствами[94].
Биохимические[править | править код]
Для выполнения анализа in vitro белок должен быть очищен от других клеточных компонентов. Этот процесс обычно начинается с разрушения клеток и получения так называемого клеточного экстракта. Далее методами центрифугирования и ультрацентрифугирования этот экстракт может быть разделён на: фракцию, содержащую растворимые белки; фракцию, содержащую мембранные липиды и белки; и фракцию, содержащую клеточные органеллы и нуклеиновые кислоты.
Осаждение белков методом высаливания применяется для разделения белковых смесей, а также позволяет сконцентрировать белки. Седиментационный анализ (центрифугирование) позволяет фракционировать белковые смеси по значению константы седиментации отдельных белков, измеряемой в сведбергах (S)[95]. Чтобы выделить необходимый белок или белки на основе таких свойств, как молекулярная масса, заряд и аффинность, затем используются различные виды хроматографии[96][97]. Кроме того, белки могут быть выделены в соответствии с их зарядом с использованием электрофокусирования[98].
Чтобы упростить процесс очистки белков, часто используется генетическая инженерия, которая позволяет создать производные белков, удобные для очистки, не затрагивая их структуры или активности. «Метки», представляющие собой небольшие аминокислотные последовательности, например, цепочку из 6 и более остатков гистидина, и прикрепляются к одному из концов белка. Когда экстракт клеток, синтезировавших «меченый» белок, пропускается через хроматографическую колонку, содержащую ионы никеля, гистидин связывается никелем и остаётся на колонке, в то время как остальные компоненты лизата беспрепятственно проходят сквозь колонку (никель-хелатная хроматография). Множество других меток было разработано, чтобы помочь исследователям выделить специфические белки из сложных смесей чаще всего методом аффинной хроматографии[99].
Степень очистки белка можно определить, если известны его молекулярная масса и изоэлектрическая точка — с помощью различных видов гель-электрофореза — или измерения ферментативной активности, если белок является ферментом. Масс-спектрометрия позволяет идентифицировать выделенный белок по его молекулярной массе и массе его фрагментов[100].
Для определения количества белка в образце используют ряд методов[101]: биуретовый метод, микробиуретовый метод, метод Бредфорда, метод Лоури, спектрофотометрический метод.
Протеомика[править | править код]
Совокупность белков клетки называется протеомом, его изучение — протеомикой, названной по аналогии с геномикой. Основные экспериментальные методы протеомики включают:
- 2D-электрофорез, который позволяет разделять многокомпонентные белковые смеси[102];
- масс-спектрометрию, которая позволяет идентифицировать белки по массе составляющих их пептидов с высокой пропускной способностью[103];
- белковые микрочипы, которые позволяют одновременно измерять содержание большого количества белков в клетке[104];
- дрожжевую двугибридную систему (англ.) (рус., которая позволяет систематически изучать белок-белковые взаимодействия[105].
Совокупность всех биологически значимых взаимодействий белков в клетке называется интерактомом[106]. Систематическое исследование структуры белков, представляющих все возможные типы третичных структур, называется структурной геномикой[107].
Предсказание структуры и моделирование[править | править код]
Предсказание пространственной структуры с помощью компьютерных программ (in silico) позволяется строить модели белков, структура которых ещё не определена экспериментально[108]. Самый успешный тип предсказания структур, известный как гомологическое моделирование, опирается на существующую «шаблонную» структуру, сходную по аминокислотной последовательности с моделируемым белком[109]. Методы предсказания пространственной структуры белков используются в развивающейся области генетической инженерии белков, с помощью которой уже получены новые третичные структуры белков[110]. Более сложной вычислительной задачей является прогнозирование межмолекулярных взаимодействий, таких как молекулярная стыковка и предсказание белок-белковых взаимодействий[111].
Укладка и межмолекулярные взаимодействия белков могут быть смоделированы с использованием молекулярной механики (англ.) (рус., в частности, молекулярной динамики и метода Монте-Карло, которые всё чаще используют преимущества параллельных и распределённых вычислений (например, проект Folding@home[112]). Укладка небольших α-спиральных белковых доменов, например, белка виллина[113] или одного из белков ВИЧ[114], были успешно смоделированы in silico. С помощью гибридных методов, сочетающих стандартную молекулярную динамику с квантовой механикой, были исследованы электронные состояния зрительного пигмента родопсина[115].
См. также[править | править код]
- Прионы
- Сплайсинг белков
- Гиперпротеинемия
- Предсказание структуры белка
- Предсказание функции белка
Примечания[править | править код]
- ↑ С химической точки зрения все белки являются полипептидами. Однако короткие, меньше 30 аминокислотных остатков в длину полипептиды, особенно химически синтезированные, нельзя назвать белками.
- ↑ Perutz M. F., Rossmann M. G., Cullis A. F., Muirhead H., Will G., North A. C. Structure of haemoglobin: a three-dimensional Fourier synthesis at 5.5-A. resolution, obtained by X-ray analysis (англ.) // Nature. — 1960. — Vol. 185, iss. 4711. — P. 416—422. — PMID 18990801.
- ↑ Kendrew J. C., Bodo G., Dintzis H. M., Parrish R. G., Wyckoff H., Phillips D. C. A three-dimensional model of the myoglobin molecule obtained by x-ray analysis (англ.) // Nature. — 1958. — Vol. 181, iss. 4610. — P. 662—666. — PMID 13517261.
- ↑ 1 2 3 Ю. А. Овчинников. Биоорганическая химия. — Москва: Просвещение, 1987. — С. 24—26.
- ↑ Henry Leicester. Berzelius, Jöns Jacob // Dictionary of Scientific Biography 2. — New York: Charles Scribner’s Sons, 1980. — С. 90—97. — ISBN 0-684-10114-9.
- ↑ Данилевский А.Я. Биолого-химические сообщения о белковых веществах (материалы для химической конституции и биогенеза их) // Физиологический сборник. — 1888. — Т. 1. — С. 289.
- ↑ Цветков Л. А. § 38. Белки // Органическая химия. Учебник для 10 класса. — 20-е изд. — М.: Просвещение, 1981. — С. 184—193. — 1 210 000 экз.
- ↑ Белки // Химическая энциклопедия. — Москва: Советская энциклопедия, 1988. Архивная копия от 3 февраля 2012 на Wayback Machine
- ↑ 1 2 N. H. Barton, D. E. G. Briggs, J. A. Eisen. Evolution. — Cold Spring Harbor Laboratory Press, 2007. — С. 38. — ISBN 978-0-87969-684-9.
- ↑ Нобелевская лекция Ф. Сэнгера. Дата обращения: 3 января 2013. Архивировано 5 января 2013 года.
- ↑ Sanger F., Tuppy H. The amino-acid sequence in the phenylalanyl chain of insulin. 2. The investigation of peptides from enzymic hydrolysates // Biochem J. — 1951. — Т. 49, вып. 4. — С. 481—490. — PMID 14886311. Архивировано 9 апреля 2022 года.
- ↑ Sanger F., Thompson E. O. The amino-acid sequence in the glycyl chain of insulin. II. The investigation of peptides from enzymic hydrolysates // Biochem J. — 1953. — Т. 53, вып. 3. — С. 366—374. — PMID 13032079.
- ↑ Овчинников Ю.А., Браунштейн А.Е., Егоров Ц.А., Поляновский О.Л., Алданова Н.А., Фейгина М.Ю., Липкин В.М., Абдулаев Н.Г., Гришин Е.В., Киселёв А.П., Модянов Н.Н., Носиков В.В. Полная первичная структура аспартатаминотрансферазы // Докл. АН СССР. — 1972. — Т. 207. — С. 728—731.
- ↑ Филиппович Ю.Б. Белки и их роль в процессах жизнедеятельности // Книга для чтения по органической химии. Пособие для учащихся. — М.: Просвещение, 1975. — С. 216—234.
- ↑ Protein Data Bank. Rutgers and UCSD. — Biological Macromolecular Resource. Дата обращения: 26 декабря 2012. Архивировано 27 декабря 2012 года.
- ↑ Yahav T., Maimon T., Grossman E., Dahan I., Medalia O. Cryo-electron tomography: gaining insight into cellular processes by structural approaches // Curr Opin Struct Biol. — 2011. — Т. 21, вып. 5. — С. 670—677. — PMID 21813274.
- ↑ Fulton A., Isaacs W. Titin, a huge, elastic sarcomeric protein with a probable role in morphogenesis // Bioessays. — 1991. — Т. 13, вып. 4. — С. 157—161. — PMID 1859393.
- ↑ 1 2 3 4 Х.-Д. Якубке, Х. Ешкайт. Глава 3.5 Физико-химические свойства // Аминокислоты, пептиды, белки. — Москва: Мир, 1985. — С. 356—363.
- ↑ EC 3.4.23.1 — pepsin A Пепсин А в информационной системе BRENDA. Дата обращения: 18 мая 2008. Архивировано 19 февраля 2020 года.
- ↑ 1 2 А. Н. Несмеянов, Н. А. Несмеянов. Начала органической химии. Книга вторая 221. Дата обращения: 26 декабря 2012. Архивировано 27 декабря 2012 года.
- ↑ Singer S. J. The structure and insertion of integral proteins in membranes // Annu Rev Cell Biol. — 1990. — Т. 6. — С. 247—296. — PMID 2275815.
- ↑ Страйер Л. Биохимия в 3 томах. — Москва: Мир, 1984.
- ↑ 1 2 Ленинджер А. Основы биохимии в 3 томах. — Москва: Мир, 1985.
- ↑ Koonin E. V., Tatusov R. L., Galperin M. Y. Beyond complete genomes: from sequence to structure and function // Curr Opin Struct Biol.. — 1998. — Т. 8, вып. 3. — С. 355—363. — PMID 9666332.
- ↑ David Whitford. Proteins: Structure and Function. — Wiley, 2005. — С. 41. — P. 542. — ISBN 978-0471498940.
- ↑ 1 2 3 4 David Whitford. Proteins: Structure and Function. — Wiley, 2005. — С. 45. — P. 542. — ISBN 978-0471498940.
- ↑ Финкельштейн А. В., Птицын О. Б. Вторичные структуры полипептидных цепей // Физика белка. — Москва: КДУ, 2005. — С. 86—95. — ISBN 5-98227-065-2.
- ↑ 1 2 Финкельштейн А. В., Птицын О. Б. Лекция 15 // Физика белка. — Москва: КДУ, 2005. — С. 189—205.
- ↑ А. Н. Несмеянов, Н. А. Несмеянов. Начала органической химии. Книга первая 331. Дата обращения: 26 декабря 2012. Архивировано 27 декабря 2012 года.
- ↑ Шрёдингер Э. Что такое жизнь с точки зрения физики? = пер. с англ. А.А. Малиновского. — Москва: РИМИС, 2009. — С. 176. — ISBN 978-5-9650-0057-9.
- ↑ Волькенштейн М.В. Биофизика. — Москва: Наука, 1988.
- ↑ Huber R. Conformational flexibility in protein molecules (англ.) // Nature. — 1979. — Vol. 280, iss. 5723. — P. 538—539. — PMID 460436.
- ↑ Richards F. M. Areas, volumes, packing and protein structure // Annu Rev Biophys Bioeng. — 1977. — Т. 6. — С. 151—176. — PMID 326146.
- ↑ Привалов П.Л. Стабильность белков и гидрофобные взаимодействия // Биофизика. — 1987. — Т. 32, вып. 5. — С. 742—760. — PMID 3318936.
- ↑ Морозов В. Н., Морозова Т. Я. Механические свойства глобулярных белков // Молекулярная биология. — 1983. — Т. 17, вып. 3. — С. 577—586. — PMID 6877232.
- ↑ Doster W., Cusack S., Petry W. Dynamical transition of myoglobin revealed by inelastic neutron scattering (англ.) // Nature. — 1989. — Vol. 337, iss. 6209. — P. 754—756. — PMID 2918910.
- ↑ Parak F., Frolov E. N., Mössbauer R. L., Goldanskii V. I. Dynamics of metmyoglobin crystals investigated by nuclear gamma resonance absorption // J Mol Biol. — 1981. — Т. 145, вып. 4. — С. 825—833. — PMID 7265223.
- ↑ Шайтан К.В., Рубин А.Б. Стохастическая динамика и электронно-конформационные взаимодействия в белках // Биофизика. — 1985. — Т. 30, вып. 3. — С. 517—526. — PMID 3896324.
- ↑ 1 2 3 Спирин А. С. Глава II. Информационная РНК и генетический код // Молекулярная биология. Структура рибосомы и биосинтез белка. — Москва: Высшая школа, 1986. — С. 9—16.
- ↑ Benjamin Lewin. Genes VIII. — Upper Saddle River, NJ: Pearson Prentice Hall, 2004. — ISBN 0131439812.
- ↑ Dobson C. M. The nature and significance of protein folding // Mechanisms of Protein Folding (англ.) / Pain R. H.. — 2nd. — New York, NY: Oxford University Press, 2000.
- ↑ Stack D., Neville C., Doyle S. Nonribosomal peptide synthesis in Aspergillus fumigatus and other fungi // Microbiology. — 2007. — Т. 153, вып. Pt 5. — С. 1297—1306. — PMID 17464044. (недоступная ссылка)
- ↑ Welker M., von Döhren H. Cyanobacterial peptides — nature’s own combinatorial biosynthesis // FEMS Microbiol Rev. — 2006. — Т. 30, вып. 4. — С. 530—563. — PMID 16774586.
- ↑ Wilken J., Kent S. B. Chemical protein synthesis // Curr Opin Biotechnol. — 1998. — Т. 9, вып. 4. — С. 412—426. — PMID 9720266.
- ↑ Dawson P. E., Kent S. B. Synthesis of native proteins by chemical ligation // Annu Rev Biochem. — 2000. — Т. 69. — С. 923—960. — PMID 10966479.
- ↑ Jones D. T. Protein secondary structure prediction based on position-specific scoring matrices // J Mol Biol. — 1999. — Т. 292, вып. 2. — С. 195—202. — PMID 10493868.
- ↑ Jensen O. N. Interpreting the protein language using proteomics // Nat Rev Mol Cell Biol. — 2006. — Т. 7, вып. 6. — С. 391—403. — PMID 16723975.
- ↑ Demartino G. N., Gillette T. G. Proteasomes: machines for all reasons (англ.) // Cell. — Cell Press, 2007. — Vol. 129, iss. 4. — P. 659—662. — PMID 17512401. Архивировано 18 марта 2021 года.
- ↑ Walsh G., Jefferis R. Post-translational modifications in the context of therapeutic proteins (англ.) // Nature Biotechnology. — Nature Publishing Group, 2006. — Vol. 24, iss. 10. — P. 1241—1252. — PMID 17033665.
- ↑ Rosenbaum, J. Cytoskeleton: functions for tubulin modifications at last (англ.) // Curr Biol : journal. — 2000. — Vol. 10. — P. 801—803. — doi:10.1016/S0960-9822(00)00767-3. — PMID 11084355.
- ↑ Bronner C., Chataigneau T., Schini-Kerth V. B., Landry Y. The “Epigenetic Code Replication Machinery”, ECREM: a promising drugable target of the epigenetic cell memory // Curr Med Chem. — 2007. — Т. 14, вып. 25. — С. 2629—2641. — PMID 17979715.
- ↑ Alberts B., Johnson A., Lewis J., et al. Chapter 12. Intracellular Compartments and Protein Sorting // Molecular Biology of the Cell. 4th edition. — New York: Garland Science, 2002. Архивная копия от 21 июня 2022 на Wayback Machine
- ↑ Hegde R. S., Bernstein H. D. The surprising complexity of signal sequences // Trends Biochem Sci. — 2006. — Т. 31, вып. 10. — С. 563—571. — PMID 16919958.
- ↑ Saraogi I., Shan S. O. Molecular mechanism of co-translational protein targeting by the signal recognition particle // Traffic. — Т. 12, вып. 5. — С. 535—542.
- ↑ Alberti S. Molecular mechanisms of spatial protein quality control // Prion. — 2012. — Т. 6, вып. 5. — С. 437—442. — doi:10.4161/pri.22470. — PMID 23051707.
- ↑ 1 2 Shintani T., Klionsky D. J. Autophagy in health and disease: a double-edged sword (англ.) // Science. — 2004. — Vol. 306, iss. 5698. — P. 990—995. — PMID 15528435. Архивировано 12 июня 2020 года.
- ↑ Anfinsen C. B. Principles that Govern the Folding of Protein Chains (англ.) // Science. — 1973. — Vol. 181, iss. 4096. — P. 223—230. — PMID 4124164. Нобелевская лекция. Автор, совместно со Стэнфордом Муром и Уильямом Стейном, получил Нобелевскую премию по химии за «изучение рибонуклеазы, в особенности взаимоотношений между аминокислотной последовательностью фермента и его биологически активной конформацией».
- ↑ Ellis R. J., van der Vies S. M. Molecular chaperones // Annu Rev Biochem. — 1991. — Т. 60. — С. 321—347. — doi:10.1146/annurev.bi.60.070191.001541. — PMID 1679318.
- ↑ Sun Y., MacRae T. H. The small heat shock proteins and their role in human disease // FEBS J. — 2005. — Т. 272, вып. 11. — С. 2613—2627. — PMID 15943797. Архивировано 22 июля 2014 года.
- ↑ Union of Biochemistry and Molecular Biology (NC-IUBMB). Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB). Дата обращения: 29 декабря 2012. Архивировано 5 января 2013 года.
- ↑ 1 2 Lodish H, Berk A, Matsudaira P., Kaiser C. A., Krieger M., Scott M. P., Zipursky S. L., Darnell J. Chapter 3 // Molecular cell biology. — 5th. — New York: W.H. Freeman and CO, 2004. — С. 66—72. — ISBN 0-7167-4366-3.
- ↑ 1 2 Сорокин А. В., Ким Е. Р., Овчинников Л. П. Протеасомная система деградации и процессинга белков // Успехи биологической химии. — 2009. — Т. 49. — С. 3—76. Архивировано 7 октября 2013 года.
- ↑ 1 2 3 Farrugia G., Balzan R. Oxidative stress and programmed cell death in yeast // Front Oncol. — 2012. — Т. 2, вып. 64. — doi:10.3389/fonc.2012.00064. — PMID 22737670.
- ↑ Kaganovich D., Kopito R., Frydman J. Misfolded proteins partition between two distinct quality control compartments (англ.) // Nature. — 2008. — Vol. 454, iss. 7208. — P. 1088—1095. — doi:10.1038/nature07195. — PMID 18756251. Архивировано 15 декабря 2019 года.
- ↑ Yannay-Cohen N., Razin E. Translation and transcription: the dual functionality of LysRS in mast cells // Mol Cells. — 2006. — Т. 22, вып. 2. — С. 127—132. — PMID 17085962.
- ↑ База данных номенклатуры ферментов ENZYME. Дата обращения: 25 апреля 2013. Архивировано 28 апреля 2013 года.
- ↑ Bairoch A. The ENZYME database in 2000 // Nucleic Acids Res. — 2000. — Т. 28, вып. 1. — С. 304—305. — PMID 10592255. Архивировано 3 февраля 2022 года.
- ↑ Radzicka A., Wolfenden R. A proficient enzyme (англ.) // Science. — 1995. — Vol. 267, iss. 5194. — P. 90—93. — PMID 7809611.
- ↑ The Catalytic Site Atlas at The European Bioinformatics Institute. Дата обращения: 28 сентября 2007. Архивировано 20 июня 2013 года.
- ↑ Номенклатура ферментов на сайте Международного союза биохимии и молекулярной биологии. Дата обращения: 25 апреля 2013. Архивировано 28 апреля 2013 года.
- ↑ Erickson H. P. Evolution of the cytoskeleton // Bioessays. — 2007. — Т. 29, вып. 7. — С. 668—677. — PMID 17563102. Архивировано 26 апреля 2021 года.
- ↑ Wolberg A. S. Thrombin generation and fibrin clot structure // Blood Rev. — 2007. — Т. 21, вып. 3. — С. 131—142. — PMID 17208341.
- ↑ Я. Кольман, К.-Г. Рем. Наглядная биохимия. — Москва: Мир, 2000. — С. 308—309.
- ↑ Li J., Barreda D. R., Zhang Y. A., Boshra H., Gelman A. E., Lapatra S., Tort L., Sunyer J. O. B lymphocytes from early vertebrates have potent phagocytic and microbicidal abilities // Nat Immunol. — 2006. — Т. 7, вып. 10. — С. 1116—1124. — PMID 16980980.
- ↑ Hinnebusch A. G. Translational regulation of GCN4 and the general amino acid control of yeast // Annu Rev Microbiol. — 2005. — Т. 59. — С. 407—450. — PMID 16153175.
- ↑ Повещенко А. Ф., Абрамов В. В., Козлов В. В. Цитокины — факторы нейроэндокринной регуляции // Успехи физиологических наук. — 2007. — Т. 38, вып. 3. — С. 40—46.
- ↑ Wittenberg JB. On optima: the case of myoglobin-facilitated oxygen diffusion. Gene. 2007 Aug 15. 398(1—2):156—161.
- ↑ Driessen AJ, Nouwen N. Protein Translocation Across the Bacterial Cytoplasmic Membrane. Annu Rev Biochem. 2007 Dec 13 [Epub ahead of print]
- ↑ Drory O., Nelson N. The emerging structure of vacuolar ATPases (англ.) // Physiology (Bethesda).. — 2006. — Vol. 21. — P. 317—325. Архивировано 21 ноября 2008 года.
- ↑ Eliot M. Hermana and Brian A. Larkins. Protein Storage Bodies and Vacuoles // The Plant Cell. — 1999. — Т. 11. — С. 601—613.
- ↑ Dupré DJ, Hébert TE. Biosynthesis and trafficking of seven transmembrane receptor signalling complexes. Cell Signal. 2006;18(10):1549—1559
- ↑ Karp G. Cell and Molecular Biology: Concepts and Experiments, Fourth ed, pp. 346—358. John Wiley and Sons, Hoboken, NJ. 2005.
- ↑ Schroer, Trina A. Dynactin. Annual Review of Cell and Developmental Biology. 2004 20, 759—779. PMID 15473859
- ↑ Voet D, Voet JG. Biochemistry Vol 1 3rd ed., Hoboken, NJ (2004).
- ↑ Brosnan J. Interorgan amino acid transport and its regulation (англ.) // J Nutr (англ.) (рус. : journal. — 2003. — Vol. 133, no. 6 Suppl 1. — P. 2068S—72S. — PMID 12771367. Архивировано 26 июля 2006 года.
- ↑ David Whitford. Proteins: Structure and Function. — Wiley, 2005. — С. 313. — P. 542. — ISBN 978-0471498940.
- ↑ Stepanenko O. V., Verkhusha V. V., Kuznetsova I. M., Uversky V. N., Turoverov K. K. Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes (англ.) // Current Protein & Peptide Science : journal. — 2008. — Vol. 9, no. 4. — P. 338—369. — doi:10.2174/138920308785132668. — PMID 18691124. — PMC 2904242.
- ↑ Yuste R. Fluorescence microscopy today (англ.) // Nature Methods : journal. — 2005. — Vol. 2, no. 12. — P. 902—904. — doi:10.1038/nmeth1205-902. — PMID 16299474.
- ↑ Margolin W. Green fluorescent protein as a reporter for macromolecular localization in bacterial cells (англ.) // Methods (San Diego, Calif.) (англ.) (рус. : journal. — 2000. — Vol. 20, no. 1. — P. 62—72. — doi:10.1006/meth.1999.0906. — PMID 10610805. Архивировано 9 июня 2019 года.
- ↑ Walker J. H., Wilson K. Principles and Techniques of Practical Biochemistry (англ.). — Cambridge, UK: Cambridge University Press, 2000. — P. 287—289. — ISBN 0-521-65873-X.
- ↑ Остерман Л. А. Методы исследования белков и нуклеиновых кислот: Электрофорез и ультрацентрифугирование (практическое пособие). — М.: «Наука», 1981. — С. 240—263. — 288 с.
- ↑ Mayhew T. M., Lucocq J. M. Developments in cell biology for quantitative immunoelectron microscopy based on thin sections: a review (англ.) // Histochemistry and Cell Biology (англ.) (рус. : journal. — 2008. — Vol. 130, no. 2. — P. 299—313. — doi:10.1007/s00418-008-0451-6. — PMID 18553098. — PMC 2491712.
- ↑ Hohsaka T., Sisido M. Incorporation of non-natural amino acids into proteins (англ.) // Current Opinion in Chemical Biology. — Elsevier, 2002. — Vol. 6, no. 6. — P. 809—815. — doi:10.1016/S1367-5931(02)00376-9. — PMID 12470735.
- ↑ Cedrone F., Ménez A., Quéméneur E. Tailoring new enzyme functions by rational redesign (англ.) // Current Opinion in Structural Biology : journal. — Elsevier, 2000. — Vol. 10, no. 4. — P. 405—410. — doi:10.1016/S0959-440X(00)00106-8. — PMID 10981626.
- ↑ Colea J. L., Hansenb J. C. «Analytical Ultracentrifugation as a Contemporary Biomolecular Research Tool» // J. Biomol. Techn. V 10. 1999. P. 163—176
- ↑ Murray R. F., Harper H. W., Granner D. K., Mayes P. A., Rodwell V. W. Harper’s Illustrated Biochemistry (англ.). — New York: Lange Medical Books/McGraw-Hill, 2006. — ISBN 0-07-146197-3.
- ↑ Остерман Л. А. Хроматография белков и нуклеиновых кислот. — Москва, 1985.
- ↑ Hey J., Posch A., Cohen A., Liu N., Harbers A. Fractionation of complex protein mixtures by liquid-phase isoelectric focusing (англ.) // Methods in Molecular Biology (англ.) (рус. : journal. — 2008. — Vol. 424. — P. 225—239. — ISBN 978-1-58829-722-8. — doi:10.1007/978-1-60327-064-9_19. — PMID 18369866.
- ↑ Terpe K. Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems (англ.) // Applied Microbiology and Biotechnology (англ.) (рус. : journal. — Springer, 2003. — Vol. 60, no. 5. — P. 523—533. — doi:10.1007/s00253-002-1158-6. — PMID 12536251.
- ↑ Н. А. Понькин. Что в имени твоём, масс-спектрометрия? Архивная копия от 4 марта 2016 на Wayback Machine сайт Всероссийского масс-спектрометрического общества
- ↑ Editor: John M. Walker. The Protein Protocols Handbook. — 3. — Springer. — С. 3—69. — 1985 с. — (Springer Protocols Handbooks). — ISBN 978-1-60327-474-6. Архивная копия от 18 августа 2016 на Wayback Machine Архивированная копия. Дата обращения: 29 сентября 2017. Архивировано из оригинала 18 августа 2016 года.
- ↑ Görg A., Weiss W., Dunn M. J. Current two-dimensional electrophoresis technology for proteomics (англ.) // Proteomics : journal. — 2004. — Vol. 4, no. 12. — P. 3665—3685. — doi:10.1002/pmic.200401031. — PMID 15543535.
- ↑ Conrotto P, Souchelnytskyi S. Proteomic approaches in biological and medical sciences: principles and applications // Exp Oncol.. — Т. 30, вып. 3. — С. 171—180. — PMID 18806738.
- ↑ Joos T., Bachmann J. Protein microarrays: potentials and limitations (англ.) // Frontiers in Bioscience (англ.) (рус. : journal. — Frontiers in Bioscience (англ.) (рус., 2009. — Vol. 14, no. 14. — P. 4376—4385. — doi:10.2741/3534. — PMID 19273356. Архивировано 28 ноября 2012 года.
- ↑ Koegl M., Uetz P. Improving yeast two-hybrid screening systems (англ.) // Briefings in Functional Genomics & Proteomics. — 2007. — Vol. 6, no. 4. — P. 302—312. — doi:10.1093/bfgp/elm035. — PMID 18218650. Архивировано 15 апреля 2013 года. Архивированная копия. Дата обращения: 1 января 2013. Архивировано из оригинала 15 апреля 2013 года.
- ↑ Plewczyński D., Ginalski K. The interactome: predicting the protein–protein interactions in cells (англ.) // Cellular & Molecular Biology Letters : journal. — 2009. — Vol. 14, no. 1. — P. 1—22. — doi:10.2478/s11658-008-0024-7. — PMID 18839074.
- ↑ Zhang C., Kim S. H. Overview of structural genomics: from structure to function (англ.) // Current Opinion in Chemical Biology : journal. — Elsevier, 2003. — Vol. 7, no. 1. — P. 28—32. — doi:10.1016/S1367-5931(02)00015-7. — PMID 12547423.
- ↑ Zhang Y. Progress and challenges in protein structure prediction (англ.) // Current Opinions in Structural Biology : journal. — 2008. — Vol. 18, no. 3. — P. 342—348. — doi:10.1016/j.sbi.2008.02.004. — PMID 18436442. — PMC 2680823.
- ↑ Xiang Z. Advances in homology protein structure modeling (англ.) // Current Protein and Peptide Science. — 2006. — Vol. 7, no. 3. — P. 217—227. — doi:10.2174/138920306777452312. — PMID 16787261. — PMC 1839925.
- ↑ Kuhlman B., Dantas G., Ireton G. C., Varani G., Stoddard B. L., Baker D. Design of a novel globular protein fold with atomic-level accuracy (англ.) // Science : journal. — 2003. — Vol. 302, no. 5649. — P. 1364—1368. — doi:10.1126/science.1089427. — Bibcode: 2003Sci…302.1364K. — PMID 14631033. Архивировано 8 марта 2020 года.
- ↑ Ritchie D. W. Recent progress and future directions in protein–protein docking (англ.) // Current Protein and Peptide Science : journal. — 2008. — Vol. 9, no. 1. — P. 1—15. — doi:10.2174/138920308783565741. — PMID 18336319.
- ↑ Scheraga H. A., Khalili M., Liwo A. Protein-folding dynamics: overview of molecular simulation techniques (англ.) // Annual Review of Physical Chemistry (англ.) (рус. : journal. — 2007. — Vol. 58. — P. 57—83. — doi:10.1146/annurev.physchem.58.032806.104614. — Bibcode: 2007ARPC…58…57S. — PMID 17034338.
- ↑ Zagrovic B., Snow C. D., Shirts M. R., Pande V. S. Simulation of folding of a small alpha-helical protein in atomistic detail using worldwide-distributed computing (англ.) // Journal of Molecular Biology (англ.) (рус. : journal. — 2002. — Vol. 323, no. 5. — P. 927—937. — doi:10.1016/S0022-2836(02)00997-X. — PMID 12417204.
- ↑ Herges T., Wenzel W. In silico folding of a three helix protein and characterization of its free-energy landscape in an all-atom force field (англ.) // Physical Review Letters : journal. — 2005. — Vol. 94, no. 1. — P. 018101. — doi:10.1103/PhysRevLett.94.018101. — Bibcode: 2005PhRvL..94a8101H. — PMID 15698135.
- ↑ Hoffmann M., Wanko M., Strodel P., König P. H., Frauenheim T., Schulten K., Thiel W., Tajkhorshid E., Elstner M. Color tuning in rhodopsins: the mechanism for the spectral shift between bacteriorhodopsin and sensory rhodopsin II (англ.) // Journal of the American Chemical Society (англ.) (рус. : journal. — 2006. — Vol. 128, no. 33. — P. 10808—10818. — doi:10.1021/ja062082i. — PMID 16910676.
Литература[править | править код]
- Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки. В 3 томах. — М.: Мир, 1994. — ISBN 5-03-001986-3.
- Ленинджер А. Основы биохимии. В 3 томах. — М.: Мир, 1985.
- Страйер Л. Биохимия. В 3 томах. — М.: Мир, 1984.
Ссылки[править | править код]
- Свойства аминокислот и белков
- PDB — Protein Data Bank
- Обзоры статей о фолдинге белков на русском
- Хаос и порядок дискретных систем в свете синергетической теории информации (В статье проводится количественный анализ первичной структуры белков со стороны соотношения хаоса и порядка)
- Научно-популярный фильм «Белок»
Белки – наиболее важные органические соединения клетки. Их содержание колеблется от 50% до 80% в разных клетках организма.
Строение белков
В состав белков, кроме 4 основных химических элементов (углерод, кислорода, водород, азот), могут входит фосфор, сера, железо. Белки – сложные высокомолекулярные соединения, которые составлены из аминокислотных последовательностей. Аминокислоты состоят из двух частей: аминогруппы -NH2 и карбоксильной группы -COOH. Первая несет в себе основные свойства, а вторая – кислотные, что обуславливает активности и амфотерность этих соединений (Амфотерность – проявление кислотных или основных свойств в зависимости от реакции). Аминокислоты отличаются радикалами.
Строение аминокислоты
Аминокислоты ассоциируются с генетическим кодом, так как последовательности нуклеотидов кодируют триплеты нуклеотидов. Такие задачи изучаются в школе и встречаются в ЕГЭ. Всем, кто сталкивался с генетикой, хорошо знакома таблица аминокислот:
Таблица аминокислот
В один белок может входить много аминокислот. Они соединяются в цепь посредством образования пептидных связей: азот одной аминокислоты связывается с углеродом другой аминокислоты:
Строение белка. Зеленым цветом обозначена карбоксильная группа аминокислоты, голубым цветом – аминогруппа аминокислоты
В состав белка может входить даже несколько аминокислотных цепей. Всего аминокислот насчитывается около 170, однако основное разнообразие задают 20 аминокислот, что связано с тем, что одна аминокислота может кодироваться различными последовательностями кодонов, или другими словами, аминокислота может кодироваться разными триплетами нуклеотидов. Это одно из свойств генетического кода (свойство избыточности).
Некоторые аминокислоты животный организм синтезирует самостоятельно, но, как можно догадаться, не все. Такие аминокислоты называются незаменимыми аминокислотами, их следует употреблять с пищей. Например, лейцин используется не просто как биологическая добавка, что достаточно распространено среди фармакологических компаний, но и применяется при лечении заболеваний печени, а также анемии, она же малокровие.
Классификация белков
Протеины – белки, в состав которых входят только белковые молекулы.
Протеиды – белки, в состав которых, кроме белковых молекул, входят небелковые молекулы.
- Гликопротеиды (белок + углевод)
- Липопротеиды (белок + липид)
- Нуклеопротеиды (белок + нуклеиновые кислоты)
Для того чтобы не путаться в понятиях, нужно вспомнить, что принимают спортсмены для того, чтобы скорее нарастить мышечную массу, то есть протеиновые коктейли, батончики и т.д. Именно протеиновые, это слово на слуху, пусть теперь оно ассоциируется с этой классификацией.
Уровни организации белковой молекулы
Структура белка именуется просто по счету, в зависимости от сложности укладки.
Первичная структура белка представляет собой прямую цепь из аминокислот. Она является главной и определяющей свойства, форму и функции белка.
Вторичная структура белка – уже две цепи. Однако эти цепи не идут параллельно друг другу. Они скручены в спираль и связаны водородными связями, которые их удерживают за счет того, что их много. ДНК была обнаружена именно в форме двойной спирали. В этом виде она наиболее известна.
Третичная структура белка – глобула. Глобула означает шар, что и является описанием структуры белка. В этом случае прочность обусловлена тремя видами связей: водородными, ионными и дисульфидными.
Четвертичная структура белка – это как бы глобула из глобул. Она встречается не у всех белков. Белок крови гемоглобин состоит из 4х субъединиц четвертичной структуры.
Денатурация – утрата белковой молекулой своей природной структуры. Это обратимый процесс, похожий на сохранение в игре. Если белок денатурировал, но его природная структура не нарушена, то он восстановится. Причин разрушения белка может быть много: высокая температура, химические повреждения, радиация, обезвоживание и т.д. Так что когда мы варим яйца или мясо, то происходит денатурация белка. Как мы видим, к исходному состояния он уже не возвращается (не ренатурирует). Денатурацию и ренатурацию просто запомнить по похожим словам: денатурация – деградация – разрушение; ренатурация – регенерация – восстановление.
Денатурация и ренатурация
Функции белков
1.Структурная функция
Белки входят в состав всего в клетке: мембраны и органоиды. Кроме того, есть белки, которые очень важно знать:
- Коллаген – входит в состав соединительной ткани. Коллаген можно запомнить по кремам, которые обещают продлить молодость и расправить морщины.
- Кератин – известен всем, кто когда-либо смотрел рекламу шампуня для волос. Кератин входит в структуру волос и прочих производных нашего и животного тела: шерсть, перья, ногти, когти, копыта, рога.
- Эластин – как понятно из названия, отвечает за эластичность. Она важна а) в связках, так как они должны растягиваться для совершения движений и возвращаться в исходное состояние. Кстати, в том числе и голосовые связки; б) в сосудах, по которым течет кровь порой под большим давлением, с высоким давлением и скоростью.
2.Ферментативная функция
Ферменты – катализаторы (= ускорители химических реакций) белковой природы. С ферментами происходит тесное знакомство в разделе «пищеварение». Есть одно важное правило, которое нужно обязательно запомнить: все ферменты – белки, но не все белки – ферменты.
3.Транспортная функция
Белки-транспортеры осуществляют перенос веществ через мембрану клетки. Очень наглядным примером транспорта белками является белок-переносчик гемоглобин, благодаря которому мы дышим. В мышцах существует аналог этого белка – миоглобин (приставка мио- означает «сокращение», тем самым называя месторасположение белка).
4.Защитная функция
Изучая иммунитет, ученики и студенты знакомятся с антителами – специфическими белками крови, которые вырабатываются иммунными клетками лимфоцитами для борьбы с чужеродными организмами или вредными соединениями. Так антитела сражаются за нас, когда мы хватаем где-то микробов, так же эти белки воюют, когда человеку переливают кровь неподходящей группы или пересаживают орган, который его организм отторгает. Переливание крови неподходящей группы может привести к летальному исходу, так как произойдет агглютинация – склеивание эритроцитов.
Некоторые растения и животные вырабатывают яды или токсины для того, чтобы защитить себя от нападения и поедания. Поэтому не следует есть незнакомые ягоды, грибы и ловить где-нибудь в тропиках лягушек. Это может закончиться плачевно.
Кроме оборонительной и атакующей функции во благо защиты организма, есть и латающая. При порезе и кровопотере молекулы белка тромбина объединяются для того, чтобы закрыть поврежденный сосуд, а тем временем, тонкие нити белка фибрина переплетаются на поверхности раны, образуя тоненькую пленочку. Если порез был несерьезным, то кровотечение успешно остановлено.
5.Регуляторная функция
Некоторые белки являются гормонами. Они отвечают за регуляцию физиологических процессов организма. Наиболее известным примером белкового гормона является инсулин.
6.Энергетическая функция
Как и углеводы с жирами, белки тоже могут быть расщеплены для получения энергии. Однако, чаще всего, аминокислоты, полученные в результате распада белка, снова используются организмом для построения других белков. Это делает для экономии энергии и биологического материала, ведь в случае повторного использования, не нужно тратиться на синтез новых соединений. При расщеплении 1 г белка высвобождается 17,6 кДж энергии.
Задание EB11693
Установите соответствие между классами органических веществ и выполняемыми ими функциями в клетке.
| ОСОБЕННОСТИ СТРОЕНИЯ И СВОЙСТВ ВЕЩЕСТВА | ВЕЩЕСТВА |
|
A) запасание энергии Б) сигнальная B) хранение генетической информации Г) перенос энергии Д) входит в состав клеточных стенок и мембран Е) реализация генетической информации (синтез белка) |
1) углеводы 2) нуклеиновые кислоты (ДНК, РНК) |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
| А | Б | В | Г | Д | Е |
Для начала вспомним какие вообще есть классы органических веществ в клетке.
Это белки, жиры, углеводы и нуклеиновые кислоты. Белки, жиры и углеводы являются источниками энергии, но у них есть и более локальные функции:
| Белки | Жиры | Углеводы | Нуклеиновые кислоты | |
| Структурная | + | + | ||
| Энергетическая | + | + | + | |
| Защитная | + | + | ||
| Ферментативная | + | |||
| Двигательная | + | |||
| Транспортная | + | |||
| Регуляторная | + | |||
| Рецепторная | + | |||
| Хранение и передача ген.информации | + | |||
| Биосинтез белка | + |
Выберем вначале то,что относится к нуклеиновым кислотам: биосинтез белка и хранение генетической информации.
Остальное — углеводы.
PS: сигнальная и рецепторная функция — одно и то же.
Ответ: 112112
pазбирался: Ксения Алексеевна | обсудить разбор
Задание EB21891
Рассмотрите предложенную схему реакции между аминокислотами. Запишите в ответ понятие, обозначающее название химической связи, отмеченной на схеме знаком вопроса.
На данной схеме изображена реакция между двумя аминокислотами, что известно из вопроса. Между ними действуют пептидные связи.
Пептидная связь — это химическая связь, возникающая между двумя молекулами в результате реакции конденсации между карбоксильной группой (-СООН) одной молекулы и аминогруппой (-NH2) другой молекулы, при выделении одной молекулы воды (H2O).
Ответ: пептидная
pазбирался: Ксения Алексеевна | обсудить разбор
Ксения Алексеевна | Просмотров: 5.7k
- Состав белков.
- Структура белков.
- Химические свойства белков.
- Роль белков в организме.
- Регуляторные белки.
- Искусственный синтез белков.
- Белки как источники питания.
- БЕЛКИ (статья 2)
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- Строение.
- Оптическая активность.
- Последовательность аминокислот.
- Сложные белки.
- Третичная структура.
- Белки у разных видов организмов.
- Денатурация.
- СИНТЕЗ БЕЛКОВ
- Активация ферментов.
- Метаболический кругооборот.
- Синтетические белки.
- БЕЛКИ И ПИТАНИЕ
- Источники аминокислот.
- Потребность в белках.
- Азотистый баланс.
- Незаменимые аминокислоты.
- Питательная ценность белков.
- Синтетические белки в рационе.
БЕЛКИ (статья 1) – класс биологических полимеров, присутствующих в каждом живом организме. С участием белков проходят основные процессы, обеспечивающие жизнедеятельность организма: дыхание, пищеварение, мышечное сокращение, передача нервных импульсов. Костная ткань, кожный, волосяной покров, роговые образования живых существ состоят из белков. Для большинства млекопитающих рост и развитие организма происходит за счет продуктов, содержащих белки в качестве пищевого компонента. Роль белков в организме и, соответственно, их строение весьма разнообразно.
Состав белков.
Все белки представляют собой полимеры, цепи которых собраны из фрагментов аминокислот. Аминокислоты – это органические соединения, содержащие в своем составе (в соответствии с названием) аминогруппу NH2 и органическую кислотную, т.е. карбоксильную, группу СООН. Из всего многообразия существующих аминокислот (теоретически количество возможных аминокислот неограниченно) в образовании белков участвуют только такие, у которых между аминогруппой и карбоксильной группой – всего один углеродный атом. В общем виде аминокислоты, участвующие в образовании белков, могут быть представлены формулой: H2N–CH(R)–COOH. Группа R, присоединенная к атому углерода (тому, который находится между амино- и карбоксильной группой), определяет различие между аминокислотами, образующими белки. Эта группа может состоять только из атомов углерода и водорода, но чаще содержит помимо С и Н различные функциональные (способные к дальнейшим превращениям) группы, например, HO-, H2N- и др. Существует также вариант, когда R = Н.
В организмах живых существ содержится более 100 различных аминокислот, однако, в строительстве белков используются не все, а только 20, так называемых «фундаментальных». В табл. 1 приведены их названия (большинство названий сложилось исторически), структурная формула, а также широко применяемое сокращенное обозначение. Все структурные формулы расположены в таблице таким образом, чтобы основной фрагмент 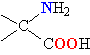
| Название | Структура | Обозначение |
| ГЛИЦИН | 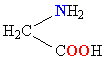 |
ГЛИ |
| АЛАНИН | 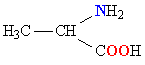 |
АЛА |
| ВАЛИН | 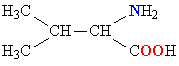 |
ВАЛ |
| ЛЕЙЦИН | 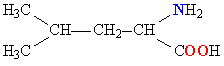 |
ЛЕЙ |
| ИЗОЛЕЙЦИН | 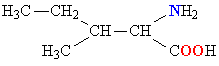 |
ИЛЕ |
| СЕРИН | 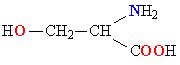 |
СЕР |
| ТРЕОНИН | 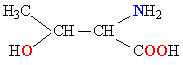 |
ТРЕ |
| ЦИСТЕИН | 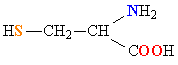 |
ЦИС |
| МЕТИОНИН | 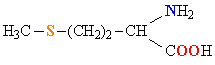 |
МЕТ |
| ЛИЗИН | 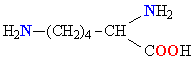 |
ЛИЗ |
| АРГИНИН | 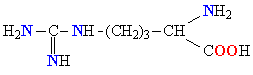 |
АРГ |
| АСПАРАГИНОВАЯ КИСЛОТА | 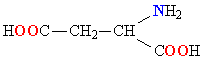 |
АСН |
| АСПАРАГИН | 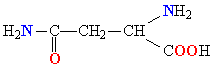 |
АСН |
| ГЛУТАМИНОВАЯ КИСЛОТА | 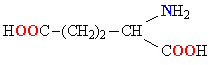 |
ГЛУ |
| ГЛУТАМИН | 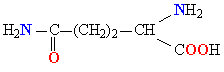 |
ГЛН |
| ФЕНИЛАЛАНИН | 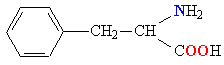 |
ФЕН |
| ТИРОЗИН | 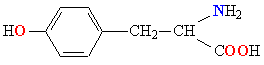 |
ТИР |
| ТРИПТОФАН | 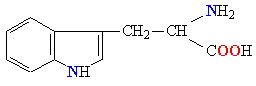 |
ТРИ |
| ГИСТИДИН | 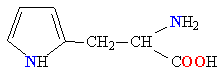 |
ГИС |
| ПРОЛИН | 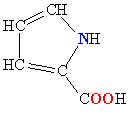 |
ПРО |
| В международной практике принято сокращенное обозначение перечисленных аминокислот с помощью латинских трехбуквенных или однобуквенных сокращений, например, глицин – Gly или G, аланин – Ala или A. |
Среди этих двадцати аминокислот (табл. 1) только пролин содержит рядом с карбоксильной группой СООН группу NH (вместо NH2), так как она входит в состав циклического фрагмента.
Восемь аминокислот (валин, лейцин, изолейцин, треонин, метионин, лизин, фенилаланин и триптофан), помещенные в таблице на сером фоне, называют незаменимыми, поскольку организм для нормального роста и развития должен постоянно получать их с белковой пищей.
Белковая молекула образуется в результате последовательного соединения аминокислот, при этом карбоксильная группа одной кислоты взаимодействует с аминогруппой соседней молекулы, в результате образуется пептидная связь –CO–NH– и выделяется молекула воды. На рис. 1 показано последовательное соединение аланина, валина и глицина.
Рис. 1 ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ при образовании белковой молекулы. В качестве основного направления полимерной цепи выбран путь от концевой аминогруппы H2N к концевой карбоксильной группе COOH.
Чтобы компактно описать строение белковой молекулы, используют сокращенные обозначения аминокислот (табл. 1, третий столбец), участвующих в образовании полимерной цепи. Фрагмент молекулы, показанный на рис. 1, записывают следующим образом: H2N-АЛА-ВАЛ-ГЛИ-COOH.
Белковые молекулы содержат от 50 до 1500 аминокислотных остатков (более короткие цепи называют полипептидами). Индивидуальность белка определяется набором аминокислот, из которых составлена полимерная цепь и, что не менее важно, порядком их чередования вдоль цепи. Например, молекула инсулина состоит из 51 аминокислотного остатка (это один из самых короткоцепных белков) и представляет собой две соединенных между собой параллельных цепи неодинаковой длины. Порядок чередования аминокислотных фрагментов показан на рис. 2.
Рис. 2 МОЛЕКУЛА ИНСУЛИНА, построенная из 51 аминокислотного остатка, фрагменты одинаковых аминокислот отмечены соответствующей окраской фона. Содержащиеся в цепи остатки аминокислоты цистеина (сокращенное обозначение ЦИС) образуют дисульфидные мостики –S-S-, которые связывают две полимерных молекулы, либо образуют перемычки внутри одной цепи.
Молекулы аминокислоты цистеина (табл. 1) содержат реакционно-способные сульфгидридные группы –SH, которые взаимодействуют между собой, образуя дисульфидные мостики –S-S-. Роль цистеина в мире белков особая, с его участием образуются поперечные сшивки между полимерными белковыми молекулами.
Объединение аминокислот в полимерную цепь происходит в живом организме под управлением нуклеиновых кислот, именно они обеспечивают строгий порядок сборки и регулируют фиксированную длину полимерной молекулы (см. НУКЛЕИНОВЫЕ КИСЛОТЫ).
Структура белков.
Состав белковой молекулы, представленный в виде чередующихся остатков аминокислот (рис. 2), называют первичной структурой белка. Между присутствующими в полимерной цепи имино-группами HN и карбонильными группами CO возникают водородные связи (см. ВОДОРОДНАЯ СВЯЗЬ), в результате молекула белка приобретает определенную пространственную форму, называемую вторичной структурой. Наиболее распространены два типа вторичной структуры белков.
Первый вариант, называемый α-спиралью, реализуется с помощью водородных связей внутри одной полимерной молекулы. Геометрические параметры молекулы, определяемые длинами связей и валентными углами, таковы, что образование водородных связей оказывается возможным для групп H-N и C=O, между которыми находятся два пептидных фрагмента H-N-C=O (рис. 3).
Рис. 3
Состав полипептидной цепи, показанной на рис. 3, записывают в сокращенном виде следующим образом:
H2N-АЛА ВАЛ-АЛА-ЛЕЙ-АЛА-АЛА-АЛА-АЛА-ВАЛ-АЛА-АЛА-АЛА-COOH.
В результате стягивающего действия водородных связей молекула приобретает форму спирали – так называемая α-спираль, ее изображают в виде изогнутой спиралевидной ленты, проходящей через атомы, образующие полимерную цепь (рис. 4)
Рис. 4 ОБЪЕМНАЯ МОДЕЛЬ МОЛЕКУЛЫ БЕЛКА в форме α-спирали. Водородные связи показаны зелеными пунктирными линиями. Цилиндрическая форма спирали видна при определенном угле поворота (атомы водорода на рисунке не показаны). Окраска отдельных атомов дана в соответствии с международными правилами, которые рекомендуют для атомов углерода черный цвет, для азота – синий, для кислорода – красный, для серы – желтый цвет (для не показанных на рисунке атомов водорода рекомендован белый цвет, в этом случае всю структуру изображают на темном фоне).
Другой вариант вторичной структуры, называемый β-структурой, образуется также при участии водородных связей, отличие состоит в том, что взаимодействуют группы H-N и C=O двух или более полимерных цепей, расположенных параллельно. Поскольку полипептидная цепь имеет направление (рис. 1), возможны варианты, когда направление цепей совпадает (параллельная β-структура, рис. 5), либо они противоположны (антипараллельная β-структура, рис. 6).
В образовании β-структуры могут участвовать полимерные цепи различного состава, при этом органические группы, обрамляющие полимерную цепь (Ph, CH2ОН и др.), в большинстве случаев играют второстепенную роль, решающее значение имеет взаиморасположение групп H-N и C=O. Поскольку относительно полимерной цепи H-N и C=O группы направлены в различные стороны (на рисунке – вверх и вниз), становится возможным одновременное взаимодействие трех и более цепей.
Состав первой полипептидной цепи на рис. 5:
H2N-ЛЕЙ-АЛА-ФЕН-ГЛИ-АЛА-АЛА-COOH
Состав второй и третей цепи:
H2N-ГЛИ-АЛА-СЕР-ГЛИ-ТРЕ-АЛА-COOH
Рис. 5
Состав полипептидных цепей, показанных на рис. 6, тот же, что и на рис. 5, отличие в том, что вторая цепь имеет противоположное (в сравнении с рис. 5) направление.
Рис. 6
Возможно образование β-структуры внутри одной молекулы, когда фрагмент цепи на определенном участке оказывается повернутым на 180°, в этом случае две ветви одной молекулы имеют противоположное направление, в результате образуется антипараллельная β-структура (рис. 7).
Рис. 7
Структура, показанная на рис. 7 в плоском изображении, представлена на рис. 8 в виде объемной модели. Участки β-структуры принято упрощенно обозначать плоской волнистой лентой, которая проходит через атомы, образующие полимерную цепь.
Рис. 8
В структуре многих белков чередуются участки α-спирали и лентообразные β-структуры, а также одиночные полипептидные цепи. Их взаиморасположение и чередование в полимерной цепи называют третичной структурой белка.
Способы изображения структуры белков показаны далее на примере растительного белка крамбина. Структурные формулы белков, содержащих часто до сотни аминокислотных фрагментов, сложны, громоздки и трудны для восприятия, поэтому иногда используют упрощенные структурные формулы – без символов химических элементов (рис. 9, вариант А), но при этом сохраняют окраску валентных штрихов в соответствии с международными правилами (рис. 4). Формулу при этом представляют не в плоском, а в пространственном изображении, что соответствует реальной структуре молекулы. Такой способ позволяет, например, различить дисульфидные мостики (подобные тем, которые есть в инсулине, рис. 2), фенильные группы в боковом обрамлении цепи и др. Изображение молекул в виде объемных моделей (шарики, соединенные стержнями) несколько более наглядно (рис. 9, вариант Б). Однако оба способа не позволяют показать третичную структуру, поэтому американский биофизик Джейн Ричардсон предложил изображать α-структуры в виде спирально закрученных лент (см. рис. 4), β-структуры – в виде плоских волнистых лент (рис. 8), а соединяющие их одиночные цепи – в форме тонких жгутов, каждый тип структуры имеет свою окраску. Сейчас широко применяют такой способ изображения третичной структуры белка (рис. 9, вариант В). Иногда для большей информативности показывают совместно третичную структуру и упрощенную структурную формулу (рис. 9, вариант Г). Есть и модификации способа, предложенного Ричардсоном: α-спирали изображают в виде цилиндров, а β-структуры – в форме плоских стрелок, указывающих и направление цепи (рис. 9, вариант Д). Менее распространен способ, при котором всю молекулу изображают в виде жгута, где неодинаковые структуры выделяют различающейся окраской, а дисульфидные мостики показывают в виде желтых перемычек (рис. 9, вариант Д).
Наиболее удобен для восприятия вариант В, когда при изображении третичной структуры особенности строения белка (аминокислотные фрагменты, порядок их чередования, водородные связи) не указывают, при этом исходят из того, что все белки содержат «детали», взятые из стандартного набора двадцати аминокислот (табл. 1). Основная задача при изображении третичной структуры – показать пространственное расположение и чередование вторичных структур.
Рис. 9 РАЗЛИЧНЫЕ ВАРИАНТЫ ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА.
А– структурная формула в пространственном изображении.
Б – структура в виде объемной модели.
В – третичная структура молекулы.
Г – сочетание вариантов А и В.
Д – упрощенное изображение третичной структуры.
Е – третичная структура с дисульфидными мостиками.
Наиболее удобна для восприятия объемная третичная структура (вариант В), освобожденная от деталей структурной формулы.
Белковая молекула, обладающая третичной структурой, как правило, принимает определенную конфигурацию, которую формируют полярные (электростатические) взаимодействия и водородные связи. В результате молекула приобретает форму компактного клубка – глобулярные белки (globules, лат. шарик), либо нитевидную – фибриллярные белки (fibra, лат. волокно).
Пример глобулярной структуры – белок альбумин, к классу альбуминов относят белок куриного яйца. Полимерная цепь альбумина собрана, основном, из аланина, аспаргиновой кислоты, глицина, и цистеина, чередующихся в определенном порядке. Третичная структура содержит α-спирали, соединенные одиночными цепями (рис. 10).
Рис. 10 ГЛОБУЛЯРНАЯ СТРУКТУРА АЛЬБУМИНА
Пример фибриллярной структуры – белок фиброин. Он содержат большое количество остатков глицина, аланина и серина (каждый второй аминокислотный остаток – глицин); остатки цистеина, содержащего сульфгидридные группы, отсутствуют. Фиброин – основной компонент натурального шелка и паутины, содержит β-структуры, соединенные одиночными цепями (рис. 11).
Рис. 11 ФИБРИЛЛЯРНЫЙ БЕЛОК ФИБРОИН
Возможность образования третичной структуры определенного типа заложена в первичной структуре белка, т.е. определена заранее порядком чередования аминокислотных остатков. Из определенных наборов таких остатков преимущественно возникают α-спирали (подобных наборов существует достаточно много), другой набор приводит к появлению β-структур, одиночные цепи характеризуются своим составом.
Некоторые белковые молекулы, сохраняя третичную структуру, способны объединяться в крупные надмолекулярные агрегаты, при этом их удерживают вместе полярные взаимодействия, а также водородные связи. Такие образования называют четвертичной структурой белка. Например, белок ферритин, состоящий в основной массе из лейцина, глутаминовой кислоты, аспарагиновой кислоты и гиститдина (в феррицине есть в различном количестве все 20 аминокислотных остатков) образует третичную структуру из четырех параллельно уложенных α-спиралей. При объединении молекул в единый ансамбль (рис. 12) образуется четвертичная структура, в которую может входить до 24 молекул ферритина.
Рис.12 ОБРАЗОВАНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ ГЛОБУЛЯРНОГО БЕЛКА ФЕРРИТИНА
Другой пример надмолекулярных образований – структура коллагена. Это фибриллярный белок, цепи которого построены в основном из глицина, чередующегося с пролином и лизином. Структура содержит одиночные цепи, тройные α-спирали, чередующиеся с лентообразными β-структурами, уложенными в виде параллельных пучков (рис. 13).
Рис.13 НАДМОЛЕКУЛЯРНАЯ СТРУКТУРА ФИБРИЛЛЯРНОГО БЕЛКА КОЛЛАГЕНА
Химические свойства белков.
При действии органических растворителей, продуктов жизнедеятельности некоторых бактерий (молочнокислое брожение) или при повышении температуры происходит разрушение вторичных и третичных структур без повреждения его первичной структуры, в результате белок теряет растворимость и утрачивает биологическую активность, этот процесс называют денатурацией, то есть потерей натуральных свойств, например, створаживание кислого молока, свернувшийся белок вареного куриного яйца. При повышенной температуре белки живых организмов (в частности, микроорганизмов) быстро денатурируют. Такие белки не способны участвовать в биологических процессах, в результате микроорганизмы погибают, поэтому кипяченое (или пастеризованное) молоко может дольше сохраняться.
Пептидные связи H-N-C=O, образующие полимерную цепь белковой молекулы, в присутствии кислот или щелочей гидролизуются, при этом происходит разрыв полимерной цепи, что, в конечном итоге, может привести к исходным аминокислотам. Пептидные связи, входящие в состав α-спиралей или β-структур, более устойчивы к гидролизу и различным химическим воздействиям (по сравнению с теми же связями в одиночных цепях). Более деликатную разборку белковой молекулы на составляющие аминокислоты проводят в безводной среде с помощью гидразина H2N–NH2, при этом все аминокислотные фрагменты, кроме последнего, образуют так называемые гидразиды карбоновых кислот, содержащие фрагмент C(O)–HN–NH2 (рис. 14).
Рис. 14. РАСЩЕПЛЕНИЕ ПОЛИПЕПТИДА
Подобный анализ может дать информацию об аминокислотном составе того или иного белка, однако важнее знать их последовательность в белковой молекуле. Одна из широко применяемых для этой цели методик – действие на полипептидную цепь фенилизотиоцианата (ФИТЦ), который в щелочной среде присоединяется к полипептиду (с того конца, который содержит аминогруппу), а при изменении реакции среды на кислую, отсоединяется от цепи, унося с собой фрагмент одной аминокислоты (рис. 15).
Рис. 15 ПОСЛЕДОВАТЕЛЬНОЕ РАСЩЕПЛЕНИЕ ПОЛИПЕПТИДА
Разработано много специальных методик для подобного анализа, в том числе и такие, которые начинают «разбирать» белковую молекулу на составляющие компоненты, начиная с карбоксильного конца.
Поперечные дисульфидные мостики S-S (образовавшиеся при взаимодействии остатков цистеина, рис. 2 и 9) расщепляют, превращая их в HS-группы действием различных восстановителей. Действие окислителей (кислорода или перекиси водорода) приводит вновь к образованию дисульфидных мостиков (рис. 16).
Рис. 16. РАСЩЕПЛЕНИЕ ДИСУЛЬФИДНЫХ МОСТИКОВ
Для создания дополнительных поперечных сшивок в белках используют реакционную способность амино- и карбоксильных групп. Более доступны для различных взаимодействий аминогруппы, которые находятся в боковом обрамлении цепи – фрагменты лизина, аспарагина, лизина, пролина (табл. 1). При взаимодействии таких аминогрупп с формальдегидом идет процесс конденсации и возникают поперечные мостики –NH–CH2–NH– (рис. 17).
Рис. 17 СОЗДАНИЕ ДОПОЛНИТЕЛЬНЫХ ПОПЕРЕЧНЫХ МОСТИКОВ МЕЖДУ МОЛЕКУЛАМИ БЕЛКА.
Концевые карбоксильные группы белка способны реагировать с комплексными соединениями некоторых поливалентных металлов (чаще применяют соединения хрома), при этом также возникают поперечные сшивки. Оба процесса используются при дублении кожи.
Роль белков в организме.
Роль белков в организме разнообразна.
Ферменты (fermentatio лат. – брожение), другое их название – энзимы (en zumh греч. – в дрожжах) – это белки, обладающие каталитической активностью, они способны увеличивать скорости биохимических процессов в тысячи раз. Под действием ферментов составные компоненты пищи: белки, жиры и углеводы – расщепляются до более простых соединений, из которых затем синтезируются новые макромолекулы, необходимые организму определенного типа. Ферменты принимают участие и во многих биохимических процессах синтеза, например, в синтезе белков (одни белки помогают синтезировать другие). См. ФЕРМЕНТЫ
Ферменты не только высокоэффективные катализаторы, но и селективные (направляют реакцию строго в заданном направлении). В их присутствии реакция проходит практически со 100%-ным выходом без образования побочных продуктов и при этом условия протекания – мягкие: обычное атмосферное давление и температура живого организма. Для сравнения, синтез аммиака из водорода и азота в присутствии катализатора – активированного железа – проводят при 400–500° С и давлении 30 МПа, выход аммиака 15–25% за один цикл. Ферменты считаются непревзойденными катализаторами.
Интенсивное исследование ферментов началось в середине 19 в., сейчас изучено более 2000 различных ферментов, это самый многообразный класс белков.
Названия ферментов составляют следующим образом: к наименованию реагента, с которым взаимодействует фермент, или к названию катализируемой реакции добавляют окончание -аза, например, аргиназа разлагает аргинин (табл. 1), декарбоксилаза катализирует декарбоксилирование, т.е. отщепление СО2 от карбоксильной группы:
– СООН → – СН + СО2
Часто, для более точного обозначения роли фермента в его названии указывают и объект, и тип реакции, например, алкогольдегидрогеназа – фермент, осуществляющий дегидрирование спиртов.
Для некоторых ферментов, открытых достаточно давно, сохранилось историческое название (без окончания –аза), например, пепсин (pepsis, греч. пищеварение) и трипсин (thrypsis греч. разжижение), эти ферменты расщепляют белки.
Для систематизации ферменты объединяют в крупные классы, в основу классификации положен тип реакции, классы именуют по общему принципу – название реакции и окончание – аза. Далее перечислены некоторые из таких классов.
Оксидоредуктазы – ферменты, катализирующие окислительно-восстановительные реакции. Входящие в этот класс дегидрогеназы осуществляют перенос протона, например алкогольдегидрогеназа (АДГ) окисляет спирты до альдегидов, последующее окисление альдегидов до карбоновых кислот катализируют альдегиддегидрогеназы (АЛДГ). Оба процесса происходят в организме при переработке этанола в уксусную кислоту (рис. 18).
Рис. 18 ДВУХСТАДИЙНОЕ ОКИСЛЕНИЕ ЭТАНОЛА до уксусной кислоты
Наркотическим действием обладает не этанол, а промежуточный продукт ацетальдегид, чем ниже активность фермента АЛДГ, тем медленнее проходит вторая стадия – окисление ацетальдегида до уксусной кислоты и тем дольше и сильнее проявляется опьяняющее действие от приема внутрь этанола. Анализ показал, что более чем у 80% представителей желтой расы относительно низкая активность АЛДГ и потому заметно более тяжелая переносимость алкоголя. Причина такой врожденной пониженной активности АЛДГ состоит в том, что часть остатков глутаминовой кислоты в молекуле «ослабленной» АЛДГ заменена фрагментами лизина (табл. 1).
Трансферазы – ферменты, катализирующие перенос функциональных групп, например, трансиминаза катализирует перемещение аминогруппы.
Гидролазы – ферменты, катализирующие гидролиз. Упомянутые ранее трипсин и пепсин осуществляют гидролиз пептидных связей, а липазы расщепляют сложноэфирную связь в жирах:
–RС(О)ОR1 +Н2О → –RС(О)ОН + НОR1
Лиазы – ферменты, катализирующие реакции, которые проходят не гидролитическим путем, в результате таких реакций происходит разрыв связей С-С, С-О, С-N и образование новых связей. Фермент декарбоксилаза относится к этому классу
Изомеразы – ферменты, катализирующие изомеризацию, например, превращение малеиновой кислоты в фумаровую (рис. 19), это пример цис – транс изомеризации (см. ИЗОМЕРИЯ).
Рис. 19. ИЗОМЕРИЗАЦИЯ МАЛЕИНОВОЙ КИСЛОТЫ в фумаровую в присутствии фермента.
В работе ферментов соблюдается общий принцип, в соответствии с которым всегда есть структурное соответствие фермента и реагента ускоряемой реакции. По образному выражению одного из основателей учения о ферментах Э.Фишера, реагент подходит к ферменту, как ключ к замку. В связи с этим каждый фермент катализирует определенную химическую реакцию или группу реакций одного типа. Иногда фермент может действовать на одно единственное соединение, например, уреаза (uron греч. – моча) катализирует только гидролиз мочевины:
(H2N)2C = O + H2O = CO2 + 2NH3
Наиболее тонкую избирательность проявляют ферменты, различающие оптически активные антиподы – лево- и правовращающие изомеры. L-аргиназа действует только на левовращающий аргинин и не затрагивает правовращающий изомер. L-лактатдегидрогеназа действует только на левовращающие эфиры молочной кислоты, так называемые лактаты (lactis лат. молоко), в то время как D-лактатдегидрогеназа расщепляет исключительно D-лактаты.
Большая часть ферментов действует не на одно, а на группу родственных соединений, например, трипсин «предпочитает» расщеплять пептидные связи образованные лизином и аргинином (табл. 1.)
Каталитические свойства некоторых ферментов, таких как гидролазы, определяются исключительно строением самой белковой молекулы, другой класс ферментов – оксидоредуктазы (например, алкогольдегидрогеназа) могут проявлять активность только в присутствии связанных с ними небелковых молекул – витаминов, активирующих ионов Mg, Са, Zn, Мn и фрагментов нуклеиновых кислот (рис. 20).
Рис. 20 МОЛЕКУЛА АЛКОГОЛЬДЕГИДРОГЕНАЗЫ
Транспортные белки связывают и переносят различные молекулы или ионы через мембраны клеток (как внутрь клетки, так и вовне), а также от одного органа к другому.
Например, гемоглобин связывает кислород при прохождении крови через легкие и доставляет его к различным тканям организма, где кислород высвобождается и затем используется для окисления компонентов пищи, этот процесс служит источником энергии (иногда употребляют термин «сжигание» пищевых продуктов в организме).
Помимо белковой части гемоглобин содержит комплексное соединение железа с циклической молекулой порфирином (porphyros греч. – пурпур), что и обусловливает красный цвет крови. Именно этот комплекс (рис. 21, слева) играет роль переносчика кислорода. В гемоглобине порфириновый комплекс железа располагается внутри белковой молекулы и удерживается с помощью полярных взаимодействий, а также координационной связи с азотом в гистидине (табл. 1), входящем в состав белка. Молекула О2, которую переносит гемоглобин, присоединяется с помощью координационной связи к атому железа со стороны, противоположной той, к которой присоединен гистидин (рис. 21, справа).
Рис. 21 СТРОЕНИЕ КОМПЛЕКСА ЖЕЛЕЗА
Справа показано строение комплекса в форме объемной модели. Комплекс удерживается в белковой молекуле с помощью координационной связи (синий пунктир) между атомом Fe и атомом N в гистидине, входящим в состав белка. Молекула О2, которую переносит гемоглобин, присоединена координационно (красный пунктир) к атому Fe с противоположной страны плоского комплекса.
Гемоглобин – один из наиболее подробно изученных белков, он состоит из a-спиралей, соединенных одиночными цепями, и содержит в своем составе четыре комплекса железа. Таким образом, гемоглобин представляет собой как бы объемистую упаковку для переноса сразу четырех молекул кислорода. По форме гемоглобин соответствует глобулярным белкам (рис. 22).
Рис. 22 ГЛОБУЛЯРНАЯ ФОРМА ГЕМОГЛОБИНА
Основное «достоинство» гемоглобина состоит в том, что присоединение кислорода и последующее его отщепление при передаче различным тканям и органам проходит быстро. Монооксид углерода, СО (угарный газ), связывается с Fe в гемоглобине еще быстрее, но, в отличие от О2, образует трудно разрушающийся комплекс. В результате такой гемоглобин не способен связывать О2, что приводит (при вдыхании больших количеств угарного газа) к гибели организма от удушья.
Вторая функция гемоглобина – перенос выдыхаемого СО2, но в процессе временного связывания углекислоты участвует не атом железа, а H2N-группы белка.
«Работоспособность» белков зависит от их строения, например, замена единственного аминокислотного остатка глутаминовой кислоты в полипептидной цепи гемоглобина на остаток валина (изредка наблюдаемая врожденная аномалия) приводит к заболеванию, называемому серповидноклеточная анемия.
Существуют также транспортные белки, способные связывать жиры, глюкозу, аминокислоты и переносить их как внутрь, так и вовне клеток.
Транспортные белки особого типа не переносят сами вещества, а выполняют функции «транспортного регулировщика», пропуская определенные вещества сквозь мембрану (внешнюю стенку клетки). Такие белки чаще называют мембранными. Они имеют форму пустотелого цилиндра и, встраиваясь в стенку мембраны, обеспечивают перемещение некоторых полярных молекул или ионов внутрь клетки. Пример мембранного белка – порин (рис. 23).
Рис. 23 БЕЛОК ПОРИН
Пищевые и запасные белки, как следует из названия, служат источниками внутреннего питания, чаще для зародышей растений и животных, а также на ранних стадиях развития молодых организмов. К пищевым белкам относят альбумин (рис. 10) – основной компонент яичного белка, а также казеин – главный белок молока. Под действием фермента пепсина казеин в желудке створаживается, это обеспечивает его задержку в пищеварительном тракте и эффективное усвоение. Казеин содержит фрагменты всех аминокислот, необходимых организму.
В ферритине (рис. 12), который содержится в тканях животных, запасены ионы железа.
К запасным белкам относят также миоглобин, по составу и строению напоминающий гемоглобин. Миоглобин сосредоточен, главным образом, в мышцах, его основная роль – хранение кислорода, который ему отдает гемоглобин. Он быстро насыщается кислородом (намного быстрее, чем гемоглобин), а затем постепенно передает его различным тканям.
Структурные белки выполняют защитную функцию (кожный покров) или опорную – скрепляют организм в единое целое и придают ему прочность (хрящи и сухожилия). Их главным компонентом является фибриллярный белок коллаген (рис. 11), наиболее распространенный белок животного мира, в организме млекопитающих, на его долю приходится почти 30% от всей массы белков. Коллаген обладает высокой прочностью на разрыв (известна прочность кожи), но из-за малого содержания поперечных сшивок в коллагене кожи, шкуры животных мало пригодны в сыром виде для изготовления различных изделий. Чтобы уменьшить набухание кожи в воде, усадку при сушке, а также для увеличения прочности в обводненном состоянии и повышения упругости в коллагене создают дополнительные поперечные сшивки (рис. 15а), это, так называемый процесс дубления кожи.
В живых организмах молекулы коллагена, возникшие в процессе роста и развития организма, не обновляются и не замещаются заново синтезированными. По мере старения организма увеличивается количество поперечных сшивок в коллагене, что приводит к снижению его эластичности, а поскольку обновление не происходит, то проявляются возрастные изменения – увеличение хрупкости хрящей и сухожилий, появление морщин на коже.
В суставных связках содержится эластин – структурный белок, легко растягивающийся в двух измерениях. Наибольшей эластичностью обладает белок резилин, который находится в местах шарнирного прикрепления крыльев у некоторых насекомых.
Роговые образования – волосы, ногти, перья состоя, в основном, из белка кератина (рис. 24). Его основное отличие – заметное содержание остатков цистеина, образующего дисульфидные мостики, что придает высокую упругость (способность восстанавливать исходную форму после деформации) волосам, а также шерстяным тканям.
Рис. 24. ФРАГМЕНТ ФИБРИЛЛЯРНОГО БЕЛКА КЕРАТИНА
Для необратимого изменения формы кератинового объекта нужно вначале разрушить дисульфидные мостики с помощью восстановителя, придать новую форму, а затем вновь создать дисульфидные мостики с помощью окислителя (рис. 16), именно так делается, например, химическая завивка волос.
При увеличении содержания остатков цистеина в кератине и, соответственно, возрастании количества дисульфидных мостиков способность к деформации исчезает, но при этом появляется высокая прочность (в рогах копытных животных и панцирях черепах содержится до 18% цистеиновых фрагментов). В организме млекопитающих содержится до 30 различных типов кератина.
Родственный кератину фибриллярный белок фиброин, выделяемый гусеницами шелкопряда при завивке кокона, а также пауками при плетении паутины, содержит только β-структуры, соединенные одиночными цепями (рис. 11). В отличие от кератина, у фиброина нет поперечных дисульфидных мостиков, он обладает очень прочен на разрыв (прочность в расчете на единицу поперечного сечения у некоторых образцов паутины выше, чем у стальных тросов). Из-за отсутствия поперечных сшивок фиброин неупруг (известно, что шерстяные ткани почти несминаемы, а шелковые легко мнутся).
Регуляторные белки.
Регуляторные белки, чаще называемые гормонами, участвуют в различных физиологических процессах. Например, гормон инсулин (рис. 25) состоит из двух α-цепей, соединенных дисульфидными мостиками. Инсулин регулирует обменные процессы с участием глюкозы, его отсутствие ведет к диабету.
Рис. 25 БЕЛОК ИНСУЛИН
В гипофизе мозга синтезируется гормон, регулирующий рост организма. Существуют регуляторные белки, контролирующие биосинтез различных ферментов в организме.
Сократительные и двигательные белки придают организму способность сокращаться, изменять форму и перемещаться, прежде всего, речь идет о мышцах. 40% от массы всех белков, содержащихся в мышцах, составляет миозин (mys, myos, греч. – мышца). Его молекула содержит одновременно фибриллярную и глобулярную часть (рис. 26)
Рис. 26 МОЛЕКУЛА МИОЗИНА
Такие молекулы объединяются в крупные агрегаты, содержащие 300–400 молекул.
При изменении концентрации ионов кальция в пространстве, окружающем мышечные волокна, происходит обратимое изменение конформации молекул – изменение формы цепи за счет поворота отдельных фрагментов вокруг валентных связей. Это приводит к сокращению и расслаблению мышц, сигнал для изменения концентрации ионов кальция поступает от нервных окончаний в мышечных волокнах. Искусственное сокращение мышц можно вызвать действием электрических импульсов, приводящих к резкому изменению концентрации ионов кальция, на этом основана стимуляция сердечной мышцы для восстановления работы сердца.
Защитные белки позволяют уберечь организм от вторжения атакующих его бактерий, вирусов и от проникновения чужеродных белков (обобщенное название чужеродных тел – антигены). Роль защитных белков выполняют иммуноглобулины (другое их название – антитела), они распознают антигены, проникшие в организм, и прочно связываются с ними. В организме млекопитающих, включая человека, есть пять классов иммуноглобулинов: M, G, A, D и E, их структура, как следует из названия, глобулярная, кроме того, все они построены сходным образом. Молекулярная организация антител показана далее на примере иммуноглобулина класса G (рис. 27). Молекула содержит четыре полипептидные цепи, объединенные тремя дисульфидными мостиками S-S (на рис. 27 они показаны с утолщенными валентными связями и крупными символами S), кроме того, каждая полимерная цепь содержит внутрицепные дисульфидные перемычки. Две большие полимерные цепи (выделены синим цветом) содержат 400–600 аминокислотных остатков. Две другие цепи (выделены зеленым цветом) почти вдвое короче, они содержат приблизительно 220 аминокислотных остатков. Все четыре цепи расположены таким образом, что концевые H2N-группы направлены в одну сторону.
Рис. 27 СХЕМАТИЧЕСКОЕ ИЗОБРАЖЕНИЕ СТРУКТУРЫ ИММУНОГЛОБУЛИНА
После контакта организма с чужеродным белком (антигеном), клетки иммунной системы начинают вырабатывать иммуноглобулины (антитела), которые накапливаются в сыворотке крови. На первом этапе основную работу совершают участки цепей, содержащие концевые H2N (на рис. 27 соответствующие участки отмечены светло-синим и светло-зеленым цветом). Это области захвата антигенов. В процессе синтеза иммуноглобулина эти участки формируется таким образом, чтобы их строение и конфигурация максимально соответствовали структуре приблизившегося антигена (как ключ к замку, подобно ферментам, но задачи в данном случае иные). Таким образом, для каждого антигена в качестве иммунного ответа создается строго индивидуальное антитело. Столь «пластично» изменять строение в зависимости от внешних факторов, помимо иммуноглобулинов, не может ни один известный белок. Ферменты решают задачу структурного соответствия реагенту иным путем – с помощью гигантского набора разнообразных ферментов в расчете на все возможные случаи, а иммуноглобулины каждый раз заново перестраивают «рабочий инструмент». Сверх того, шарнирный участок иммуноглобулина (рис. 27) обеспечивает двум областям захвата некоторую независимую подвижность, в результате молекула иммуноглобулина может «найти» сразу два наиболее удобных для захвата участка в антигене с тем, чтобы его надежно зафиксировать, это напоминает действия ракообразного существа.
Далее включается цепь последовательных реакций иммунной системы организма, подключаются иммуноглобулины других классов, в результате происходит дезактивация чужеродного белка, а затем уничтожение и удаление антигена (постороннего микроорганизма или токсина).
После контакта с антигеном максимальная концентрация иммуноглобулина достигается (в зависимости от природы антигена и индивидуальных особенностей самого организма) в течение нескольких часов (иногда нескольких дней). Организм сохраняет память о таком контакте, и при повторной атаке таким же антигеном иммуноглобулины накапливаются в сыворотке крови значительно быстрее и в большем количестве – возникает приобретенный иммунитет.
Приведенная классификация белков носит в определенной степени условный характер, например белок тромбин, упомянутый среди защитных белков, по существу представляет собой фермент, катализирующий гидролиз пептидных связей, то есть, относится к классу протеаз.
К защитным белкам часто относят белки змеиного яда и токсичные белки некоторых растений, поскольку их задача – уберечь организм от повреждений.
Есть белки, функции которых настолько уникальны, что это затрудняет их классификацию. Например, белок монеллин, содержащийся в одном из африканских растений, – очень сладкий на вкус, он стал предметом изучения как нетоксичное вещество, которое может быть использовано вместо сахара для предотвращения ожирения. Плазма крови некоторых антарктических рыб содержит белки со свойствами антифриза, который предохраняет кровь этих рыб от замерзания.
Искусственный синтез белков.
Конденсация аминокислот, приводящая к полипептидной цепи, представляет собой хорошо изученный процесс. Можно провести, например, конденсацию какой – либо одной аминокислоты или смеси кислот и получить, соответственно, полимер, содержащий одинаковые звенья, либо различные звенья, чередующиеся в случайном порядке. Такие полимеры мало похожи на природные полипептиды и не обладают биологической активностью. Основная задача состоит в том, чтобы соединять аминокислоты в строго определенном, заранее намеченном порядке, чтобы воспроизвести последовательность аминокислотных остатков в природных белках. Американский ученый Роберт Меррифилд предложил оригинальный метод, позволивший решить такую задачу. Сущность метода состоит в том, что первую аминокислоту присоединяют к нерастворимому полимерному гелю, который содержит реакционно-способные группы, способные соединяться с –СООН – группами аминокислоты. В качестве такой полимерной подложки был взят сшитый полистирол с введенными в него хлорметильными группами. Чтобы взятая для реакции аминокислота не прореагировала сама с собой и чтобы она не присоединилась H2N-группой к подложке, аминогруппу этой кислоты предварительно блокируют объемистым заместителем [(С4Н9)3]3ОС(О)-группой. После того, как аминокислота присоединилась к полимерной подложке, блокирующую группу удаляют и в реакционную смесь вводят другую аминокислоту, у которой также предварительно заблокирована H2N-группа. В такой системе возможно только взаимодействие H2N-группы первой аминокислоты и группы –СООН второй кислоты, которое проводят в присутствии катализаторов (солей фосфония). Далее всю схему повторяют, вводя третью аминокислоту (рис. 28).
Рис. 28. СХЕМА СИНТЕЗА ПОЛИПЕПТИДНЫХ ЦЕПЕЙ
На последней стадии полученные полипептидные цепи отделяют от полистирольной подложки. Сейчас весь процесс автоматизирован, существуют автоматические синтезаторы пептидов, действующие по описанной схеме. Таким методом синтезировано множество пептидов, используемых в медицине и сельском хозяйстве. Удалось также получить улучшенные аналоги природных пептидов с избирательным и усиленным действием. Синтезированы некоторые небольшие белки, например гормон инсулина и некоторые ферменты.
Существуют также методы синтеза белков, копирующие природные процессы: синтезируют фрагменты нуклеиновых кислот, настроенных на получение определенных белков, затем эти фрагменты встраивают в живой организм (например, в бактерию), после чего организм начинает вырабатывать нужный белок. Таким способом сейчас получают значительные количества труднодоступных белков и пептидов, а также их аналогов.
Белки как источники питания.
Белки в живом организме постоянно расщепляются на исходные аминокислоты (с непременным участием ферментов), одни аминокислоты переходят в другие, затем белки вновь синтезируются (также с участием ферментов), т.е. организм постоянно обновляется. Некоторые белки (коллаген кожи, волос) не обновляются, организм непрерывно их теряет и взамен синтезирует новые. Белки как источники питания выполняют две основные функции: они поставляют в организм строительный материал для синтеза новых белковых молекул и, кроме того, снабжают организм энергией (источники калорий).
Плотоядные млекопитающие (в том числе и человек) получают необходимые белки с растительной и животной пищей. Ни один из полученных с пищей белков не встраивается в организм в неизменном виде. В пищеварительном тракте все поглощенные белки расщепляются до аминокислот, и уже из них строятся белки, необходимые конкретному организму, при этом из 8 незаменимых кислот (табл. 1) в организме могут синтезироваться остальные 12, если они не поступают в достаточном количестве с пищей, но незаменимые кислоты должны поступать с пищей непременно. Атомы серы в цистеине организм получает с незаменимой аминокислотой – метионином. Часть белков распадается, выделяя энергию, необходимую для поддержания жизнедеятельности, а содержавшийся в них азот выводится из организма с мочой. Обычно организм человека теряет 25–30 г. белка в сутки, поэтому белковая пища должны постоянно присутствовать в нужном количестве. Минимальная суточная потребность в белке составляет у мужчин 37 г, у женщин 29 г, однако рекомендованные нормы потребления почти вдвое выше. При оценке пищевых продуктов важно учитывать качество белка. При отсутствии или низком содержании незаменимых аминокислот белок считается малоценным, поэтому такие белки должны потребляться в большем количестве. Так, белки бобовых культур содержат мало метионина, а в белках пшеницы и кукурузы низкое содержанием лизина (обе аминокислоты незаменимые). Животные белки (исключая коллагены) относят к полноценным пищевым продуктам. Полный набор всех незаменимых кислот содержит казеин молока, а также приготовляемые из него творог и сыр, поэтому вегетарианская диета, в том случае, если она очень строгая, т.е. «безмолочная», требует усиленного потребления бобовых культур, орехов и грибов для снабжения организма незаменимыми аминокислотами в нужном количестве.
Синтетические аминокислоты и белки используют и как пищевые продукты, добавляя их в корма, которые содержат незаменимые аминокислоты в малом количестве. Существуют бактерии, которые могут перерабатывать и усваивать углеводороды нефти, в этом случае для полноценного синтеза белков их нужно подкармливать азотсодержащими соединениями (аммиак или нитраты). Получаемый таким способом белок используют в качестве корма для скота и домашней птицы. В комбикорм домашних животных часто добавляют набор ферментов – карбогидраз, которые катализируют гидролиз трудно разлагаемых компонентов углеводной пищи (клеточные стенки зерновых культур), в результате чего растительная пища усваивается более полно.
Михаил Левицкий
БЕЛКИ (статья 2)
(протеины), класс сложных азотсодержащих соединений, наиболее характерных и важных (наряду с нуклеиновыми кислотами) компонентов живого вещества. Белки выполняют многочисленные и разнообразные функции. Большинство белков – ферменты, катализирующие химические реакции. Многие гормоны, регулирующие физиологические процессы, тоже являются белками. Такие структурные белки, как коллаген и кератин, служат главными компонентами костной ткани, волос и ногтей. Сократительные белки мышц обладают способностью изменять свою длину, используя химическую энергию для выполнения механической работы. К белкам относятся антитела, которые связывают и нейтрализуют токсичные вещества. Некоторые белки, способные реагировать на внешние воздействия (свет, запах), служат в органах чувств рецепторами, воспринимающими раздражение. Многие белки, расположенные внутри клетки и на клеточной мембране, выполняют регуляторные функции.
В первой половине 19 в. многие химики, и среди них в первую очередь Ю.фон Либих, постепенно пришли к выводу, что белки представляют собой особый класс азотистых соединений. Название «протеины» (от греч. protos – первый) предложил в 1840 голландский химик Г.Мульдер.
ФИЗИЧЕСКИЕ СВОЙСТВА
Белки в твердом состоянии белого цвета, а в растворе бесцветны, если только они не несут какой-нибудь хромофорной (окрашенной) группы, как, например, гемоглобин. Растворимость в воде у разных белков сильно варьирует. Она изменяется также в зависимости от рН и от концентрации солей в растворе, так что можно подобрать условия, при которых один какой-нибудь белок будет избирательно осаждаться в присутствии других белков. Этот метод «высаливания» широко используется для выделения и очистки белков. Очищенный белок часто выпадает в осадок из раствора в виде кристаллов.
В сравнении с другими соединениями молекулярная масса белков очень велика – от нескольких тысяч до многих миллионов дальтон. Поэтому при ультрацентрифугировании белки осаждаются, и притом с разной скоростью. Благодаря присутствию в молекулах белков положительно и отрицательно заряженных групп они движутся с разной скоростью и в электрическом поле. На этом основан электрофорез – метод, применяемый для выделения индивидуальных белков из сложных смесей. Очистку белков проводят и методом хроматографии.
ХИМИЧЕСКИЕ СВОЙСТВА
Строение.
Белки – это полимеры, т.е. молекулы, построенные, как цепи, из повторяющихся мономерных звеньев, или субъединиц, роль которых играют у них aльфа-аминокислоты. Общая формула аминокислот
где R – атом водорода или какая-нибудь органическая группа.
Белковая молекула (полипептидная цепь) может состоять всего лишь из относительно небольшого числа аминокислот или из нескольких тысяч мономерных звеньев. Соединение аминокислот в цепи возможно потому, что у каждой из них имеются две разные химические группы: обладающая основными свойствами аминогруппа, NH2, и кислотная карбоксильная группа, СООН. Обе эти группы присоединены к a-атому углерода. Карбоксильная группа одной аминокислоты может образовать амидную (пептидную) связь с аминогруппой другой аминокислоты:
После того как две аминокислоты таким образом соединились, цепь может наращиваться путем добавления ко второй аминокислоте третьей и т.д. Как видно из приведенного выше уравнения, при образовании пептидной связи выделяется молекула воды. В присутствии кислот, щелочей или протеолитических ферментов реакция идет в обратном направлении: полипептидная цепь расщепляется на аминокислоты с присоединением воды. Такая реакция называется гидролизом. Гидролиз протекает спонтанно, а для соединения аминокислот в полипептидную цепь требуется энергия.
Карбоксильная группа и амидная группа (или сходная с ней имидная – в случае аминокислоты пролина) имеются у всех аминокислот, различия же между аминокислотами определяются природой той группы, или «боковой цепи», которая обозначена выше буквой R. Роль боковой цепи может играть и один атом водорода, как у аминокислоты глицина, и какая-нибудь объемистая группировка, как у гистидина и триптофана. Некоторые боковые цепи в химическом смысле инертны, тогда как другие обладают заметной реакционной способностью.
Синтезировать можно многие тысячи различных аминокислот, и множество различных аминокислот встречается в природе, но для синтеза белков используется только 20 видов аминокислот: аланин, аргинин, аспарагин, аспарагиновая кислота, валин, гистидин, глицин, глутамин, глутаминовая кислота, изолейцин, лейцин, лизин, метионин, пролин, серин, тирозин, треонин, триптофан, фенилаланин и цистеин (в белках цистеин может присутствовать в виде димера – цистина). Правда, в некоторых белках присутствуют и другие аминокислоты, помимо регулярно встречающихся двадцати, но они образуются в результате модификации какой-нибудь из двадцати перечисленных уже после того, как она включилась в белок.
Оптическая активность.
У всех аминокислот, за исключением глицина, к α-атому углерода присоединены четыре разные группы. С точки зрения геометрии, четыре разные группы могут быть присоединены двумя способами, и соответственно есть две возможные конфигурации, или два изомера, относящиеся друг к другу, как предмет к своему зеркальному отражению, т.е. как левая рука к правой. Одну конфигурацию называют левой, или левовращающей (L), а другую – правой, или правовращающей (D), поскольку два таких изомера различаются направлением вращения плоскости поляризованного света. В белках встречаются только L-аминокислоты (исключение составляет глицин; он может быть представлен лишь одной формой, поскольку у него две из четырех групп одинаковы), и все они обладают оптической активностью (поскольку имеется только один изомер). D-аминокислоты в природе редки; они встречаются в некоторых антибиотиках и клеточной оболочке бактерий.
Последовательность аминокислот.
Аминокислоты в полипептидной цепи располагаются не случайным образом, а в определенном фиксированном порядке, и именно этот порядок определяет функции и свойства белка. Варьируя порядок расположения 20 видов аминокислот, можно получить огромное число разных белков, точно так же, как из букв алфавита можно составить множество разных текстов.
В прошлом на определение аминокислотной последовательности какого-нибудь белка уходило нередко несколько лет. Прямое определение и теперь достаточно трудоемкое дело, хотя созданы приборы, позволяющие вести его автоматически. Обычно проще бывает определить нуклеотидную последовательность соответствующего гена и вывести из нее аминокислотную последовательность белка. К настоящему времени уже определены аминокислотные последовательности многих сотен белков. Функции расшифрованных белков, как правило, известны, и это помогает представить себе возможные функции сходных белков, образующихся, например, при злокачественных новообразованиях.
Сложные белки.
Белки, состоящие из одних только аминокислот, называют простыми. Часто, однако, к полипептидной цепи бывают присоединены атом металла или какое-нибудь химическое соединение, не являющееся аминокислотой. Такие белки называются сложными. Примером может служить гемоглобин: он содержит железопорфирин, который определяет его красный цвет и позволяет ему играть роль переносчика кислорода.
В названиях большинства сложных белков содержится указание на природу присоединенных групп: в гликопротеинах присутствуют сахара, в липопротеинах – жиры. Если от присоединенной группы зависит каталитическая активность фермента, то ее называют простетической группой. Нередко какой-нибудь витамин играет роль простетической группы или входит в ее состав. Витамин А, например, присоединенный к одному из белков сетчатки, определяет ее чувствительность к свету.
Третичная структура.
Важна не столько сама аминокислотная последовательность белка (первичная структура), сколько способ ее укладки в пространстве. По всей длине полипептидной цепи ионы водорода образуют регулярные водородные связи, которые придают ей форму спирали либо слоя (вторичная структура). Из комбинации таких спиралей и слоев возникает компактная форма следующего порядка – третичная структура белка. Вокруг связей, удерживающих мономерные звенья цепи, возможны повороты на небольшие углы. Поэтому с чисто геометрической точки зрения число возможных конфигураций для любой полипептидной цепи бесконечно велико. В действительности же каждый белок существует в норме только в одной конфигурации, определяемой его аминокислотной последовательностью. Структура эта не жесткая, она как бы «дышит» – колеблется вокруг некой средней конфигурации. Цепь складывается в такую конфигурацию, при которой свободная энергия (способность производить работу) минимальна, подобно тому как отпущенная пружина сжимается лишь до состояния, соответствующего минимуму свободной энергии. Нередко одна часть цепи бывает жестко сцеплена с другой дисульфидными (–S–S–) связями между двумя остатками цистеина. Отчасти именно поэтому цистеин среди аминокислот играет особо важную роль.
Сложность строения белков столь велика, что пока еще невозможно вычислить третичную структуру белка, если даже известна его аминокислотная последовательность. Но если удается получить кристаллы белка, то его третичную структуру можно определить по дифракции рентгеновских лучей.
У структурных, сократительных и некоторых других белков цепи вытянуты и несколько лежащих рядом слегка свернутых цепей образуют фибриллы; фибриллы, в свою очередь, складываются в более крупные образования – волокна. Однако большинство белков в растворе имеет глобулярную форму: цепи свернуты в глобуле, как пряжа в клубке. Свободная энергия при такой конфигурации минимальна, поскольку гидрофобные («отталкивающие воду») аминокислоты скрыты внутри глобулы, а гидрофильные («притягивающие воду») находятся на ее поверхности.
Многие белки – это комплексы из нескольких полипептидных цепей. Такое строение называется четвертичной структурой белка. Молекула гемоглобина, например, состоит из четырех субъединиц, каждая из которых представляет собой глобулярный белок.
Структурные белки благодаря своей линейной конфигурации образуют волокна, у которых предел прочности на разрыв очень высок, глобулярная же конфигурация позволяет белкам вступать в специфические взаимодействия с другими соединениями. На поверхности глобулы при правильной укладке цепей возникают определенной формы полости, в которых размещены реакционноспособные химические группы. Если данный белок – фермент, то другая, обычно меньшая, молекула какого-то вещества входит в такую полость подобно тому, как ключ входит в замок; при этом меняется конфигурация электронного облака молекулы под влиянием находящихся в полости химических групп, и это вынуждает ее определенным образом реагировать. Таким способом фермент катализирует реакцию. В молекулах антител тоже имеются полости, в которых различные чужеродные вещества связываются и тем самым обезвреживаются. Модель «ключа и замка», объясняющая взаимодействие белков с другими соединениями, позволяет понять специфичность ферментов и антител, т.е. их способность реагировать только с определенными соединениями.
Белки у разных видов организмов.
Белки, выполняющие одну и ту же функцию у разных видов растений и животных и потому носящие одно и то же название, имеют и сходную конфигурацию. Они, однако, несколько различаются по своей аминокислотной последовательности. По мере того как виды дивергируют от общего предка, некоторые аминокислоты в определенных положениях замещаются в результате мутаций другими. Вредные мутации, являющиеся причиной наследственных болезней, выбраковываются естественным отбором, но полезные или по крайней мере нейтральные могут сохраняться. Чем ближе друг к другу два каких-нибудь биологических вида, тем меньше различий обнаруживается в их белках.
Некоторые белки меняются относительно быстро, другие весьма консервативны. К последним принадлежит, например, цитохром с – дыхательный фермент, имеющийся у большинства живых организмов. У человека и шимпанзе его аминокислотные последовательности идентичны, а в цитохроме с пшеницы иными оказались лишь 38% аминокислот. Даже сравнивая человека и бактерии, сходство цитохромов с (различия затрагивают здесь 65% аминокислот) все еще можно заметить, хотя общий предок бактерии и человека жил на Земле около двух миллиардов лет назад. В наше время сравнение аминокислотных последовательностей часто используют для построения филогенетического (генеалогического) древа, отражающего эволюционные связи между разными организмами.
Денатурация.
Синтезированная молекула белка, складываясь, приобретает свойственную ей конфигурацию. Эта конфигурация, однако, может разрушиться при нагревании, при изменении рН, под действием органических растворителей и даже при простом взбалтывании раствора до появления на его поверхности пузырьков. Измененный таким образом белок называют денатурированным; он утрачивает свою биологическую активность и обычно становится нерастворимым. Хорошо знакомые всем примеры денатурированного белка – вареные яйца или взбитые сливки. Небольшие белки, содержащие всего лишь около сотни аминокислот, способны ренатурировать, т.е. вновь приобретать исходную конфигурацию. Но большинство белков превращается при этом просто в массу спутанных полипептидных цепей и прежнюю конфигурацию не восстанавливает.
Одна из главных трудностей при выделении активных белков связана с их крайней чувствительностью к денатурации. Полезное применение это свойство белков находит при консервировании пищевых продуктов: высокая температура необратимо денатурирует ферменты микроорганизмов, и микроорганизмы погибают.
СИНТЕЗ БЕЛКОВ
Для синтеза белка живой организм должен располагать системой ферментов, способных присоединять одну аминокислоту к другой. Необходим также источник информации, которая бы определяла, какие именно аминокислоты следует соединять. Поскольку в организме имеются тысячи видов белков и каждый из них состоит в среднем из нескольких сотен аминокислот, необходимая информация должна быть поистине огромной. Хранится она (подобно тому, как хранится запись на магнитной ленте) в молекулах нуклеиновых кислот, из которых состоят гены.
Активация ферментов.
Синтезированная из аминокислот полипептидная цепь – это далеко не всегда белок в его окончательной форме. Многие ферменты синтезируются сначала в виде неактивных предшественников и переходят в активную форму лишь после того, как другой фермент удалит на одном из концов цепи несколько аминокислот. В такой неактивной форме синтезируются некоторые из пищеварительных ферментов, например трипсин; эти ферменты активируются в пищеварительном тракте в результате удаления концевого фрагмента цепи. Гормон инсулин, молекула которого в активной форме состоит из двух коротких цепей, синтезируется в виде одной цепи, т.н. проинсулина. Затем средняя часть этой цепи удаляется, а оставшиеся фрагменты связываются друг с другом, образуя активную молекулу гормона. Сложные белки образуются лишь после того, как к белку будет присоединена определенная химическая группа, а для этого присоединения часто тоже требуется фермент.
Метаболический кругооборот.
После скармливания животному аминокислот, меченных радиоактивными изотопами углерода, азота или водорода, метка быстро включается в его белки. Если меченые аминокислоты перестают поступать в организм, то количество метки в белках начинает снижаться. Эти эксперименты показывают, что образовавшиеся белки не сохраняются в организме до конца жизни. Все они, за немногими исключениями, находятся в динамичном состоянии, постоянно распадаются до аминокислот, а затем вновь синтезируются.
Некоторые белки распадаются, когда гибнут и разрушаются клетки. Это постоянно происходит, например, с эритроцитами и клетками эпителия, выстилающего внутреннюю поверхность кишечника. Кроме того, распад и ресинтез белков протекают и в живых клетках. Как ни странно, о распаде белков известно меньше, чем об их синтезе. Ясно, однако, что в распаде участвуют протеолитические ферменты, сходные с теми, которые расщепляют белки до аминокислот в пищеварительном тракте.
Период полураспада у разных белков различен – от нескольких часов до многих месяцев. Единственное исключение – молекулы коллагена. Однажды образовавшись, они остаются стабильными, не обновляются и не замещаются. Со временем, однако, меняются некоторые их свойства, в частности эластичность, а поскольку они не обновляются, следствием этого оказываются определенные возрастные изменения, например появление морщин на коже.
Синтетические белки.
Химики давно уже научились полимеризовать аминокислоты, но аминокислоты соединяются при этом неупорядоченно, так что продукты такой полимеризации мало похожи на природные. Правда, имеется возможность соединять аминокислоты в заданном порядке, что позволяет получать некоторые биологически активные белки, в частности инсулин. Процесс достаточно сложен, и таким способом удается получать лишь те белки, в молекулах которых содержится около сотни аминокислот. Предпочтительнее вместо этого синтезировать или выделить нуклеотидную последовательность гена, соответствующую желаемой аминокислотной последовательности, а затем ввести этот ген в бактерию, которая и будет вырабатывать путем репликации большое количество нужного продукта. У этого метода, впрочем, тоже есть свои недостатки.
БЕЛКИ И ПИТАНИЕ
Когда белки в организме распадаются до аминокислот, эти аминокислоты могут быть снова использованы для синтеза белков. В то же время и сами аминокислоты подвержены распаду, так что они реутилизируются не полностью. Ясно также, что в период роста, при беременности и заживлении ран синтез белков должен превышать распад. Некоторые же белки организм непрерывно теряет; это белки волос, ногтей и поверхностного слоя кожи. Поэтому для синтеза белков каждый организм должен получать аминокислоты с пищей.
Источники аминокислот.
Зеленые растения синтезируют из СО2, воды и аммиака или нитратов все 20 аминокислот, встречающихся в белках. Многие бактерии тоже способны синтезировать аминокислоты при наличии сахара (или какого-нибудь его эквивалента) и фиксированного азота, но и сахар, в конечном счете, поставляется зелеными растениями. У животных способность к синтезу аминокислот ограниченна; они получают аминокислоты, поедая зеленые растения или других животных. В пищеварительном тракте поглощенные белки расщепляются до аминокислот, последние всасываются, и уже из них строятся белки, характерные для данного организма. Ни один поглощенный белок не включается в структуры тела как таковой. Единственное исключение заключается в том, что у многих млекопитающих часть материнских антител может в интактном виде попасть через плаценту в кровоток плода, а через материнское молоко (особенно у жвачных) быть передано новорожденному сразу же после его появления на свет.
Потребность в белках.
Ясно, что для поддержания жизни организм должен получать с пищей некоторое количество белков. Однако размеры этой потребности зависят от ряда факторов. Организму необходима пища и как источник энергии (калорий), и как материал для построения его структур. На первом месте стоит потребность в энергии. Это значит, что, когда углеводов и жиров в рационе мало, пищевые белки используются не для синтеза собственных белков, а в качестве источника калорий. При длительном голодании даже собственные белки расходуются на удовлетворение энергетических нужд. Если же углеводов в рационе достаточно, то потребление белков может быть снижено.
Азотистый баланс.
В среднем ок. 16% всей массы белка составляет азот. Когда входившие в состав белков аминокислоты расщепляются, содержавшийся в них азот выводится из организма с мочой и (в меньшей мере) с калом в виде различных азотистых соединений. Удобно поэтому для оценки качества белкового питания использовать такой показатель, как азотистый баланс, т.е. разность (в граммах) между количеством азота, поступившего в организм, и количеством выведенного азота за сутки. При нормальном питании у взрослого эти количества равны. У растущего организма количество выведенного азота меньше количества поступившего, т.е. баланс положителен. При нехватке белков в рационе баланс отрицателен. Если калорий в рационе достаточно, но белки в нем полностью отсутствуют, организм сберегает белки. Белковый обмен при этом замедляется, и повторная утилизация аминокислот в синтезе белка идет с максимально возможной эффективностью. Однако потери неизбежны, и азотистые соединения все же выводятся с мочой и частично с калом. Количество азота, выведенного из организма за сутки при белковом голодании, может служить мерой суточной нехватки белка. Естественно предположить, что, введя в рацион количество белка, эквивалентное этому дефициту, можно восстановить азотистый баланс. Однако это не так. Получив такое количество белка, организм начинает использовать аминокислоты менее эффективно, так что для восстановления азотистого баланса требуется некоторое дополнительное количество белка.
Если количество белка в рационе превышает необходимое для поддержания азотистого баланса, то вреда от этого, по-видимому, нет. Избыток аминокислот просто используется как источник энергии. В качестве особенно яркого примера можно сослаться на эскимосов, которые потребляют мало углеводов и примерно в десять раз больше белка, чем требуется для поддержания азотистого баланса. В большинстве случаев, однако, использование белка в качестве источника энергии невыгодно, поскольку из определенного количества углеводов можно получить намного больше калорий, чем из такого же количества белка. В бедных странах население получает необходимые калории за счет углеводов и потребляет минимальное количество белка.
Если необходимое число калорий организм получает в форме небелковых продуктов, то минимальное количество белка, обеспечивающее поддержание азотистого баланса, составляет для взрослого человека ок. 30 г в день. Примерно столько белка содержится в четырех ломтиках хлеба или 0,5 л молока. Оптимальным считают обычно несколько большее количество; рекомендуется от 50 до 70 г.
Незаменимые аминокислоты.
До сих пор белок рассматривался как нечто целое. Между тем для того, чтобы мог идти синтез белка, в организме должны присутствовать все необходимые аминокислоты. Некоторые из аминокислот организм животного сам способен синтезировать. Их называют заменимыми, поскольку они не обязательно должны присутствовать в рационе, – важно лишь, чтобы в целом поступление белка как источника азота было достаточным; тогда при нехватке заменимых аминокислот организм может синтезировать их за счет тех, что присутствуют в избытке. Остальные, «незаменимые», аминокислоты не могут быть синтезированы и должны поступать в организм с пищей. Для человека незаменимыми являются валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, гистидин, лизин и аргинин. (Хотя аргинин и может синтезироваться в организме, его относят к незаменимым аминокислотам, поскольку у новорожденных и растущих детей он образуется в недостаточном количестве. С другой стороны, для человека зрелого возраста поступление некоторых из этих аминокислот с пищей может стать необязательным.)
Этот список незаменимых аминокислот приблизительно одинаков также и у других позвоночных и даже у насекомых. Питательную ценность белков обычно определяют, скармливая их растущим крысам и следя за прибавкой веса животных.
Питательная ценность белков.
Питательную ценность белка определяют по той незаменимой аминокислоте, которой более всего не хватает. Проиллюстрируем это на примере. В белках нашего тела содержится в среднем ок. 2% триптофана (по весу). Допустим, что в рацион входит 10 г белка, содержащего 1% триптофана, и что других незаменимых аминокислот в нем достаточно. В нашем случае 10 г этого неполноценного белка по сути эквивалентны 5 г полноценного; остальные 5 г могут послужить только источником энергии. Отметим, что, поскольку аминокислоты в организме практически не запасаются, а для того чтобы мог идти синтез белка, должны одновременно присутствовать все аминокислоты, эффект от поступления незаменимых аминокислот можно обнаружить лишь в том случае, если все они поступят в организм одновременно.
Усредненный состав большей части животных белков близок к усредненному составу белков человеческого тела, так что аминокислотная недостаточность нам вряд ли грозит, если наш рацион богат такими продуктами, как мясо, яйца, молоко и сыр. Однако есть белки, например желатин (продукт денатурации коллагена), которые содержат очень мало незаменимых аминокислот. Растительные белки, хотя они в этом смысле и лучше желатина, тоже бедны незаменимыми аминокислотами; особенно мало в них лизина и триптофана. Тем не менее и чисто вегетарианскую диету вовсе нельзя считать вредной, если только при этом потребляется несколько большее количество растительных белков, достаточное для того, чтобы обеспечить организм незаменимыми аминокислотами. Больше всего белка содержится у растений в семенах, особенно в семенах пшеницы и различных бобовых культур. Богаты белком также и молодые побеги, например у спаржи.
Синтетические белки в рационе.
Добавляя небольшие количества синтетических незаменимых аминокислот или богатых ими белков к неполноценным белкам, например к белкам кукурузы, можно значительно повысить питательную ценность последних, т.е. тем самым как бы увеличить количество потребляемого белка. Другая возможность состоит в выращивании бактерий или дрожжей на углеводородах нефти с добавлением нитратов или аммиака в качестве источника азота. Полученный таким путем микробный белок может служить кормом для домашней птицы или скота, а может и непосредственно потребляться человеком. Третий, широко применяющийся, метод использует особенности физиологии жвачных животных. У жвачных в начальном отделе желудка, т.н. рубце, обитают особые формы бактерий и простейших, которые превращают неполноценные растительные белки в более полноценные микробные белки, а эти, в свою очередь, – после переваривания и всасывания – превращаются в животные белки. К корму скота можно добавить мочевину – дешевое синтетическое азотсодержащее соединение. Обитающие в рубце микроорганизмы используют азот мочевины для превращения углеводов (которых в корме значительно больше) в белок. Около трети всего азота в корме скота может поступать в виде мочевины, что по сути и означает в определенной мере химический синтез белка.
В основу классификации белков положены их физико-химические и химические особенности. Белки классифицируют по нескольким признакам.
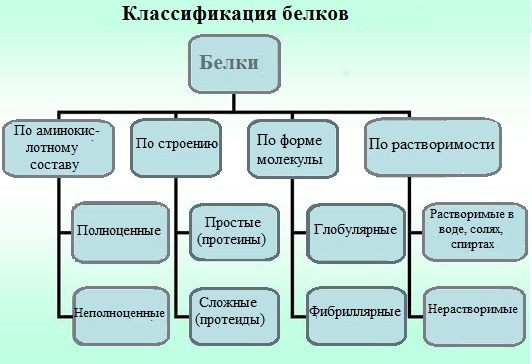
1.По строению
По химическому строению молекул все белки подразделяют на простые и сложные.
Простые белки (протеины) состоят только из аминокислот.
Сложные белки (протеиды) состоят из глобулярных белков и небелкового компонента. Небелковая часть сложного белка называется простетической группой.
Простетическая группа может быть представлена различными по химической природе соединениями. В зависимости от ее строения и свойств сложные белки подразделяются:
- хромопротеины – содержат в качестве небелковой части окрашенный компонент (гемоглобин, миоглобин, цитохромы, хлорофилл);
- гликопротеины – содержат углеводы;
- нуклеопротеины – содержат нуклеиновые кислоты;
- липопротеины – содержат липиды;
- фосфопротеины – содержат остаток ортофосфорной кислоты;
- металлопротеины – содержат комплексно связанный металл.
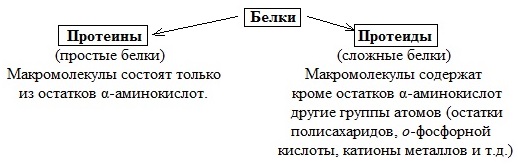
Простые белки
К простым белкам относят альбумины, глобулины, протамины, гистоны, проламины, глютелины, протеиноиды.
Альбумины и глобулины белки, которые есть во всех тканях. Сыворотка крови наиболее богата этими белками. На долю альбуминов приходится более половины белков плазмы крови.
Альбумины
Альбумины – составляют основную часть белков животных и растительных тканей. Альбумины – это глобулярные белки.
Альбумины – белки относительно небольшой молекулярной массы 25000-70000, они имеют выраженный кислый характер, так как содержат большое количество аспарагиновой и глутаминовой кислот.
Они растворяются в чистой воде и разбавленных растворах кислот, щелочей и солей. Из водных растворов альбумины осаждаются сернокислым аммонием только при полном насыщении раствора, т.к. это сильно гидратированые белки.
При кипячении свертываются и выпадают в осадок в виде густых хлопьев денатурированного белка. Образование пенки на молоке, загустение содержимого яиц при варке объясняется денатурацией альбуминов. Пена, образующаяся при варке плодов и овощей, частично состоит из свернувшихся растительных альбуминов.
Альбумины – белки преимущественно животного происхождения. К ним относятся альбумины сыворотки крови, лактальбумин молока, овальбумин яичного белка, миоальбумин мышц животных, а также лейкозин пшеницы, ржи и ячменя, легуменин гречихи и сои, рицин касторовых бобов.
Альбумины выполняют в организме питательную, транспортную, обезвреживающую функции.
Характерным свойством альбуминов является их высокая адсорбционная способность. Они адсорбируют полярные и неполярные молекулы, выполняя транспортную роль.
Они транспортируют гормоны, холестерол, билирубин, лекарственные вещества, ионы кальция.
Альбумины связывают токсичные соединения – алкалоиды, тяжелые металлы, билирубин.
Благодаря высокой гидрофильности, небольшим размерам молекул, значительной концентрации альбумины играют важную роль в поддержании осмотического давления крови. Альбумины обеспечивают на 80% осмотическое давление крови от всех других сывороточных белков.
Альбумины синтезируются преимущественно в печени и быстро обновляются.
Глобулины
Глобулины – широко распространённая группа глобулярных белков, обычно сопутствующая альбуминам. Глобулины имеют более высокую молекулярную массу, чем альбумины. Глобулины слабокислые или нейтральные белки.
Глобулины растворимы в слабых солевых растворах, не растворимы в дистиллированной воде и выпадают в осадок при 50% и более насыщении растворов сернокислым аммонием, при нагревании свертываются.
К глобулинам относятся сывороточный, молочный, яичный, мышечный и другие глобулины.
Глобулинов много в пищевых продуктах. В горохе содержится белок легумин, в сое – глиципин, в семенах фасоли — фазеолин, в картофеле — туберин, в крови — фибриноген, в молоке — лактоглобулин, в яйцах — яичный глобулин, в конопле – эдестин.
Глобулины в организме выполняют питательную, защитную, транспортную функции.
В крови глобулины транспортируют холестерин, фосфолипиды, триглицериды, ионы железа (Fe2+), меди (Cu2+), витамин В12. В молоке лактоглобулины и лактальбумины также выполняют транспортную функцию.
Глобулины вырабатываются печенью и иммунной системой.
Протамины
Протамины – низкомолекулярные положительно заряженные ядерные белки с резко выраженными основными свойствами (щелочные белки), с низкой молекулярной массой – 4000–12000, содержат 60-85% аргинина.
Протамины являются составной частью многих важных сложных белков (нуклеопротеидов), входящих в состав клеточных ядер. В ядрах клеток они находятся в комплексе с ДНК.
Протамины хорошо растворяются в воде, кислой и нейтральной среде и осаждаются в щелочных средах, не осаждаются при кипячении.
Протамины обнаружены в ядрах сперматозоидов у рыб. Составляют фракцию основного белка в зрелой сперме рыб.
Протамины содержатся в сперме некоторых видов рыб (сальмин – семга, клупеин – сельдь), скумбрин – скумбрия.
Выполняют главным образом структурную функцию, поэтому и присутствуют в клетках не способных к делению.
Гистоны
Гистоны представляют собой низкомолекулярные (11000–22000) белки с третичной структурой, обладают выраженными основными (щелочными) свойствами, т.к. содержат большое количество аргинина и лизина.
Гистоны содержатся в ядрах клеток высших организмов в соединении с нуклеиновыми кислотами, образуя нуклеопротеиды.
Гистоны играют важную роль в регуляции генной активности. Это белки хромосом, они входят в структуру хроматина. В клетках положительно заряженные гистоны связаны с отрицательно заряженными ДНК в составе хроматина. Гистоны в хроматине формируют остов, на который накручивается молекула ДНК.
Это очень стабильные белки, молекулы которых могут сохраняться в течение всей жизни клетки.
Гистоны находятся в виде нуклеопротеидов в лейкоцитах и красных кровяных шариках (гемоглобин).
Гистоны по своим свойствам близки к протаминам, растворимы в воде и разбавленных кислотах, нерастворимы в водном аммиаке и не свертываются при нагревании. Молекулы гистонов полярны, очень гидрофильны, поэтому они с трудом высаливаются из растворов.
Основные функции гистонов – структурная и регуляторная.
Структурная – гистоны участвуют в стабилизации пространственной структуры ДНК, а следовательно хроматина, хромосом и нуклеосом.
Регуляторная – заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Проламины
Проламины – белки растительного происхождения, содержатся в клейковине семян злаковых растений, где выполняют роль запасных белков. В их состав входит большое количество глутаминовой кислоты и пролина (отсюда название проламин).
Проламины почти не содержат глицина и лизина, что делает невысокой их пищевую ценность.
Характерной особенностью проламинов является то, что они не растворимы в воде, солевых растворах, щелочах, хорошо растворимы в 60-80% растворе этилового спирта (это связано с наличием большого количества неполярной аминокислоты пролина), в то время как все другие белки денатурируют и выпадают в осадок.
К ним относятся глиадин (белок пшеницы, ржи), гордеин (белок ячменя), зеин (белок кукурузы), авенин (белокян овса), эдестин (белок конопли).
Проламины практически отсутствуют в бобовых и масличных культурах.
Глютелины
Глютелины – белки растительного происхождения, характеризующиеся высоким содержанием аминокислот пролина и глутаминовой кислоты.
Глютелины играют важную роль в питании человека, т. к. их питательная ценность высока. Они присутствуют в семенах злаковых культур вместе с проламинами.
Глютелины занимают промежуточное положение между проламинами и глобулинами.
Глютелины растворяются в разбавленных кислотах и щелочах, не растворяются в воде, спирте и разбавленных солевых растворах.
Представителями данного класса простых белков является оризенин (белок риса), глютелин (белок кукурузы) и глютенин (белок пшеницы).
У риса 80% всего белка приходится на глютелины (оризенин), этим можно объяснить высокое содержание лизина в белке рисового зерна.
Эти белки в ржаной муке не образуют клейковины, что обусловлено качественным различием белков ржи и пшеницы.
Протеиноиды
Протеиноиды – фибриллярные белки, их молекулы образуют многомолекулярные нитевидные комплексы – фибриллы.
Протеиноиды – белки животного происхождения, богаты глицином, пролином, цистином. Они могут иметь третичную и четвертичную структуры.
Протеиноиды – белки опорных тканей (костей, хрящей, сухожилий, связок). Они представлены коллагеном, эластином и кератином.
Протеиноиды не растворяются в воде, солевых растворах, разведенных кислотах и щелочах. Не перевариваются в желудочно-кишечном тракте большинства животных и человека и поэтому не могут выполнять питательную функцию. Однако, некоторые членистоногие приспособились к питанию фибриллярными белками кожи, перьев птиц, шерсти (например, моль).
К протеиноидам относятся коллаген – основной белок кожи, костей и хрящей, эластин – белок сухожилий и соединительной ткани, кератин – белок волос, шерсти, копыт, рогов и фиброин шелка.
Коллаген
Коллаген – основной белок соединительной ткани животных и человека, состоящий из трех белковых нитей, закрученных в спираль. Коллаген защищает ткани от механических воздействий, поддерживая прочность кожного покрова.
Коллаген – широко распространённый в организме белок, составляет около трети всех белков организма. Более 80% всего коллагена организма находится в межклеточном веществе соединительной ткани кожи, костей, связок, сухожилий, хрящей. Эти ткани обладают малой растяжимостью и высокой прочностью.

К особенностям аминокислотного состава коллагена относится, прежде всего, высокое содержание глицина, пролина. Полипептидные цепи коллагена содержит около 1000 аминокислот.
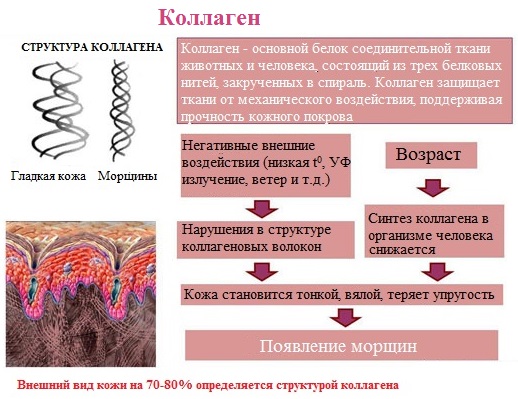
Коллаген, долго нагреваемый в воде при 56-1000С, переходит в растворимый клей, или глютин (желатин), который охлаждаясь, застывает и образует студень. На этом свойстве желатина основано приготовление заливных блюд.
Эластин
Эластин – основной белок эластических волокон, которые в больших количествах содержатся в межклеточном веществе таких тканей, как кожа, стенки кровеносных сосудов, связки, лёгкие. Эти ткани обладают очень важными свойствами: они могут растягиваться в несколько раз по сравнению с исходной длиной, сохраняя при этом высокую прочность на разрыв, и возвращаться в первоначальное состояние после снятия нагрузки.
Эластичность связана с присутствием в эластине большого количества межцепочечных сшивок при участии аминокислоты лизина.
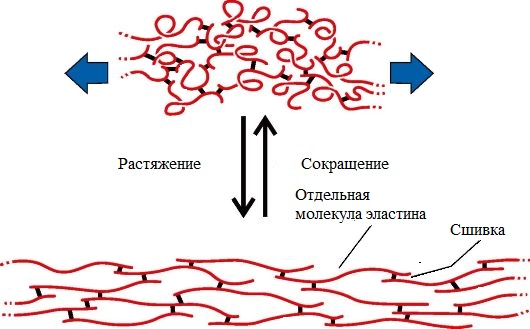
Эластин не растворим в воде, не способен к набуханию. В составе эластина содержится много гидрофобных аминокислот — глицина, валина, аланина, лейцина, пролина.
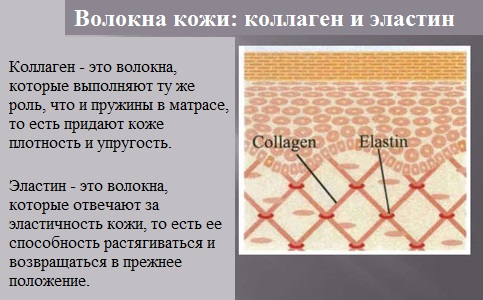
Кератин
Кератины — семейство фибриллярных белков, обладающих механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину.
Волосы (шерсть), ногти, перья, иглы, когти, рога и копыта животных состоят главным образом из кератина.
Кератины могут иметь α-структуру и β-структуру.
α-Кератин — структурный белок, построенный преимущественно в виде α-спирали.
В α-кератинах три α-спирали объединяются в суперспираль. Молекулы α-кератина ориентированы параллельно и соединены дисульфидными связями (содержат много цистеина), что придает прочность структуре.
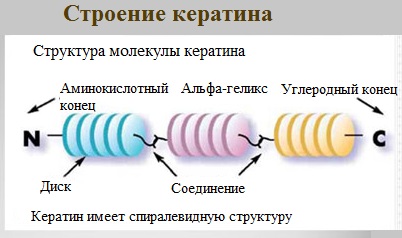
Примером β-кератинов является фиброин шелка.
Кератины не растворимы в растворах солей, кислот, щелочей. Их молекулярная масса очень высока.
Фиброин шелка
Фиброин шелка – фибриллярный белок, выделяемый паукообразными и некоторыми насекомыми и составляющий основу нитей паутины и коконов насекомых, в частности, шёлка тутового шелкопряда.
Его β-структура состоит из антипараллельных полипептидных цепей, связанных между собой водородными связями. Фиброин состоит в основном из глицина, аланина, серина, тирозина.
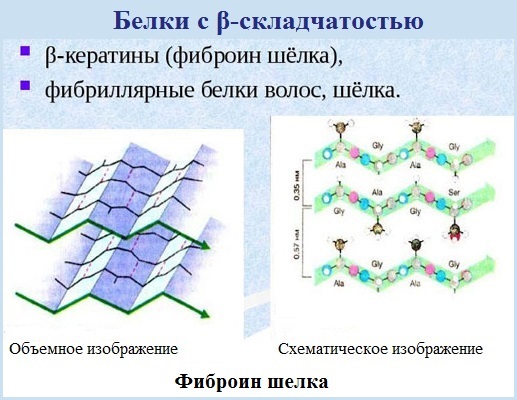
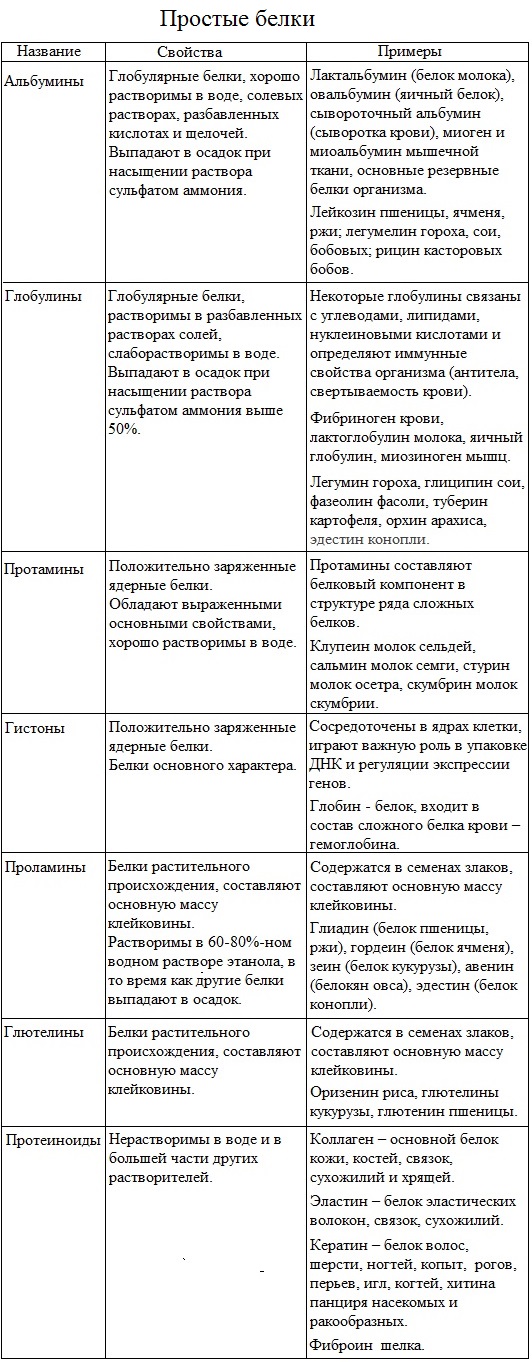
Сложные белки
Фосфопротеины
Фосфопротеины – это сложные белки, простетической группой которых является остаток фосфорной кислоты. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу.
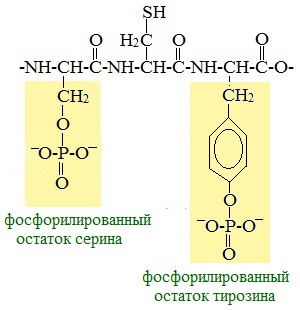
К белкам этого класса относятся:
- казеин молока, в котором содержание фосфорной кислоты достигает 1%;
- вителлин, вителлинин и фосвитин, выделенные из желтка куриного яйца;
- овальбумин, открытый в белке куриного яйца;
- ихтулин, обнаруженный в икре рыб и, который играет немаловажную роль в развитии эмбриона рыб.
Биологическая роль фосфопротеинов заключается в том, что они являются питательными веществами необходимыми для растущих организмов.
Фосфопротеины – это ценный источник энергетического и пластического материала для развития зародыша и дальнейшего роста и развития организма.
Например, казеин (казеиноген) молока содержит все незаменимые аминокислоты и фосфорную кислоту. В его состав также входят ионы кальция.
Фосфор и кальций необходимы растущему организму в больших количествах для формирования скелета.
Гликопротеины
Гликопротеины (гликоконъюгаты) – это сложные белки, которые содержат в качестве простетической группы углеводный компонент.
У некоторых гликопротеидов углеводная часть непрочно связана с белком и может легко от него отделяться. Простетические группы некоторых гликопротеидов могут встречаться в тканях и в свободном состоянии.
Гликопротеины широко распространены в природе. Они встречаются в секретах (слюне и т.д.), в составе клеточных мембран, клеточных стенок, межклеточного вещества, соединительной ткани. Многие ферменты и транспортные белки являются гликопротеинами.
Гликопротеины разделяют на истинные гликопротеины и протеогликаны.
Истинные гликопротеины
Углеводная часть гликопротеинов представлена небольшими гетерополисахаридами или олигосахаридами нерегулярного строения и содержит маннозу, галактозу, глюкозу, и их аминопроизводные. Белок в них составляет 80-85% массы макромолекулы.
Для гликопротеинов характерна ковалентная гликозидная связь. N-гликозидная связь возникает между углеводным компонентом и амидной группой аспарагина в белках. Например, в иммуноглобулинах, ферментах и гормонах).
О-гликозидная связь – моносахарид связан с ОН-группой серина или треонина (в муцинах), а иногда с ОН-группой гидроксилизина или гидроксипролина (коллагены).
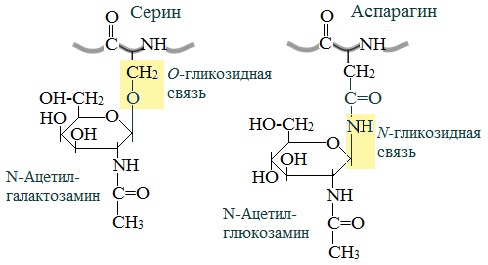
К типичным гликопротеинам относят большинство белковых гормонов, секретируемые в жидкие среды организма вещества, мембранные сложные белки, все антитела (иммуноглобулины), белки плазмы крови, молока, интерфероны, группы крови.
Функциии гликопротеинов
- Структурная – коллаген, эластин.
- Защитная – антитела (иммуноглобулины), интерферон, факторы свертывания крови (протромбин, фибриноген).
- Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ.
- Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны.
- Ферментативная – ферменты: холинэстераза, нуклеаза.
- Транспортная – перенос веществ в крови и через мембраны (трансферрин, транскортин, альбумин, Na+,К+-АТФаза).
Протеогликаны
Особую группу гликопротеинов составляют протеогликаны, в составе которых углеводный компонент преобладает и на его долю приходится от 90% и выше. Более того, эти вещества по своим свойствам более сходны с полисахаридами, чем с белками.
Простетическая группа протеогликанов представлена гетерополисахаридами, имеющими регулярное строение.
Углеводная часть, аналогично с гликопротеинами, связывается с белком через остатки серина и аспарагина.
Углеводные фрагменты усиливают гидрофильные свойства белка за счёт большого количества ОН-групп и кислотных группировок. Цепи последних недостаточно гибкие и стремятся принять конформацию очень рыхлого случайного клубка, занимая огромный объём.
Будучи гидрофильными, они притягивают много воды и даже в низких концентрациях образуют гидратированные гели. Подобная способность создаёт во внеклеточном пространстве – тургор.
Протеогликаны образуют основное вещество межклеточного матрикса (межклеточного пространства).
Протеогликаны хрящевого матрикса содержат гиалуроновую кислоту, образующую студенистый гель, выполняющий роль амортизатора в хрящах и суставных поверхностях.
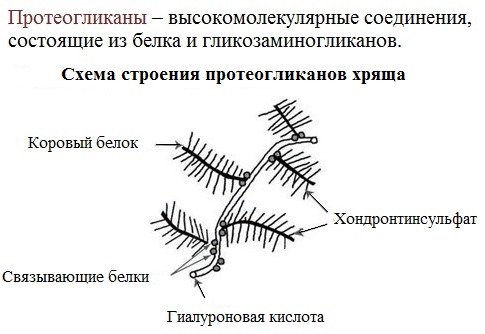
По функции протеогликаны значимы для межклеточного пространства, особенно соединительной ткани, в которое погружены коллагеновые волокна. Они имеют древовидную структуру, в центре находится гиалуроновая кислота.
Т.к. их молекулы гидрофильны, они создают сетчатый желеподобный матрикс и заполняют пространство между клетками, являясь преградой для крупных молекул и микроорганизмов.
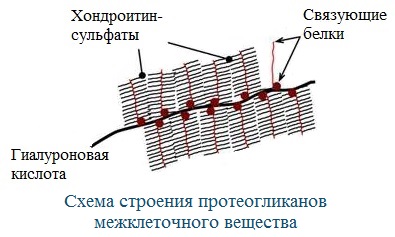
В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные – например агрекан и ворсикан.
В межклеточном пространстве имеется также целый набор так называемых малых протеогликанов, которые широко распространены в разных видах соединительной ткани и выполняют там разнообразные функции.

По соотношению белковой и углеводной частей гликопротеины подразделяются на нейтральные и кислые.
К нейтральным гликопротеинам относятся яичный белок (овальбумин), гликопротеины плазмы крови, белок щитовидной железы (тиреоглобулин).
К кислым гликопротеинам относятся – муцины и мукоиды.
Муцины являются основой слизей организма (слюны, желудочного и кишечного сока). Выполняют защитную функцию — предохраняют стенки пищеварительного тракта от механических, химических повреждений. Муцины устойчивы к действию ферментов, которые гидролизуют белок.
Мукоиды – это белки синовиальной жидкости суставов, хрящей, жидкости глазного яблока. Выполняют защитную функцию, являются смазочным материалом в аппарате движения.
В состав кислых гликопротеинов входит уроновая кислота, которая принимает участие в обезвреживании билирубина и лекарственных средств.
Нуклеопротеины
Нуклеопротеины (ДНП и РНП) – это сложные белки, простетической группой которых являются нуклеиновые кислоты (РНК и ДНК).
В природе обнаружено 2 типа нуклеопротеинов – дезоксирибонуклеопротеины (ДНП) – комплексы белков с дезоксирибонуклеиновой кислотой (ДНК) и рибонуклеопротеиды (РНП) – комплексы белков с рибонуклеиновой кислотой (РНК).
ДНП преимущественно локализованы в ядре, митохондриях, а РНП – в цитоплазме, а в ядре (ядрышке) обнаружены также высокомолекулярные РНП.
Выделяют два вида нуклеиновых кислот в зависимости от пентозы, входящей в их состав – рибонуклеиновая кислота (РНК), если в ее состав входит рибоза и дезоксирибонуклеиновая кислота (ДНК), если в ее состав входит дезоксирибоза.
Отличия между РНК и ДНК
- количество цепей: в РНК одна цепь, в ДНК две цепи;
- размеры: ДНК намного крупнее;
- локализация в клетке: ДНК находится в ядре, почти все РНК – вне ядра;
- вид моносахарида: в ДНК – дезоксирибоза, в РНК – рибоза;
- азотистые основания: в ДНК имеется тимин, в РНК – урацил;
- функция: ДНК отвечает за хранение наследственной информации, РНК – за ее реализацию.
ДНК преимущественно сосредоточена в ядре клеток в составе хромосом, митохондриях и хлоропластах.
Функции ДНК
Хранение, воспроизводство и передача по наследству генетического материала, экспрессия генов.
Различают три главных вида РНК:
- матричная (информационная) – мРНК (иРНК) содержится в ядре и цитоплазме.
- транспортная – тРНК в основном содержится в цитоплазме клетки.
- рибосомная – рРНК составляет существенную часть рибосомы.
Функции РНК
мРНК (иРНК) – считывает информацию с участка ДНК о первичной структуре белка и несет эту информацию к рибосомам (несет информацию из ядра в цитоплазму).
тРНК – транспортирует аминокислоты к месту синтеза белка (из цитоплазмы к рибосомам).
рРНК – входит в состав рибосом (из нее построен каркас рибосом), участвует в синтезе белковой (полипептидной) цепи.
РНК в некоторых вирусах является носителем генетической информации вместо ДНК.
Видеофильм «Нуклеиновые кислоты в биосинтезе белка»
Липопротеины
Липопротеины – сложные белки, простетическая группа которых представлена каким-либо липидом.
Липиды играют важную роль в организме человека. Они содержатся во всех клетках и тканях и участвуют во многих обменных процессах.
Они составляют структурную основу всех биологических мембран, в свободном состоянии присутствуют в основном в плазме крови и лимфе.
Липопротеины плазмы, сыворотки крови растворимы в воде. Липопротеины мембранных стенок клеток, нервных волокон нерастворимы в воде.
В состав липопротеинов могут одновременно входить свободные триглицериды, жирные кислоты, нейтральные жиры, фосфолипиды и холестерин (холестерол).
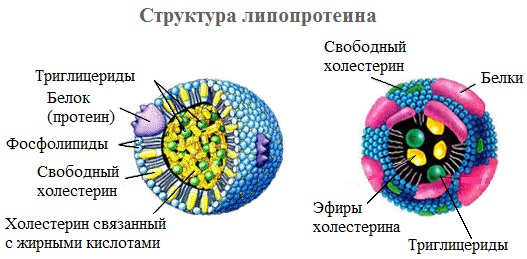
Все типы липопротеинов имеют сходное строение: гидрофобное ядро и гидрофильный слой на поверхности. Гидрофильный слой образован белками (апопротеинами), фосфолипидами и холестеролом. Триацилглицеролы (ТАГ) и эфиры холестерола составляют гидрофобное ядро.
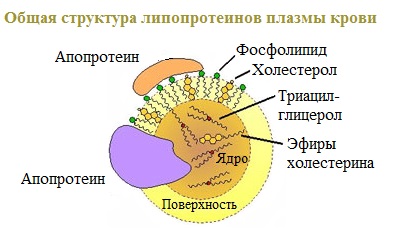
Гидрофильные группы этих молекул ориентированы в водную фазу, а гидрофобные части – к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды.
Липиды не растворяются в воде, потому не могут переноситься кровью в чистом виде. Поэтому для транспорта липидов кровью в организме образуются комплексы липидов с белками – липопротеины.
В организме синтезируются следующие типы липопротеинов: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП).
Каждый из типов ЛП образуется в разных тканях и транспортирует определенные липиды.
Общая функция всех липопротеинов – это транспорт липидов.
Липопротеины хорошо растворимы в крови, так как имеют небольшой размер и отрицательный заряд на поверхности. Некоторые липопротеины легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам.
Большой размер хиломикронов не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой.
Липопротеины очень низкой и низкой плотности вызывают при повышении их концентрации в крови атеросклероз.
При нарушениях транспорта липидов и липидного обмена снижается энергетический потенциал организма, ухудшается передача нервных импульсов, снижается скорость ферментивных реакций. Без участия липопротеинов невозможен транспорт жирорастворимых витаминов: витаминов групп А, Е, К, D.
Хромопротеины
Хромопротеины («цветные белки») – сложные белки, содержащие в качестве простетической группы окрашенный компонент.
Хромопротеины участвуют в таких процессах жизнедеятельности, как фотосинтез, дыхание, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето- и цветовосприятие и др.
В зависимости от их строения различают гемопротеины, флавопротеины, родопсин.
Гемопротеины (красные) – сложные белки, простетической группой которых служит гем.
К группе гемопротеинов относятся гемоглобин, миоглобин, хлорофиллсодержащие белки и ферменты (цитохромы, каталаза и пероксидаза). Все они содержат в качестве небелкового компонента железо- (или магний) порфирины, но различные по составу и структуре белки, и выполняют разнообразные биологические функции.
Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). Гемопротеины (железопорфирины), напротив, катализируют обратную реакцию — образование молекулы воды, связанное с освобождением энергии.
Гемоглобин – главный компонент эритроцита и основной дыхательный пигмент, обеспечивает перенос кислорода (О2) из легких в ткани и углекислого газа (СО2) из тканей в легкие. Поддерживает кислотно-основное равновесие крови.
У гемоглобина белковый компонент представлен глобином, а небелковым компонентом является гем – пигмент. Ион железа расположен в центре гема-пигмента, придающего крови характерный красный цвет. Гем представлен порфирином, состоящим из 4-х пиррольных колец. Каждая из 4 молекул гема «обернута» одной полипептидной цепью.
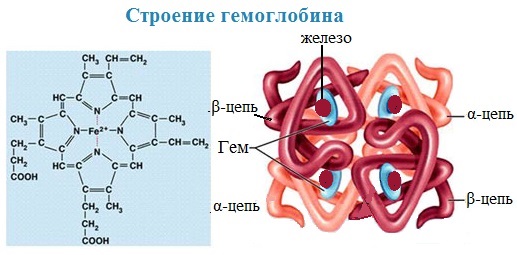
Гем является простетической группой и у миоглобина, каталазы, пероксидазы, цитохромов. Гем встречается также в растительных гемопротеинах и участвует в процессе фотосинтеза.
Миоглобин (белок мышц) – небольшой глобулярный белок, молекула его состоит из одной полипептидной цепи и одного гема. Миоглобин создает в мышцах резерв кислорода, используемый мышечными волокнами.
К хромопротеинам относятся и флавопротеиды, простетическими группами у которых являются изоаллоксазиновые производные. Флавопротеиды входят в состав оксидоредуктаз – ферментов, катализирующих окислительно-восстановительные реакции в клетке. В некоторые флавоноиды включены ионы металлов и молекула гема.
Родопсин – это белок, простетической группой которого служит активная форма витамина А – ретиналь. Родопсин — основное светочувствительное вещество палочек сетчатки глаза. Его функция состоит в восприятии света в сумерках, т.е. отвечает за сумеречное зрение.
Металлопротеины
Металлопротеины – сложные белки, где роль небелкового компонента выполняют ионы металлов.
К числу металлопротеинов относятся около сотни ферментов.
Важная функция металлопротеинов связана с транспортированием металлов и их хранением в организме.
Типичными металлопротеинами являются белки, содержащие негемовое железо – трансферрин, ферритин, гемосидерин, имеющие важное значение в обмене железа в организме.
Трансферрин – растворимый в воде железопротеин, содержащийся в сыворотке крови в составе β-глобулинов. Молекула трансферрина содержит два иона Fe3+. Этот белок служит переносчиком железа в организме. Трансферрин синтезируется в печени.
Ферритин – внутриклеточный глобулярный белок, содержится главным образом в селезенке, печени, костном мозге, выполняя роль депо железа в организме. Благодаря ферритину цитозольные запасы железа поддерживаются в растворимой и нетоксичной форме.
Гемосидерин, в отличие от ферритина и трансферрина, является водонерастворимым железосодержащим белковым комплексом. Он содержится главным образом в клетках печени и селезенки, накапливается при избытке железа в организме, например, при частых переливаниях крови.
Церулоплазмин – сывороточный белок, содержащий медь и принимающий участие в ее метаболизме, а также обменных процессах железа. Относится к α-2-глобулинам.

Каталаза — обезвреживает перекись водорода.
Цитохромоксидаза — в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ.
Алкогольдегидрогеназа — обеспечивает метаболизм этанола и других спиртов
Лактатдегидрогеназа — участвует в метаболизме молочной кислоты
Карбоангидраза — образует угольную кислоту из CO2 и H2O.
Ксантиноксидаза — отвечает за последние реакции катаболизма пуриновых оснований.
Тиреопероксидаза — участвует в синтезе гормонов щитовидной железы.
Глутатионпероксидаза — антиоксидантный фермент.
Уреаза — отвечает за распад мочевины.
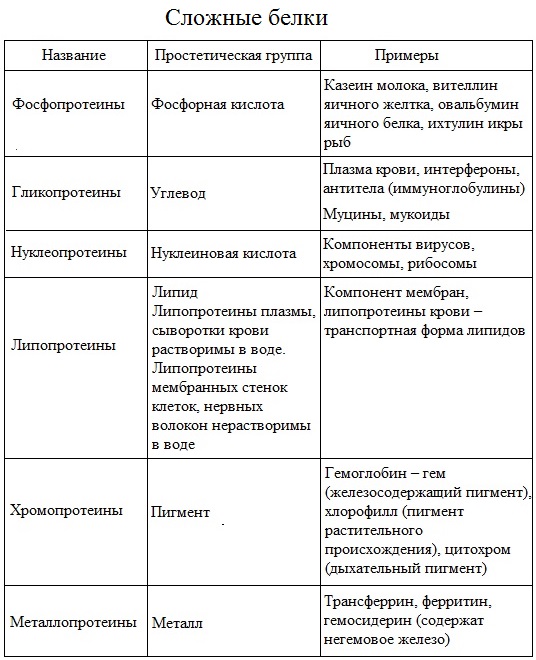
2.По форме молекул (фибриллярные и глобулярные)
Белки можно классифицировать по форме молекул и некоторым физически свойствам на два больших класса: фибриллярные и глобулярные белки.
Фибриллярные белки представляют собой длинные нитевидные молекулы, полипептидные цепи которых расположены параллельно друг другу вдоль одной оси и образуют длинные волокна (фибриллы) или слои.
Наиболее важна вторичная структура (третичная почти совсем не выражена).
Большинство фибриллярных белков не растворяется в воде, имеет большую молекулярную массу.
Эти белки отличаются высокой механической прочностью, выполняют структурную функцию.
К фибриллярным белкам относятся кератины (волосы, шерсть, рога, копыта, ногти, перья), миозин (мышцы), коллаген (сухожилия и хрящи), фиброин (шелк, паутина).
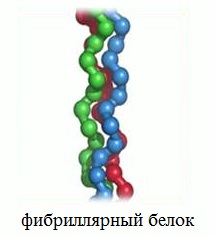
Глобулярные белки характеризуются компактной трехмерной укладкой полипептидных цепей, их молекулы имеют форму глобулы.
Наиболее важна третичная структура.
Глобулярные белки растворяются в воде или в разбавленных солевых растворах. Из-за большого размера молекул эти растворы – коллоидные.
Глобулярные белки выполняют функции ферментов, антител (глобулины сыворотки крови определяют иммунологическую активность) и в некоторых случаев гормонов (инсулин).
Они играют важную роль в протоплазме, удерживая в ней воду и некоторые другие вещества, способствуют поддержанию молекулярной организации.
Глобулярные белки встречаются в физиологических жидкостях (сыворотке крови, молоке, пищеварительных жидкостях), в тканях организма.

Существуют также и промежуточные белки фибриллярной природы, но растворимые. Примером служит фибриноген, превращающийся в нерастворимый фибрин при свертывании крови.
3.По растворимости в отдельных растворителях
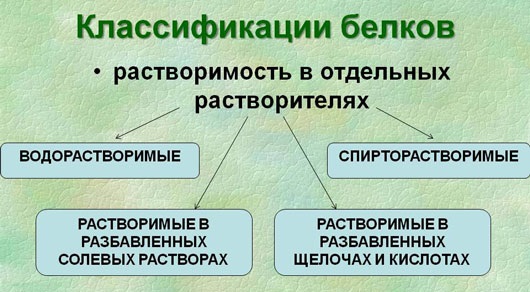
Классификация простых белков основана преимущественно на растворимости в воде, спирте, солевых растворах, растворах щелочей и кислот.
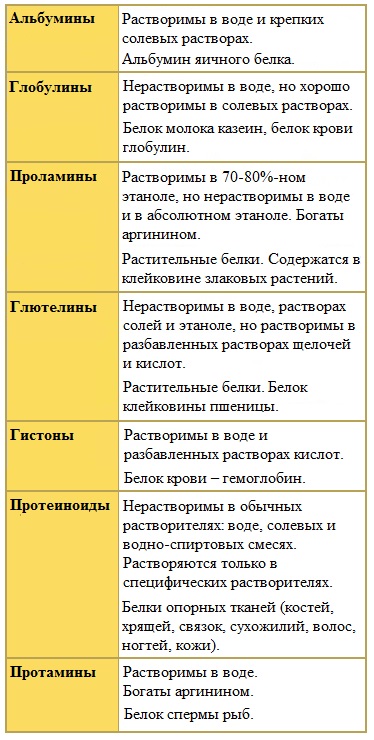
4.По аминокислотному составу
С точки зрения пищевой ценности белков, определяемой их аминокислотным составом и содержанием незаменимых аминокислот, белки подразделяются на полноценные и неполноценные.
Полноценными считаются белки, включающие в состав восемь незаменимых аминокислот, которые самостоятельно организм синтезировать не может.
Неполноценными считаются белки, которые содержат недостаточное количество одной или нескольких незаменимых аминокислот, которые не могут быть синтезированы организмом.
Полноценные белки содержатся в продуктах животного происхождения (кроме желатина), а также некоторой растительной пище (горох, фасоль, соя).
Неполноценные белки – преимущественно растительного происхождения.

Белки