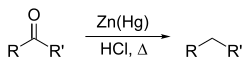В основу научной
классификации и номенклатуры органических
соединений положены принципы химического
строения А.М. Бутлерова. Существование
огромного числа изомерных углеводородов
требует точной и ясной номенклатуры
для того, чтобы по структурной формуле
можно было назвать, а по названию написать
структурную формулу соединения. Для
названия изомеров в органической химии
используются следующие номенклатуры:
эмпирическая (тривиальная), рациональная
и систематическая.
Эмпирические
(тривиальные) названия не дают
представления о химической природе
соединения, не расшифровывают его
строения. Происхождение их связано с
природными источниками, из которых
данные вещества были выделены (винный
спирт, уксусная кислота, мочевина,
молочная кислота, винная кислота), с
наиболее характерными свойствами
(индиго, какодил, гремучая кислота) или
со способами получения (серный эфир,
пировиноградная кислота). Отдельные
соединения названы по имени исследовавших
их ученых (кетон Михлера).
В ряду алканов
первые четыре представителя с
неразветвленной цепью имеют тривиальные
названия.
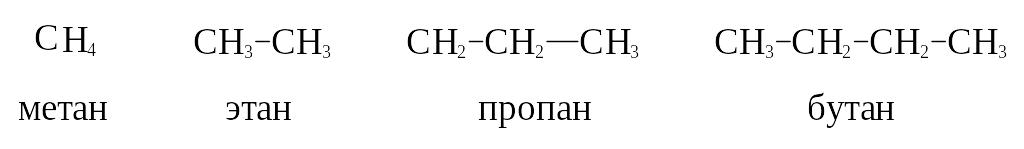
Все названия
углеводородов, начиная с С5,
являются систематическими.
Рациональная
номенклатура
возникла в середине XIX
века и основана на принципе научной
систематики соединений: название
соединений должно отражать их химическое
строение.
По рациональной
номенклатуре за основу наименования
органического соединения обычно
принимают название наиболее простого
(чаще всего первого) члена гомологического
ряда. Все остальные соединения
рассматривают как его производные,
образованные замещением в нем атомов
водорода углеводородными радикалами,
атомами или функциональными группами.
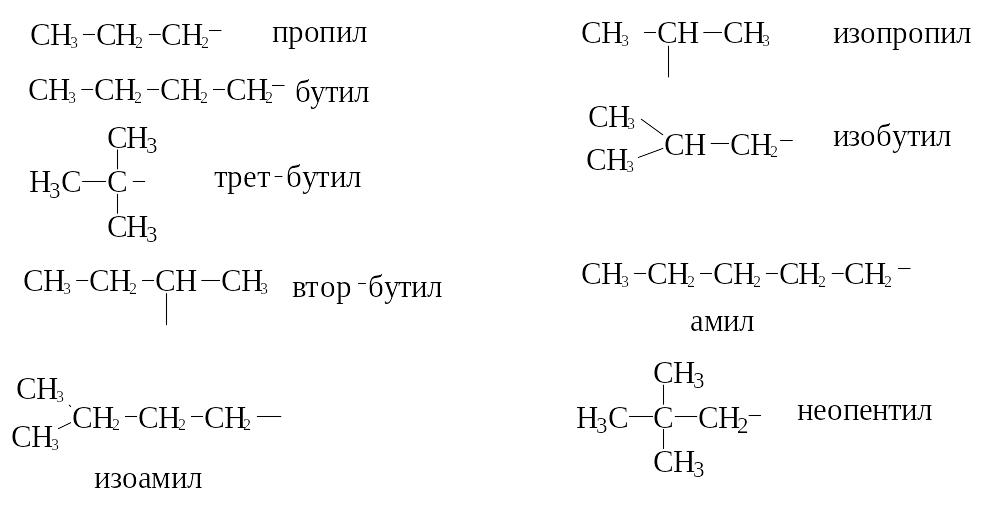
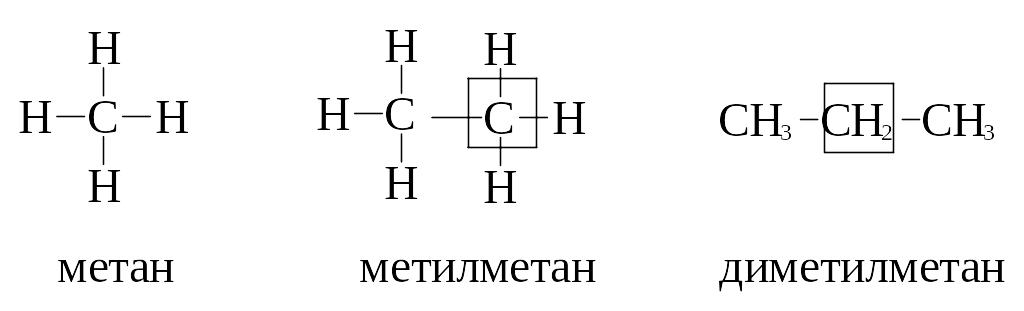
Углеводородный
радикал –
это остаток молекулы углеводорода после
удаления одного атома водорода. Все
радикалы алканов называют алкилами,
их названия
образуются из названий соответствующих
предельных углеводородов заменой
окончания ан
на ил:
СН4
метан СН3– метил
С2Н6 этан С2Н5– этил
С3Н8
пропан С3Н7– пропил
С4Н10 бутан С4Н9– бутил
С5Н12 пентан С5Н11– амил
(пентил)
С6Н14 гексан
С6Н13– гексил
С7Н16
гептан С7Н15– гептил
Начиная с пропана,
появляются изомерные радикалы:
В рациональной
номенклатуре алканы рассматривают как
замещенные метана, остатком которого
считают атом углерода, наиболее замещенный
радикалами. Перед словом метан
перечисляют по старшинству (в порядке
увеличения числа углеродных атомов)
названия радикалов, связанных с
центральным углеродным атомом. Если в
молекуле имеется несколько одинаковых
радикалов, перед их названием ставится
приставка, образованная от греческих
числительных (ди -два, три – три, тетра –
четыре).
Например:
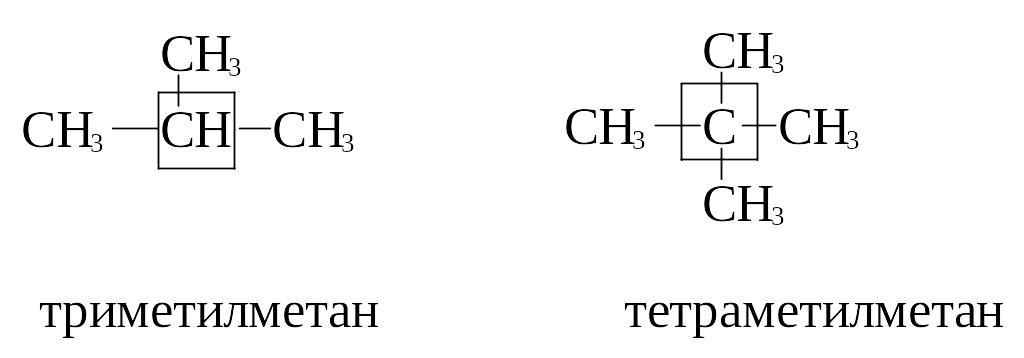
Систематическая
номенклатура (ИЮПАК).
В 1892 г. в г.
Женеве на Международном конгрессе
представителей химических обществ была
утверждена новая номенклатура органических
соединений, которая стала называться
женевской. После внесения в эту
номенклатуру некоторых изменений и
дополнений на международных форумах
Международного союза чистой и прикладной
химии “ИЮПАК” она стала называться
систематической номенклатурой.
Предельным
углеводородам было присвоено название
алканы.
Были приняты следующие правила
номенклатуры:
-
Названия предельных
углеводородов с неразветвленной цепью
образованы от греческих числительных
с окончанием ан:
пентан,
гексан, гептан, нонан, декан и т.д., за
исключением первых четырех (метан,
этан, пропан, бутан).
-
В основу названия
алкана с разветвленной цепью положено
название углеводорода с самой длинной
нормальной цепью, боковые цепи называются
с помощью соответствующих радикалов.
Место присоединения боковой цепи к
главной указывается номером перед
названием радикала. -
Нумерацию главной
цепи начинают с того конца, к которому
ближе боковая цепь; при наличии
симметрично расположенных боковых
цепей – с той стороны, к которой ближе
более простой радикал. Правильной
считается нумерация, при которой сумма
цифр в соединении минимальна.
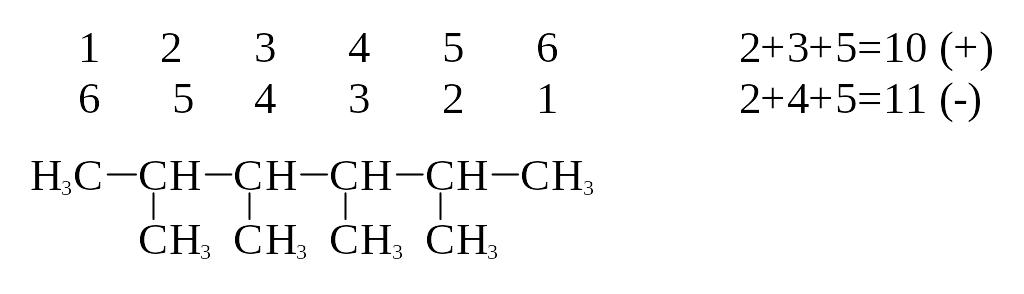
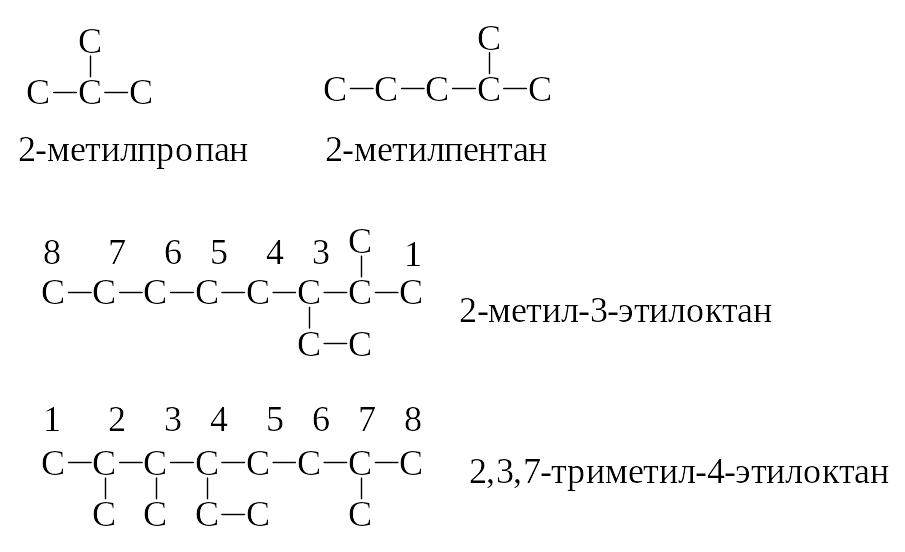
-
Боковые цепи
(радикалы) перечисляются в порядке
увеличения их сложности; при наличии
нескольких одинаковых заместителей
их количество указывают перед названием
радикала при помощи греческих числительных
– ди-, три-, тетра-, пента-, гекса- … Цифры
располагают по возрастанию, разделяют
друг от друга запятыми. Цифры в названии
выделяют тире. Примеры:
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
29.03.201621.08 Mб19Альбом. Блок-схемы к главам Градостроительного кодекса Российской Федерации с комментариями к ним.pdf
Рассмотрим правила составления названий алканов и их производных согласно международной номенклатуре ИЮПАК.
Вспомним, что для четырёх первых алканов используются тривиальные названия:
CH4
— метан,
C2H6
— этан,
C3H8
— пропан,
C4H10
— бутан.
Названия следующих гомологов образуются от греческих числительных, к которым добавляется суффикс «-ан»:
C5H12
— пентан,
C6H14
— гексан,
C7H16
— гептан,
C8H18
— октан,
C9H20
— нонан,
C10H22
— декан,
C14H30
— тетрадекан и т. д.
В названиях радикалов суффикс «-ан» заменяется на «-ил»:
CH3
— метил,
C2H5
— этил.
По правилам международной номенклатуры ИЮПАК, алканы с разветвлённой цепью атомов углерода рассматриваются как производные неразветвлённых углеводородов, в молекулах которых есть боковые радикалы.
Чтобы назвать такие вещества, выбирают самую длинную цепь углеродных атомов.
Атомы нумеруют, начиная с того конца, к которому ближе расположено боковое ответвление.
Сначала цифрой указывают положение радикала, а затем его название. Если одинаковых радикалов несколько, то добавляют приставку: «ди-» (два), «три-» (три), «тетра-» (четыре) и т. д. Затем называют главную цепь.
Пример (1). Назовём алкан такого строения.

Самая длинная цепь в этой молекуле содержит шесть атомов углерода. Нумерацию начинаем слева, так как со вторым атомом соединены два радикала. В молекуле три радикала
CH3
.
Указываем цифрами через запятую положение каждого радикала ((2),(2),(4)), ставим дефис (–), указываем число и название радикалов (триметил) и добавляем название главной цепи (гексан): (2),(2),(4)-триметилгексан.
Если в молекуле содержатся разные радикалы, то их называют в алфавитном порядке.
Пример (2). Рассмотрим это правило на примере алкана следующего строения.

В этой молекуле три радикала
CH3
(метил) и один
C2H5
(этил). Название алкана: (2),(2),(4)-триметил-(4)-этилгексан.
В реакциях алканов с разными веществами образуются их производные, содержащие заместители (атомы галогенов, нитрогруппы и т. д.). Такие соединения называются по общим правилам.
Пример (3). Назовём производное алкана, в молекуле которого есть атомы хлора и брома, а также радикал метил.

Выбираем и нумеруем самую длинную цепь. Записываем «адрес» и название каждого заместителя в алфавитном порядке: (3)-бром-(2)-метил-(1)-хлорбутан.
Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:

Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:

Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
![]()
соответствуют структурные формулы

Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.

2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:

3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:

Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:

Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |
Найди девять отличий |
Правила составления изомеров на примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:
![]()
4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность С – IV. В результате получают изомер а):
![]()
5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):

Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):

6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4с углеродным заместителем при С-2 и С-3:

Записывают структурные формулы новых изомеров:

7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:

8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:

Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.
Загрузить PDF
Загрузить PDF
Углеводороды, или соединения на основе цепочки из водорода и углерода, являются основой органической химии. Вам нужно научится наименовывать их согласно ИЮПАК, или Международному союзу теоритической и прикладной химии, который в настоящее время является признанным методом наименования углеводородных цепей.
Шаги
-

1
Узнайте, почему существуют правила. Правила ИЮПАК были созданы, чтобы поэтапно сократить старые названия (такие как толуол) и заменить их системой, которая будет последовательной, а также будет давать информацию о расположении заместителей (атомы или молекулы, присоединившиеся к углеводородной цепи).
-

2
Держите список префиксов под рукой. Эти префиксы помогут составить название вашему углеводороду. Они основаны на количестве углерода в главной цепи(а не все количество углерода в соединении). Например, CH3-CH3, называется этан. Возможно, ваш преподаватель не будет требовать от вас знания более 10 префиксов; но будьте готовы, если он или она все же потребуют больших знаний.
- 1: мет-
- 2: эт-
- 3: проп-
- 4: бут-
- 5: пент-
- 6: гекс-
- 7: гепт-
- 8: окт-
- 9: нон-
- 10: дек-
-

3
Практикуйтесь. Изучение системы ИЮПАК требует практики. Прочтите о следующих методах, чтобы рассмотреть несколько примеров, и затем найдите ссылки по практическим проблемам в разделе «Источники и ссылки» внизу страницы.
Реклама
-

1
Узнайте, что такое алканы. Алканы – это углеводородные цепи, которые не содержат двойной или тройной связи между молекулами. В названии алканов всегда должен быть суффикс -ан.
-

2
Нарисуйте молекулу. Вы можете нарисовать все символы молекулы или использовать структуру скелета. Выясните, каким способом требует рисовать ваш преподаватель, и придерживайтесь его.
-

3
Посчитайте количество углерода в главной цепи. Главная цепь – это самая длинная непрерывная углеродная цепь в молекуле. Считайте углерод, начиная с ближайшего заместителя группы. Каждый заместитель должен быть записан по номеру его расположения в цепи.
-

4
Составьте название в алфавитном порядке. Заместители должны быть названы в алфавитном порядке (за исключением таких приставок, как «ди-», «три-» или «тетра-»), но не в числовом.
- Если в углеводородной цепи два одинаковых заместителя, используйте приставку «ди-» перед его названием. Даже если они присоединены к одному и тому же углероду, дважды напишите этот номер.
Реклама
-

1
Узнайте, что такое алкены. Алкены – это углеводородные цепи, которые содержат одну или более двойных связей между молекулами углерода, но не содержат тройную связь. В названии алкенов всегда должен быть суффикс -ен.
-

2
Нарисуйте молекулу.
-

3
Найдите главную цепь. Главная цепь алкенов должна содержать какую-либо двойную связь между углеродом. Кроме того, она должна быть пронумерована с ближайшей двойной связи углерод-углерод от конца.
-

4
Отметьте, где расположена двойная связь. Кроме того, что вы отметили расположение заместителей, вы также должны отметить, где находится двойная связь. Сделайте это таким образом, чтобы использовалось наименьшее число в нумерации двойных связей.
-

5
Измените суффикс на основе числа двойных связей в главной цепи. Если в главной цепи две двойные связи, название будет оканчиваться на «-диен», если три – то на «-триен» и так далее.
-

6
Назовите заместители в алфавитном порядке. Как и в случае с алканами, вы должны перечислить заместители в алфавитном порядке в окончательном названии. Исключением являются такие приставки, как «ди-», «три-» или «тетра-».
Реклама
-

1
Узнайте, что такое алкины. Алкины – это углеводородные цепи, которые содержат одну или более тройных связей. В названии всегда должен стоять суффикс -ин.
-

2
Нарисуйте молекулу.
-

3
Найдите главную цепь. Главная цепь алкинов должна содержать какой-либо атом углерода с тройной связью. Нумерацию стоит начать с самой ближайшей тройной связи в конце цепи.
- Если вы работаете с молекулой, которая имеет и двойную, и тройную связь, начните нумерацию с ближайшей множественной связи в конце цепи.
-

4
Отметьте расположение тройной связи. Кроме того, что вы отметили расположение заместителей, вы также должны отметить местонахождение тройной связи. Сделайте это таким образом, чтобы использовалось наименьшее число на тройной связи при нумерации.
- Если ваша молекула также содержит и двойные связи, вы должны их отметить.
-

5
Измените суффикс на основании количества тройных связей в главной цепи. Если в главной цепи две тройные связи, то название будет оканчиваться на «-диин», три связи – «триин» и так далее.
-

6
Назовите заместители в алфавитном порядке. Как и в случае с алканами и алкенами, вы должны перечислить заместители в алфавитном порядке в окончательном названии. Исключением являются такие приставки, как «ди-», «три-» или «дельта-».
- Если в молекуле также содержатся двойные связи, назовите их в первую очередь.
Реклама
-

1
Выясните, какой вид циклических углеводородов вы рассматриваете. Процесс наименования циклических углеводородов работает, как и у нециклических – те, которые не содержат множественные связи, являются циклоалканами, с двойными связями – циклоалкенами, с тройными – циклоалкинами. К примеру, шести-углеродное кольцо без множественных связей называется циклогексаном.
-

2
Различайте названия циклических углеводородов. Есть несколько заметных различий между наименованием циклических и нециклических углеводородов:
- Так как все атомы углерода в кольце циклических углеводородов равны, вам не нужно нумеровать их, если в вашем циклической углеводороде только одна составляющая.
- Если в циклическом углеводороде содержится алкильная группа, большая и более сложная, чем само кольцо, то циклический углеводород может стать заместителем, а не главной цепью.
- Если на кольце два заместителя, пронумеруйте их в алфавитном порядке. Сперва (в алфавитном порядке) заместитель 1; затем нумерация происходит против часовой стрелки или по часовой стрелке –в зависимости от того, какой вариант даст меньшее число для второго заместителя.
- Если на кольце больше двух заместителей, то необходимо указать, что первый по алфавитному порядку присоединен к первому атому углерода. Другие нумеруются против или по часовой стрелке – в зависимости от того, какой вариант приведет к использованию меньшего количества чисел.
- Как и нециклические углеводороды, конечное название молекулы дается в алфавитном порядке, за исключением таких приставок, как «ди-», «три-» и «тетра-».
Реклама
-

1
Узнайте, что такое производные бензола. Производные бензола основаны на молекуле бензола, C6H6, в которой равномерно расположены три двойные связи.
-

2
Не нумеруйте углерод, если есть только один заместитель. Как и в случае с другими циклическими углеводородами, не требуется использование нумерации, если в кольце только один заместитель.
-

3
Узнайте о названиях бензола. Можно назвать вашу молекулу бензола как и любой другой циклический углеводород, начиная в алфавитном порядке с первого заместителя и присваивая номера по кругу. Однако есть некоторые специальные обозначения для расположения заместителей в молекуле бензола:
- Орто или о-: два заместителя расположены в 1 и 2.
- Мета или м-: два заместителя расположены в 1 и 3.
- Пара или п-: два заместителя расположены в 1 и 4.
-

4
Если в вашей молекуле бензола три заместителя, назовите ее как и обычный циклический углеводород.
Реклама
Советы
- Если есть два кандидата на длинную цепь, выберите ту, в которой больше разветвлений. Если же у вас две цепи с одинаковым количеством ответвлений, выберите ту, в которой ответвления ближе. Если же две цепи идентичны в отношении ответвлений, просто выберите одну из них.
- Если углеводород имеет ОН (гидроксильная группа) где-либо в связи, он является спиртом и в названии появляется суффикс «-ол» вместо «-ан».
- Продолжайте практиковаться! Когда вы столкнетесь с этими проблемами в тесте, знайте, что преподаватель, вероятно, составил вопросы так, что есть всего один верный ответ. Запомните правила и затем следуйте им шаг за шагом.
Реклама
Предупреждения
- Многие соединения называют распространенными названиями вместо использования системы ИЮПАК. Например, боковая цепь, которая будет называться по системе ИЮПАК 1-метилэтил, также известна как изопропиловая группа. Будьте осторожны, чтобы не смешать системы наименований.
Реклама
Об этой статье
Эту страницу просматривали 29 728 раз.
Была ли эта статья полезной?
Эта статья — о химических соединениях. О канадской алюминиевой компании см. Rio Tinto Alcan.
|
|
|
|
|
Химическая структура (вверху) и 3D-модель (внизу) метана — простейшего алкана |
Алка́ны (парафи́ны, также насы́щенные или преде́льные углеводоро́ды) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые (одинарные) связи и образующие гомологический ряд с общей формулой CnH2n+2.
Все алканы и алкены относятся к классу алифатических углеводородов. Алканы являются насыщенными углеводородами, то есть содержат максимально возможное число атомов водорода для заданного числа атомов углерода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С идентичны по форме и энергии, 4 связи направлены в вершины тетраэдра под углами 109°28′. Связи C—C представляют собой σ-связи, отличающиеся низкой полярностью и поляризуемостью. Длина связи C—C составляет 0,154 нм, длина связи C—H — 0,1087 нм.
Простейшим представителем класса является метан (CH4). Углеводород с самой длинной цепью — нонаконтатриктан C390H782 синтезировали в 1985 году английские химики И. Бидд и М. К. Уайтинг[1].
Номенклатура[править | править код]
Рациональная[править | править код]
Выбирается один из атомов углеродной цепи, он считается замещённым метаном, и относительно него строится название «алкил1алкил2алкил3алкил4метан», например:

- а: н-бутил-втор-бутилизобутилметан
- б: триизопропилметан
- в: триэтилпропилметан
Систематическая ИЮПАК[править | править код]
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь, при этом нумерация этой цепи начинается со стороны ближайшего к концу цепи заместителя. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.[2]
Например:

2,6,6-триметил-3-этилгептан (слева направо) / 2,2,6-триметил-5-этилгептан (справа налево)
При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра является наименьшей. Таким образом, правильное название — 2,2,6-триметил-5-этилгептан.
Гомологический ряд и изомерия[править | править код]
Алканы образуют гомологический ряд.
| Гомологический ряд алканов (первые 10 членов) | ||
|---|---|---|
| Метан | CH4 | CH4 |
| Этан | CH3—CH3 | C2H6 |
| Пропан | CH3—CH2—CH3 | C3H8 |
| Бутан | CH3—CH2—CH2—CH3 | C4H10 |
| Пентан | CH3—CH2—CH2—CH2—CH3 | C5H12 |
| Гексан | CH3—CH2—CH2—CH2—CH2—CH3 | C6H14 |
| Гептан | CH3—CH2—CH2—CH2—CH2—CH2—CH3 | C7H16 |
| Октан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C8H18 |
| Нонан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C9H20 |
| Декан | CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3 | C10H22 |
Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета, а начиная с C7H16 — также оптической изомерией[3]. Число структурных изомеров алканов CnH2n+2 в зависимости от числа атомов углерода n без учёта стереоизомерии[4][5] и с учётом стереоизомерии[6]:
| n | Число изомеров | С учётом стереоизомерии |
|---|---|---|
| 4 | 2 | 2 |
| 5 | 3 | 3 |
| 6 | 5 | 5 |
| 7 | 9 | 11 |
| 8 | 18 | 24 |
| 9 | 35 | 55 |
| 10 | 75 | 136 |
| 11 | 159 | 345 |
| 12 | 355 | 900 |
| 13 | 802 | 2412 |
| 14 | 1858 | 6563 |
| 15 | 4347 | 18 127 |
| 20 | 366 319 | 3 396 844 |
| 25 | 36 797 588 | 749 329 719 |
| 30 | 4 111 846 763 | 182 896 187 256 |
Число структурных изомеров низших углеводородов до C14H30 было установлено прямым подсчётом; в 1931 году был разработан рекурсивный метод подсчёта числа изомеров[7]. Какой-либо простой связи между числом атомов углерода n и числом изомеров обнаружено не было[7]. При 
Физические свойства[править | править код]
[источник не указан 1008 дней]
- Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При стандартных условиях, установленных ИЮПАК (давление 105 Па, температура 0 °C), неразветвлённые алканы с CH4 до C4H10 являются газами, с C5H12 до C15H32 — жидкостями, а начиная с C16H34 и далее — твёрдыми веществами.
- Температуры плавления и кипения понижаются от менее разветвлённых к более разветвлённым. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
- Газообразные и твердые алканы не пахнут, некоторые жидкие алканы обладают характерным «бензиновым» запахом.
- Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) используются как растворители.
| n | Название | Тпл, °C | Ткип, °C | Плотность, г/см3 | Показатель преломления |
|---|---|---|---|---|---|
| 1 | Метан | −182,48 | −161,5 | 0,416 при Tкип | |
| 2 | Этан | −183,3 | −88,63 | 0,546 при Tкип | |
| 3 | Пропан | −187,7 | −42,1 | 0,585 при Tкип | |
| 4 | Бутан | −138,35 | −0,5 | 0,6 при Tкип | 1,3326 |
| Изобутан | −159,60 | −11,73 | 0,5510 при Tкип | ||
| 5 | Пентан | −129,7 | 36,07 | 0,6262 | 1,3575 |
| 6 | Гексан | −95,3 | 68,7 | 0,6594 | 1,3749 |
| 7 | Гептан | −90,6 | 98,4 | 0,6795 | 1,3876 |
| 8 | Октан | −55,8 | 125,7 | 0,7025 | 1,3974 |
| 9 | Нонан | −54 | 150,8 | 0,718 | 1,4054 |
| 10 | Декан | −29,7 | 174,1 | 0,730 | 1,4119 |
| 11 | Ундекан | −25,6 | 195,9 | 0,7402 | 1,4151 |
| 12 | Додекан | −9,6 | 216,3 | 0,7487 | 1.4216 |
| 13 | Тридекан | −5,4 | 235,5 | 0,7564 | 1,4256 |
| 14 | Тетрадекан | 5,9 | 253,6 | 0,7628 | 1,4289 |
| 15 | Пентадекан | 9,9 | 270,6 | 0,7685 | 1,4310 |
| 16 | Гексадекан | 18,2 | 286,8 | 0,7734 | 1,4345 |
| 17 | Гептадекан | 22,0 | 301,9 | 0,778* | 1,4369* |
| 18 | Октадекан | 28,2 | 316,1 | 0,7819* | 1,4390* |
| 19 | Нонадекан | 32,1 | 329,76 | 0,7855* | 1,4409* |
| 20 | Эйкозан | 36,8 | 342,7 | 0,7887* | 1,4426* |
| 21 | Генэйкозан | 40,5 | 355,1 | 0,7917* | 1,4441* |
| 22 | Докозан | 44,4 | 367,0 | 0,7944* | 1,4455* |
| 23 | Трикозан | 47,6 | 380,2 | 0,7969* | 1,4468* |
| 24 | Тетракозан | 50,9 | 389,2 | 0,7991* | 1,4480* |
| 25 | Пентакозан | 53,7 | 401,0 | 0,8012* | 1,4491* |
| 26 | Гексакозан | 57 | 262 (15 мм рт. ст.) | 0,778 | |
| 27 | Гептакозан | 60 | 270 (15 мм рт. ст.) | 0,780 | |
| 28 | Октакозан | 61,1 | 280 (15 мм рт. ст.) | 0,807 | |
| 29 | Нонакозан | 64 | 286 (15 мм рт. ст.) | 0,808 | |
| 30 | Триаконтан | 65,8 | 446,4 | 0,897* | 1,4536* |
| 31 | Гентриаконтан | 67,9 | 455 | 0,8111* | 1,4543* |
| 32 | Дотриаконтан | 69,7 | 463 | 0,8124* | 1,4550* |
| 33 | Тритриаконтан | 71 | 474 | 0,811 | |
| 34 | Тетратриаконтан | 73,1 | 478 | 0,8148* | 1,4563* |
| 35 | Пентатриаконтан | 74,7 | 486 | 0,8159* | 1,4568* |
| 36 | Гексатриаконтан | 75 | 265 при 130 Па | 0,814 | |
| 37 | Гептатриаконтан | 77,4 | 504,14 | 0,815 | |
| 38 | Октатриаконтан | 79 | 510,93 | 0,816 | |
| 39 | Нонатриаконтан | 78 | 517,51 | 0,817 | |
| 40 | Тетраконтан | 81,4 | 523,88 | 0,817 | |
| 41 | Гентетраконтан | 80,7 | 530,75 | 0,818 | |
| 42 | Дотетраконтан | 82,9 | 536,07 | 0,819 | |
| 43 | Тритетраконтан | 85,3 | 541,91 | 0,820 | |
| 44 | Тетратетраконтан | 86,4 | 547,57 | 0,820 | |
| 45 | Пентатетраконтан | 553,1 | 0,821 | ||
| 46 | Гексатетраконтан | 558,42 | 0,822 | ||
| 47 | Гептатетраконтан | 563,6 | 0,822 | ||
| 48 | Октатетраконтан | 568,68 | 0,823 | ||
| 49 | Нонатетраконтан | 573,6 | 0,823 | ||
| 50 | Пентаконтан | 93 | 421 | 0,824 | |
| 51 | Генпентаконтан | 583 | 0,824 | ||
| 52 | Допентаконтан | 94 | 587,6 | 0,825 | |
| 53 | Трипентаконтан | 592 | 0,825 | ||
| 54 | Тетрапентаконтан | 95 | 596,38 | 0,826 | |
| … | … | … | … | … | … |
| 60 | Гексаконтан | 98,9 | |||
| … | … | … | … | … | … |
| 70 | Гептаконтан | 105,3 | |||
| … | … | … | … | … | … |
| 100 | Гектан | 115,2 | |||
| … | … | … | … | … | … |
| 150 | Пентаконтагектан | 123 | |||
| … | … | … | … | … | … |
| 390 | Нонаконтатриктан | 132 |
Примечание к таблице: * отмечены значения, полученные для переохлаждённой жидкости.
Спектральные свойства[править | править код]
ИК-спектроскопия[править | править код]
В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С—Н в области 2850—3000 см−1. Частоты валентных колебаний связи С—С переменны и часто малоинтенсивны. Характеристические деформационные колебания в связи С—Н в метильной и метиленовой группах обычно лежат в интервале 1400—1470 см−1, однако метильная группа даёт в спектрах слабую полосу при 1380 см−1.
УФ-спектроскопия[править | править код]
Чистые алканы не поглощают излучение в ультрафиолетовой области выше 2000 Å и по этой причине часто оказываются отличными растворителями для измерения УФ-спектров других соединений.
Химические свойства[править | править код]
Алканы имеют низкую химическую активность. Это объясняется тем, что одинарные связи C—H и C—C относительно прочны, и их сложно разрушить. Поскольку связи С—C неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Реакции радикального замещения[править | править код]
Галогенирование[править | править код]
Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-излучением или нагреть.
Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от хлорметана до тетрахлорметана. Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного, и в 2 раза меньше, чем вторичного. Таким образом, хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Галогенирование происходит тем легче, чем длиннее углеродная цепь н-алкана. В этом же направлении уменьшается энергия ионизации молекулы вещества, то есть, алкан легче становится донором электрона.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно с последовательным образованием хлорметана, дихлорметана, хлороформа и тетрахлорметана: за один этап замещается не более одного атома водорода:
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, отрывая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Цепной механизм галогенирования:
1) Инициирование
2) Рост цепи
3) Обрыв цепи
Бромирование алканов отличается от хлорирования более высокой стереоселективностью из-за большей разницы в скоростях бромирования третичных, вторичных и первичных атомов углерода при низких температурах.
Иодирование алканов иодом не происходит, получение иодидов прямым иодированием осуществить нельзя.
С фтором и хлором реакция может протекать со взрывом, в таких случаях галоген разбавляют азотом или подходящим растворителем.
Сульфирование[править | править код]
При одновременном действии на алканы оксидом серы (IV) и кислородом, при ультрафиолетовом облучении или при участии веществ, являющихся донорами свободных радикалов (диазометан, органические перекиси), протекает реакция сульфирования с образованием алкилсульфокислот:
Сульфохлорирование (реакция Рида)[править | править код]

При облучении ультрафиолетовым излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Развитие цепного процесса:
Легче всего сульфохлорируются углеводороды линейного строения, в отличие от реакций хлорирования и нитрования.[9]
Образовавшиеся сульфонилхлориды широко применяются в производстве ПАВ.
Нитрование[править | править код]
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных:
Имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Реакции окисления[править | править код]
- Автоокисление
Окисление алканов в жидкой фазе протекает по свободно-радикальному механизму и приводит к образованию гидропероксидов, продуктов их разложения и взаимодействия с исходным алканом. Схема основной реакции автоокисления:
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается оксид углерода(II) или уголь (в зависимости от концентрации кислорода).
- Каталитическое окисление
В реакциях каталитического окисления алканов могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
Реакция окисления алканов диметилдиоксираном:
Механизм реакций получения кислот путём каталитического окисления и расщепления алканов показан ниже на примере получения из бутана уксусной кислоты:
Термические превращения алканов[править | править код]
- Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
- Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
Во время крекинга одна из связей (С-С) разрывается, образуя два радикала. Далее одновременно происходят три процесса, вследствие которых реакция дает множество различных продуктов:
1) Рекомбинация:
2) Диспропорционирование:
3) β-распад (разрыв связи (C-H)):
- Дегидрирование
1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3, например, образование этилена из этана:
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов, например, бутадиена-1,3 и бутадиена-1,2 из бутана:
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
Конверсия метана[править | править код]
В присутствии никелевого катализатора протекает реакция:
Продукт этой реакции (смесь CO и H2) называется «синтез-газом».
Реакции электрофильного замещения[править | править код]
Изомеризация:
Под действием катализатора (например, AlCl3) происходит изомеризация алкана: например, бутан (C4H10), взаимодействуя с хлоридом алюминия (AlCl3), превращается из н-бутана в 2-метилпропан.
С марганцевокислым калием (KMnO4) и бромной водой (раствор Br2 в воде) алканы не взаимодействуют.
Нахождение в природе[править | править код]
Нахождение в космосе[править | править код]
В небольших количествах алканы содержатся в атмосфере внешних газовых планет Солнечной системы: на Юпитере — 0,1 % метана, 0,0002 % этана, на Сатурне метана 0,2 %, а этана — 0,0005 %, метана и этана на Уране — соответственно 1,99 % и 0,00025 %, на Нептуне же — 1,5 % и 1,5⋅10−10, соответственно[10]. На спутнике Сатурна Титане метан (1,6 %) содержится в жидком виде, причём, подобно воде, находящейся на Земле в круговороте, на Титане существуют (полярные) озёра метана (в смеси с этаном) и метановые дожди. К тому же, как предполагается, метан поступает в атмосферу Титана в результате деятельности вулкана[11]. Кроме того, метан найден в хвосте кометы Хиякутаке и в метеоритах (углистых хондритах). Предполагается также, что метановые и этановые кометные льды образовались в межзвёздном пространстве[12].
Нахождение на Земле[править | править код]

В земной атмосфере метан присутствует в очень небольших количествах (около 0,0001 %), он производится некоторыми археями (архебактериями), в частности, находящимися в кишечном тракте крупного рогатого скота. Промышленное значение имеют месторождения низших алканов в форме природного газа, нефти и, вероятно, в будущем — газовых гидратов (найдены в областях вечной мерзлоты и под океанами). Также метан содержится в биогазе.
Высшие алканы содержатся в кутикуле растений, предохраняя их от высыхания, паразитных грибков и мелких растительноядных организмов. Это обыкновенно цепи с нечётным числом атомов углерода, образующиеся при декарбоксилировании жирных кислот с чётным количеством углеродных атомов. У животных алканы встречаются в качестве феромонов у насекомых, в частности у мухи цеце (2-метилгептадекан C18H38, 17,21-диметилгептатриаконтан C39H80, 15,19-диметилгептатриаконтан C39H80 и 15,19,23-триметилгептатриаконтан C40H82). Некоторые орхидеи при помощи алканов-феромонов привлекают опылителей.
Получение[править | править код]
Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно.
Восстановление галогенпроизводных алканов:
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы[13]:
Восстановление иодалканов происходит при нагревании последних с иодоводородной кислотой:
Для восстановления галогеналканов пригодны также амальгама натрия, гидриды металлов, натрий в спирте, цинк в соляной кислоте или цинк в спирте[13]
Восстановление спиртов:
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например, проходит реакция восстановления бутанола (C4H9OH), проходящую в присутствии LiAlH4. При этом выделяется вода[14].
Восстановление карбонильных соединений
Реакция Кижнера — Вольфа:
Реакцию проводят в избытке гидразина в высококипящем растворителе в присутствии KOH[15].
Реакция Клемменсена[16]:
Гидрирование непредельных углеводородов
- Из алкенов
- Из алкинов
Катализатором реакции являются соединения никеля, платины или палладия[17].
Синтез Кольбе
При электролизе солей карбоновых кислот, анион кислоты — RCOO− перемещается к аноду, и там, отдавая электрон превращается в неустойчивый радикал RCOO•, который сразу декарбоксилируется. Радикал R• стабилизируется путём сдваивания с подобным радикалом, и образуется R—R[18]. Например:
Газификация твёрдого топлива (Процессы Бертло, Шрёдера, Бергиуса)
Проходит при повышенной температуре и давлении. Катализатор — Ni (для Бертло), Mo (для Шрёдера) или без катализатора (для Бергиуса):
Реакция Вюрца
Реакция идёт в ТГФ при температуре −80 °C[19]. При взаимодействии R и R` возможно образование смеси продуктов (R—R, R`—R`, R—R`)
Синтез Фишера — Тропша
Реакция Дюма[править | править код]
Получением алканов с помощью декарбоксилирования солей карбоновых кислот, при сплавлении со щелочью (обычно NaOH или KOH):

Гидролиз карбида алюминия[20]

Биологическое действие[править | править код]
Низшие алканы обладают наркотическим действием, вызывают асфиксию, раздражают органы дыхания. При хроническом действии алканы нарушают работу нервной системы, что проявляется в виде бессонницы, брадикардии, повышенной утомляемости и функциональных неврозов. Вследствие раздражающего действия газов при подострых, острых и хронических отравлениях развивается пневмония и отёк лёгких.
Примечания[править | править код]
- ↑ Bidd, Ilesh and Whiting, Mark C. The synthesis of pure n-paraffins with chain-lengths between one and four hundred. J. Chem. Soc., Chem. Commun., Issue 19, 1985, p. 543—544
- ↑ Дерябина Г. И., Кантария Г. В. 2.4.2. Правила построения названий алканов по систематической международной номенклатуре ИЮПАК (недоступная ссылка — история). Интерактивный мультимедиа-учебник «Органическая химия». Кафедра органической, биоорганической и медицинской химии СамГУ. Дата обращения: 10 октября 2012. Архивировано 14 октября 2012 года.
- ↑ Химическая энциклопедия, т. 3, 1992, с. 177.
- ↑ Физер Л., Физер М. Органическая химия, т. 1, 1966, с. 125.
- ↑ Последовательность A000602 в OEIS = Number of n-node unrooted quartic trees; number of n-carbon alkanes C(n)H(2n+2) ignoring stereoisomers
- ↑ Последовательность A000628 в OEIS = Number of n-node unrooted steric quartic trees; number of n-carbon alkanes C(n)H(2n+2) taking stereoisomers into account
- ↑ 1 2 Henze Henry R., Blair Charles M. The number of isomeric hydrocarbons of the methane series (англ.) // Journal of the American Chemical Society. — ACS Publishers, 1931. — Vol. 53, no. 8. — P. 3077–3085. — doi:10.1021/ja01359a034.
- ↑ G. Pólya. Kombinatorische Anzahlbestimmungen für Gruppen, Graphen und chemische Verbindungen // Acta Mathematica. — 1937. — Vol. 68. — P. 145–254. — doi:10.1007/BF02546665.
- ↑ Перекалин В. В., Зонис С. А. Органическая химия
- ↑ (англ.)Dr. David R. Williams. Jupiter Fact Sheet (англ.) (недоступная ссылка — история). NASA (2007). Дата обращения: 6 октября 2010. Архивировано 5 октября 2011 года.
- ↑ (англ.)Emily Lakdawalla. Titan: Arizona in an Icebox? Дата обращения: 21 января 2004. Архивировано из оригинала 6 апреля 2008 года.
- ↑ (англ.)Mumma, M.J.; Disanti, M.A., dello Russo, N., Fomenkova, M., Magee-Sauer, K., Kaminski, C.D., and D.X. Xie. Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin (англ.) // Science : journal. — 1996. — Vol. 272, no. 5266. — P. 1310. — doi:10.1126/science.272.5266.1310. — PMID 8650540.
- ↑ 1 2 Химический каталог >> Органическая химия стр 63
- ↑ СПИРТЫ — статья из энциклопедии «Кругосвет»
- ↑ Кижнера — Вольфа реакция // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ http://www.cnshb.ru/AKDiL/0048/base/RK/160003.shtm
- ↑ Катализаторы гидрирования. Дата обращения: 10 июня 2009. Архивировано из оригинала 22 апреля 2009 года.
- ↑ Кольбе реакция // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ ВЮРЦА РЕАКЦИЯ. Дата обращения: 10 июня 2009. Архивировано из оригинала 3 мая 2011 года.
- ↑ карбид, гидролиз его – Справочник химика 21. chem21.info. Дата обращения: 12 апреля 2018.
Литература[править | править код]
- Активация и каталитические реакции алканов / Пер. с англ.; под ред. К. Хилла. — М.: Мир, 1992.
- Общая токсикология / Под ред. Лойта А. О.. — СПб.: ЭЛБИ-СПб., 2006.
- Петров Ал. А. Химия алканов. — М.: Наука, 1974. — 243 с.
- Пойа Д. Комбинаторные вычисления для групп, графов и химических соединений // Перечислительные задачи комбинаторного анализа. — М.: Мир, 1979. — С. 36—138.
- Пэрэушану В. Производство и использование углеводородов. — М.: Химия, 1987.
- Рудаков Е. С. Реакции алканов с окислителями, металлокомплексами и радикалами в растворах. — Киев: Наукова думка, 1985.
- Физер Л., Физер М. Органическая химия. Углубленный курс. — М., 1966. — Т. 1. — 680 с.
- Хейнс А. Методы окисления органических соединений. Алканы, алкены, алкины и арены. — М.: Мир, 1988.
- Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди сульфиды — Полимерные красители. — 640 с. — ISBN 5-85270-039-8.
- Перекалин В.В., Зонис С. А. Органическая химия. — 4-е изд., переработанное. — М.: Просвещение, 1982. — 560 с.
- Неотложная помощь при острых отравлениях. Справочник по токсикологии / Под ред. академика АМН СССР С. Н. Голикова. — М.: Медицина, 1977.
Ссылки[править | править код]
- Получение алканов
- Особенности строения, реакционной способности и методы синтеза алканов
- Электронный учебник для средней школы по органической химии






![{displaystyle {ce {mathsf {Cl{text{:}}Cl->[{hnu }]Cl{text{·}}+{text{·}}Cl}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/541855de60e8ee945e8eeb2b311c20d1a4a56830)














![mathsf{CH_4 xrightarrow[]{^ot > 1000 ^oC} C + 2H_2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f10d34c7bcb0601c0c53767fc4a8cde04bbd900)

![mathsf{2CH_4 xrightarrow[]{^ot > 1500 ^oC} C_2H_2 + 3H_2}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b09aec162fc81c5ca99e8746c44442cac12cd87)














![mathsf{CH_3CH_2CH_2CH_2OH xrightarrow[]{LiAlH_4} CH_3CH_2CH_2CH_3 + H_2O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/710e85520863ccedbc9aec5cba5aef8754924ca6)