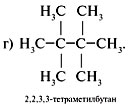
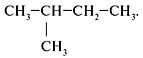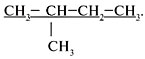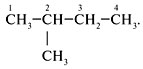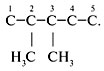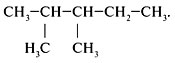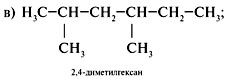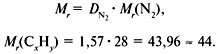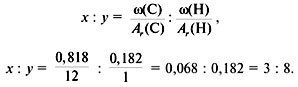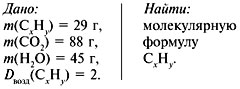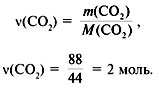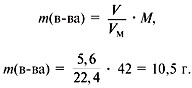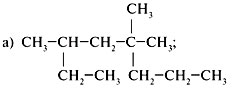Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
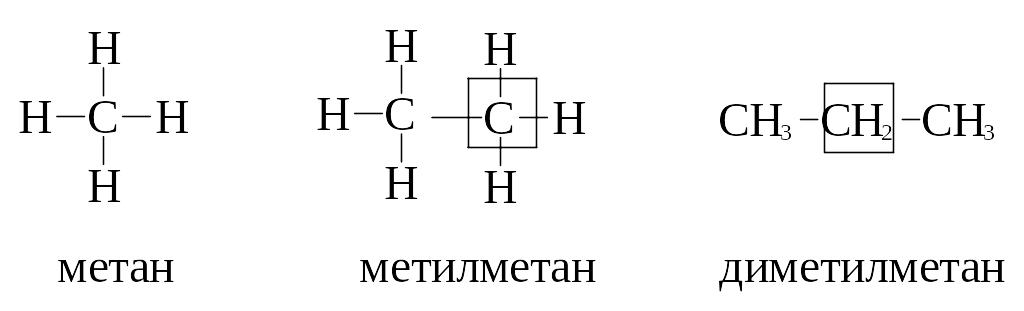
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:
Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:
Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.
2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:
3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |
Найди девять отличий |
Правила составления изомеров на примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:
4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность С – IV. В результате получают изомер а):
5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):
Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):
6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4с углеродным заместителем при С-2 и С-3:
Записывают структурные формулы новых изомеров:
7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:
8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:
Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.
CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
В основу научной
классификации и номенклатуры органических
соединений положены принципы химического
строения А.М. Бутлерова. Существование
огромного числа изомерных углеводородов
требует точной и ясной номенклатуры
для того, чтобы по структурной формуле
можно было назвать, а по названию написать
структурную формулу соединения. Для
названия изомеров в органической химии
используются следующие номенклатуры:
эмпирическая (тривиальная), рациональная
и систематическая.
Эмпирические
(тривиальные) названия не дают
представления о химической природе
соединения, не расшифровывают его
строения. Происхождение их связано с
природными источниками, из которых
данные вещества были выделены (винный
спирт, уксусная кислота, мочевина,
молочная кислота, винная кислота), с
наиболее характерными свойствами
(индиго, какодил, гремучая кислота) или
со способами получения (серный эфир,
пировиноградная кислота). Отдельные
соединения названы по имени исследовавших
их ученых (кетон Михлера).
В ряду алканов
первые четыре представителя с
неразветвленной цепью имеют тривиальные
названия.
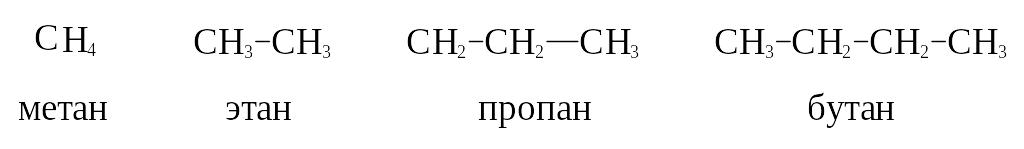
Все названия
углеводородов, начиная с С5,
являются систематическими.
Рациональная
номенклатура
возникла в середине XIX
века и основана на принципе научной
систематики соединений: название
соединений должно отражать их химическое
строение.
По рациональной
номенклатуре за основу наименования
органического соединения обычно
принимают название наиболее простого
(чаще всего первого) члена гомологического
ряда. Все остальные соединения
рассматривают как его производные,
образованные замещением в нем атомов
водорода углеводородными радикалами,
атомами или функциональными группами.
Углеводородный
радикал –
это остаток молекулы углеводорода после
удаления одного атома водорода. Все
радикалы алканов называют алкилами,
их названия
образуются из названий соответствующих
предельных углеводородов заменой
окончания ан
на ил:
СН4
метан СН3– метил
С2Н6 этан С2Н5– этил
С3Н8
пропан С3Н7– пропил
С4Н10 бутан С4Н9– бутил
С5Н12 пентан С5Н11– амил
(пентил)
С6Н14 гексан
С6Н13– гексил
С7Н16
гептан С7Н15– гептил
Начиная с пропана,
появляются изомерные радикалы:
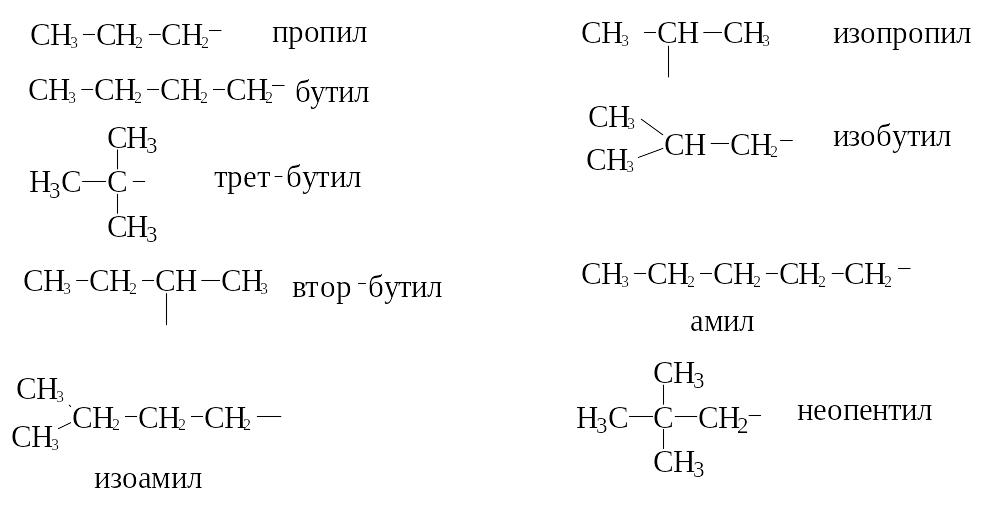
В рациональной
номенклатуре алканы рассматривают как
замещенные метана, остатком которого
считают атом углерода, наиболее замещенный
радикалами. Перед словом метан
перечисляют по старшинству (в порядке
увеличения числа углеродных атомов)
названия радикалов, связанных с
центральным углеродным атомом. Если в
молекуле имеется несколько одинаковых
радикалов, перед их названием ставится
приставка, образованная от греческих
числительных (ди -два, три – три, тетра –
четыре).
Например:
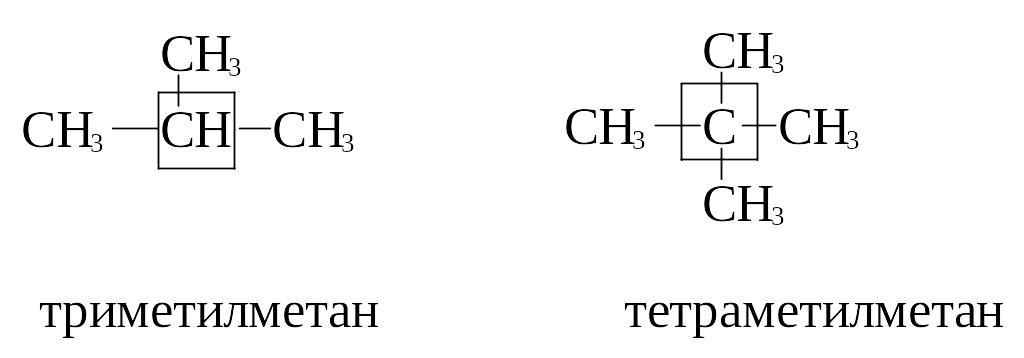
Систематическая
номенклатура (ИЮПАК).
В 1892 г. в г.
Женеве на Международном конгрессе
представителей химических обществ была
утверждена новая номенклатура органических
соединений, которая стала называться
женевской. После внесения в эту
номенклатуру некоторых изменений и
дополнений на международных форумах
Международного союза чистой и прикладной
химии “ИЮПАК” она стала называться
систематической номенклатурой.
Предельным
углеводородам было присвоено название
алканы.
Были приняты следующие правила
номенклатуры:
-
Названия предельных
углеводородов с неразветвленной цепью
образованы от греческих числительных
с окончанием ан:
пентан,
гексан, гептан, нонан, декан и т.д., за
исключением первых четырех (метан,
этан, пропан, бутан).
-
В основу названия
алкана с разветвленной цепью положено
название углеводорода с самой длинной
нормальной цепью, боковые цепи называются
с помощью соответствующих радикалов.
Место присоединения боковой цепи к
главной указывается номером перед
названием радикала. -
Нумерацию главной
цепи начинают с того конца, к которому
ближе боковая цепь; при наличии
симметрично расположенных боковых
цепей – с той стороны, к которой ближе
более простой радикал. Правильной
считается нумерация, при которой сумма
цифр в соединении минимальна.
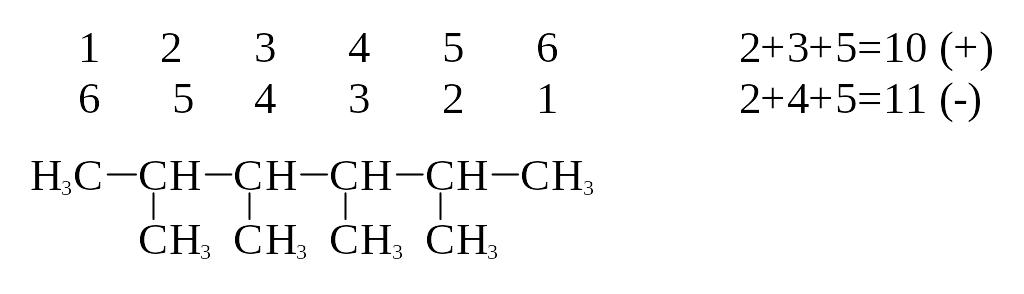
-
Боковые цепи
(радикалы) перечисляются в порядке
увеличения их сложности; при наличии
нескольких одинаковых заместителей
их количество указывают перед названием
радикала при помощи греческих числительных
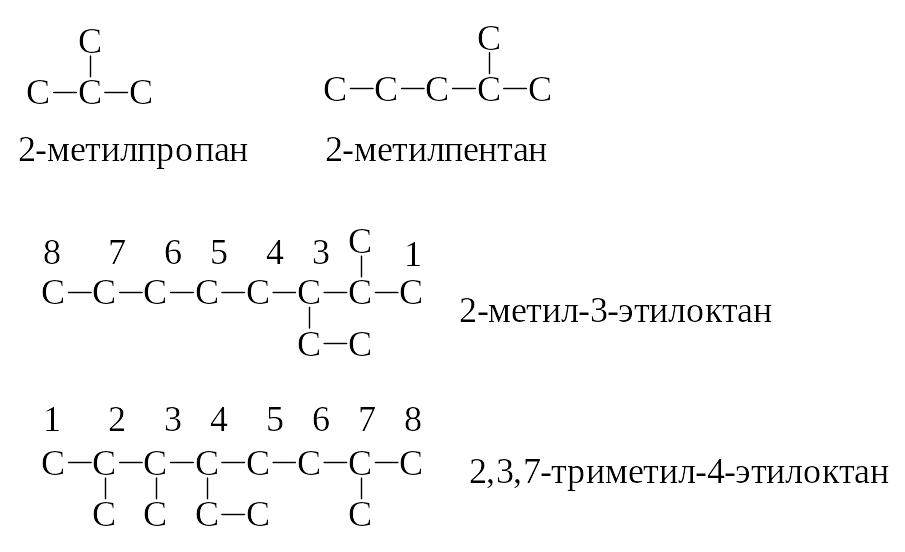
– ди-, три-, тетра-, пента-, гекса- … Цифры
располагают по возрастанию, разделяют
друг от друга запятыми. Цифры в названии
выделяют тире. Примеры:
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
29.03.201621.08 Mб19Альбом. Блок-схемы к главам Градостроительного кодекса Российской Федерации с комментариями к ним.pdf
Загрузить PDF
Загрузить PDF
Углеводороды, или соединения на основе цепочки из водорода и углерода, являются основой органической химии. Вам нужно научится наименовывать их согласно ИЮПАК, или Международному союзу теоритической и прикладной химии, который в настоящее время является признанным методом наименования углеводородных цепей.
Шаги
-
1
Узнайте, почему существуют правила. Правила ИЮПАК были созданы, чтобы поэтапно сократить старые названия (такие как толуол) и заменить их системой, которая будет последовательной, а также будет давать информацию о расположении заместителей (атомы или молекулы, присоединившиеся к углеводородной цепи).
-
2
Держите список префиксов под рукой. Эти префиксы помогут составить название вашему углеводороду. Они основаны на количестве углерода в главной цепи(а не все количество углерода в соединении). Например, CH3-CH3, называется этан. Возможно, ваш преподаватель не будет требовать от вас знания более 10 префиксов; но будьте готовы, если он или она все же потребуют больших знаний.
- 1: мет-
- 2: эт-
- 3: проп-
- 4: бут-
- 5: пент-
- 6: гекс-
- 7: гепт-
- 8: окт-
- 9: нон-
- 10: дек-
-
3
Практикуйтесь. Изучение системы ИЮПАК требует практики. Прочтите о следующих методах, чтобы рассмотреть несколько примеров, и затем найдите ссылки по практическим проблемам в разделе «Источники и ссылки» внизу страницы.
Реклама
-
1
Узнайте, что такое алканы. Алканы – это углеводородные цепи, которые не содержат двойной или тройной связи между молекулами. В названии алканов всегда должен быть суффикс -ан.
-
2
Нарисуйте молекулу. Вы можете нарисовать все символы молекулы или использовать структуру скелета. Выясните, каким способом требует рисовать ваш преподаватель, и придерживайтесь его.
-
3
Посчитайте количество углерода в главной цепи. Главная цепь – это самая длинная непрерывная углеродная цепь в молекуле. Считайте углерод, начиная с ближайшего заместителя группы. Каждый заместитель должен быть записан по номеру его расположения в цепи.
-
4
Составьте название в алфавитном порядке. Заместители должны быть названы в алфавитном порядке (за исключением таких приставок, как «ди-», «три-» или «тетра-»), но не в числовом.
- Если в углеводородной цепи два одинаковых заместителя, используйте приставку «ди-» перед его названием. Даже если они присоединены к одному и тому же углероду, дважды напишите этот номер.
Реклама
-
1
Узнайте, что такое алкены. Алкены – это углеводородные цепи, которые содержат одну или более двойных связей между молекулами углерода, но не содержат тройную связь. В названии алкенов всегда должен быть суффикс -ен.
-
2
Нарисуйте молекулу.
-
3
Найдите главную цепь. Главная цепь алкенов должна содержать какую-либо двойную связь между углеродом. Кроме того, она должна быть пронумерована с ближайшей двойной связи углерод-углерод от конца.
-
4
Отметьте, где расположена двойная связь. Кроме того, что вы отметили расположение заместителей, вы также должны отметить, где находится двойная связь. Сделайте это таким образом, чтобы использовалось наименьшее число в нумерации двойных связей.
-
5
Измените суффикс на основе числа двойных связей в главной цепи. Если в главной цепи две двойные связи, название будет оканчиваться на «-диен», если три – то на «-триен» и так далее.
-
6
Назовите заместители в алфавитном порядке. Как и в случае с алканами, вы должны перечислить заместители в алфавитном порядке в окончательном названии. Исключением являются такие приставки, как «ди-», «три-» или «тетра-».
Реклама
-
1
Узнайте, что такое алкины. Алкины – это углеводородные цепи, которые содержат одну или более тройных связей. В названии всегда должен стоять суффикс -ин.
-
2
Нарисуйте молекулу.
-
3
Найдите главную цепь. Главная цепь алкинов должна содержать какой-либо атом углерода с тройной связью. Нумерацию стоит начать с самой ближайшей тройной связи в конце цепи.
- Если вы работаете с молекулой, которая имеет и двойную, и тройную связь, начните нумерацию с ближайшей множественной связи в конце цепи.
-
4
Отметьте расположение тройной связи. Кроме того, что вы отметили расположение заместителей, вы также должны отметить местонахождение тройной связи. Сделайте это таким образом, чтобы использовалось наименьшее число на тройной связи при нумерации.
- Если ваша молекула также содержит и двойные связи, вы должны их отметить.
-
5
Измените суффикс на основании количества тройных связей в главной цепи. Если в главной цепи две тройные связи, то название будет оканчиваться на «-диин», три связи – «триин» и так далее.
-
6
Назовите заместители в алфавитном порядке. Как и в случае с алканами и алкенами, вы должны перечислить заместители в алфавитном порядке в окончательном названии. Исключением являются такие приставки, как «ди-», «три-» или «дельта-».
- Если в молекуле также содержатся двойные связи, назовите их в первую очередь.
Реклама
-
1
Выясните, какой вид циклических углеводородов вы рассматриваете. Процесс наименования циклических углеводородов работает, как и у нециклических – те, которые не содержат множественные связи, являются циклоалканами, с двойными связями – циклоалкенами, с тройными – циклоалкинами. К примеру, шести-углеродное кольцо без множественных связей называется циклогексаном.
-
2
Различайте названия циклических углеводородов. Есть несколько заметных различий между наименованием циклических и нециклических углеводородов:
- Так как все атомы углерода в кольце циклических углеводородов равны, вам не нужно нумеровать их, если в вашем циклической углеводороде только одна составляющая.
- Если в циклическом углеводороде содержится алкильная группа, большая и более сложная, чем само кольцо, то циклический углеводород может стать заместителем, а не главной цепью.
- Если на кольце два заместителя, пронумеруйте их в алфавитном порядке. Сперва (в алфавитном порядке) заместитель 1; затем нумерация происходит против часовой стрелки или по часовой стрелке –в зависимости от того, какой вариант даст меньшее число для второго заместителя.
- Если на кольце больше двух заместителей, то необходимо указать, что первый по алфавитному порядку присоединен к первому атому углерода. Другие нумеруются против или по часовой стрелке – в зависимости от того, какой вариант приведет к использованию меньшего количества чисел.
- Как и нециклические углеводороды, конечное название молекулы дается в алфавитном порядке, за исключением таких приставок, как «ди-», «три-» и «тетра-».
Реклама
-
1
Узнайте, что такое производные бензола. Производные бензола основаны на молекуле бензола, C6H6, в которой равномерно расположены три двойные связи.
-
2
Не нумеруйте углерод, если есть только один заместитель. Как и в случае с другими циклическими углеводородами, не требуется использование нумерации, если в кольце только один заместитель.
-
3
Узнайте о названиях бензола. Можно назвать вашу молекулу бензола как и любой другой циклический углеводород, начиная в алфавитном порядке с первого заместителя и присваивая номера по кругу. Однако есть некоторые специальные обозначения для расположения заместителей в молекуле бензола:
- Орто или о-: два заместителя расположены в 1 и 2.
- Мета или м-: два заместителя расположены в 1 и 3.
- Пара или п-: два заместителя расположены в 1 и 4.
-
4
Если в вашей молекуле бензола три заместителя, назовите ее как и обычный циклический углеводород.
Реклама
Советы
- Если есть два кандидата на длинную цепь, выберите ту, в которой больше разветвлений. Если же у вас две цепи с одинаковым количеством ответвлений, выберите ту, в которой ответвления ближе. Если же две цепи идентичны в отношении ответвлений, просто выберите одну из них.
- Если углеводород имеет ОН (гидроксильная группа) где-либо в связи, он является спиртом и в названии появляется суффикс «-ол» вместо «-ан».
- Продолжайте практиковаться! Когда вы столкнетесь с этими проблемами в тесте, знайте, что преподаватель, вероятно, составил вопросы так, что есть всего один верный ответ. Запомните правила и затем следуйте им шаг за шагом.
Реклама
Предупреждения
- Многие соединения называют распространенными названиями вместо использования системы ИЮПАК. Например, боковая цепь, которая будет называться по системе ИЮПАК 1-метилэтил, также известна как изопропиловая группа. Будьте осторожны, чтобы не смешать системы наименований.
Реклама
Об этой статье
Эту страницу просматривали 29 759 раз.
Была ли эта статья полезной?
И.М. ХАРЧЕВА
Учебно-методическое пособие
по органической химии
Тема 2.
Предельные углеводороды.
Циклопарафины
Знать: общие формулы алканов и
циклоалканов, строение алканов, гомологический
ряд алканов, изомерию и номенклатуру алканов и
циклоалканов, их физические и химические
свойства; получение, применение и механизмы
реакций замещения алканов и циклоалканов.
Уметь: давать названия алканам и
циклоалканам, составлять их формулы по названиям
веществ; составлять структурные формулы
гомологов и изомеров для предложенного алкана
или циклоалкана; составлять уравнения реакций,
характеризующих свойства алканов, циклоалканов
и галогеналканов; составлять структурные
формулы галогеналканов, называть их, графически
обозначать распределение электронной плотности
в молекулах; решать расчетные задачи на
нахождение молекулярной формулы вещества по
массовым долям элементов и по массе (объему)
продуктов сгорания.
Основные понятия: алканы, циклоалканы,
тетраэдрическое строение молекул, общая формула,
гомологи, гомологическая разность, взаимное
влияние атомов, заместитель, изомерия положения
заместителей, индукционный эффект, цепная
реакция, простейшая формула, истинная формула.
Алгоритм 2.1. Номенклатура алканов
Задание 1. Назвать вещество по
систематической номенклатуре:
Решение
1. Выбрать главную цепь (наиболее длинная цепь
углеродных атомов):
2. Пронумеровать атомы углерода в главной цепи с
того конца, к которому ближе стоит заместитель
(углеводородный радикал):
Последовательно назвать:
1) номер углеродного атома, с которым связан
радикал;2) радикал;
3) углеводород, которому соответствует длинная
цепь: 2-метилбутан.
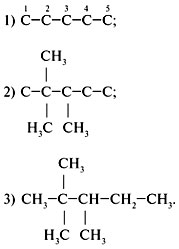
Задание 2. Составить структурную
формулу углеводорода по его названию
«2,3-диметилпентан».
Решение
Анализируем название углеводорода, начиная с
конца слова.
1. «Пентан» – в главной цепи находится пять
атомов углерода:
2. «Диметил» – в состав углеводорода входят два
радикала CH3.
3. «2, 3-» – радикалы находятся у 2-го и 3-го
углеродных атомов:
4. Дописать недостающие атомы водорода,
соблюдая четырехвалентность атома углерода:
Алгоритм 2.2. Гомологи и изомеры
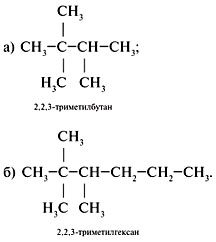
Задание. Для 2,2,3-триметилпентана
составить формулы двух гомологов и двух
изомеров.
Решение
1. Составить формулу исходного вещества,
используя задание 2 алгоритма 2.1:
2. Составить формулы г о м о л о г о в, сохраняя
строение (разветвление 2,2,3-триметил-). Для этого
уменьшить главную цепь на группу СН2
(гомологическая разность) – пример а или
увеличить главную цепь на СН2 – пример б:
3. Составляя формулы и з о м е р о в, изменить
строение, сохраняя состав исходного
углеводорода (C8H18), примеры в, г:
Алгоритм 2.3. Решение расчетных задач на
вывод
молекулярной формулы вещества по массовым долям
элементов
Задача 1. Найти молекулярную формулу
вещества, содержащего 81,8% углерода и 18,2% водорода.
Относительная плотность вещества по азоту равна
1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy)
по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44,
следовательно, C3H8 – истинная
формула.
Задача 2. Найти молекулярную формулу
предельного углеводорода, массовая доля
углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100%
– 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для
углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая
формула алканов СnH2n+2, то
истинная формула – С4Н10.
Алгоритм 2.4. Решение расчетных задач
на вывод
молекулярной формулы вещества по массе (объему)
продуктов сгорания
Задача 1. При сжигании 29 г углеводорода
образовалось 88 г углекислого газа и 45 г воды,
относительная плотность вещества по воздуху
равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу
вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29
= 58.
3. Найти количество вещества образовавшегося
оксида углерода(IV):
4. Найти количество вещества углерода в
сожженном веществе:
(C) =
(CO2) = 2 моль.
5. Найти количество вещества воды:
(H2O)
= 45/18 = 2,5 моль.
6. Найти количество вещества водорода в
сожженном веществе:
(H) = 2
(H2O),
(H) = 2,5•2 =
5 моль.
7. Найти простейшую формулу углеводорода:
(C) :
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
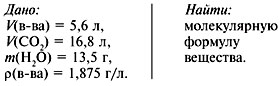
Задача 2. При сжигании 5,6 л (н.у.)
газообразного органического вещества было
получено 16,8 л (н.у.) углекислого газа и 13,5 г воды.
Масса 1 л исходного вещества при н.у. равна 1,875 г.
Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из
пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и
углерода:
(CO2)
= 16,8/22,4 = 0,75 моль,
(C) = 0,75
моль.
4. Найти количества веществ воды и водорода:
(H2O)
= 13,5/18 = 0,75 моль,
(H) = 0,75•2
= 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только
углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) :
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) =
42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Контрольные вопросы
1. Какие углеводороды называют предельными?
2. Строение метана.
3. Физические свойства алканов.
4. Виды изомерии алканов и циклоалканов.
5. Причины инертности алканов.
6. Какие типы химических реакций характерны
для алканов, циклоалканов и галогеналканов?
7. Какова последовательность замещения
атомов водорода на галоген в алканах, содержащих
более двух углеродных атомов?
8. Каков механизм реакции замещения?
9. Каковы способы получения алканов,
галогеналканов и циклоалканов?
10. Дайте определения следующим понятиям: гомологи,
изомеры, заместитель, электронный эффект,
электронная плотность связи, индуктивный эффект,
электронодоноры, электроноакцепторы.
Задания для самоконтроля
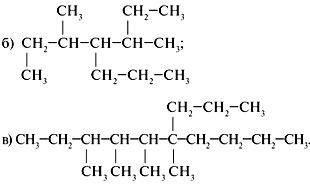
1. Назвать предельные углеводороды:
2. Составить структурную формулу
2,4,5,5-тетраметил-3-этилоктана. Указать все
первичные, вторичные, третичные и четвертичные
углеродные атомы.
3. Составить структурные формулы трех
углеводородов, содержащих четвертичный
углеродный атом, выбирая из первых семи членов
ряда алканов С1–С7. Назвать эти
углеводороды.
4. Привести структуры и названия продуктов
взаимодействия следующих алканов с хлором (в
мольном соотношении 1:1):
а) пропан;
б) 2,2-диметилбутан;
в) 2,3-диметилбутан.
5. Написать уравнения реакций, которые нужно
провести для осуществления следующих
превращений:
CH3COONa CH4
CH3Br
C2H6
CO2
CO
CH4
C3H8.
6. Привести уравнения реакций получения и
названия дигалогеналканов, необходимых для
получения следующих соединений:
а) 1,2-диметилциклобутан;
б) пропилциклобутан;
в) метилциклопропан.
7. Органическое вещество содержит 84,21%
углерода и 15,79% водорода. Плотность паров
вещества по воздуху 3,93. Определить формулу
вещества.
Ответ. С8Н18.
8. Алкан имеет плотность паров по воздуху
4,414. Определить формулу алкана.
Ответ. С9Н20.
9. При сгорании 3,6 г алкана получили 5,6 л
оксида углерода(IV) (н.у.). Какие объемы кислорода и
воздуха затратились на эту реакцию?
Ответ. 8,96 л О2 и 42,67 л воздуха.
10. Углеводород содержит 82,76% углерода и 17,24%
водорода (по массе). При монохлорировании этот
углеводород образует два изомерных алкилхлорида
– первичный и третичный. Определить строение
исходного углеводорода.
Ответ. 2-метилпропан.