Содержание
- Строение
- Получение
- Химические свойства
- Применение
Нитриды — соединения азота с менее электроотрицательными элементами, например, с металлами и с рядом неметаллов.
Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Строение
В зависимости от типа химической связи между атомами нитриды подразделяются на ионные, ковалентные и металлоподобные (ионно-ковалентно-металлические). Атомы азота в нитридах могут принимать электроны менее электроотрицательного элемента, при этом образуя стабильную электронную конфигурацию s2p6 или отдавать электрон партнеру с образованием устойчивой конфигурации sp3). В первом случае нитриды характеризуются наличием ионной связи, во втором химическая связь является типично металлической. В обоих случаях присутствует также некоторая доля ковалентной составляющей. В соединениях азота с бором и кремнием преобладает ковалентный характер химической связи.
Ионная связь наблюдается в нитридах металлов I и II групп периодической системы. Состав этих нитридов отвечает обычным валентным соотношениям. Эти нитриды подвергаются гидролизу с выделением аммиака, обладают высоким электрическим сопротивлением, у них наблюдаются полупроводниковые свойства).
Ковалентными нитридами являются нитриды бора, кремния, алюминия, галлия, индия. Ковалентные нитриды являются диэлектриками и полупроводниками с широкой запрещенной зоной.
Переходные металлы образуют нитриды с преимущественной металлической связью. Эти вещества обладают значительной твёрдостью и хрупкостью, высокой электропроводностью, высокими температурами плавления, большой энтальпией образования.
Получение
Нитриды ионного типа получаются при взаимодействии металлов с азотом при температурах 700—1200 °C. Другие нитриды можно получить взаимодействием металла с азотом или аммиаком или восстановлением оксидов, хлоридов металла углеродом в присутствии азота или аммиака при высоких температурах. Нитриды образуются также в плазме в дуговых, высокочастотных и сверхвысокочастотных плазмотронах. В последнем случае нитриды образуются как ультрадисперсные порошки с размером частиц 10-100 нм.
Химические свойства
Нитриды ионного типа легко разлагаются водой и кислотами, проявляя основные свойства:
Нагревание нитридов элементов V, VI и VIII групп приводит к их разложению с выделением азота, низших нитридов и твердых растворов азота в металлах. Нитриды бора, кремния, алюминия, индия, галлия и переходных металлов IV группы при нагревании в вакууме не разлагаются.
Окисление нитридов кислородом приводит к образованию оксидов металлов и азота. Взаимодействие нитридов с углеродом приводит к карбидам и карбонитридам.
Применение
Тугоплавкие нитриды применяют в качестве огнеупорных и температуростойких материалов, твёрдые — в производстве твердосплавного и абразивного инструмента, как изностостойкие, жаропрочные и жаростойкие материалы.
Нитриды переходных металлов IV—VI групп периодической системы элементов можно получать, воздействуя азотом или азотсодержащими газами на металлы, их окислы, гидриды или другие соединения. Практический интерес представляют следующие способы:
а) азотизация окислов металлов азотом или аммиаком в присутствии углерода;
2) азотизация металлов или гидридов металла азотом или аммиаком;
3) обработка хлоридов и оксихлоридов металлов аммиаком разложение аммонийных соединений;
4) осаждение из газовой фазы (метод наращивания).
В табл. 56 схематически представлены основные реакции, протекающие в названных процессах.

Азотизация окислов металлов азотом или аммиаком в присутствии углерода
Относительно дешевый способ получения нитридов прокаливанием смесей окислов металлов с углеродом в атмосфере азота или аммиака часто дает не вполне чистый продукт. Способ основан на том, что нитриды металлов IV, V и частично VI групп образуются в данных условиях при температурах существенна более низких, чем температуры образования соответствующих карбидов. Это позволяет получать нитриды в электрических керамических трубчатых печах в присутствии углерода. Как показывают данные табл. 57, реакции между окислами металлов и свободным азотом (в присутствии углерода) требуют температур порядка 1250°, при которых окисел еще не восстанавливается до металла. Большую роль здесь играет сильное сродство к азоту, особенно металлов IV группы. При азотизации металлов V и частично VI групп гораздо труднее избежать карбидообразования.

Получение нитридов титана, циркония, ванадия и ниобия из окислов этих металлов в токе чистейшего азота и в присутствии углерода описано в классической работе Фридерика и Зиттига. Несомненно, что таким же путем можно получить нитриды гафния. Получение нитрида металла затруднено карбидообразованием.
В настоящее время этот метод применяется редко. Целесообразнее получать нитриды вторым или третьим способом.
Азотизация металлов, гидридов и хлоридов
Прокаливание чистых порошков металлов в токе очищенного азота или аммиака позволяет получать весьма чистые нитриды, не загрязненные карбидами. В табл. 58 приведены температуры для основных реакций получения нитридов этим методом; они не превышают 1200°, и любой процесс можно легко осуществить в керамических трубчатых электрических или в вакуумных индукционных печах.

Агте и Moepc получили нитриды титана, циркония и тантала, прокаливая порошки металла в токе чистого азота в молибденовых лодочках в керамической трубчатой печи. Для получения нитрида тантала, в частности, необходим чистый от углерода азот во избежание образования карбидов. Обрабатывая металлы азотом или аммиаком, многие исследователи получали нитриды титана, циркония, гафния, ванадия, ниобия, тантала и хрома.
Молибден и вольфрам при требуемых низких температурах медленно взаимодействуют с молекулярным азотом. В данном случае необходимо применять весьма чистый аммиак, при разложении которого образуется высокоактивный атомарный азот. Это позволяет проводить азотизацию вольфрама и молибдена при низких температурах в приемлемое время.
В качестве исходных материалов можно применять легко разлагающиеся гидриды металлов (титана, циркония, урана), обрабатывая их также азотом или аммиаком. Таким путем быстро получают чистые образцы для рентгеновских исследований, применяя высокие температуры азотизации, свыше 2000°.
Обрабатывая различные металлические соединения аммиаком или разлагая аммонийные соединения, можно также получать чистые нитриды. Например, получают нитриды титана из четыреххлористого титана и аммиака, нитрид ванадия из VOCl3 + 4- NH3 или из NH4VO3 и аммиака, нитриды хрома из CrCl3 или CrO3*Cl2 и аммиака.
Осаждение из газовой фазы (наращивание на нити)
Как и карбиды, наращиванием на нити, по Ван-Аркелю, можно получать особо чистые нитриды металлов, в частности для научных целей. Нитриды титана, хрома, гафния, ванадия, ниобия и при определенных условиях тантала можно осаждать на раскаленной вольфрамовой нити из смеси паров соответствующих галоидов металлов с весьма чистым азотом (или аммиаком) и водородом по следующей примерной реакции

Все сказанное относительно карбидов о методике, форме выделений и т. д. в полной мере относится и к нитридам.
О получении наращиванием нитридов титана, циркония и тантала сообщают Ван-Аркель и Боер, Фишвойт и Кореф.
В обширной работе Moepca сообщаются подробные данные об условиях осаждения нитридов из газовой фазы (табл. 59). Там же указывается, что одновременное присутствие в газовой среде азота и углерода позволяет осадить смеси TaN + TaC. Одновременное выделение нитрида и карбида титана или циркония не удается по причинам, отмеченным выше.

При изыскании жаропрочных и жаростойких покрытий Кемпбелл с сотр. также получали нитриды способом наращивания, используя аппаратуру, изображенную на рис. 18, при условиях, указанных в табл. 59. Авторы также упоминают об одновременном выделении нитрида и карбида тантала.
Рафинирование нитридов и изготовление спеченных материалов
Для рафинирования нитридов и получения плотных материалов Aune и Moepc применили следующую методику. Исходные порошкообразные нитриды с присадкой от 2 до 5% чистого металла (этот металл при» спекании также превращался в нитрид) прессовали при давлении 2 кг/см2 в штабики и прокаливали в вольфрамовой трубчатой печи в токе весьма чистого азота при 2300°. После измельчения полученной массы весь цикл повторяли. При рафинировании необходимо всячески избегать загрязнения кислородом и особенно углеродом, так как последующее удаление окислов и карбидов крайне затруднено. При спекании штабиков нитридов рекомендуется применять засыпку из порошка нитрида, обеспечивающую защиту от окисления. Высокотемпературное спекание штабиков нитридов с целью их рафинирования (испарения примесей) и максимального уплотнения успешно осуществляется пропусканием электрического тока непосредственно через штабики и соответствующим их нагревом в атмосфере весьма чистого азота почти до температуры плавления.
Чиотти сообщает об изготовлении металлокерамичеcких изделий из нитридов титана, циркония, тантала, урана й тория. Спекают прессовки в высокочастотной вакуумной печи.
Нитри́ды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN, TiNx, Na3N, Ca3N2, Zn3N2 и т. д.) и с рядом неметаллов (NH3, BN, Si3N4).
Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор.
Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Строение
В зависимости от типа химической связи между атомами нитриды подразделяются на ионные, ковалентные и металлоподобные (ионно-ковалентно-металлические). Атомы азота в нитридах могут принимать электроны менее электроотрицательного элемента, при этом образуя стабильную электронную конфигурацию s2p6 или отдавать электрон партнеру с образованием устойчивой конфигурации sp3). В первом случае нитриды характеризуются наличием ионной связи, во втором химическая связь является типично металлической. В обоих случаях присутствует также некоторая доля ковалентной составляющей. В соединениях азота с бором и кремнием преобладает ковалентный характер химической связи.
Ионная связь наблюдается в нитридах металлов I и II групп периодической системы. Состав этих нитридов отвечает обычным валентным соотношениям. Эти нитриды подвергаются гидролизу с выделением аммиака, обладают высоким электрическим сопротивлением, у них наблюдаются полупроводниковые свойства).
Ковалентными нитридами являются нитриды бора, кремния, алюминия, галлия, индия. Ковалентные нитриды являются диэлектриками и полупроводниками с широкой запрещенной зоной.
Переходные металлы образуют нитриды с преимущественной металлической связью. Эти вещества обладают значительной твёрдостью и хрупкостью, высокой электропроводностью, высокими температурами плавления, большой энтальпией образования.
Получение
Нитриды ионного типа получаются при взаимодействии металлов с азотом при температурах 700—1200 °C. Другие нитриды можно получить взаимодействием металла с азотом или аммиаком или восстановлением оксидов, хлоридов металла углеродом в присутствии азота или аммиака при высоких температурах. Нитриды образуются также в плазме в дуговых, высокочастотных и сверхвысокочастотных плазмотронах. В последнем случае нитриды образуются как ультрадисперсные порошки с размером частиц 10-100 нм.
Химические свойства
Нитриды ионного типа легко разлагаются водой и кислотами, проявляя основные свойства:
-
- [math]displaystyle{ mathsf{Li_3N + 3H_2O rightarrow 3LiOH + NH_3uparrow} }[/math]
-
- [math]displaystyle{ mathsf{Ca_3N_2 + 6H_2O rightarrow 3Ca(OH)_2 + 2NH_3uparrow} }[/math]
Нагревание нитридов элементов V, VI и VIII групп приводит к их разложению с выделением азота, низших нитридов и твердых растворов азота в металлах. Нитриды бора, кремния, алюминия, индия, галлия и переходных металлов IV группы при нагревании в вакууме не разлагаются.
Окисление нитридов кислородом приводит к образованию оксидов металлов и азота. Взаимодействие нитридов с углеродом приводит к образованию карбидов и карбонитридов.
Применение
Тугоплавкие нитриды применяют в качестве огнеупорных и температуростойких материалов, твёрдые — в производстве твердосплавного и абразивного инструмента, как изностостойкие, жаропрочные и жаростойкие материалы.
Примеры
- Нитрид диниобия
- Нитрид калия
- Нитрид лантана
- Нитрид лютеция
- Нитрид неодима
- Нитрид нептуния
- Нитрид олова
- Нитрид полония
- Нитрид селена
- Нитрид тетражелеза
См. также
- Нитраты
- Нитриты
Ссылки
- [www.xumuk.ru/encyklopedia/2/2905.html Нитриды]
НИТРИДЫ
НИТРИДЫ, соед. азота
с металлами и более электроположительными, чем N, неметаллами. По типу хим.
связи нитриды делят на ионные, ковалентные и металлоподобные (ион-но-ковалентно-металлические).
Атомы азота в нитридах могут принимать электроны партнера (образуется стабильная электронная
конфигурация s2p6)или отдавать электрон
партнеру (стабильная конфигурация sp3). В первом случае соед.
обладают четко выраженной ионной связью, во втором-типично металлич., причем
в обоих случаях им сопутствует определенная доля ковалентной составляющей. Ковалентная
связь является основной в соединениях азота с бором и кремнием.
Нитриды с преим. ионной связью
образуют металлы I и II гр. периодич. системы (табл. 1), атомы к-рых имеют внеш.
s-электроны. Эти нитриды имеют составы, отвечающие обычным валентным соотношениям,
что обусловливает их ионный характер (они подвергаются гидролизу с выделением
NH3, обладают высоким электрич. сопротивлением, проявляют полупроводниковые
св-ва).
К ковалентным нитридам относят
бора нитрид, кремния нитрид, а также алюминия нитрид, нитриды галлия
(см. Галлий)и индия (InN, кристаллич. решетка гексагональная, т. пл.
1200°С, DH0обp —17,2 кДж/моль). Ковалентные
нитриды-диэлектрики; полупроводники с широкой запрещенной зоной.
Табл.1.- СВОЙСТВА ИОННЫХ
НИТРИДОВ

Нитриды с преим. металлической
связью образуют переходные металлы. Эти соед. характеризуются широкими областями
гомогенности, высокой электрич. проводимостью и ее положительным температурным
коэф., высокими т-рами плавления, твердостью, высокой энтальпией образования
(табл. 2).
Табл. 2.-СВОЙСТВА МЕТАЛЛОПОДОБНЫХ
НИТРИДОВ
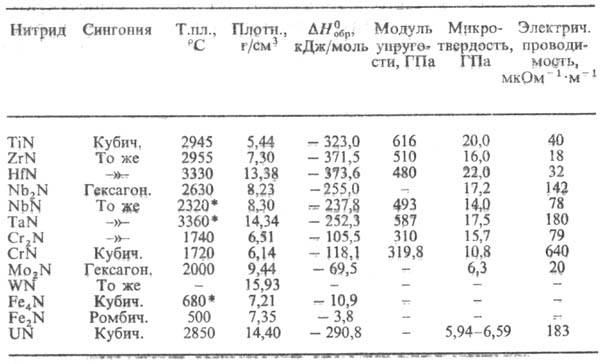
* Т-ра разложения.
Мех. св-ва нитридов зависят от
прочности хим. связи, степени ее ковалентности, а также от структуры (величины
зерен, состояния границ зерен, степени дефектности кристаллич. решетки). Большинство
нитридов очень твердые и хрупкие в-ва, их пластич. деформация возможна только при
высоких т-рах и напряжениях.
При нагр. на воздухе и
в среде О2 нитриды разрушаются с образованием оксидов и выделением в осн.
N2. Нитриды бора, Si, Al, In, Ga и переходных металлов IV гр. устойчивы
при нагр. в вакууме, нитриды элементов V, VI и VIII гр. разлагаются с выделением
N2 и последоват. образованием низших нитридов и твердых р-ров азота
в металлах. С углеродом нитриды взаимод. с образованием карбидов, а также твердых
р-ров нитридов и карбидов-к а р б о н и т р и д о в. Нитриды металлов I и II гр. легко
гидролизуются, разлагаются минер. к-тами и р-рами щелочей. нитриды переходных металлов,
Al, In, Ga, а также В и Si устойчивы к действию большинства к-т и щелочей, не
взаимод. с водой.
Получают нитриды, из элементов
при высоких т-рах в атмосфере N2 или NH3, а также восстановлением
оксидов и гало-генидов металлов в присут. азота. Синтез из элементов может осуществляться
Э режиме горения, т. к. в результате р-ции выделяется большое кол-во тепла,
либо в плазме в дуговых, высокочастотных и сверхвысокочастотныя плаз-мотронах.
В результате быстрого охлаждения из парогазо-вой смеси плазменным методом получают
ультрадисперсные порошки нитридов с размером частиц 10-100 нм.
Восстановление оксидов
в присут. азота с образованием нитридов происходит по схеме:
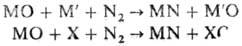
М’-металл-восстановитель,
Х-неметаллич. восстановитель (углерод, кремний, бор и т.д.).
Чаще всего восстановителем
является углерод. Однако при восстановлении оксидов карбидообразующих металлов
конечный продукт р-ции может представлять собой не чистый нитрид, а карбонитрид.
Нитриды получают также восстановлением газообразных галогенидов металлов аммиаком
или смесью N2 и Н2 по р-циям типа:
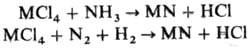
Эти р-ции проходят обычно
при т-рах выше 800 °С. Осаждение нитридов из газовой фазы используют обычно для
получения покрытий- Получают нитриды также термич. разложением аммиакатов галогенидов
металлов.
Компактные изделия из порошков
нитридов получают спеканием предварительно спрессованных порошков, горячим прессованием,
реакц. спеканием. Спекание заготовок, спрессованных из порошков нитридов, может осуществляться
в среде N2, азотсодержащих восстановит. газов или в вакууме. Горячим
прессованием получают изделия с меньшей остаточной пористостью, чем при спекании.
Однако применяемые при горячем прессовании графитовые прессформы служат источником
загрязнения нитридов углеродом. Реакц. спекание совмещение процессов образования нитридов
и их спекания – интенсифицирует уплотнение изделий по сравнению с обычным спеканием
предварительно спрессованных заготовок из порошков заранее полученных нитридов. Уд.
объем образующейся фазы нитрида больше уд. объема исходного металла, что приводит
к снижению пористости.
Области применения нитридов весьма
разнообразны. Наиб. развито использование огнеупорных св-в нек-рых ковалентных
нитридов-BN, SiN, AlN, а также их сложных соед. и разл. материалов на их основе. Нитриды
используют для футеровки, изготовления огнеупорных тиглей, муфелей, чехлов термопар,
крепления транзисторов, цоколей электронных ламп, устройств ядерной техники,
высокотемпературной смазки, в произ-ве твердосплавного и абразивного инструмента
и др. Металлоподобные нитриды переходных металлов – компоненты твердых сплавов, их
используют при произ-ве огнеупорных тиглей, лодочек для испарения Аl, в качестве
износостойких покрытий на твердосплавном режущем инструменте, для поверхностного
упрочнения деталей машин и механизмов. Нитриды входят в состав жаропрочных и жаростойких
композиц. материалов, в т.ч. керметов.
См. также Плутония нитрид,
Титана нитрид, Урана нитриды.
Лит.: Самсонов Г.
В., Нитриды, К., 1969; Тот Л., Карбиды и нитриды переходных металлов, пер. с
англ., М., 1974; Самсонов Г. В., Винницкий И. М., Тугоплавкие соединения. Справочник,
2 изд., М., 1976; Бол-гap А. С., Литвиненко В.Ф., Термодинамические свойства
нитридов, К., 1980; Свойства, получение и применение тугоплавких соединений.
Справочник, под ред. Т. Я. Косолаповой, М., 1986. Ю. В. Левинский.
Нитриды — соединения азота с менее электроотрицательными элементами, например, с металлами (AlN;TiNx;Na3N;Ca3N2;Zn3N2; и т. д.) и с рядом неметаллов (NH3, BN, Si3N4).
Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Строение
В зависимости от типа химической связи между атомами нитриды подразделяются на ионные, ковалентные и металлоподобные (ионно-ковалентно-металлические). Атомы азота в нитридах могут принимать электроны менее электроотрицательного элемента, при этом образуя стабильную электронную конфигурацию s2p6)или отдавать электрон партнеру с образованием устойчивой конфигурации sp3). В первом случае нитриды характеризуются наличием ионной связи, во втором химическая связь является типично металлической. В обоих случаях присутствует также некоторая доля ковалентной составляющей. В соединениях азота с бором и кремнием преобладает ковалентный характер химической связи.
Ионная связь наблюдается а нитридах металлов I и II групп Периодической системы. Состав этих нитридов отвечает обычным валентным соотношениям. Эти нитриды подвергаются гидролизу с выделением аммиака, обладают высоким электрическим сопротивлением, у них наблюдаются полупроводниковые свойства).
Ковалентными нитридами являются нитриды бора, кремния, алюминия, галлия, индия. Ковалентные нитриды являются диэлектриками и полупроводниками с широкой запрещенной зоной.
Переходные металлы образуют нитриды с преимущественной металлической связью. Эти вещества обладают значительной твёрдостью и хрупкостью, высокой электропроводностью, высокими температурами плавления, большой энтальпией образования.
Получение
Нитриды ионного типа получаются при взаимодействии металлов с азотом при температурах 700—1200 °C. Другие нитриды можно получить взаимодействием металла с азотом или аммиаком или восстановлением оксидов, хлоридов металла углеродом в присутствии азота или аммиака при высоких температурах. Нитриды образуются также в плазме в дуговых, высокочастотных и сверхвысокочастотных плазмотронах. В последнем случае нитриды образуются как ультрадисперсные порошки с размером частиц 10-100 нм.
Химические свойства
Нитриды ионного типа легко разлагаются водой и кислотами, проявляя основные свойства:
Нагревание нитридов элементов V, VI и VIII групп приводит к их разложению с выделением азота, низших нитридов и твердых растворов азота в металлах. Нитриды бора, кремния, алюминия, индия, галлия и переходных металлов IV группы при нагревании в вакууме не разлагаются.
Окисление нитридов кислородом приводит к образованию оксидов металлов и азота. Взаимодействие нитридов с углеродом приводит к карбидам и карбонитридам.
Применение
Тугоплавкие нитриды применяют в качестве огнеупорных и температуростойких материалов, твёрдые – в производстве твердосплавного и абразивного инструмента, как изностостойкие, жаропрочные и жаростойкие материалы.
Ссылки
- Нитриды


