Как написать общую формулу для гомологического ряда, основываясь на формуле одного из его представителей?
В данной статье я вам покажу, как написать общую молекулярную формулу органических веществ любого класса, отталкиваясь от структурной формулы любого из его представителей.
Поехали.
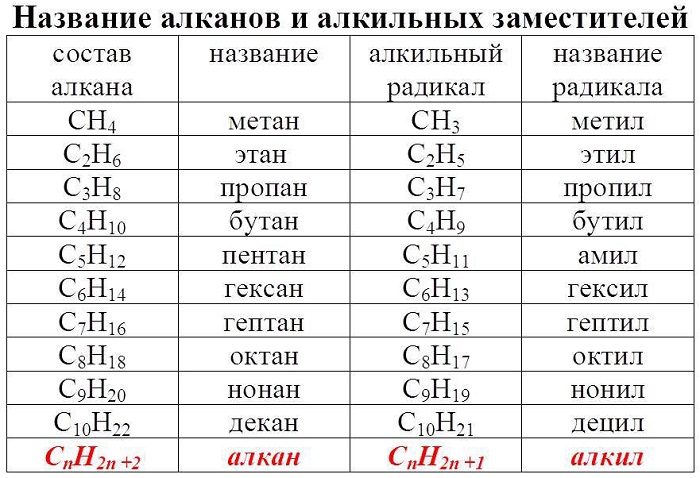
Что вам нужно помнить железно, так это общую формулу алканов, она имеет вид CnH2n+2.
Далее, если вас просят, написать общую формулу, например предельных альдегидов:
1) вам следует записать формулу любого из них. Например:
2) Написать молекулярную формулу выбранного выше соединения, посчитав все атомы, входящие в состав его молекулы. В формуле выбранного в п.1. соединения мы обнаруживаем 3 атома углерода, 6 атомов водорода и 1 атом кислорода. Таким образом, оно имеет молекулярную формулу С3Н6O
3) Записать формулу алкана с таким же числом атомов углерода в молекуле. В нашем случае, с тремя атомами. Подставляя значение n=3 в формулу CnH2n+2 получаем С3Н8
4) Посмотреть, чем отличаются друг от друга молекулярные формулы полученного алкана и исходного вещества. В исходном веществе на два атома водорода меньше, и на один атом кислорода больше.
5) Внести изменения в общую формулу алканов, т.е. CnH2n+2 в соответствии с установленной разницей, т.е. уменьшить число атомов водорода на два и добавить один атом О в формулу. Т.е.
CnH2n+2-2O
или
CnH2nO
Для того чтобы были очевидны преимущества данного метода, давайте попробуем записать общую формулу гомологического ряда ароматических сложных эфиров. Ароматический значит в его структурной формуле есть бензольное кольцо, а сложные эфиры это вещества со сложноэфирной группой –С(O)-O-. Запишем формулу любого такого вещества, например:
Для удобства ведения подсчетов атомов дорисуем не отображенные на структурной формуле выше атомы водорода, получим:
1) молекула выше состоит из 9 атомов С, 10 атомов Н, двух атомов O. Т.е. молекулярная формула данного вещества С9Н10O2
2) алкан с тем же числом атомов углерода имеет формулу C9H20. Сравнивая эту формулу с формулой изначального вещества С9Н10O2 мы видим, что в ней на 10 атомов H меньше и на два атома О больше, чем в соответствующем алкане.
3) Разница составов молекул исходного вещества и алкана с таким же числом атомов углерода будет той же самой и для общих формул гомологических рядов. Т.е.
CnH2n+2-10O2
или
CnH2n-8O2
Здравствуйте, уважаемые читатели! В конце прошлого (2020) года вышел СтатГрадовский пробник, в котором была замечена повышенная частота использования брутто-формул органических веществ (в частности, в 33 задании). На это оперативно отреагировали интернет-сообщества и отдельные авторы, занимающиеся в инициативном порядке разработкой методического материала к ЕГЭ по химии. Появившиеся задания отличались степенью сложности. Среди них были типовые, с брутто-формулами основных классов органических веществ:
или
Наибольший интерес (у меня лично) вызвали более сложные задания, с брутто-формулами веществ, являющихся производными от основных классов, например, задание по ссылке: https://scienceforyou.ru/trenirovochnye-varianty-dlja-podgotovki-k-egje/trenirovochnij-kim-n30
или из региональных пробников:
Не так давно, в откликах на одну из моих статей, прозвучало предложение: “…. .покажите алгоритм выведения общей формулы гомологического ряда по формуле вещества. Не могу найти методику изложения этого вопроса. Я имею ввиду задание 11 вашей статьи“.
Излагаемый ниже материал является авторской методикой вывода общей формулы гомологического ряда по структурной формуле вещества.
1. Базовой формулой во всех случаях является формула гомологического ряда алканов СnH2n+2.
2. Каждая из структур (кратная связь, группа атомов или отдельные атомы), входящая в конкретную молекулу органического вещества, определенным образом влияет на количество атомов водорода по сравнению с базовой формулой (см. п.1). В таблице 1 приведены наиболее распространенные структуры и их влияние на состав молекулы:
Пояснения к таблице 1:
структуры -“акцепторы” уменьшают количество атомов водорода в молекуле по сравнению с алканами. В случае пи-связи и циклической структуры это уменьшение равно двум, в случае атомов галогенов и нитрогрупп – одному. Структуры – доноры, наоборот, увеличивают количество атомов водорода в молекуле по сравнению с алканами. К ним относится азот в аминах (увеличение составляет 1 атом водорода на 1 атом азота) и азот в алкил(арил)аммониевых солях( увеличивает количество атомов водорода на 3). Наличие атомов кислорода не влияет на изменение количества атомов водорода по сравнению с базовой формулой.
3. Формула расчета количества атомов водорода в молекуле органического вещества:
К-во «Н»= 2n+2-2*«пи»-2*«цикл»-1*«Гал» +1* «Nамин»+3* «Nаммоний»-1*«Nнитро» (формула 1)
где: n-количество атомов углерода в молекуле;
«пи»- количество пи-связей в молекуле
«цикл» – количество циклических структур в молекуле
«гал»- количество атомов галогенов в молекуле
«Nамин» – количество атомов азота, входящего в молекулу алкил (арил)амина
«Nаммоний»- количество атомов азота, входящего в молекулу алкил (арил)аммониевой соли
«Nнитро» – количество атомов азота, входящего в состав нитрогрупп, присутствующих в данной молекуле.
4. Примеры использования формулы (1) приведены в таблице 2.
Таблица 2.
Таким образом, зная структурную формулу конкретного вещества, с помощью формулы 1 можно легко вывести общую формулу соответствующего гомологического ряда.
Всего доброго!
При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять – свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд – определения и примеры
Гомология – химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
Гомологический ряд – последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
-
этин — C2H2;
-
пропин — C3H4;
-
бутин — C4H6;
-
пентин — C5H8 и т. д.
Гомологический ряд алканов в таблице
Алканы – ациклические предельные углеводороды:
-
всеобщая формула алканов — СnH2n+2;
-
названия веществ имеют суффикс -ан-.
Алканы обладают следующими свойствами:
-
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
-
нерастворимы в воде, но могут растворяться в неполярных растворителях;
-
используются в промышленности (метан – топливо, пропан – автомобильное топливо, бутан – сырье для производства каучука, пропан и бутан – балонные газы).
|
Метан |
СН4 |
|
Этан |
С2Н6 |
|
Пропан |
С3Н8 |
|
Бутан |
С4Н10 |
|
Пентан |
С5Н12 |
|
Гексан |
С6Н14 |
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана – метилбутан.
Алканы могут вступать в следующие реакции:
-
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
-
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
-
Разложение при высокой температуре: СН4 = C + 2H2.
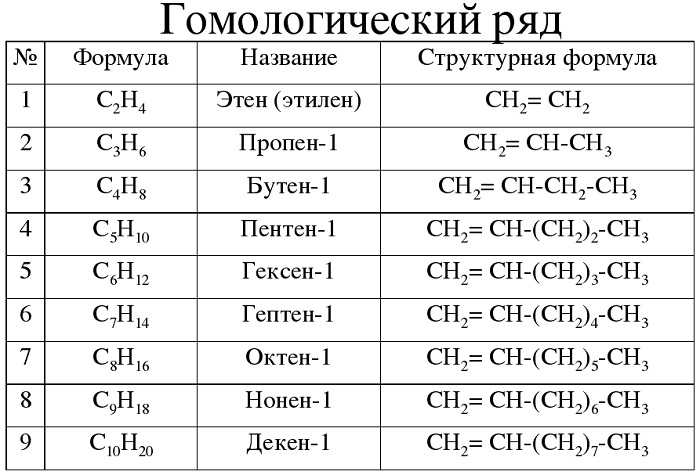
Гомологический ряд алкенов в таблице
Алкены – углеводороды, имеющие ациклический непредельный характер.
Краткая характеристика:
-
общая формула — CnH2n;
-
имеют суффикс -ен-.
Алкены обладают следующими свойствами:
-
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
-
имеют очень высокую температуру плавления и кипения;
-
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
|
Этилен |
C2H4 |
|
Пропен |
C3H6 |
|
Бутен |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
Алкены участвуют в следующих химических реакциях:
-
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
-
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
-
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
-
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
-
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
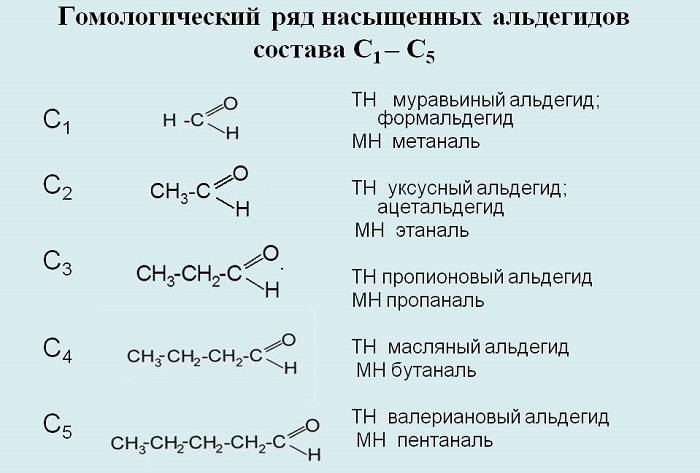
Гомологический ряд альдегидов
Альдегиды – органические вещества, имеющие в своём составе группу -CHO.
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых – СnH2nO, вторых – СnH2n+1CHO соответственно.
Названия составляются с помощью суффикса -аль-.
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
-
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
-
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
-
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
-
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
-
низшие представители класса имеют резкий запах;
-
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
-
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Гомологи – это вещества близкие по строению и свойствам, которые
отличаются на одну или несколько групп – СН2.
Каждый класс органических соединений имеет свою общую формулу и для
каждого класса органических соединений можно составить их гомологический ряд.
Например, алканы имеют общую
формулу CnH2n+2, где n –
число атомов углерода, причём каждый член гомологического ряда будет отличаться
от предыдущего на группу – СН2. Такая последовательность соединений
называется гомологическим рядом (от греческого homolog – «сходный»), отдельные
члены этого ряда называются гомологами, а группа атомов, на которую
отличаются соседние гомологи (группа – СН2) – гомологической
разностью.
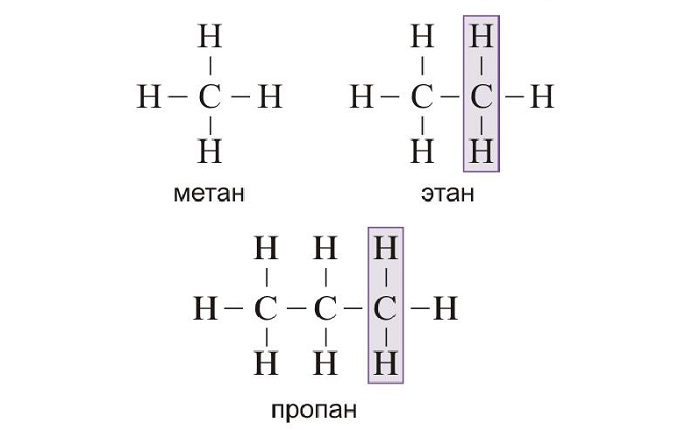
Гомологический ряд легко построить, для этого нужно к каждому последующему
представителю добавить один атом углерода и 2 атома водорода, то есть группу –
СН2. Так, первым представителем алканов
является метан – СН4 содержит один атом углерода (Н – СН2
– Н). Второй член гомологического ряда, у которого 2 атома углерода – этан – С2Н6
(Н – СН2 – СН2 – Н). Третий член гомологического – С3Н8, у него 3 атома углерода и он отличается
от предыдущего на группу – СН2 (Н – СН2 – СН2
– СН2 – Н). Четвёртый представитель гомологического ряда алканов также отличается от предыдущего на группу – СН2,
у него уже четыре атома углерода (Н – СН2 – СН2 – СН2
– СН2 – Н).
Понятно, что гомологи отличаются молярной массой, а значит физическими
свойствами. Как правило, с увеличение числа атомов углерода в молекуле
увеличиваются температуры кипения и плавления, увеличивается плотность.
Для алкенов характерна общая формула СnH2n. Первый член
гомологического ряда имеет формулу С2Н4 и называется этен, второй представитель алкенов
– пропен – С3Н6, третий –
бутен-1,четвёртый – пентен-1. И так далее, то есть в
данном гомологическом ряду также каждый последующий член гомологического ряда
отличается от предыдущего на группу – СН2.
Для алкинов также можно составить
гомологический ряд. Общая формула алкинов – СnH2n-2, поэтому первым
представителем этого ряда будет этин, али ацетилен –
С2Н2, вторым членом ряда является пропин
– С3Н4, третим – бутин-1 – С4Н6,
четвёртым – пентин-1 – С5Н8.
Общая формула спиртов – СnH2n+1OH. Первым членом
гомологического ряда спиртов является метанол – СН3ОН, или метиловый
спирт, затем С2Н5ОН – этанол, или этиловый спирт, третьим
представителем ряда спиртов является пропанол-1, или пропиловый
спирт – С3Н7ОН, четвёртым – бутанол-1, или бутиловый
спирт – С4Н9ОН, пятым – пентанол-1, или амиловый спирт –
С5Н11ОН. Таким образом, в этом гомологическом ряду каждый
последующий представитель отличается от предыдущего на группу -СН2.
Составим гомологический ряд альдегидов. Учитывая, что общая формула альдегидов
СnH2n+1CHO, то первым
представителем данного гомологического ряда будет метаналь,
или муравьиный альдегид – НСОН, вторым членом ряда – этаналь,
или уксусный альдегид – СН3СНО, третьим – пропаналь,
или пропионовый альдегид – СН3СН2СНО,
четвёртым – бутаналь, или масляный альдегид – СН3СН2СН2СНО
и так далее.
Аналогично и для карбоновых кислот. Так, общая формула насыщенных
одноосновных карбоновых кислот – CnH2n+1COOH. Поэтому первым
представителем данного гомологического ряда является метановая кислота, или
муравьиная – НСООН, вторым – этановая кислота, или
уксусная – СН3СООН, третьим – пропановая,
или пропионовая кислота – СН3СН2СООН,
четвёртым – бутановая, или масляная кислота – СН3СН2СН2СООН,
пятым – пентановая, или валериановая кислота – СН3СН2СН2СН2СООН.
Таким образом, для каждого класса органических соединений можно составить
гомологический ряд, учитывая общую формулу данного класса. Каждый последующий
член гомологического ряда отличается от предыдущего на группу – СН2,
которую называют гомологической разность. А сами вещества этого ряда называются
гомологами. Как правило, с увеличением числа атомов углерода в гомологическом
ряду увеличиваются температуры плавления и кипения, увеличивается плотность.
В этой статье мы разберем, как составлять молекулярные формулы основных классов органических соединений из информации об особенностях строения (наличие кратных связей, циклов, функциональных групп), и наоборот — как определять общую формулу гомологического ряда веществ с определенными функциональными группами, кратными связями или циклами.
Углеводороды
За основу берем формулу алканов — предельных нециклических углеводородов с одинарными связями между атомами углерода.
В молекуле линейных алканов на каждый атом углерода приходится по два атома водорода плюс по одному дополнительному атому водорода на концах углеродной цепи:
Таким образом, общая формула предельных нециклических углеводородов (алканов) — CnH2n+2.
В алкенах присутствует одна двойная связь. Двойная связь «отщипывает» от молекулы два атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна двойная связь (алкенов) CnH2n+2-2 — CnH2n.
Формулы алкенов отличаются от формул алканов с таким же количеством атомов углерода на 2 атома водорода:
C3H8 — C3H6 = 2H
Каждая пара атомов водорода определяет степень ненасыщенности молекулы. Степень ненасыщенности алкенов равна одному.
В алкинах присутствует одна тройная связь. Тройная связь «отщипывает» от молекулы уже четыре атома водорода:
| Ацетилен, этин | H-C≡C-H |
| Пропин | H-C≡C-СH3 |
| Бутин-1 | H-C≡C-СH2-СH3 |
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна тройная связь (алкинов): CnH2n+2-4 — CnH2n-2.
Формулы алкинов отличаются от формул алканов с таким же количеством атомов углерода на 4 водорода:
C3H8 — C3H4 = 4H
Степень ненасыщенности алкинов равна двум.
В алкадиенах присутствуют две двойные связи. Две двойные связи «отщипывают» от молекулы уже четыре атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть две двойные связи (алкадиенов): CnH2n+2-4 — CnH2n-2.
Степень ненасыщенности алкадиенов также равна двум.
В циклоалканах присутствуют только одинарные связи и атомы углерода образуют замкнутый цикл. Наличие цикла также уменьшает количество атомов водорода на два:
Таким образом, общая формула циклических углеводородов, в молекулах которых есть только одинарные связи (циклоалканов): CnH2n+2-2 — CnH2n.
В циклоалкенах присутствует одна одинарная связь и атомы углерода образуют замкнутый цикл. Наличие цикла и двойной связи уменьшает количество атомов водорода на четыре:
| Циклобутен |  |
Таким образом, общая формула циклических углеводородов, в молекулах которых есть одна двойная связь (циклоалкенов): CnH2n+2-4 — CnH2n-2.
Этот ряд можно продолжить и дальше:
Алкатриены — содержат три двойные связи, общая формула: CnH2n+2-6 = CnH2n-4
Алкенины — содержат одну двойную и одну тройную связь, общая формула:
CnH2n+2-6 = CnH2n-4
и так далее.
| Класс/группа | Тип связей и наличие цикла | Степень ненасыщенности | Общая формула |
| Алканы |
одинарные связи |
0 | CnH2n+2 |
| Алкены | двойная связь | 1 | CnH2n |
| Алкины | тройная связь | 2 | CnH2n-2 |
| Алкадиены | две двойные связи | 2 | CnH2n-2 |
| Циклоалканы | одинарные связи, цикл | 2 | CnH2n |
| Циклоалкены | двойная связь, цикл | 2 | CnH2n-2 |
| Циклоалкины | тройная связь, цикл | 6 | CnH2n-4 |
| Циклоалкадиены | две двойные связи, цикл | 6 | CnH2n-4 |
Определите молекулярную формулу и степень ненасыщенности гомологического ряда следующих классов органических веществ:
а) алкадиенины
б) циклоалкины
в) циклоалкатриены
г) алкендиины
а) CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
б) CnH2n-4, степень ненасыщенности 3, не хватает 6 атомов Н до алкана
в)CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
г) CnH2n-8, степень ненасыщенности 5, не хватает 10 атомов Н до алкана
Эта система работает и наоборот: знание молекулярной формулы можно определить возможный состав вещества.
Например, проанализируем формулу С3Н6.
До формулы алкана не хватает С3Н8 — С3Н6 = 2Н два атома водорода.
Степень непредельности равна одному. То есть в молекуле органического вещества есть либо цикл, либо двойная связь.
Определите возможную структуру (наличие кратных связей, циклов) молекул, которым соответствуют следующие формулы:
а) CnH2n-2
б) CnH2n-4
в) CnH2n-6
г) CnH2n-8
а) CnH2n-2, степень ненасыщенности 4, в молекуле либо две двойные связи, либо цикл и двойная связь, либо тройная связь
б) CnH2n-4, степень ненасыщенности 6, в молекуле либо три двойные связи; цикл и тройная связь; тройная связь и двойная связь и др.
в) CnH2n-6, степень ненасыщенности 8:
4 двойные связи; цикл и 3 двойные связи; две тройные связи; тройная связь и две двойные связи и др.
г) CnH2n-8, степень ненасыщенности 10:
5 двойных связей; цикл и 4 двойные связи и др.