Составление схем гальванических элементов
Задача 4.
Схема гальванического элемента : Al/Al2(SO4)3//AgNO3/Ag.
Указать анод и катод, написать электродные процессы, суммарное уравнение реакции и рассчитать электродвижущую силу элемента при 298К, если
[Al3+] = 0,0001 моль/л, [Аg+] = 0,1моль/л.
Решение:
Решение:
Серебро, потенциал которого (+0,80 В) более электроположительный, чем у алюминия (-1,66 В) – катод, т. е. электрод, на котором протекает восстановительный процесс:
Ag+ + 1
Алюминий имеет меньший потенциал (-1,66 В) является анодом, на котором протекает окислительный процесс:
Al0 – 3
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов, получим:
Al0 + 3Ag+ = 3Ag0 + Al3+
Для расчета значения потенциалов, используем уравнение Нернста:
Е = Е0 + (0,059/n)lgC где
Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе.
Тогда
Е(Ag) = +0,80 + (0,059/1)lg0,1 = +0,74 B;
Е(Al) = -1,66 + (0,059/3)lg0,0001 = -1,74 B.
Для определения ЭДС гальванического элемента необходимо из потенциала катода вычесть потенциал анода, т е. при вычислении ЭДС элемента меньший электродный потенциал вычитается из большего (в алгебраическом смысле), получим:
ЭДС = +0,74 – (-1,74) = +2,48 B.
Задача 65.
Составить схему гальванического элемента, в котором алюминий будет катодом. Написать электродные процессы, суммарное уравнение процесса.
Решение:
Cхема гальванического элемента, в котором алюминий будет катодом может иметь вид:
Mg/Mg2+//Al3+/Al
Или
Mg/MgCl2//AlCl3/Al
Алюминий, потенциал которого (-1,66 В) более электроположительный, чем у магния (-2,38 В) – катод, т. е. электрод, на котором протекает восстановительный процесс:
Al3+ + 3
Магний имеет меньший потенциал (-2,38 В) является анодом, на котором протекает окислительный процесс:
Mg0 – 2
Cуммарное уравнение процесса:
3Mg0 + 2Al3+ = 3Mg2+ + 2Al0
Задача 66.
Составить схему гальванического элемента, в котором протекает реакция: Ag+ + Cl– = AgCl. Рассчитать стандартную ЭДС элемента при 25o C, 
Решение.
1. Схема гальванического элемента имеет вид:
Ag|AgCl|Cl–||Ag+|Ag
2. Электродные процессы:
Правый электрод: Ag+ +1
Левый электрод: AgCl + 1
Общая реакция: Ag+ + Cl– = AgCl; Eo = +0,557 В.
3. Рассчитаем энергию Гиббса процесса:
Для расчета 

n – количество электронов, участвующих в процессе, 1 электрон; F – универсальная газовая постоянная, 96485 Кл.моль-1; Eo – окислительно-восстановительный потенциал процесса, +0,557 В.
Тогда

4. Расчет константы равновесия реакции:
Для расчета используем формулу:
К = exp–
ПОМОГИТЕ СРОЧНО, скоро ЭКЗАМЕН! Как составить схему,написать электронные уравнения электродных процессов и вычислить ЭДС
Ученик
(186),
закрыт
12 лет назад
Geselle
Гений
(63461)
12 лет назад
В этом элементе цинк имет более отрицательный электродный потенциал, являеется анодом, кадмий – катодом.
Схема элемента – Zn | Zn(2+) || Cd(2+) | Cd +
Процессы: на катоде Cd(2+)+2е = Cd ; на аноде Zn – 2е = Zn(2+)
(на аноде всегда окисление, на катоде – восстановление)
ЭДС данного элемента
ЭДС = Ест (Cd) – Ест ( Zn) + 0,059/2 lg(CионовCd/CионовZn )
Поскольку концентрации ионов кадмия и цинка здесь одинаковые, логарифм равен нулю, ЭДС вычисляется просто как разность стандартных электродных потенциалов кадмиевого и цинкового электродов (табличные значения)
ЭДС =- -0,403 -(-0,763) = 0,36 В
(См. в учебнике уравнение Нернста)
Алгоритм составления схемы гальванического элемента.
-
Записать схемы
электродов. -
Используя
уравнение Нернста рассчитать величины
электродных потенциалов. -
Определить,
зная, что φк
φа,
электрод-анод и электрод-катод. -
Составить
схему гальванического элемента,
используя принятую форму записи. -
Записываем
уравнения катодной, анодной и суммарной
реакций, идущих в элементе. -
Рассчитать ЭДС
гальванического элемента.
Пример
1. Составить
схему гальванического элемента, анодом
которого является магний, погруженный
в раствор соли с концентрацией 0,01М.
Решение.
1.
Записываем схему электрода: Mg|Mg2+
-
По
уравнению. Нернста рассчитываем величину
электродного потенциала:
-
Так
как в условии задачи не указан материал,
из которого изготовлен катод, то
используя соотношение φк
φа,
выбираем металл с более положительным
потенциалом. Например, цинковый электрод.
Значение потенциала выбранного электрода
определяем по таблице «Стандартные
электродные потенциалы металлов при
250С».
Следовательно,
.
-
Записываем схему
гальванического элемента:
А(-)
Mg|Mg2+||Zn2+|Zn (+)K
-
Записываем
электродные реакции:
А(-)
Mg
2e–
Mg2+
K(+)
Zn2+
+ 2e–
Zn0
Суммарная
реакция: Mg0
+ Zn2+
Mg2+
+ Zn0
-
Рассчитываем ЭДС
гальванического элемента:
Пример
2. Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с рН =3 и железного
электрода, погруженного в раствор соли
с концентрацией 0.1М. Рассчитайте ЭДС
элемента.
Решение.
1.
Записываем схемы электродов:
Водородный
– 2Н+|
Н2
(Pt);
Железный
–
Fe|Fe2+
-
По
уравнению Нернста рассчитываем величину
электродного потенциала железного
электрода:
Используя
уравнение Нернста (4) рассчитываем
величину электродного потенциала
водородного электрода:
-
Используя
соотношение φк
φа
определяем электрод-анод.
Так
как величина φ-потенциала
железного электрода меньше
следовательно этот электрод является
анодом.
-
Записываем схему
гальванического элемента:
А(-) Fe|Fe2+||2H+|H2 (+)
K
-
Рассчитываем ЭДС
гальванического элемента.
Задания для
самоконтроля
-
Составьте
схему гальванического элемента,
состоящего из никелевого электрода-катода,
погруженного в раствор соли с концентрацией
0.02М. Напишите уравнения электродных
реакций и вычислите ЭДС гальванического
элемента. -
Составьте
схему гальванического элемента,
состоящего из медного электрода,
погруженного в раствор соли меди с
концентрацией 0.01М и железного электрода,
погруженного в раствор соли железа с
концентрацией 0.1М. Напишите уравнения
электродных реакций. Вычислите ЭДС
гальванического элемента. -
Составьте
схему гальванического элемента,
состоящего из стандартного водородного
электрода и ртутного электрода.
Рассчитайте его ЭДС при [Hg2+]=0,1
М. Напишите уравнения электродных
реакций. -
Составьте
схему и рассчитайте ЭДС концентрированного
гальванического элемента, составленного
из двух железных электродов, погруженных
в раствор соли железа с концентрациями
1 М и 0,01 М. Напишите уравнения электродных
реакций. -
В гальваническом
элементе протекает химическая реакция
Zn+NiSO4=ZnSO4+Ni.
Напишите его схему
и уравнения электродных реакций.
Вычислите ЭДС этого элемента при
стандартных условиях. Какой металл
вместо никеля можно взять, чтобы увеличить
ЭДС?
-
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=5,
и марганцевого электрода, погруженного
в раствор соли марганца с концентрацией
0,2 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС. -
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=10,
и серебряного электрода, погруженного
в раствор соли серебра с концентрацией
0,01 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Решение типовых задач. Пример 1. В ГЭ катодом является висмут
- I Психологические принципы, задачи и функции социальной работы
- I. ГИМНАСТИКА, ЕЕ ЗАДАЧИ И МЕТОДИЧЕСКИЕ ОСОБЕННОСТИ
- I. ЗАДАЧИ ПЕДАГОГИЧЕСКОЙ ПРАКТИКИ
- I. Решение логических задач средствами алгебры логики
- I. Розв’язати задачі
- I. Ситуационные задачи и тестовые задания.
- I. Цель и задачи дисциплины
- II. Основные задачи и функции
- II. Основные задачи и функции
- II. Решение логических задач табличным способом
- II. ЦЕЛИ, ЗАДАЧИ И ПРИНЦИПЫ ДЕЯТЕЛЬНОСТИ ВОИ
- II. Цель и задачи государственной политики в области развития инновационной системы
Пример 1. В ГЭ катодом является висмут. Выберите металл, который может быть анодом. Составьте схему ГЭ. Напишите процессы, протекающие на электродах этого ГЭ, и рассчитайте его ЭДС для стандартных условий.
Пользуясь рядом стандартных электродных потенциалов, выберем металл, который может быть анодом. 
Составим схему ГЭ, напишем процессы, протекающие на электродах, и рассчитаем ЭДС в стандартных условиях.
При составлении схемы ГЭ необходимо помнить, что электрод с меньшим значением электродного потенциала является анодом, на нем протекает процесс окисления, он заряжается отрицательно, электрод с большим значением электродного потенциала является катодом, на нем протекают процессы восстановления, он заряжается положительно.
Электрохимическая схема ГЭ.
(-) Sn | SnCL2 || Bi(NO3)3 | Bi (+)
Электронные уравнения процессов, протекающих на электродах.
Олово – металл с меньшим значением φ0 будет анодом, на нем протекает процесс окисления.
Висмут, имеющий большее значение φ0 является катодом, на нем протекает процесс восстановления.
Для определения ЭДС ГЭ из потенциала катода следует вычесть потенциал анода ε = φ к – φ А. (13)
При концентрации солей висмута и олова равном 1 моль/л, ЭДС будет равна разности их потенциалов:
ЭДС = φ0 Bi3+/Bi0 – φ0 Sn2+/Sn0 = +0,216 – (- 0,136) = 0, 352 B
Пример 2. Гальванический элемент состоит из стандартного водородного электрода и никелевого электрода, опущенного в раствор своей соли с концентрацией его ионов 0,001 моль/л. Составить схему ГЭ. Написать электронные уравнения процессов, протекающих на электродах, и рассчитать ЭДС.


Электрохимическая схема данного ГЭ
(-) Ni|NiSO4|| H2SO4| Pt, H2 (+).
Процессы, протекающие на электродах, выражаются электронными уравнениями:
Так как концентрация ионов никеля в растворе равна 0,001 моль/л, то пользуясь формулой Нернста


где φ0 – стандартный электродный потенциал металла;
n – заряд иона металла;

Найдем электродный потенциал для никеля.
ЭДС = 0 – (- 0,337) = 0,337В.
Пример 3. Составить схему гальванического элемента, в котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Схема данного гальванического элемента
(-) Mg | Mg2+ || Zn2+ | Zn (+)
Вертикальная линия обозначает поверхность раздела между металлом и раствором, а две линии – границу раздела двух жидких фаз – пористую перегородку или соединительную трубку, заполненную раствором электролита.
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Цинк, потенциал которого – 0,763 В, – катод, т.е. электрод, на котором протекает восстановительный процесс:
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного и катодного процессов:
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 моль/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
Пример 4. Стандартный электродный потенциал никеля (- 0,25) больше, чем кобальта (-0,277). Изменится ли это соотношение, если измерить потенциал никеля в растворе его ионов с концентрацией 0,001 моль/л, а потенциалы кобальта – в растворе с концентрацией 0,1 моль/л.
Решение: Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста (14)

φ0 – для никеля и кобальта соответственно равны – 0,25 и – 0,277 В. Определим электродные потенциалы этих металлов при заданных концентрациях:


Таким образом, при изменившейся концентрации потенциал кобальта стал больше потенциала никеля.
Пример 5. Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен – 2,41 В. Вычислите концентрацию ионов магния (в моль/л).
Подобные задачи также решаются на основании уравнения Нернста (14)



Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.005 сек.)
Задачи к разделу Электродные процессы, Гальванический элемент
В настоящем разделе представлены типовые задачи на гальванические элементы: Определение ЭДС гальванического элемента, составление схемы гальванического элемента, определение энергии химической реакции в кДж.
Задача 1. Вычислите значение э.д.с. гальванического элемента:
(-) Mg / MgSO4 // CuSO4 / Cu (+)
Напишите процессы на аноде и катоде, реакцию, генерирующую ток, и определите в кДж энергию химической реакции, превращающуюся в электрическую.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
(-) Mg / MgSO4 // CuSO4 / Cu (+)
А: Mg 0 -2e — = Mg 2+
К : Cu 2+ +2e — = Cu
Mg 0 + Cu 2+ = Mg 2+ + Cu
Вычислим ЭДС гальванического элемента:
ЭДС =0,337 + 2,37 = 2,71 В
ΔG 0 298 = -nFE = -2∙96500∙2,71 = — 523030 Дж = — 523 кДж
Задача 2. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
А: Pb 0 -2e — = Pb 2+
К: 2 H + +2 e — = H 2
Pb 0 + 2H + = Pb 2+ + H2
Определим электродный потенциал свинца:
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
Вычислим ЭДС гальванического элемента:
ЭДС = 0 + 0,185 = 0,185 В
Задача 3. По уравнению токообразующей реакции составьте схему гальванического элемента:
Ni + СuSO4 = NiSO4 + Cu Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Ni2+/Ni и E 0 Cu2+/Cu
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции:
ЭДС = 0,337 – (- 0,250) = 0,587 В
Задача 4. Составьте схему гальванического элемента из магния и свинца, погруженных в растворы их солей с концентрацией ионов:
[Mg 2+ ] = 0,001 моль/л, [Pb 2+ ] = 1 моль/л. Напишите уравнения реакций, протекающих на катоде и аноде. Рассчитайте стандартную ЭДС этого элемента.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg и E 0 Pb2+/Pb
В данной паре потенциал магния имеет более отрицательное значение и является анодом:
А: Mg 0 -2e — = Mg 2+
К: Pb 2+ +2 e — = Pb 0
Mg 0 + Pb 2+ = Mg 2+ + Pb 0
Составим схему гальванического элемента:
(-) Mg 0 |Mg 2+ || Pb 2+ |Pb 0 (+)
Применяя уравнение Нернста, найдем EPb2+/Pb и EMg2+/Mg заданной концентрации:
Рассчитаем стандартную ЭДС реакции
ЭДС = -0,126 – (-2,46) = 2,334 В
Задача 5. Как изменится (увеличится, уменьшится) или останется постоянной масса пластины из кобальта, погруженной в раствор, содержащий соли Fe (II), Mg, Ag (I). Напишите молекулярные уравнения реакций.
Решение.
Пользуясь таблицей стандартных электродных потенциалов, найдем E 0 Mg2+/Mg, E 0 Co2+/Co, E 0 Fe2+/Fe, E 0 Ag+/Ag
Протекание реакции возможно при условии, когда E 0 восст 0 ок.
В нашем случае восстановителем является кобальт и условие E 0 восст 0 ок соблюдается только для пары
Co 0 + Ag + = Co 2+ + Ag 0
Молекулярное уравнение, например:
В процессе пластина из кобальта будет растворяться, но одновременно на ее поверхности будет осаждаться серебро.
Из уравнения реакции видно, что при взаимодействии 1 моль кобальта, образуется 2 моль серебра.
Мольная масса кобальта M(Co) = 59 г/моль, мольная масса серебра M(Ag) = 108 г/моль.
Найдем массы металлов:
n = m/M, m = n∙M
m(Ag) = 2∙108 = 216 г.
Таким образом, масса осажденного серебра больше, чем масса растворенного кобальта, т.е. масса пластины из кобальта увеличится.
В случаях, когда пластина опущена в раствор соли железа или соли магния ее масса не изменится, т.к. кобальт не вытесняет эти металлы из их солей. Т.е. реакции не происходит и масса пластины остается неизменной.
Задача 6. Составьте схему гальванического элемента, уравнения полуреакций анодного и катодного процессов, молекулярное уравнение реакции, проходящей при работе гальванического элемента, анодом которого является никель. Подберите материал для катода. Рассчитайте стандартную ЭДС этого гальванического элемента.
Решение.
По условию задачи материал анода известен – никель. Электродный потенциал анода всегда имеет более отрицательное значение, т.е. анод состоит из более активного металла, чем катод.
Поэтому нам надо подобрать такой металл, значение потенциала которого, будет иметь большее значение, чем значение электродного потенциала никеля. Например, медь:
Составим уравнения полуреакций анодного и катодного процессов и молекулярное уравнение реакции, проходящей при работе гальванического элемента.
А: Ni 0 -2e — = Ni 2+
К: Cu 2+ +2 e — = Cu 0
Ni 0 + Cu 2+ = Ni 2+ + Cu 0
Ni 0 + CuSO4 = NiSO4 + Cu 0
Составим схему гальванического элемента:
(-) Ni 0 |NiSO4 || CuSO4|Cu 0 (+)
Рассчитаем стандартную ЭДС реакции
Дана схема ГЭ: Mn | MnSO4 || Bi2(SO4)3 | Bi Определить анод и катод, написать схемы электродных процессов. Определить ЭДС.
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,247
- разное 16,834
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
[spoiler title=”источники:”]
http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-elektrodnye-processy-galvanicheskij-element.html
http://www.soloby.ru/1092907/%D1%81%D1%85%D0%B5%D0%BC%D0%B0-%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D1%8C-%D0%BD%D0%B0%D0%BF%D0%B8%D1%81%D0%B0%D1%82%D1%8C-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%B4%D0%BD%D1%8B%D1%85-%D0%BF%D1%80%D0%BE%D1%86%D0%B5%D1%81%D1%81%D0%BE%D0%B2-%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D1%8C
[/spoiler]
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Содержание:
1) Простейший гальванический элемент: схема работы.
2) Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
3) Типовые задачи на схему гальванического элемента: примеры решения.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:
В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.
Возникает так называемый двойной электрический слой.
Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:
На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn2+. Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:
Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu2+из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO42-и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.
Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
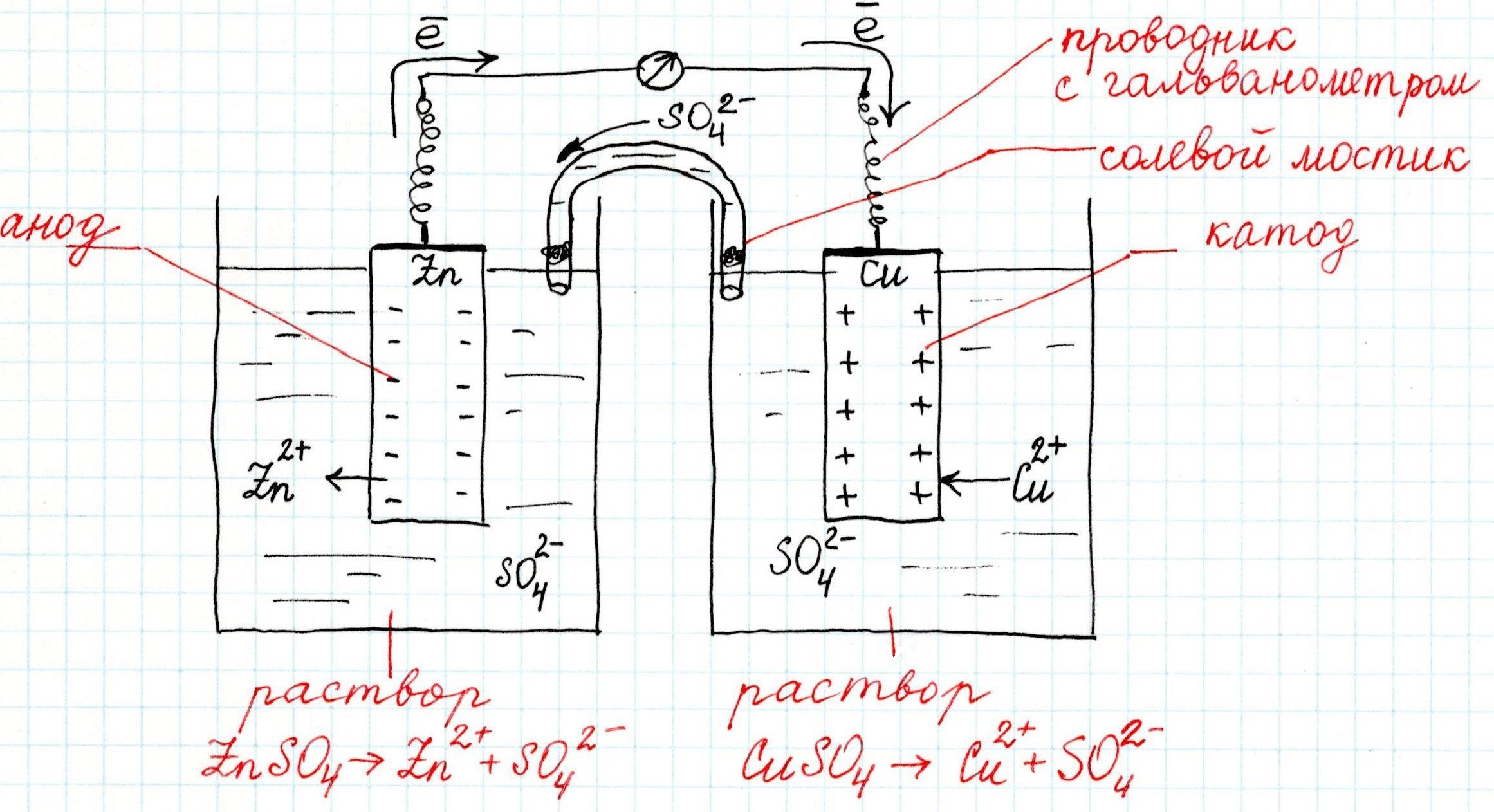
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):
Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):
Катионы меди Cu2+, пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:
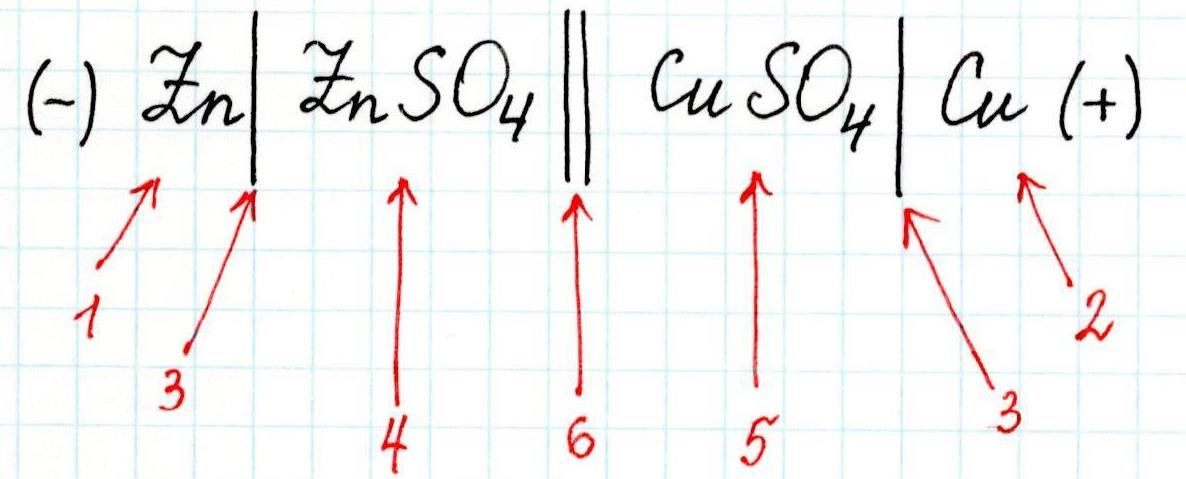
Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
Здесь:
1 – анод;
2 – катод;
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.