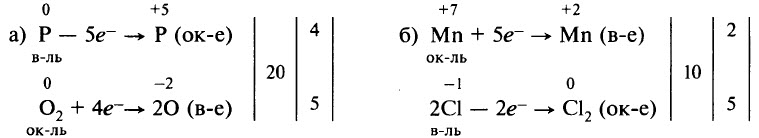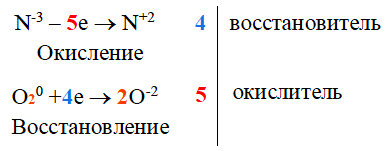Содержание
- Метод электронного баланса и ионно-электронный метод (метод полуреакций)
- Метод электронного баланса
- Ионно-электронный метод (метод полуреакций)
- Метод электронного баланса
- Примеры составления уравнений ОВР методом электронного баланса
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Источник
Метод электронного баланса
Составляя любое уравнение химической реакции, следует соблюдать закон сохранения масс веществ — кол-во атомов в исходных веществах (левая часть уравнения) и в продуктах реакции (правая часть уравнения) должны совпадать.
Составляя уравнения окислительно-восстановительных реакций, следует также следить за суммой зарядов, которые у исходных веществ и в продуктах реакции должны быть равны.
В уравнениях ОВР в левой части обычно указывают первым вещество-восстановитель (отдает электроны), а затем — вещество-окислитель (принимает электроны); в правой части уравнения первым указывают продукт окисления, затем восстановления, а потом другие вещества, если они имеются.
Главное требование, которое необходимо соблюдать при составлении уравнений окислительно-восстановительных реакций, — кол-во электронов, которое отдал восстановитель, должно быть равно кол-ву электронов, принятых окислителем.
В основе метода электронного баланса лежит сравнение степеней окисления в исходных веществах и продуктах реакции, что подразумевает тот факт, что, составляющий уравнение ОВР методом электронного баланса, должен знать, какие вещества образуются в ходе реакции.
Примеры составления уравнений ОВР методом электронного баланса
1. Составить уравнение реакции алюминия с углеродом.
- Al+C → Al4C3
- В первую очередь, определяются элементы, меняющие свои степени окисления:
Al 0 +C 0 → Al4 +3 C3 -4 - Атом алюминия в ходе реакции отдает 3 электрона, меняя свою степень окисления с 0 на +3
Al 0 → Al +3
1Al 0 -3e — → 1Al +3 - Атом углерода принимает 4 электрона, меняя свою степень окисления с 0 на -4
C 0 → C +4
1C 0 +4e — → 1C -4 - Поскольку, число отданных и принятых электронов между атомами должно совпадать, следует сбалансировать уравнение, подобрав множители, для этого кол-во отданных алюминием электронов, записывают в схему реакции углерода, а кол-во электронов, принятых углеродом — в схему реакции алюминия:
- В итоге, алюминий отдает 4·3=12 электронов;
- углерод принимает 3·4=12 электронов
- Осталось определить стехиометрические коэффициенты, которые необходимо проставить перед формулами веществ, чтобы уравнять кол-во их атомов в левой и правой части уравнения;
- Кол-во атомов алюминия, вступающих в реакцию:
4·1Al 0 =4Al 0 - Кол-во атомов углерода, вступающих в реакцию:
3·1C 0 =3C 0 - Окончательный вид уравнения:
4Al 0 +3C 0 = Al4 +3 C3 -4
2. Составить уравнение реакции азотной кислоты с йодом.
- Схема реакции:
HNO3+I2 → HIO3+NO+H2O - Определяем элементы, меняющие свои степени окисления:
HN +5 O3+I2 0 → HI +5 O3+N +2 O+H2O - Азот меняет степень окисления с +5 на +2 — принимает 3 электрона, и является окислителем:
N +5 → N +2
N +5 +3e — → N +2 - Йод меняет степень окисления с 0 на +5 — отдает 5 электронов, и является восстановителем, но, поскольку молекула йода двухатомна, то в схеме она записывается в молекулярном виде, а кол-во отдаваемых электронов соответственно удваивается:
I2 0 → 2I +5
I2 0 -10e — → 2I +5 - Уравниваем заряды:
- Было до реакции 10·1N +5 =10N +5 , после реакции образовалось: 10·1N +2 =10N +2
- В реакцию вступило всего 6 атомов йода (3·2) или три молекулы 3I2, после реакции образовалось 3·2I +5 =6I +5 ;
- Расставляем найденные коэффициенты:
10HNO3+3I2 = 6HIO3+10NO+2H2O
3. Составить уравнение реакции соляной кислоты (концентрированной) с оксидом марганца (IV).
- HCl+MnO2 → Cl2+MnCl2+H2O
- HCl -1 +Mn +4 O2 → Cl2 0 +Mn +2 Cl2+H2O
- Соляная кислота является восстановителем, оксид марганца — окислителем.
- Атом хлора отдает свой электрон, но в правой части нулевой заряд имеет молекула хлора, состоящая из двух атомов, поэтому, для ее получения нужны 2 электрона от двух атомов хлора:
Cl -1 → Cl2 0
2Cl — -2e — → Cl2 0 - Атом марганца получает 2 электрона, снижая свою степень окисления с +4 до +2:
Mn +4 → Mn +2
Mn +4 +2e — → Mn +2 - Поскольку, хлор отдает два электрона, а марганец эти же два электрона принимает, оба коэффициента будут равны 2, и их можно сократить:
- Получаем уравнение, отличающееся от исходного только стехиометрическим коэффициентом 2, который стоит перед формулой соляной кислоты (два атома хлора отдают по одному электрону):
2HCl+MnO2 → Cl2+MnCl2+H2O - Осталось найти стехиометрические коэффициенты для остальных веществ, чтобы уравнять левую и правую части уравнения.
- В левой части уравнения 2 атома хлора, в правой — 4, чтобы уравнять атомы хлора, перед формулой соляной кислоты ставим 4, но, теперь в правой части уравнения получается на 2 атома водорода меньше, чтобы уравнять атомы водорода, перед молекулой воды ставим коэффициент 2 — теперь кол-во всех атомов в левой части и в правой части уравнения одинаково:
4HCl+MnO2 → Cl2+MnCl2+2H2O - Ионное уравнение реакции:
4H + +4Cl — +MnO2 = Cl2+Mn 2+ +2Cl — +2H2O
4. Составить уравнение реакции сероводорода с раствором калия перманганата в кислой среде.
- Схема реакции:
H2S+KMnO4+H2SO4 → S+MnSO4+K2SO4+H2O - Определяем элементы, меняющие свои степени окисления:
H2S -2 +KMn +7 O4+H2SO4 → S 0 +Mn +2 SO4+K2SO4+H2O - Сера меняет свою степень окисления с -2 до 0, т.е., отдает 2 электрона (сероводород — восстановитель):
S -2 → S 0
S -2 -2e — → S 0 - Марганец меняет свою степень окисления с +7 до +2, т.е., принимает 5 электронов (калия перманганат — окислитель):
Mn +7 → Mn +2
Mn +7 +5e — → Mn +2 - Электронные уравнения:
- 5H2S+2KMnO4+H2SO4 = S+MnSO4+K2SO4+H2O
- 5H2S+2KMnO4+3H2SO4 = 5S+2MnSO4+K2SO4+8H2O
- Ионное уравнение:
5H2S+2MnO4 — +6H + = 5S+2Mn 2+ +8H2O
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Источник
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др.
вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Метод электронного баланса
Составляя любое уравнение химической реакции, следует соблюдать закон сохранения масс веществ — кол-во атомов в исходных веществах (левая часть уравнения) и в продуктах реакции (правая часть уравнения) должны совпадать.
Составляя уравнения окислительно-восстановительных реакций, следует также следить за суммой зарядов, которые у исходных веществ и в продуктах реакции должны быть равны.
В уравнениях ОВР в левой части обычно указывают первым вещество-восстановитель (отдает электроны), а затем — вещество-окислитель (принимает электроны); в правой части уравнения первым указывают продукт окисления, затем восстановления, а потом другие вещества, если они имеются.
Главное требование, которое необходимо соблюдать при составлении уравнений окислительно-восстановительных реакций, — кол-во электронов, которое отдал восстановитель, должно быть равно кол-ву электронов, принятых окислителем.
В основе метода электронного баланса лежит сравнение степеней окисления в исходных веществах и продуктах реакции, что подразумевает тот факт, что, составляющий уравнение ОВР методом электронного баланса, должен знать, какие вещества образуются в ходе реакции.
Примеры составления уравнений ОВР методом электронного баланса
1. Составить уравнение реакции алюминия с углеродом.
- Al+C → Al4C3
- В первую очередь, определяются элементы, меняющие свои степени окисления:
Al 0 +C 0 → Al4 +3 C3 -4 - Атом алюминия в ходе реакции отдает 3 электрона, меняя свою степень окисления с 0 на +3
Al 0 → Al +3
1Al 0 -3e — → 1Al +3 - Атом углерода принимает 4 электрона, меняя свою степень окисления с 0 на -4
C 0 → C +4
1C 0 +4e — → 1C -4 - Поскольку, число отданных и принятых электронов между атомами должно совпадать, следует сбалансировать уравнение, подобрав множители, для этого кол-во отданных алюминием электронов, записывают в схему реакции углерода, а кол-во электронов, принятых углеродом — в схему реакции алюминия:
- В итоге, алюминий отдает 4·3=12 электронов;
- углерод принимает 3·4=12 электронов
- Осталось определить стехиометрические коэффициенты, которые необходимо проставить перед формулами веществ, чтобы уравнять кол-во их атомов в левой и правой части уравнения;
- Кол-во атомов алюминия, вступающих в реакцию:
4·1Al 0 =4Al 0 - Кол-во атомов углерода, вступающих в реакцию:
3·1C 0 =3C 0 - Окончательный вид уравнения:
4Al 0 +3C 0 = Al4 +3 C3 -4
2. Составить уравнение реакции азотной кислоты с йодом.
- Схема реакции:
HNO3+I2 → HIO3+NO+H2O - Определяем элементы, меняющие свои степени окисления:
HN +5 O3+I2 0 → HI +5 O3+N +2 O+H2O - Азот меняет степень окисления с +5 на +2 — принимает 3 электрона, и является окислителем:
N +5 → N +2
N +5 +3e — → N +2 - Йод меняет степень окисления с 0 на +5 — отдает 5 электронов, и является восстановителем, но, поскольку молекула йода двухатомна, то в схеме она записывается в молекулярном виде, а кол-во отдаваемых электронов соответственно удваивается:
I2 0 → 2I +5
I2 0 -10e — → 2I +5 - Уравниваем заряды:
- Было до реакции 10·1N +5 =10N +5 , после реакции образовалось: 10·1N +2 =10N +2
- В реакцию вступило всего 6 атомов йода (3·2) или три молекулы 3I2, после реакции образовалось 3·2I +5 =6I +5 ;
- Расставляем найденные коэффициенты:
10HNO3+3I2 = 6HIO3+10NO+2H2O
3. Составить уравнение реакции соляной кислоты (концентрированной) с оксидом марганца (IV).
- HCl+MnO2 → Cl2+MnCl2+H2O
- HCl -1 +Mn +4 O2 → Cl2 0 +Mn +2 Cl2+H2O
- Соляная кислота является восстановителем, оксид марганца — окислителем.
- Атом хлора отдает свой электрон, но в правой части нулевой заряд имеет молекула хлора, состоящая из двух атомов, поэтому, для ее получения нужны 2 электрона от двух атомов хлора:
Cl -1 → Cl2 0
2Cl — -2e — → Cl2 0 - Атом марганца получает 2 электрона, снижая свою степень окисления с +4 до +2:
Mn +4 → Mn +2
Mn +4 +2e — → Mn +2 - Поскольку, хлор отдает два электрона, а марганец эти же два электрона принимает, оба коэффициента будут равны 2, и их можно сократить:
- Получаем уравнение, отличающееся от исходного только стехиометрическим коэффициентом 2, который стоит перед формулой соляной кислоты (два атома хлора отдают по одному электрону):
2HCl+MnO2 → Cl2+MnCl2+H2O - Осталось найти стехиометрические коэффициенты для остальных веществ, чтобы уравнять левую и правую части уравнения.
- В левой части уравнения 2 атома хлора, в правой — 4, чтобы уравнять атомы хлора, перед формулой соляной кислоты ставим 4, но, теперь в правой части уравнения получается на 2 атома водорода меньше, чтобы уравнять атомы водорода, перед молекулой воды ставим коэффициент 2 — теперь кол-во всех атомов в левой части и в правой части уравнения одинаково:
4HCl+MnO2 → Cl2+MnCl2+2H2O - Ионное уравнение реакции:
4H + +4Cl — +MnO2 = Cl2+Mn 2+ +2Cl — +2H2O
4. Составить уравнение реакции сероводорода с раствором калия перманганата в кислой среде.
- Схема реакции:
H2S+KMnO4+H2SO4 → S+MnSO4+K2SO4+H2O - Определяем элементы, меняющие свои степени окисления:
H2S -2 +KMn +7 O4+H2SO4 → S 0 +Mn +2 SO4+K2SO4+H2O - Сера меняет свою степень окисления с -2 до 0, т.е., отдает 2 электрона (сероводород — восстановитель):
S -2 → S 0
S -2 -2e — → S 0 - Марганец меняет свою степень окисления с +7 до +2, т.е., принимает 5 электронов (калия перманганат — окислитель):
Mn +7 → Mn +2
Mn +7 +5e — → Mn +2 - Электронные уравнения:
- 5H2S+2KMnO4+H2SO4 = S+MnSO4+K2SO4+H2O
- 5H2S+2KMnO4+3H2SO4 = 5S+2MnSO4+K2SO4+8H2O
- Ионное уравнение:
5H2S+2MnO4 — +6H + = 5S+2Mn 2+ +8H2O
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
источники:
http://chemege.ru/hydrogen/
http://prosto-o-slognom.ru/chimia_ovr/08_metod_elektronnogo_balansa.html
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Ключевые слова конспекта: окислительно-восстановительные реакции, метод электронного баланса, окисление, восстановление, расстановка коэффициентов.
Окислительно-восстановительные реакции (ОВР) – реакции, в ходе которых изменяются степени окисления элементов вследствие перехода электронов от восстановителя к окислителю. Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Темы, связанные с настоящим конспектом:
- Степень окисления химических элементов
- Окислительно-восстановительные реакции
- Окислители и восстановители
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Рассмотрим составление схем электронного баланса на примере горения фосфора (а) и взаимодействия перманганата калия с концентрированной соляной кислотой (б).
- Запишем схемы реакций, вычислим степени окисления элементов и определим элементы, у которых они меняются:
- Составим схемы, отражающие процессы перехода электронов:
- Определим, какой процесс является окислением, а какой – восстановлением; какой элемент является окислителем, а какой – восстановителем:
- Уравняем число отданных и принятых электронов. Для этого найдём наименьшее общее кратное для числа отданных и числа принятых электронов. В результате деления наименьшего общего кратного на число отданных и принятых электронов находим коэффициенты:
- Перенесём коэффициенты в исходную схему (п. 1), преобразуя её в уравнение реакции:
Перед формулой HCl мы не поставили коэффициент, так как не все ионы Cl– участвовали в окислительно-восстановительном процессе, часть из них участвовала в образовании солей.
В уравнении (б) требуется уравнять количество атомов элементов, не участвующих в окислительно-восстановительном процессе (К, Н, частично Cl). Получаем уравнение:
При правильной расстановке коэффициентов количество атомов кислорода в левой и правой частях уравнения будет одинаково (в случае (б) – 8).
Алгоритм расстановки коэффициентов на примерах
Пример 1. Cu + HNO3 → Cu(NO3)2 + NO + H2O
1) Определяем степени окисления всех элементов;
2) Выбираем те элементы, у которых изменилась степень окисления;
3) Составляем электронный баланс
Число принятых и отданных электронов переносим крест –накрест и сокращаем. Это множители, которые позволяют осуществить закон сохранения: число принятых электронов должно быть равно числу отданных электронов.
Теперь эти множители нужно внести в схему реакции, они должны стать коэффициентами. Перед атомами меди в левой и правой части уравнения нужно поставить коэффициент 3. В этом действии можно не сомневаться, так как медь в левой и правой части встречается только по одному разу.
3Cu + HNO3 → 3Cu(NO3)2 + NO + H2O
А вот с азотом возникает вопрос: к какому из атомов азота относится коэффициент 2? Ответ: к тому, степень окисления которого в уравнении встречается единожды, то есть +2. Ставим коэффициент 2 перед NO.
3Cu + HNO3 → 3Cu(NO3)2 + 2NO + H2O
Дальше сравниваем левую и правую часть схемы и достраиваем коэффициенты в таком порядке: в правой части после выставления коэффициентов из баланса перед всеми атомами азота есть коэффициенты, пересчитаем азот в правой части – 8, ставим этот коэффициент перед азотной кислотой.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + H2O
Теперь в левой части поставлен коэффициент перед водородом, число его атомов 8. Ставим в правую часть перед водой 4.
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Осталось сравнить число атомов кислорода в левой и правой части уравнения. 24 = 24.
Если равно – коэффициенты расставлены правильно, если нет – ищем ошибку.
Пример 2. KMnO4 + K2SO3 + H2SO4 → MnSO4 + K2SO4 + H2O
1) Определяем степени окисления всех элементов;
2) Выбираем те элементы, у которых изменилась степень окисления;
3) Составляем электронный баланс
Перед атомами марганца в левой и правой части уравнения нужно поставить коэффициент 2. В этом действии можно не сомневаться, так как марганец в левой и правой части встречается только по одному разу.
2KMnO4 + K2SO3 + H2SO4 → 2MnSO4 + K2SO4 + H2O
С серой возникает вопрос: к какому из атомов серы относится коэффициент 5? К тому, степень окисления которого в уравнении встречается единожды, то есть +4. Ставим коэффициент 5 перед K2SO3.
2KMnO4 + 5K2SO3 + H2SO4 → 2MnSO4 + K2SO4 + H2O
Дальше сравниваем левую и правую часть схемы и достраиваем коэффициенты в таком порядке: калий (в левой части 10+2=12, перед K2SO4 поставим 6.
2KMnO4 + 5K2SO3 + H2SO4 → 2MnSO4 + 6K2SO4 + H2O
Теперь в правой части поставлены коэффициенты перед серой, число её атомов 8. В левой части уже есть коэффициент перед серой 5, не хватает еще 3.
2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + H2O
Сравниваем число атомов водорода. Ставим перед водой 3.
2KMnO4 + 5K2SO3 + 3H2SO4 → 2MnSO4 + 6K2SO4 + 3H2O
Осталось сравнить число атомов кислорода в левой и правой части уравнения. 35 = 35.
Случаи, когда индекс при химическом элементе
вносится в электронный баланс.
Случай 1. Если формула простого вещества записывается с индексом: NH3 + O2 → NO + H2O
5 ставим перед простым веществом – кислородом,
4 – перед азотом в левой и правой части уравнения,
уравниваем водород, проверяем кислород.
4NH3 + 5O2 = 4NO + 6H2O
Случай 2. Если в молекуле атомы одного элемента соединены между собой (то есть присутствует ковалентная неполярная связь): пероксиды, дисульфиды, тиосульфат, веселящий газ, органические вещества: Cr(OH)3 + H2O2 + KOH –> K2CrO4 + H2O
3 ставим перед пероксидом водорода,
2 – перед хромом в левой и правой части уравнения,
уравниваем калий, потом – водород, проверяем кислород.
2Cr(OH)3 + 3H2O2 + 4KOH = 2K2CrO4 + 8H2O
Случай 3. Если у одного элемента в левой и правой части уравнения есть одинаковый индекс: K2Cr2O7 + K2SO3 + H2SO4 –> Cr2(SO4)3 + K2SO4 + H2O
Перед сульфитом ставим 3, перед хромом в левой и правой части коэффициент не нужен, уравниваем калий (в правой части перед сульфатом калия ставим 4), затем – серу (в левой части перед серной кислотой – 4), водород – перед водой 4, проверяем кислород.
K2Cr2O7 + 3K2SO3 + 4H2SO4 = Cr2(SO4)3 + 4K2SO4 + 4H2O
Вы смотрели конспект урока по химии «Метод электронного баланса».
Следующая тема: «Окислители и восстановители».

Электронный учебник
Калькулятор ОВР
Калькулятор ОВР – это способ составить уравнение электронного и массового баланса в уравнении окислительно-восстановительной реакции
Статья об окислительно-восстановительных реакциях здесь.
-
- 0
-
-
- 0
-
Вот извини за почерк . Удачи
-
Комментариев (0)