Электронное строение атома алюминия
Электронное строение нейтрального атома алюминия в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме алюминия.
Al
+13
2
8
3
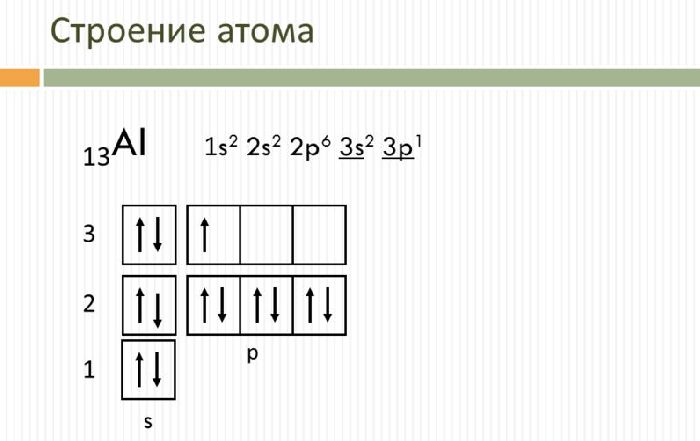
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме алюминия.
| 3 | ↑↓ | ↑ | ||||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома алюминия выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома алюминия.
13Al 1s2 2s2 2p6 3s2 3p1
Сокращённая электронная конфигурация атома алюминия.
13Al [Ne] 3s2 3p1
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома алюминия.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3s | 3 | 0 | 0 | +½ |
| -½ | ||||
| 3p | 3 | 1 | -1 | +½ |
| 1 | +½ | |||
| 2 | +½ |
Строение атома алюминия

4.6
Средняя оценка: 4.6
Всего получено оценок: 481.
4.6
Средняя оценка: 4.6
Всего получено оценок: 481.
Алюминий (Al) – лёгкий металл, занимающий третье место по распространённости в земной коре среди химических элементов. Строение атома алюминия позволяет легко обрабатывать металл: он поддаётся литью, формовке, механическому воздействию.
Строение
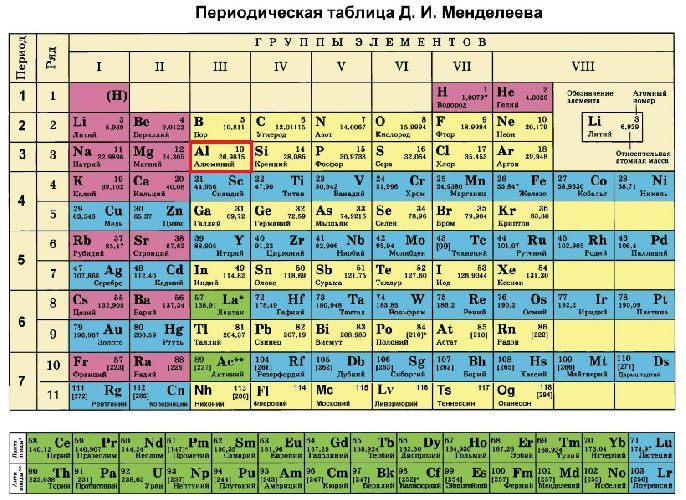
Электронное строение атома элемента алюминия связано с его положением в периодической таблице Менделеева. Алюминий имеет 13 порядковый номер и находится в третьем периоде, в IIIa группе. Относительная атомная масса алюминия – 27. Электронная конфигурация атома алюминия – 1s22s22p63s23p1, модель распределения электронов – +13Al)2)8)3.
Атом элемента состоит из положительно заряженного ядра +13 (13 протонов и 14 нейронов) и трёх электронных оболочек с 13 электронами. На внешнем энергетическом уровне находится всего три электрона. В возбуждённом состоянии атом способен отдавать все три электрона, проявляя степень окисления +3, или образовывать три ковалентные связи. Поэтому алюминий имеет третью валентность.
В природе алюминий встречается только в составе соединений – глины, слюды, корунда. Металл ценился дороже золота до открытия промышленного способа его получения.
Свойства
Алюминий – серебристый металл, обладающий высокой электропроводностью и пластичностью. Элемент при комнатной температуре легко соединяется с кислородом, образуя на поверхности оксидную плёнку, защищающую металл от коррозии. Образование плёнки препятствует реакции с водой, концентрированными азотной и серной кислотами, поэтому алюминиевая тара подходит для перевозки этих кислот.
Для снятия оксидной плёнки используют соли аммония, горячие щёлочи, сплавы ртути. После разрушения оксидной плёнки алюминий вступает в реакцию со многими неметаллами и соединениями. Основные химические свойства элемента описаны в таблице.
|
Взаимодействие |
Ход реакции |
Пример |
|
С водой |
Только в условиях отсутствия оксидной плёнки. Образуется гидроксид алюминия |
2Al + 6H2O → 2Al(OH)3 + 3H2 |
|
С кислородом |
Образуется оксид алюминия |
4Al + 3O2 → 2Al2O3 + Q |
|
С галогенами |
При комнатной температуре. С йодом – в присутствии катализатора |
2Al + 3Cl2 → 2AlCl3 |
|
С серой |
При температуре выше 200°С, образуется сульфид алюминия |
2Al + 3S → Al2S3 |
|
С фосфором |
При температуре 500°С, образуется фосфид алюминия |
Al + P → AlP |
|
С азотом |
При температуре 800°С, образуется нитрид алюминия |
2Al + N2 → 2AlN |
|
С углеродом |
При температуре 2000°С, образуется карбид алюминия |
4Al + 3C → Al4C3 |
|
С кислотами |
При комнатной температуре реагирует с разбавленными кислотами, при нагревании – с концентрированными. Образуются соли |
– 2Al + 3H2SO4 → Al2(SO4)3 + 3H2; – 2Al + 6HCl → 2AlCl3 + 3H2; – Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O |
|
Со щелочами |
Реагируют растворы и сплавы |
– 2Al + 2NaOH + 10H2O → 2Na[Al(H2O)2(OH)4] + 3H2; – 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2 |
|
С оксидами |
Вытесняет металлы |
2Al + Cr2O3 = 2Cr + Al2O3 |
Алюминий не взаимодействует с водородом.
Что мы узнали?
Атом алюминия включает 13 электронов. Схема строения алюминия – 1s22s22p63s23p1. На внешнем уровне находится три электрона, определяющие третью валентность элемента. Алюминий – лёгкий, плавкий металл, легко вступающий в реакцию с кислородом и образующий на поверхности оксидную плёнку. Благодаря плёнке металл не подвержен коррозии и не вступает в реакцию с концентрированными кислотами. При комнатной температуре алюминий реагирует с галогенами, при нагревании – с серой, фосфором, азотом, углеродом.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
El’nore Christopher
5/5
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 481.
А какая ваша оценка?
Al (алюминий) – элемент с прядковым номером 13 в периодической системе.
Находится в III периоде. Температура плавления: 660.5 ℃. Плотность: 2.7 г/см3.
Электронная формула атома алюминия:
1s2 2s2 2p6 3s2 3p1
Сокращенная электронная конфигурация Al:
[Ne] 3s2 3p1
Ниже приведена электронно-графическая схема атома алюминия
Распределение электронов по энергетическим уровням в атоме Al
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 3
Валентные электроны алюминия
Количество валентных электронов в атоме алюминия – 3.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
Степени окисления, которые может проявлять алюминий: +3
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,655 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,944 -
разное
16,904
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Алюминий в таблице менделеева занимает 13 место, в 3 периоде.
| Символ | Al |
| Номер | 13 |
| Атомный вес | 26.9815385 |
| Латинское название | Aluminium |
| Русское название | Алюминий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема алюминия
Al: 1s2 2s2 2p6 3s2 3p1
Короткая запись:
Al: [Ne]3s2 3p1
Одинаковую электронную конфигурацию имеют
атом алюминия и
Si+1, P+2, S+3, Cl+4
Порядок заполнения оболочек атома алюминия (Al) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Алюминий имеет 13 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
1 электрон на 3p-подуровне
Степень окисления алюминия
Атомы алюминия в соединениях имеют степени окисления 3, 1.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы алюминия
Валентность Al
Атомы алюминия в соединениях проявляют валентность III, I.
Валентность алюминия характеризует способность атома Al к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Al
Квантовые числа определяются последним электроном в конфигурации,
для атома Al эти числа имеют значение N = 3, L = 1, Ml = -1, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Al:
Eo = 578 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Al в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве