Электронное строение атома азота
Электронное строение нейтрального атома азота в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме азота.
N
+7
2
5
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме азота.
| 2 | ↑↓ | ↑ | ↑ | ↑ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома азота выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома азота.
7N 1s2 2s2 2p3
Сокращённая электронная конфигурация атома азота.
7N [He] 2s2 2p3
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома азота.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 2s | 2 | 0 | 0 | +½ |
| -½ | ||||
| 2p | 2 | 1 | -1 | +½ |
| 1 | +½ | |||
| 2 | +½ |
Строение атома азота


4.7
Средняя оценка: 4.7
Всего получено оценок: 207.
4.7
Средняя оценка: 4.7
Всего получено оценок: 207.
Азот (N) – газ, содержание которого в атмосфере составляет около 78 %. Азот входит в состав аминокислот и нуклеотидов. Строение атома азота определяет физические и химические свойства элемента.
Строение
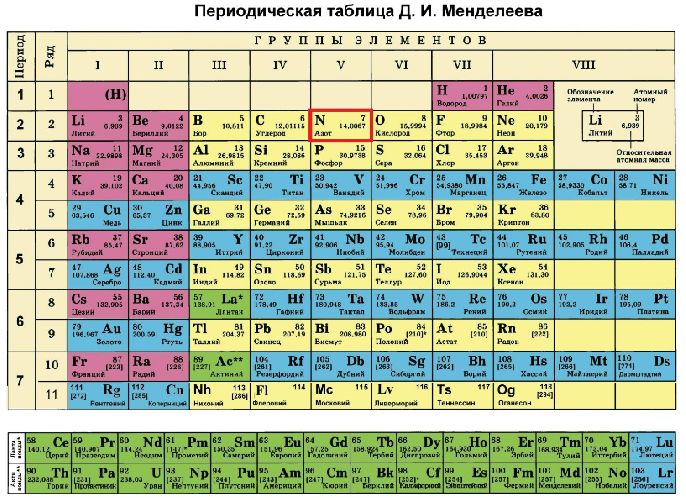
Азот – седьмой элемент периодической таблицы, расположенный в пятой группе и втором периоде. Относительная атомная масса равна 14. В природных условиях встречаются два изотопа азота – 14N и 15N.
Азот состоит из ядра с зарядом +7 и семи электронов, распределённых по двум энергетическим уровням. Нахождение элемента в пятой группе указывает на количество электронов на внешнем уровне и высшую валентность. В невозбуждённом состоянии на внешнем энергетическом уровне находится три электрона, поэтому азот может проявлять две валентности – III и V.
Запись электронного строения атома азота – 1s22s22p3 или +7 N)2)5.
Физические свойства
Азот – двухатомный (N2) газ без запаха и вкуса, плохо растворимый в воде. Азот может находиться в газообразном, жидком и твёрдом состояниях. В сжиженной форме азот имеет температуру кипения -196°С. При -209,86°C азот становится твёрдым. Под влиянием разных температур кристаллическая решётка твёрдого азота может изменяться, создавая модификации элемента.

Химические свойства
Атомы азота соединены тройной связью (N ≡ N), что обеспечивает максимальную прочность. Даже при нагревании азота до 3000°C наблюдается незначительное разложение молекул (до 0,1 % от взятого количества газа). Именно поэтому азот – химически малоактивный элемент. В соединениях при нагревании азот легко расстаётся с другими элементами.
Основные химические свойства азота приведены в таблице.
|
Взаимодействие |
Продукт реакции |
Пример |
|
С металлами (реагирует с сильными восстановителями) |
Соль |
6Li + N2 → 2Li3N |
|
Окисление под действием электрического тока |
Оксид азота |
O2 + N2 → 2NO |
|
С водородом в присутствии катализатора (Fe), под действием температуры (400 °С) и давления (200 атм) |
Аммиак |
3H2 + N2 → 2NH3 |
|
С неметаллами при высоких температурах |
Соль |
2B + N2 → 2BN |
Соединения азота с металлами и неметаллами называются нитридами.
Азот не реагирует с кислотами, водой и основаниями. Невозможно непосредственное взаимодействие молекул азота с серой и галогенами. Более активно с этими веществами при нормальных условиях реагирует атомарный азот.
Применение
Несмотря на пассивность азота, элемент широко применяется в промышленности. Кроме того, азот входит в состав клеток, без него невозможно построение белка и ДНК.
Азот используется при производстве:
- удобрений;
- взрывчатых веществ;
- медикаментов;
- красителей;
- пластмассы;
- искусственных волокон;
- аммиака.
Жидкий азот используется для охлаждения, заморозки, а также для окисления двигателей ракет. Оксид азота применяется в качестве наркоза и для производства аэрозолей.

Что мы узнали?
Рассмотрели схему строения азота, его физические, химические свойства, применение. Азот состоит из положительно заряженного ядра и двух электронных оболочек, на которых находится семь электронов. Азот – малоактивный газ. Молекула азота состоит из двух атомов элемента, соединённых тройной связью. Азот может находиться в трёх агрегатных состояниях. Элемент реагирует с некоторыми металлами, неметаллами и кислородом. Азот используется в промышленности, медицине, сельском хозяйстве. Кроме того, азот входит в состав живых организмов.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Александр Котков
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 207.
А какая ваша оценка?
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,653 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,912 -
разное
16,901
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
N (азот) – элемент с прядковым номером 7 в периодической системе.
Находится во II периоде. Температура плавления: -209.9 ℃. Плотность: 0.00117 г/см3.
Электронная формула атома азота:
1s2 2s2 2p3
Сокращенная электронная конфигурация N:
[He] 2s2 2p3
Ниже приведена электронно-графическая схема атома азота

Распределение электронов по энергетическим уровням в атоме N
1-й уровень (K): 2
2-й уровень (L): 5

Валентные электроны азота
Количество валентных электронов в атоме азота – 5.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 2 | 0 | 0 | +1/2 |
| s | 2 | 0 | 0 | -1/2 |
| p | 2 | 1 | -1 | +1/2 |
| p | 2 | 1 | 0 | +1/2 |
| p | 2 | 1 | 1 | +1/2 |
Степени окисления, которые может проявлять азот: -3, -2, -1, +1, +2, +3, +4, +5
Азот (N) – газ, содержание которого в атмосфере составляет около 78 %. Азот входит в состав аминокислот и нуклеотидов. Строение атома азота определяет физические и химические свойства элемента.

Строение
Азот – седьмой элемент периодической таблицы, расположенный в пятой группе и втором периоде. Относительная атомная масса равна 14. В природных условиях встречаются два изотопа азота – 14N и 15N.

Рис. 1. Азот в таблице Менделеева.
Азот состоит из ядра с зарядом +7 и семи электронов, распределённых по двум энергетическим уровням. Нахождение элемента в пятой группе указывает на количество электронов на внешнем уровне и высшую валентность. В невозбуждённом состоянии на внешнем энергетическом уровне находится три электрона, поэтому азот может проявлять две валентности – III и V.
Запись электронного строения атома азота – 1s22s22p3 или +7 N)2)5.
Физические свойства
Азот – двухатомный (N2) газ без запаха и вкуса, плохо растворимый в воде. Азот может находиться в газообразном, жидком и твёрдом состояниях. В сжиженной форме азот имеет температуру кипения -196°С. При -209,86°C азот становится твёрдым. Под влиянием разных температур кристаллическая решётка твёрдого азота может изменяться, создавая модификации элемента.

Рис. 2. Жидкий и твёрдый азот.
Химические свойства
Атомы азота соединены тройной связью (N ≡ N), что обеспечивает максимальную прочность. Даже при нагревании азота до 3000°C наблюдается незначительное разложение молекул (до 0,1 % от взятого количества газа). Именно поэтому азот – химически малоактивный элемент. В соединениях при нагревании азот легко расстаётся с другими элементами.
Основные химические свойства азота приведены в таблице.
|
Взаимодействие |
Продукт реакции |
Пример |
|
С металлами (реагирует с сильными восстановителями) |
Соль |
6Li + N2 → 2Li3N |
|
Окисление под действием электрического тока |
Оксид азота |
O2 + N2 → 2NO |
|
С водородом в присутствии катализатора (Fe), под действием температуры (400 °С) и давления (200 атм) |
Аммиак |
3H2 + N2 → 2NH3 |
|
С неметаллами при высоких температурах |
Соль |
2B + N2 → 2BN |
Соединения азота с металлами и неметаллами называются нитридами.
Азот не реагирует с кислотами, водой и основаниями. Невозможно непосредственное взаимодействие молекул азота с серой и галогенами. Более активно с этими веществами при нормальных условиях реагирует атомарный азот.
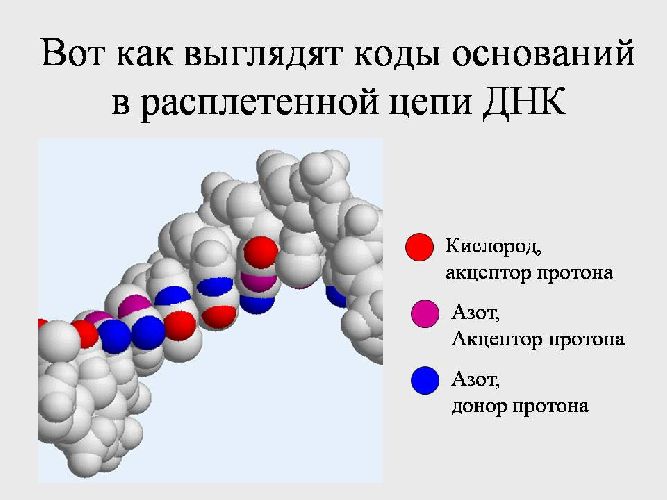
Применение
Несмотря на пассивность азота, элемент широко применяется в промышленности. Кроме того, азот входит в состав клеток, без него невозможно построение белка и ДНК.

Рис. 3. Азот в составе ДНК.
Азот используется при производстве:
- удобрений;
- взрывчатых веществ;
- медикаментов;
- красителей;
- пластмассы;
- искусственных волокон;
- аммиака.
Жидкий азот используется для охлаждения, заморозки, а также для окисления двигателей ракет. Оксид азота применяется в качестве наркоза и для производства аэрозолей.
Что мы узнали?
Рассмотрели схему строения азота, его физические, химические свойства, применение. Азот состоит из положительно заряженного ядра и двух электронных оболочек, на которых находится семь электронов. Азот – малоактивный газ. Молекула азота состоит из двух атомов элемента, соединённых тройной связью. Азот может находиться в трёх агрегатных состояниях. Элемент реагирует с некоторыми металлами, неметаллами и кислородом. Азот используется в промышленности, медицине, сельском хозяйстве. Кроме того, азот входит в состав живых организмов.
Предыдущая
ХимияСтроение атома кратко и понятно (химия, 8 класс), электронно-графическая формула
Следующая
ХимияСтроение атома алюминия, электронная оболочка и схема элемента
