Алгоритм составления схемы гальванического элемента.
-
Записать схемы
электродов. -
Используя
уравнение Нернста рассчитать величины
электродных потенциалов. -
Определить,
зная, что φк
φа,
электрод-анод и электрод-катод. -
Составить
схему гальванического элемента,
используя принятую форму записи. -
Записываем
уравнения катодной, анодной и суммарной
реакций, идущих в элементе. -
Рассчитать ЭДС
гальванического элемента.
Пример
1. Составить
схему гальванического элемента, анодом
которого является магний, погруженный
в раствор соли с концентрацией 0,01М.
Решение.
1.
Записываем схему электрода: Mg|Mg2+
-
По
уравнению. Нернста рассчитываем величину
электродного потенциала:
![]()
-
Так
как в условии задачи не указан материал,
из которого изготовлен катод, то
используя соотношение φк
φа,
выбираем металл с более положительным
потенциалом. Например, цинковый электрод.
Значение потенциала выбранного электрода
определяем по таблице «Стандартные
электродные потенциалы металлов при
250С».
Следовательно,
![]() .
.
-
Записываем схему
гальванического элемента:
А(-)
Mg|Mg2+||Zn2+|Zn (+)K
-
Записываем
электродные реакции:
А(-)
Mg
2e–
Mg2+
K(+)
Zn2+
+ 2e–
Zn0
Суммарная
реакция: Mg0
+ Zn2+
Mg2+
+ Zn0
-
Рассчитываем ЭДС
гальванического элемента:
![]()
Пример
2. Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с рН =3 и железного
электрода, погруженного в раствор соли
с концентрацией 0.1М. Рассчитайте ЭДС
элемента.
Решение.
1.
Записываем схемы электродов:
Водородный
– 2Н+|
Н2
(Pt);
Железный
–
Fe|Fe2+
-
По
уравнению Нернста рассчитываем величину
электродного потенциала железного
электрода:
![]()
Используя
уравнение Нернста (4) рассчитываем
величину электродного потенциала
водородного электрода:
![]()
-
Используя
соотношение φк
φа
определяем электрод-анод.
Так
как величина φ-потенциала
железного электрода меньше
следовательно этот электрод является
анодом.
-
Записываем схему
гальванического элемента:
А(-) Fe|Fe2+||2H+|H2 (+)
K
-
Рассчитываем ЭДС
гальванического элемента.
![]()
Задания для
самоконтроля
-
Составьте
схему гальванического элемента,
состоящего из никелевого электрода-катода,
погруженного в раствор соли с концентрацией
0.02М. Напишите уравнения электродных
реакций и вычислите ЭДС гальванического
элемента. -
Составьте
схему гальванического элемента,
состоящего из медного электрода,
погруженного в раствор соли меди с
концентрацией 0.01М и железного электрода,
погруженного в раствор соли железа с
концентрацией 0.1М. Напишите уравнения
электродных реакций. Вычислите ЭДС
гальванического элемента. -
Составьте
схему гальванического элемента,
состоящего из стандартного водородного
электрода и ртутного электрода.
Рассчитайте его ЭДС при [Hg2+]=0,1
М. Напишите уравнения электродных
реакций. -
Составьте
схему и рассчитайте ЭДС концентрированного
гальванического элемента, составленного
из двух железных электродов, погруженных
в раствор соли железа с концентрациями
1 М и 0,01 М. Напишите уравнения электродных
реакций. -
В гальваническом
элементе протекает химическая реакция
Zn+NiSO4=ZnSO4+Ni.
Напишите его схему
и уравнения электродных реакций.
Вычислите ЭДС этого элемента при
стандартных условиях. Какой металл
вместо никеля можно взять, чтобы увеличить
ЭДС?
-
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=5,
и марганцевого электрода, погруженного
в раствор соли марганца с концентрацией
0,2 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС. -
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=10,
и серебряного электрода, погруженного
в раствор соли серебра с концентрацией
0,01 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как рассчитать ЭДС гальванического элемента
Решение задач на составление схемы гальванического элемента
Задание 251.
При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля. Ответ: 0,0295 В.
Решение:
Гальванический элемент, электроды которого сделаны из одного и того же металла будет работать при условии, что электроды будут опущены в растворы солей с разной концентрацией. Схема гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой – в 0,01М растворе сульфата никеля имеет вид:
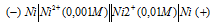
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность).
Определим электродные потенциалы никелевых электродов при разных концентрациях ионов серебра Ni2+, получим:
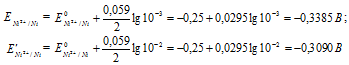
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
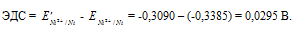
Ответ: 0,0295 В.
Задание 252.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Рb2+] = [Мg2+] = 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз? Ответ: 2,244 В.
Решение:
Схема гальванического элемента
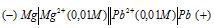
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (—2,37 В) и является анодом, на котором протекает окислительный процесс:
Мg0 – 2 = Mg2+ (1)
= Mg2+ (1)
Свинец, потенциал которой -0,127 В – катод, т.е. электрод, на котором протекает восстановительный процесс:
Pb2+ + 2  = Pb0 (2)
= Pb0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg0 + Pb2+ = Mg2+ + Pb0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
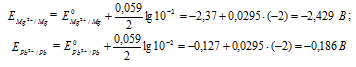
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
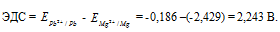
Если концентрацию каждого из ионов Mg2+ и Pb2+ увеличить в одинаковое число раз, то ЭДС гальванического элемента не изменится, так как при этом соответственно будут уменьшаться численные значения потенциалов металлов, а разница между значениями их не изменится. Например, при увеличении концентрации ионов в 100 раз концентрация их примет значения 1 моль/л, а потенциалы электродов станут равными стандартным потенциалам металлов, то ЭДС = -0,127 – (-2,37) = 2,243 В.
Ответ: 2,243 В.
Задание 253.
Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором никель является катодом:
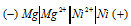
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки – границу раздела двух жидких фаз – пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg0 – 2  = Mg2+ (1)
= Mg2+ (1)
Никель, потенциал которой -0,25 В – катод, т.е. электрод, на котором протекает восстановительный процесс:
Ni2+ + 2  = Ni0 (2)
= Ni0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg0 + Ni2+ = Mg2+ + Ni0
б) Схема гальванического элемента, в котором никель является анодом:
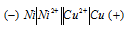
Никель имеет меньший потенциал (-0,25 В) и является анодом, на котором протекает окислительный процесс:
Ni0 – 2  = Ni2+ (1)
= Ni2+ (1)
Медь, потенциал которой (+0,34 В) – катод, т.е. электрод, на котором протекает восстановительный процесс:
Сu2+ + 2  = Сu0 (2)
= Сu0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Ni0 + Cu2+ = Ni2+ + Cu0
Задание 254.
Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и на катоде.
Решение:
Стандартные электродные потенциалы железа и серебра соответственно равны -0,44 В и +0,80 В. Исходя из того, что железо имеет более электроотрицательный потенциал, чем водород 0,00 В, то между железом и раствором серной кислоты проходит реакция (железо вытесняет водород из кислоты), и железная пластинка при этом будет уменьшаться по массе:
Fe + H2SO4 = FeSO4 + H2
Исходя из того, что серебро имеет более электроположительный потенциал, чем водород, то между серебром и раствором серной кислоты реакция не проходит. Но так как железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты, то между ними будет проходить окислительно-восстановительный процесс, в котором железная пластина будет анодом, а серебряная – катодом.
На аноде протекает процесс:
Fe0 → Fe2+ + 2 
На катоде серебряной пластинке будут разряжаться ионы водорода:
2Н+ + 2  → Н20
→ Н20
Схема гальванического элемента имеет вид:
(-) Fe | Fe2+ || 2H+ | H2, Ag (+)
Задание 255.
Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Мg2+] = [Cd2+] = 1 моль/л. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л? Ответ: 1,967 В.
Решение:
Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg0 – 2  = Mg2+ (1)
= Mg2+ (1)
Кадмий, потенциал которой (-0,403 В) – катод, т.е. электрод, на котором протекает восстановительный процесс:
Cd2+ + 2  = Cd0 (2)
= Cd0 (2)
Схема гальванического элемента имеет вид:
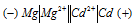
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
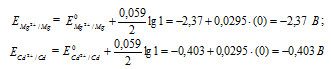
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
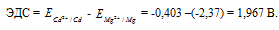
Рассчитаем электродные потенциалы магния и кадмия при концентрации их ионов в растворе равной 0,01 моль/л:
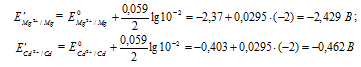
Рассчитаем ЭДС:
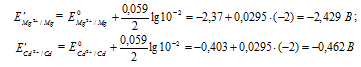
Таким образом, ЭДС гальванического элемента при равном уменьшении концентрации ионов металлов в их растворах не изменяется.
Ответ: 1,967 В.
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Содержание:
1) Простейший гальванический элемент: схема работы.
2) Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
3) Типовые задачи на схему гальванического элемента: примеры решения.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:

В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.

Возникает так называемый двойной электрический слой.

Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:

На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn2+. Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:

Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu2+из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO42-и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.

Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
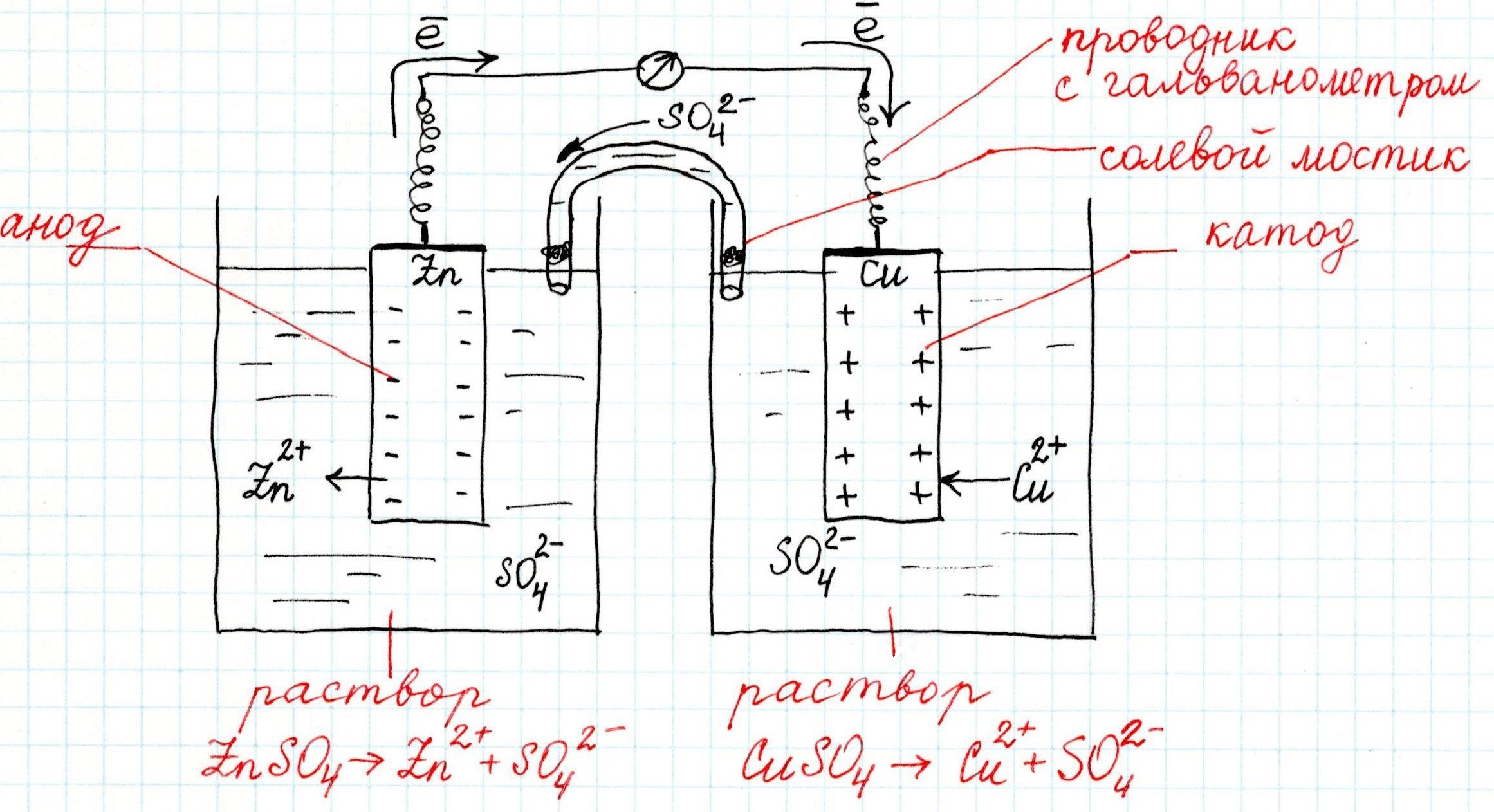
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):

Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):

Катионы меди Cu2+, пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:

Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
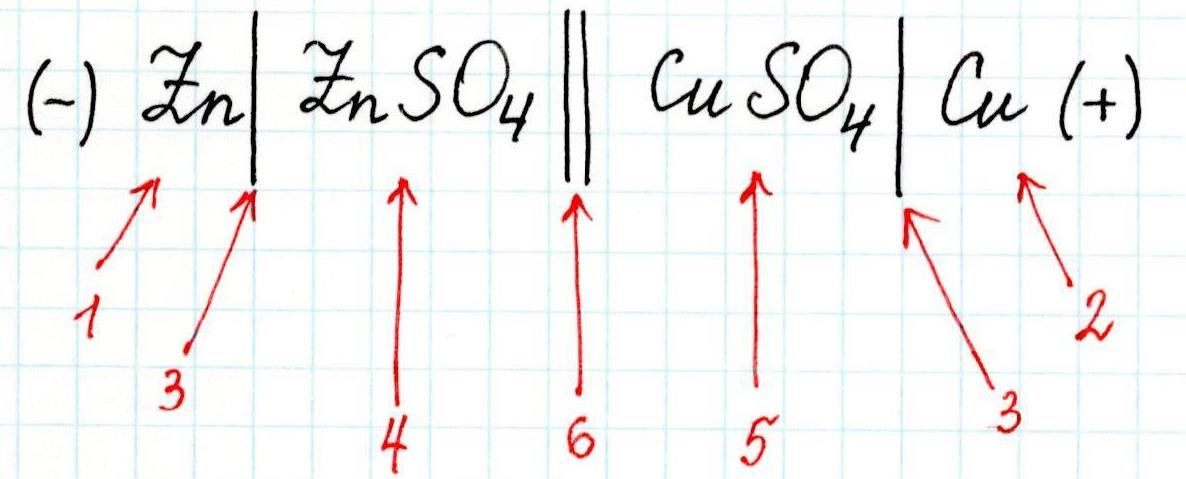
Здесь:
1 – анод;
2 – катод;
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:
 Решение:
Решение:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:
 Решение:
Решение:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Как составить схему гальванического элемента
В основе работы гальванического элемента, или элемента Даниэля, лежат химические реакции для выработки электрической энергии. Несколько гальванических элементов соединенных между собой составляют батарею. Расчет такой электрохимической ячейки не составляет трудностей.

Вам понадобится
- Справочная литература
- База по окислительно-восстановительным потенциалам
- Стандартные электродные потенциалы при 25o С
- Ручка
- Листок бумаги
Инструкция
Подобрать химические элементы, которые будут использованы для работы с помощью базы по окислительно-восстановительным потенциалам. Очень часто в таких целях используют сульфат цинка и медный купорос, потому что их очень легко приобрести в любом садоводческом магазине.
Записать формулу гальванического элемента в стандартном виде. Например:
Zn | ZnSO4 || CuSO4 | Cu
Здесь вертикальная линия обозначает границу раздела фаз, а двойная вертикальная линия – солевой мостик.
Записать электродные полуреакции, пользуясь таблицей электродных потенциалов. Обычно их записывают в виде реакций восстановления. Для нашего примера это выглядит следующим образом:
Правый электрод: +2Cu + 2e = Cu
Левый электрод: +2Zn + 2e = Zn
Записать общую реакцию на гальваническом элементе. Она представляет собой разность между реакциями на правом и левом электродах:
+2Cu + Zn = Cu + Zn2+
Рассчитать потенциалы левого и правого электродов по формуле Нернста.
Рассчитать электродвижущую силу (ЭДС) для гальванического элемента. Она, в общем случае, равна разности потенциалов левого и правого электродов. Если ЭДС положительна, то реакция на электродах протекает самопроизвольно. Если ЭДС отрицательна, то самопроизвольно протекает обратная реакция. Для большинства гальванических элементов ЭДС находится в пределах 1.1 Вольта.
Обратите внимание
Старайтесь выбирать те химические элементы, которые не являются токсичными или особо вредными, так как их будет сложно найти в продаже, и они могут нанести непоправимый вред вашему здоровью.
Полезный совет
Перед тем как выбирать вещества для гальванического элемента, посоветуйтесь со специалистом или найдите в справочной литературе, какая пара даст наибольшую положительную разность потенциалов.
Проверьте свои расчеты несколько раз или дайте их на проверку опытному человеку.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Свинцовую и цинковую пластины опустили в раствор нитрата серебра. Составьте уравнения реакций, происходящих на этих пластинах. Какие процессы будут проходить на пластинах, если наружные концы их соединить проводником? Напишите схему гальванического элемента.
Решение задачи
Запишем уравнения химических реакций, происходящих на пластинах.
Свинцовая пластина:
![]()
Pb0 – 2e– → Pb2+
Ag+ + e– → Ag+
Цинковая пластина:
![]()
Zn0 – 2e– → Zn2+
Ag+ + e– → Ag0
Если наружные концы пластин соединить проводником, образуется гальванический элемент.
Гальванический элемент (ГЭ) – это устройство, в котором энергия химической реакции превращается в электрическую. В основе работы гальванического элемента лежит ОВР.
Составим схему гальванического элемента:
Zn │Zn(NO3)2 ║ Pb(NO3)2 │Pb
Сравним стандартные электродные потенциалы цинка (Zn) и свинца (Pb):
E0(Zn2+/Zn0) = – 0,76 В,
E0(Pb 2+/ Pb 0) = – 0,13 В.
Цинк (Zn) – металл, имеющий более отрицательное значение стандартного электродного потенциала и поэтому является более сильным восстановителем. Следовательно, цинк (Zn) будет подвергаться окислению под действием ионов свинца (Pb), и электроны от цинка (Zn) будут переходить к свинцу(Pb):
Таким образом, Zn – анод (А) и Zn – восстановитель, Pb – катод.
(–) Zn │Zn(NO3)2 ║ Pb(NO3)2 │Pb (+)
Электроны двигаются от цинка к свинцу. Схема гальванического элемента
Запишем электронные уравнения процессов, протекающих на электродах на пластинах, и составим суммарное уравнение:
(-) (А) Zn0 – 2e– → Zn2+ – процесс окисления
(+) (K) Ag+ + e– → Ag0 – процесс восстановления
Схема гальванического элемента
Вывод:
при замыкании пластин цинковая пластина растворяется, а на свинцовой пластине осаждается серебро.
