Алгоритм составления схемы гальванического элемента.
-
Записать схемы
электродов. -
Используя
уравнение Нернста рассчитать величины
электродных потенциалов. -
Определить,
зная, что φк
φа,
электрод-анод и электрод-катод. -
Составить
схему гальванического элемента,
используя принятую форму записи. -
Записываем
уравнения катодной, анодной и суммарной
реакций, идущих в элементе. -
Рассчитать ЭДС
гальванического элемента.
Пример
1. Составить
схему гальванического элемента, анодом
которого является магний, погруженный
в раствор соли с концентрацией 0,01М.
Решение.
1.
Записываем схему электрода: Mg|Mg2+
-
По
уравнению. Нернста рассчитываем величину
электродного потенциала:
![]()
-
Так
как в условии задачи не указан материал,
из которого изготовлен катод, то
используя соотношение φк
φа,
выбираем металл с более положительным
потенциалом. Например, цинковый электрод.
Значение потенциала выбранного электрода
определяем по таблице «Стандартные
электродные потенциалы металлов при
250С».
Следовательно,
![]() .
.
-
Записываем схему
гальванического элемента:
А(-)
Mg|Mg2+||Zn2+|Zn (+)K
-
Записываем
электродные реакции:
А(-)
Mg
2e–
Mg2+
K(+)
Zn2+
+ 2e–
Zn0
Суммарная
реакция: Mg0
+ Zn2+
Mg2+
+ Zn0
-
Рассчитываем ЭДС
гальванического элемента:
![]()
Пример
2. Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с рН =3 и железного
электрода, погруженного в раствор соли
с концентрацией 0.1М. Рассчитайте ЭДС
элемента.
Решение.
1.
Записываем схемы электродов:
Водородный
– 2Н+|
Н2
(Pt);
Железный
–
Fe|Fe2+
-
По
уравнению Нернста рассчитываем величину
электродного потенциала железного
электрода:
![]()
Используя
уравнение Нернста (4) рассчитываем
величину электродного потенциала
водородного электрода:
![]()
-
Используя
соотношение φк
φа
определяем электрод-анод.
Так
как величина φ-потенциала
железного электрода меньше
следовательно этот электрод является
анодом.
-
Записываем схему
гальванического элемента:
А(-) Fe|Fe2+||2H+|H2 (+)
K
-
Рассчитываем ЭДС
гальванического элемента.
![]()
Задания для
самоконтроля
-
Составьте
схему гальванического элемента,
состоящего из никелевого электрода-катода,
погруженного в раствор соли с концентрацией
0.02М. Напишите уравнения электродных
реакций и вычислите ЭДС гальванического
элемента. -
Составьте
схему гальванического элемента,
состоящего из медного электрода,
погруженного в раствор соли меди с
концентрацией 0.01М и железного электрода,
погруженного в раствор соли железа с
концентрацией 0.1М. Напишите уравнения
электродных реакций. Вычислите ЭДС
гальванического элемента. -
Составьте
схему гальванического элемента,
состоящего из стандартного водородного
электрода и ртутного электрода.
Рассчитайте его ЭДС при [Hg2+]=0,1
М. Напишите уравнения электродных
реакций. -
Составьте
схему и рассчитайте ЭДС концентрированного
гальванического элемента, составленного
из двух железных электродов, погруженных
в раствор соли железа с концентрациями
1 М и 0,01 М. Напишите уравнения электродных
реакций. -
В гальваническом
элементе протекает химическая реакция
Zn+NiSO4=ZnSO4+Ni.
Напишите его схему
и уравнения электродных реакций.
Вычислите ЭДС этого элемента при
стандартных условиях. Какой металл
вместо никеля можно взять, чтобы увеличить
ЭДС?
-
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=5,
и марганцевого электрода, погруженного
в раствор соли марганца с концентрацией
0,2 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС. -
Составьте
схему гальванического элемента,
состоящего из водородного электрода,
погруженного в раствор с pH=10,
и серебряного электрода, погруженного
в раствор соли серебра с концентрацией
0,01 М. Напишите уравнения электродных
реакций и рассчитайте его ЭДС.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Составить схему коррозионного гальванического элемента, возникающего при повреждении лужёного железа в кислой среде …
Ученик
(129),
закрыт
3 года назад
Антон Дятлов
Гений
(83312)
6 лет назад
Если железо луженое, значит образована пара железо-олово.
Выпишем стандартные электродные потенциалы (из таблицы) обоих элементов: E0(Fe(2+)/Fe)=-0,44 B, E0(Sn(2+)/Sn)=-0,136 B. Более отрицательный потенциал имеет железо, поэтому оно представляет собой анод при коррозии, соответственно олово будет катодом. В то же время, в кислой среде E(H2)=0 B, E(O2)=1,23BТермодинамически возможна коррозия обоих металлов с кислородной деполяризацией.
Запишем процессы.
Анод: Fe-2e=Fe(2+).
Катод: О2+4Н (+)+4е=2Н2О
Суммарный процесс: 2Fe+O2+4H(+)=2Fe(2+)+2H2O.
Cхема коррозионного элемента:
(-) анод Fe| H2O, H(+), O2|Sn катод (+)
Покрытие катодное.
Фундаментальные законы физики и химии, и в том числе, закон сохранения массы и энергии вещества, находят свое подтверждение на уровне перемещения мельчайших частиц – электронов, массами которых в химии обычно пренебрегают.
Речь идет об окислительно-восстановительных процессах, сопровождающихся переходом электронов от одних веществ (восстановителей) к другим (окислителям). Причем вещества могут обмениваться электронами, непосредственно соприкасаясь друг с другом.
Однако существует множество случаев, когда прямого контакта веществ не происходит, а процесс окисления-восстановления все равно идет. А если он идет самопроизвольно, то при этом еще и энергия выделяется. Ее человек с успехом использует для выполнения электрической работы.
Реализуется такая возможность в гальваническом элементе, схема работы которого, а также расчеты, связанные с ним, рассматриваются в данной статье.
Содержание:
1) Простейший гальванический элемент: схема работы.
2) Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
3) Типовые задачи на схему гальванического элемента: примеры решения.
Простейший гальванический элемент: схема работы
Гальванический элемент – это прибор, позволяющий при посредстве химической реакции получить электрическую энергию.
Пластинка металла и вода: простые взаимоотношения
Давайте сначала разберемся, что происходит с пластинкой металла, если опустить ее в воду?
Процесс схож с диссоциацией соли: диполи воды ориентируются к ионам металла и извлекают их из пластины. Но почему же тогда не происходит растворения самой пластины в воде? Все дело в строении кристаллической решетки.
Кристаллы соли состоят из катионов и анионов, поэтому диполями воды извлекаются из решетки и те, и другие.
У металла же кристаллическая решетка представлена атомами-ионами. Внутри нее всегда происходит превращение атомов в катионы за счет отщепления валентных электронов и обратный процесс: катионы снова превращаются в атомы, присоединяя электроны. Электроны являются общими для всех ионов и атомов, присутствующих в кристаллической решетке металла.
Процессы внутри металлической кристаллической решетки в обобщенном виде можно показать так:

В итоге, вода, окружающая пластинку – это уже не собственно вода, а раствор, составленный из молекул воды и перешедших в нее из пластины ионов металла. На пластине же возникает избыток электронов, которые скапливаются у ее поверхности, так как сюда притягиваются гидратированные катионы металла.

Возникает так называемый двойной электрический слой.

Бесконечно катионы металла с пластины в раствор уходить не будут, поскольку существует и обратный процесс: переход катионов из раствора на пластину. И он будет идти до тех пор, пока не наступит динамическое равновесие:

На границе раздела «металлическая пластина – раствор» возникает разность потенциала, которая называется равновесным электродным потенциалом металла.
Пластинка металла и раствор его соли: к чему приводит такое соседство
А что произойдет, если металлическую пластинку поместить не в воду, а в раствор соли этого же металла, например, цинковую пластинку Zn в раствор сульфата цинка ZnSO4?
В растворе сульфата цинка уже присутствуют катионы цинка Zn2+. Таким образом, при погружении в него цинковой пластины возникнет избыточное количество этих катионов, и уже известное нам равновесие (см. выше) сместится влево. Все это приведет к тому, что отрицательный заряд на пластинке будет иметь меньшее значение, так как меньшее количество катионов с нее будет переходить в раствор. Как результат – более быстрое наступление равновесия и менее значительный скачок потенциала.
Потенциал металла в растворе его же соли в момент равновесия записывают так:

Металл, погруженный в раствор электролита, называют электродом, обратимым относительно катиона.
Цинк – достаточно активный металл. А если речь будет идти о медной пластинке Cu, погруженной в раствор, например, сульфата меди (II) CuSO4?
Медь – металл малоактивный. Двойной электрический слой, конечно же, появится и в этом случае. Но! Катионы из пластинки в раствор переходить не будут. Наоборот, катионы меди (II) Cu2+из раствора соли начнут встраиваться в кристаллическую решетку пластинки и создавать положительный заряд на ее поверхности. Сюда же подойдут сульфат-анионы SO42-и создадут вокруг нее отрицательный заряд. То есть распределение зарядов в данном случае будет совершенно противоположным, чем на цинковой пластинке.

Это общая закономерность: пластинки из малоактивных металлов при погружении в раствор их солей всегда заряжаются положительно.
Как устроен гальванический элемент Даниэля-Якоби, или Так где же все-таки электрический ток?
Известно, что электрический ток – это направленное движение заряженных частиц (электронов).
На активном металле скапливаются электроны, а поверхность малоактивного металла, заряжается положительно. Если соединить проводником (например, металлической проволокой) оба металла, то электроны с одного перейдут на другой, а двойной электрический слой перестанет существовать. Это будет означать возникновение электрического тока.
Причем, ток возникает за счет окислительно-восстановительного процесса: активный металл окисляется (так как отдает электроны малоактивному), а малоактивный металл восстанавливается (так как принимает электроны от активного). Металлы друг с другом не соприкасаются, а взаимодействуют через посредника: внешнего проводника. Данная схема и есть схема гальванического элемента. Именно так устроен и работает гальванический элемент Даниэля-Якоби:
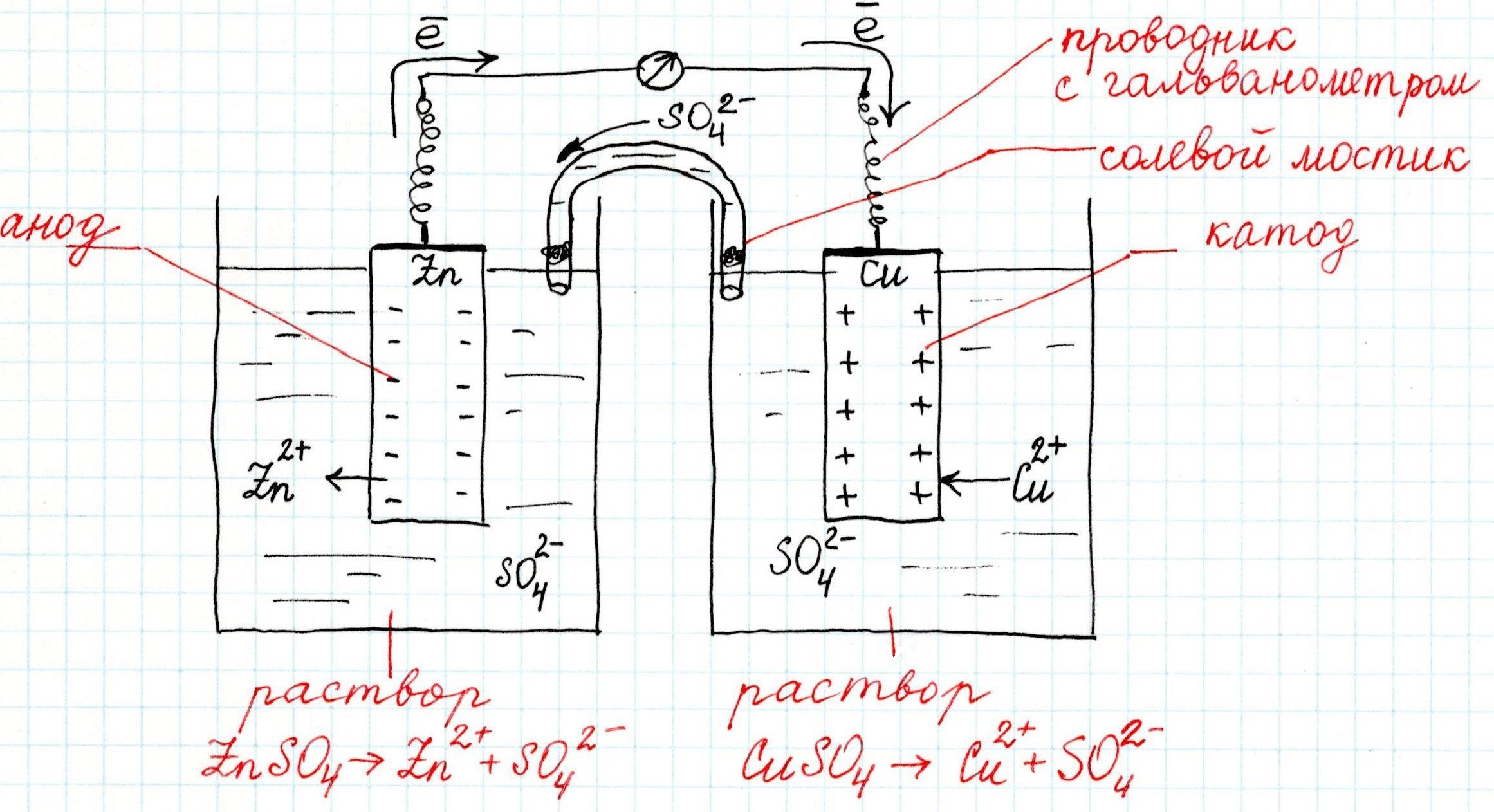
В схеме элемента показан «солевой мостик». Он представляет собой трубку, в которой присутствует электролит, не способный взаимодействовать ни с электродами (катодом или анодом), ни с электролитами в пространствах у электродов. Например, это может быть раствор сульфата натрия Na2SO4. Подобный мостик нужен для того, чтобы уравновешивать (нейтрализовать) заряды, образующиеся в растворах гальванического элемента.
Таким образом, возникшая электрическая цепь замыкается: анод → проводник с гальванометром → катод → раствор в катодном пространстве → «солевой мостик» → раствор в анодном пространстве → анод.
Анод – электрод, на котором происходит окисление (цинковая пластинка):

Электроны цинка Zn отправляются по внешней цепи (то есть по проводнику) на катод.
Катод – электрод, на котором происходит восстановление (медная пластинка):

Катионы меди Cu2+, пришедшие на пластинку из раствора сульфата меди (II), получают электроны цинкового анода.
В общем виде весь процесс окисления-восстановления в гальваническом элементе выглядит так:

Для любого гальванического элемента можно составить запись в виде схемы. Например, для приведенного элемента Даниэля-Якоби она будет выглядеть так:
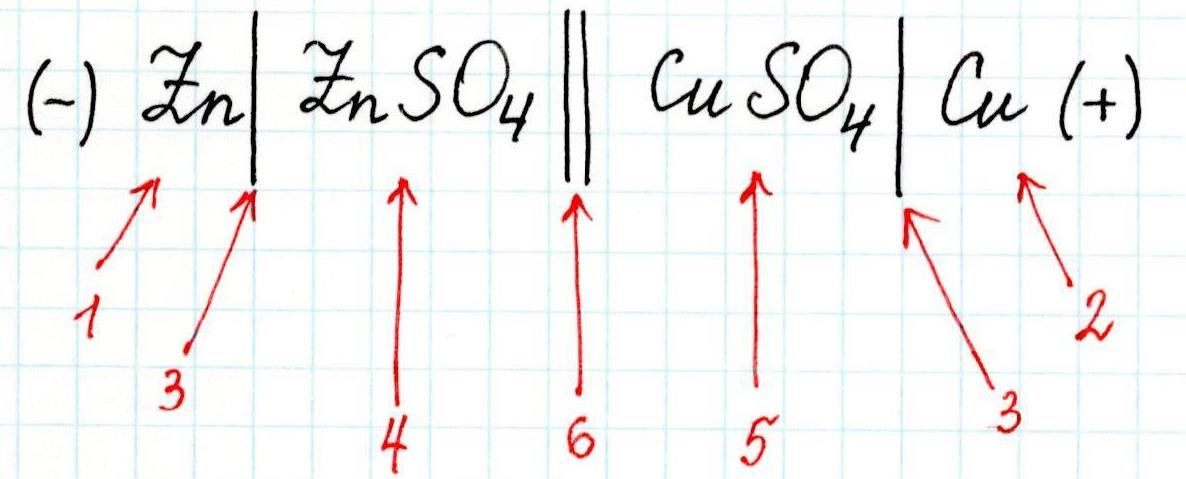
Здесь:
1 – анод;
2 – катод;
3 – скачок потенциала (граница раздела фаз);
4 – электролит в анодном пространстве;
5 – электролит в катодном пространстве;
6 – граница между растворами (солевой мостик).
Или сокращенно:
Типовые задачи на схему гальванического элемента: примеры решения
По вопросу, рассмотренному в данной статье, возможны два основных вида задач.
Задача 1. Составьте схему гальванического элемента, в котором протекает реакция:
 Решение:
Решение:

Задача 2. Напишите электродные и суммарные уравнения реакций, протекающих в гальваническом элементе:
 Решение:
Решение:

Итак, разобрав принцип работы гальванического элемента, мы научились записывать схему его работы и определять основные процессы на электродах.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.


Гальванические элементы коррозия металлов
Задача 54.
а) Алюминиевый электрод погружен в 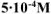 раствор сульфата алюминия. Вычислить значение потенциала алюминиевого электрода.
раствор сульфата алюминия. Вычислить значение потенциала алюминиевого электрода.

Решение:
Электродный потенциал алюминия рассчитываем по уравнению Нериста:
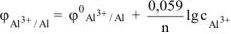
По таблице 11.1 определяем стандартный электродный потенциал алюминия
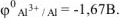
Записываем уравнение электродного процесса, протекающего на поверхности алюминиевого электрода в растворе соли:
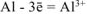
n — число электронов, участвующих в электродном процессе. Для данной реакции n равно заряду иона алюминия 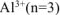 . Рассчитываем концентрацию ионов алюминия в растворе
. Рассчитываем концентрацию ионов алюминия в растворе 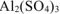 :
:
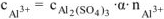
Разбавленный раствор 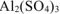 — сильный электролит.
— сильный электролит.
Следовательно, а = 1. По уравнению диссоциации 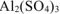 :
:
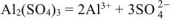
число ионов 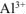 , образующихся при диссоциации одной молекулы
, образующихся при диссоциации одной молекулы 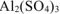 равно 2.
равно 2.
Следовательно, 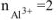
Тогда 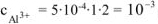 моль/л.
моль/л.
Рассчитываем электродный потенциал алюминиевого электрода:
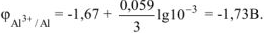
Ответ: 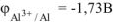
б) Потенциал цинкового электрода, погруженного в раствор своей соли, равен (-0,75В). Вычислить концентрацию ионов цинка в растворе.

Решение:
Электродный потенциал цинка определяется по уравнению Нернста:
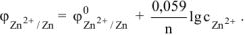
Откуда: 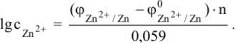
По таблице 11.1 определяем стандартный электродный потенциал цинка
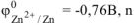 — равно заряду иона цинка
— равно заряду иона цинка 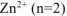 .
.
Тогда: 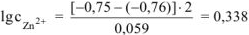
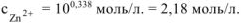
Ответ: 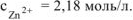 .
.
Задача 55.
Составить две схемы гальванических элементов (ГЭ), в одной из которых олово служило бы анодом, в другой — катодом. Для одной из них написать уравнения электродных процессов и суммарной токообразующей реакции. Вычислить значение стандартного напряжения ГЭ.
Решение:
В гальваническом элементе анодом является более активный металл с меньшим алгебраическим значением электродного потенциала, катодом — менее активный металл с большим алгебраическим значением электродного потенциала.
По таблице 11.1 находим 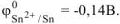 .
.
а) Олово является анодом ГЭ.
В качестве катода можно выбрать любой металл с
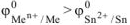
Выбираем, например, медь 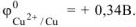 . В паре
. В паре 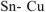 — олово будет являться анодом ГЭ, медь — катодом. Составляем схему ГЭ:
— олово будет являться анодом ГЭ, медь — катодом. Составляем схему ГЭ:
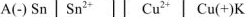
или

Уравнения электродных процессов:
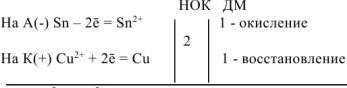
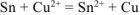 — суммарное ионно-моленкулярное уравнение токообразующей реакции
— суммарное ионно-моленкулярное уравнение токообразующей реакции
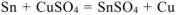 — суммарное молекулярное уравнение токообразующей реакции;
— суммарное молекулярное уравнение токообразующей реакции;
Рассчитываем стандартное напряжение ГЭ:
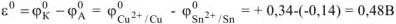
б) Олово является катодом ГЭ.
В качестве анода ГЭ можно выбрать любой металл с
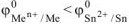 — кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
— кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
Выбираем, например, магний 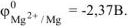
В паре 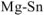 — магний является анодом, олово — катодом. Составляем схему ГЭ:
— магний является анодом, олово — катодом. Составляем схему ГЭ:
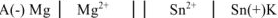
или

Задача 56.
Составить схему коррозионного гальванического элемента, возникающего при контакте железа с цинком в:
а) атмосферных условиях 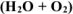 ;
;
б) кислой среде  ;
;
в) кислой среде в присутствии кислорода 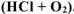 .
.
Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
Решение:
По таблице 11.1 находим значение стандартных электродных потенциалов железа и цинка:
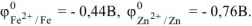
Так как 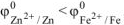 то анодом коррозионного гальванического элемента будет являться цинк, катодом — железо.
то анодом коррозионного гальванического элемента будет являться цинк, катодом — железо.
а) Коррозия в атмосферных условиях  .
.
Составляем схему коррозионного ГЭ:
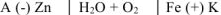
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:

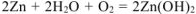 — суммарное молекулярное уравнение процесса коррозии.
— суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде 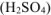
Составляем схему коррозионного ГЭ:
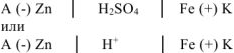
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:

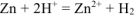 — суммарное ионно-молекулярное уравнение процесса коррозии;
— суммарное ионно-молекулярное уравнение процесса коррозии;
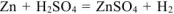 — суммарное молекулярное уравнение процесса коррозии.
— суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода 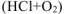 .
.
Составляем схему коррозионного ГЭ:
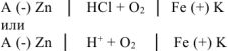
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
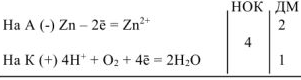
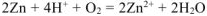 — суммарное ионно-молекулярное уравнение процесса коррозии
— суммарное ионно-молекулярное уравнение процесса коррозии
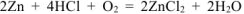 — суммарное молекулярное уравнение процесса коррозии.
— суммарное молекулярное уравнение процесса коррозии.
Во всех случаях коррозионному разрушению будет подвергаться более активный металл — цинк.
Задача 57.
Составить схему гальванического элемента (ГЭ), образованного цинковым электродом, погруженным в 1М раствор хлорида цинка, и хромовым электродом, погруженным в 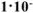
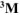 раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.
раствор хлорида хрома (III). Рассчитать напряжение ГЭ, написать уравнения электродных процессов и суммарной токообразующей реакции.

Решение:
Для составления схемы ГЭ необходимо знать величины электродных потенциалов металлов — цинка и хрома.
По таблице 11.1 определяем стандартные электродные потенциалы металлов:
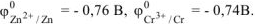
Хлорид цинка диссоциирует по уравнению:
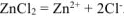
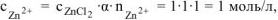
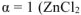 — сильный электролит),
— сильный электролит), 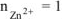 , поскольку условия стандартные
, поскольку условия стандартные 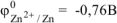 .
.
Хлорид хрома (III) диссоциирует по уравнению:
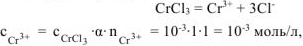
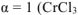 — сильный электролит),
— сильный электролит), 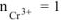 , поскольку условия отличны от стандартных, рассчитываем электродный потенциал хрома:
, поскольку условия отличны от стандартных, рассчитываем электродный потенциал хрома:
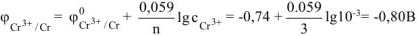
Так как 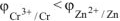 , то в ГЭ анодом будет являться хром, катодом — цинк.
, то в ГЭ анодом будет являться хром, катодом — цинк.
Составляем схему ГЭ:
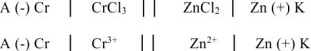
Составляем уравнения электродных процессов и суммарной токообразующей реакции:
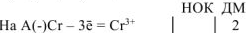
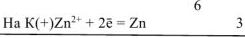
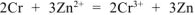 — суммарное ионно-молекулярное уравнение токообразующей реакции
— суммарное ионно-молекулярное уравнение токообразующей реакции
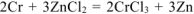 — суммарное молекулярное уравнение токообразующей реакции.
— суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем напряжение ГЭ:
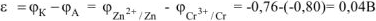
Ответ: 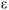 = 0,04В.
= 0,04В.
Задача 58.
Составить схему ГЭ, в котором протекает химическая реакция  . Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов
. Написать уравнения электродных процессов. На основании стандартных значений энергий Гиббса образования ионов 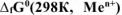 , рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.
, рассчитать стандартное напряжение ГЭ и константу равновесия реакции при 298К.

Решение:
На основании реакции, приведенной в условии задачи, составляем уравнения электродных процессов:

Анодом ГЭ является электрод, на котором происходит процесс окисления. Катодом — электрод, иа котором происходит процесс восстановления. Тогда в рассматриваемом ГЭ анодом будет являться железо, катодом — никель.
Составляем схему ГЭ:
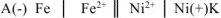
Рассчитываем стандартное напряжение ГЭ:

Рассчитываем константу равновесия токообразующей реакции (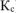 ).
).
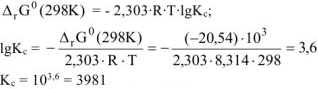
Ответ: 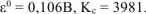 .
.
Задача 59.
Составить схему коррозионного ГЭ, возникающего при контакте железной пластинки площадью 20 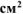 с никелевой в растворе соляной кислоты НС1. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
с никелевой в растворе соляной кислоты НС1. Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
а) Вычислить объемный и весовой показатели коррозии, если за 40 минут в процессе коррозии выделилось 0,5 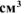 газа (н.у.).
газа (н.у.).
б) Вычислить весовой и глубинный показатели коррозии, если за 120 минут потеря массы железной пластинки составила 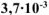 г. Плотность железа равна 7,9 г/
г. Плотность железа равна 7,9 г/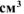 .
.
Решение:
По таблице 11.1 находим значения стандартных электродных потенциалов железа и никеля:

Так как 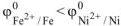 то анодом коррозионного ГЭ будет являться железо, катодом — никель.
то анодом коррозионного ГЭ будет являться железо, катодом — никель.
Составим схему коррозионного ГЭ:
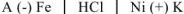
или
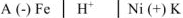
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
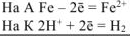
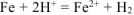 — суммарное ионно-молекуляриое уравнение процесса коррозии.
— суммарное ионно-молекуляриое уравнение процесса коррозии.
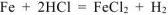 — суммарное молекулярное уравнение процесса коррозии.
— суммарное молекулярное уравнение процесса коррозии.
а)

Рассчитываем объемный показатель коррозии 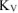 по формуле:
по формуле:
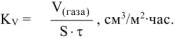
При расчете 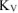 принимаем:
принимаем: 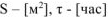 ,
, 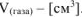 .
.
Из уравнения суммарной реакции процесса коррозии следует, что при коррозии выделяется водород.
Следовательно, 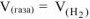 —
—
Тогда, 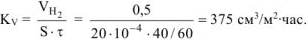 .
.
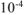 — коэффициент пересчета,
— коэффициент пересчета,  .
.
Рассчитываем весовой показатель коррозии 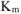 по формуле:
по формуле:
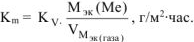
В процессе коррозии разрушению подвергается железо и выделяется водород.
Следовательно:
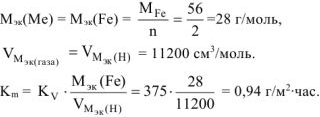
Ответ: 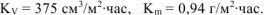
б)

Рассчитываем весовой показатель коррозии 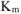 по формуле:
по формуле:
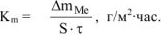
Коррозии подвергается железо. Тогда потеря массы металла
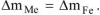
При расчете 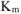 принимаем:
принимаем: 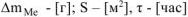 .
.
Тогда: 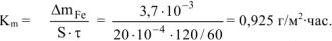
Рассчитываем глубинный показатель коррозии по формуле:
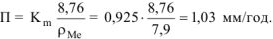
Ответ: 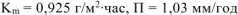 .
.
Эти задачи взяты со страницы готовых задач по предмету химия:
Решение задач по химии
Возможно эти страницы вам будут полезны:

