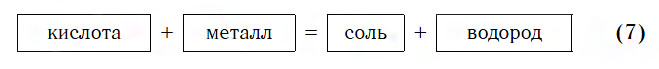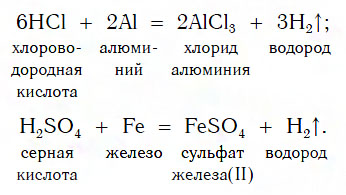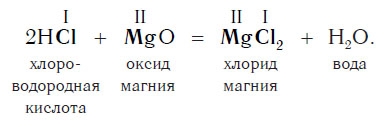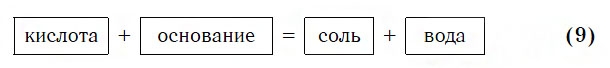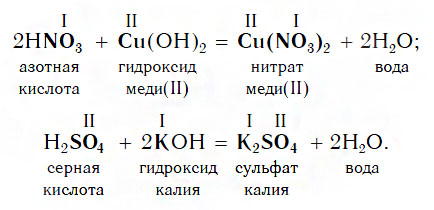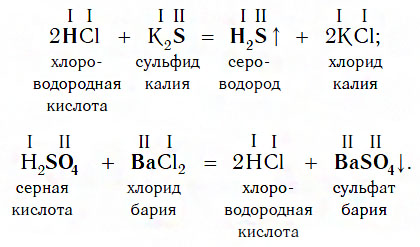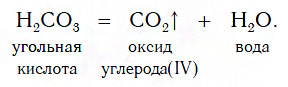Кислоты их классификация и номенклатура (Таблица)
Кислоты — это химические соединения, которые способны отдавать катион водорода (также называют кислоты Бренстеда), либо соединения, которые способны принимать электронную пару с образованием ковалентной связи (кислоты Льюиса).
Физические свойства: жидкие или твердые вещества, некоторые хорошо растворяются в воде, имеют кислый вкус.
Классификация кислот схема
Кислоты подразделяют по наличию кислорода (кислородные, безкислородные), по основности (одноосновные, многоосновные), по летучести (летучие, нелетучие), по силе (сильные, слабые), по стабильности (стабильные, нестабильные) и по растворимости в воде (растворимые, нерастворимые).
Классификация кислот таблица
|
Классификация кислот признаки |
Группы кислот |
Примеры |
|
Наличие кислорода в кислотном остатке |
а) кислородные б) бескислородные |
H3PO4, HNO3 H2S, НСl, HBr |
|
Основность (по количеству) |
а) одноосновные б) двухосновные в) трехосновные |
HCl, HNO3 H2S, H2SO4 H3PO4 |
|
Растворимость в воде |
а) растворимые б) нерастворимые |
H2SO4, H2S, HNO3 H2SiO3 (только эта!) |
|
Летучесть кислот |
а) летучие б) нелетучие |
H2S, HCl, HNO3 H2SO4, H2SiO3, H3PO4 |
|
Степень электролитической диссоциации |
а) сильные б) слабые |
H2SO4, HCl, HNO3 H2S, H2SO3, H2CO3 |
|
Стабильность кислот |
а) стабильные б) нестабильные |
H2SO4, H3PO4, НСl H2SO3, H2CO3, H2SiO3 |
Номенклатура кислот таблица
|
Номенклатура кислот |
Правило составления названия |
Примеры |
|
Бескислородная кислота |
К названию неметалла с окончанием –о добавляется слово водородная |
H2S – сероводородная НСl – хлороводородная |
|
Кислородсодержащая; степень окисления соответствует номеру группы |
Суффикс -ная или –вая |
HN+5O3 – азотная H2Si+4O3 – кремниевая HCl+7O4 – хлорная |
|
Кислородсодержащая; степень окисления ниже максимальной |
Суффиксы –оватая, -истая, -оватистая |
НСl+5O3 – хлорноватая НСl+3O2 – хлористая НСlO – хлорноватистая |
|
Элемент в одной и той же степени окисления образует несколько кислородсодержащих кислот |
К названию кислоты с меньшим содержанием кислородных атомов добавляется префикс мета-; с большим — префикс орто- |
H2SiO3 – метакремниевая H4SiO4 – ортокремниевая |
Таблица номенклатура кислот их кислотный остаток и ангидрид
|
Номенклатура кислот |
Кислотный остаток |
Ангидрид |
||
|
Формула |
Название |
Формула |
Название |
|
|
HF |
Фтороводородная (плавиковая) |
Фторид F– |
— |
— |
|
НСl |
Хлороводородная (соляная) |
Хлорид Сl– |
— |
— |
|
НВr |
Бромоводородная |
Бромид Вг– |
— |
— |
|
HI |
Иодоводородная |
Йодид I– |
— |
— |
|
H2S |
Сероводородная |
Гидросульфил HS– Сульфид S2- |
— |
— |
|
H2SO4 |
Серная |
Гидросульфат HSO4– Сульфат SO42- |
SO3 |
Серный |
|
H2SO2 |
Сернистая |
Гидросульфит HSO3– Сульфит SO32- |
SO2 |
Сернистый |
|
HNO3 |
Азотная |
Нитрат NO3– |
N2O5 |
Азотный |
|
HNO2 |
Азотистая |
Нитрит NO2– |
N2O3 |
Азотистый |
|
НPO3 |
Метафосфорная |
Метафосфат PO3– |
P2O5 |
Фосфорный |
|
H3PO4 |
Ортофосфорная |
Дигидрофосфат H2PO4– Гидрофосфат HPO42- Фосфат PO43- |
P2O5 |
Фосфорный |
|
H4P2O7 |
Дифосфорная (пирофосфорная) |
Тригидродифосфат Н3P2O7– Дигидродифосфат Н2P2O72- Гидродифосфат НP2O73- Дифосфат P2O74- |
P2O5 |
Фосфорный |
|
H3AsO4 |
Мышьяковая |
Дигидроарсенат H2AsO3– Гидроарcенат HAsO42- Арсенат AsO43- |
As2O5 |
Мышьяковый |
|
H3AsO3 |
Мышьяковистая |
Дигидроарсенит H2AsO3– Гидроарсенит HAsO32- Арсенит AsO33- |
As2O3 |
Мышьяковистый |
|
HMnO4 |
Марганцовая |
Перманганат МnО4– |
Mn2O7 |
Марганцовый |
|
HClO4 |
Хлорная |
Перхлорат ClО4– |
Сl2O7 |
Хлорный |
|
H2CrO4 |
Хромовая |
Гидрохромат HCrО4– Хромат CrО42- |
CrO3 |
Хромовый |
|
H2Cr2O7 |
Двухромовая |
Гидродихромат HCr2O7– Дихромат Cr2O72- |
CrO3 |
Хромовый |
|
H2S2O7 |
Дисерная |
Гидродисульфат HS2O7– Дисульфат S2O72- |
SO3 |
Серный |
|
H2MnO4 |
Марганцовистая |
Гидроманганат HMnO4– Манганат MnO42- |
MnO3 |
Марганцовистый |
|
H3BO3 |
Борная |
Дигидроборат H2BO3– Гидроборат HBO32- Борат BO33- |
B2O3 |
Борный |
|
H2CO3 |
Угольная |
Гидрокарбонат HCO3– Карбонат CO32- |
CO2 |
Угольный |
|
H2SiO3 |
Кремниевая |
Силикат SiO32- |
SiO2 |
Кремниевый |
|
СН3СООН |
Уксусная |
Ацетат СН3СОО– |
(СН3СO)2O |
Уксусный |
_____________
Источник информации: Насонова А.Е. Химия, школьная программа в таблицах и формулах, 1998
Поделитесь ссылкой с друзьями:
Похожие таблицы
Комментарии:
Содержание
- Как научиться писать формулы кислот
- Что такое кислоты?
- Что нужно знать для написания формул кислот
- Как записывать формулы кислот
- Как запомнить названия кислот
- Итог
- Как научиться писать формулы кислот
- 1. Изучите номенклатуру
- 2. Используйте таблицу периодических элементов
- 3. Определите общую формулу кислоты
- 4. Попрактикуйтесь в написании формул кислот
- 5. Не останавливайтесь на достигнутом
- Итог
- Как научиться писать формулы кислот
- Шаг 1: Изучайте систему номенклатуры
- Шаг 2: Определите ионы
- Шаг 3: Представление формулы
- Окисные кислоты
- Неокисные кислоты
- Двойные кислоты
- Итоги
Как научиться писать формулы кислот
Химия – это наука, которая обязательна для изучения в школе, и которая является базой для многих других наук. От знания химии зависит, как мы питаемся, как дышим, как вообще живем. Одной из базовых тем химии являются кислоты, без знания которых невозможно дальнейшее изучение химии.
Что такое кислоты?
Кислоты – это соединения, которые образуются в результате химических реакций и которые могут передавать водородные ионы. Они играют важную роль во многих жизненных процессах как в организмах, так и вне них. Нужно понимать, что кислоты бывают разного вида, и каждая из них имеет свое назначение.
Что нужно знать для написания формул кислот
- Символ каждого элемента. Обычно он прописывается с большой буквы.
- Валентность каждого элемента. Она показывает, сколько связей данный элемент может образовать.
- Формулы проводимости и диссоциации. Они описывают, как образуется и как распадается данное соединение.
Как записывать формулы кислот
Формулы кислот состоят из обозначения элементов и знаков, которые описывают их взаимодействие. Обычно кислоты записываются таким образом: элемент, затем валентность, затем -некоторый знак- и количество, затем -еще один знак-, и квадратные скобки, в которых указываются ионы.
Например, HCl — хлороводород, H2SO4 — серная кислота, HNO3 — азотная кислота, H3PO4 — фосфорная кислота.
Если в кислоте много водорода, то знаки заменяются на индексы, и через дефис прописываются ионы.
Например, H2 SO4 — серная кислота, H2 CO3 — угольная кислота, H3 PO4 — фосфорная кислота.
Как запомнить названия кислот
Все кислоты можно разделить на три большие группы: двойные, оксокислоты и гидроксокислоты.
В названии двойных кислот слово «водород» не указывается, например, Хlorovododoro – это Cl – галоген, поэтому у него валентность -1. Между ним и водородом (H) образуется одна ковалентная связь. Слово «кислоты» тоже не ставится — вместо него название оксида и слово «кислый». Например, H2S04 называется серной кислотой, а SO2 — сернистым ангидридом.
Для запоминания оксокислот стоит знать, что большинство из них содержат положительный ион и граничат с кислородом. Обычно они означаются названием иона и прибавлением суффикса «–овый» или «–ный». Например, H2SO4 — серная кислота, HNO3 — азотная кислота, HClO – хлорноватистая кислота.
Гидроксокислоты представляют собой смесь оксида, гидроксида и воды. Они являются более сложными соединениями и содержат металлы. Их название обычно состоит из названия металла, слова «кислый» и «вода». Например, С – уголь, поэтому у него валентность – 4. Х2SO3 – сернистая кислота, а Fe(NO3)3 – азотная кислота трехвалентного иона железа (III).
Итог
Кислоты – это важный элемент химии, который играет важную роль во многих жизненных процессах. Знание кислот и умение записывать их формулы – это необходимые навыки для всех, кто сталкивается с химией. Запоминание всего алфавита кислот может показаться непростой задачей, но с помощью правильного подхода и знаний о классификации кислот – возможно избежать путаницы и запомнить все формулы.
Как научиться писать формулы кислот
Кислоты являются важным классом химических соединений, которые играют важную роль в нашей жизни. Они используются в многих областях, включая медицину, пищевую промышленность и производство удобрений. Понимание того, как писать формулы кислот, является важным навыком для любого, кто занимается химией. Это также может помочь улучшить ваше понимание химических реакций и процессов, в которых кислоты участвуют.
1. Изучите номенклатуру
Прежде чем писать формулы кислот, вам необходимо изучить общую номенклатуру, используемую для классификации кислот. Она включает в себя названия, префиксы и суффиксы, которые даются кислотам в зависимости от их структуры и свойств. Например, название серной кислоты (H2SO4) содержит суффикс «-овая», который указывает на то, что кислота является оксидной.
- Оксидные кислоты: содержат кислород в своей структуре.
- Гидроксидные кислоты: содержат гидроксильную группу (-OH) в своей структуре.
- Сложные кислоты: содержат несколько кислотных групп в своей структуре.
2. Используйте таблицу периодических элементов
Таблица периодических элементов содержит информацию об атомах и молекулах, включая их массу, заряд, электронную конфигурацию и многое другое. Эта информация может быть полезна при определении структуры и свойств кислот, а также при написании их формул.
Примечание: Атомный заряд основного элемента и его валентность (количество свободных электронов) — ключевые характеристики для нахождения общей формулы кислоты.
3. Определите общую формулу кислоты
Найдите основной элемент, который является центральным в структуре кислоты, и определите количество связей, которые он образует с другими атомами. Это поможет вам определить общую формулу кислоты.
- Оксидные кислоты: общая формула HxAyOz, где H — водород, А — основной элемент, O — кислород, а x, y, z — целые числа.
- Гидроксидные кислоты: общая формула HnAx(OH)y, где H — водород, A — основной элемент, OH — гидроксильная группа, а n, x, y — целые числа.
- Сложные кислоты: общая формула HmAn(BxOy)z, где H — водород, A — основной элемент, B — второй элемент, O — кислород, а m, n, x, y, z — целые числа.
4. Попрактикуйтесь в написании формул кислот
Напишите формулы для различных кислот, используя полученные знания о номенклатуре, таблице периодических элементов и общей формуле кислоты.
- Серная кислота (H2SO4)
- Нитратная кислота (HNO3)
- Угольная кислота (H2CO3)
- Фосфорная кислота (H3PO4)
5. Не останавливайтесь на достигнутом
Научиться писать формулы кислот это только начало. Химия представляет собой огромное поле для изучения, где всегда есть что-то новое, что можно изучить и о чем можно узнать. От вам лишь зависит, насколько глубоко вы погружаетесь в эту науку и как много времени вы готовы уделять ей.
Знания в химии помогут вам развивать ваше понимание мира, так как химические процессы являются изначальными процессами в природе.
Итог
Научиться писать формулы кислот — это важный навык для лучшего понимания химии в целом. Это знание может помочь вам в работе и учебе, а также поможет расширить ваше образование в области естественных наук. Используя номенклатуру, таблицу периодических элементов и общую формулу кислоты, вы можете писать формулы для различных кислот и углублять свои знания в химии на все новый уровень.
Как научиться писать формулы кислот
Кислоты — это важнейшие химические соединения, учебный материал в школе и основа для понимания более сложных процессов в химии. Понимание, как писать формулы кислот, поможет лучше понимать их свойства и взаимодействие с другими веществами. В этой статье мы рассмотрим несколько шагов, которые помогут научиться писать формулы кислот.
Шаг 1: Изучайте систему номенклатуры
Первым шагом для понимания того, как писать формулы кислот, является изучение их номенклатуры. Именно номенклатура указывает, как именно называть кислоты, и позволяет на основе названия кислоты определять ее формулу.
- Окисные кислоты: они состоят из центрального атома (обычно атома металла), присоединенного к оксиду. Их название начинается с металла.
- Неокисные кислоты: они не содержат оксида, а состоят из центрального атома, окруженного атомами кислорода и других элементов. Их название заканчивается на -овая.
- Двойные кислоты: они состоят из двух кислотных радикалов, каждый из которых содержит отрицательный заряд. Их название заканчивается на -ная.
Шаг 2: Определите ионы
Определение ионного состава кислоты — это второй шаг, необходимый для того, чтобы научиться писать формулы кислот. Как правило, ионы кислот относятся к одной из двух категорий — они могут быть положительными или отрицательными.
- Положительные ионы: они обычно состоят из металла и нескольких водородных ионов. Обычно их записывают сначала металл, а затем водородные ионы.
- Отрицательные ионы: они обычно состоят из группы кислорода и некоторых других элементов. Обычно их записывают сначала кислород, а затем другие элементы.
Шаг 3: Представление формулы
После определения наименования кислоты и ее ионов, можно перейти к представлению ее формулы. Этот шаг по-разному может выполняться на основе названия кислоты.
Окисные кислоты
Окисные кислоты — это кислоты, которые содержат оксидный ион O2-. Формула такой кислоты обычно строится на основе следующего шаблона:
{металл}{оксид} -> {металловая кислота}
например:
Na2O -> H2O + Na2O —> H2Na2O3 (натриева триоксокарбоновая кислота)
Неокисные кислоты
Неокисные кислоты — это кислоты, которые не содержат оксида, но все же имеют кислотные свойства. Формула такой кислоты обычно строится на основе следующего шаблона:
{металл/радикал}{кислород} -> {неокислая кислота}
например:
NO2 -> HNO2 (азотная кислота)
Двойные кислоты
Двойные кислоты — это кислоты, которые состоят из двух кислотных радикалов, каждый из которых содержит отрицательный заряд.
{радикал1}{радикал2} -> {двойная кислота}
например:
SO4(2-) + HPO4(2-) -> H2SO4(H3PO4) (серная-фосфорная кислота)
Итоги
Научиться писать формулы кислот — это процесс, который требует постоянного обучения, практики и упорства. Понимание основных принципов и номенклатуры кислот поможет лучше понимать их химические свойства и научиться эффективно применять знания в решении более сложных химических задач.
Урок 35. Химические свойства кислот
В уроке 35 «Химические свойства кислот» из курса «Химия для чайников» узнаем о всех химических свойствах кислот, рассмотрим с чем они реагируют и что при этом образуется.
В состав молекулы любой кислоты обязательно входят атомы водорода, связанные с различными кислотными остатками. Такое подобие состава молекул обусловливает подобие химических свойств кислот. Оно выражается в том, что кислоты в водных растворах проявляют схожие химические свойства, называемые кислотными свойствами. Знание этих свойств очень важно для дальнейшего изучения химии, поэтому познакомимся с ними более подробно и систематизируем изученный ранее материал.
Изменение окраски индикаторов
Вы уже знаете, что для доказательства наличия кислоты или щелочи в растворе можно использовать особые вещества — индикаторы.
Вспомните, в какие цвета окрашены растворы индикаторов лакмуса, метилоранжа и фенолфталеина. Как изменяется их окраска в растворах кислот?
Взаимодействие с металлами
Из материала предыдущих тем вам известно, что в водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и выделяется газообразное простое вещество — водород:
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
Реакции этого типа, как вы уже знаете, относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.), с указанными кислотами в
водных растворах не реагируют.
Реакции с основными оксидами
Еще в младших классах, изучая математику, вы узнали, что от перемены мест слагаемых сумма не изменяется: 2 + 3 = 5; 3 + 2 = 5.
Похожее правило есть и в химии: если в уравнении реакции исходные вещества поменять местами, то ее продукты от этого не изменятся. Так, например, изучив ранее химические свойства основных оксидов, вы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, вы можете теперь смело утверждать, что кислоты реагируют с основными оксидами, образуя те же продукты — соли и воду:
Пример уравнения реакции, протекающей в соответствии с этой схемой:
Как вам уже известно, эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
Взаимодействие с основаниями
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами с образованием солей и воды. А что же тогда образуется при взаимодействии кислот с основаниями? Правильно, те же самые продукты — соли и вода! Мы еще раз убедились в том, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Итак, составим схему, согласно которой кислоты реагируют с основаниями:
Запомните, что в образующейся соли валентность атомов металла такая же, как в исходном основании, а валентность кислотного остатка такая же, как в исходной кислоте.
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
Реакции этого типа, как и предыдущего, относятся к реакциям обмена. Вспомните, как называется реакция, которую отображает последнее уравнение. Почему она так называется?
Взаимодействие с солями
Еще один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, — соли. Реакции этого типа идут по общей схеме:
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
Разложение кислот на кислотные оксиды и воду
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, которые называют неустойчивыми, относят угольную (H2CO3), сернистую (H2SO3) и кремниевую (H2SiO3) кислоты. Особенно неустойчива угольная кислота — она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
Краткие выводы урока:
- Кислоты в растворах изменяют окраску индикаторов.
- Кислоты реагируют с металлами, основными оксидами, основаниями и солями.
Надеюсь урок 35 «Химические свойства кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Как решать химические уравнения – схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO – 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Химические свойства кислот
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
На холоду — пассивация
Реакция не проходит
На холоду — пассивация
На холоду — пассивация
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Соляная кислота вступает в реакцию с каждым из двух веществ:
[spoiler title=”источники:”]
http://nauka.club/khimiya/khimicheskie-uravneniya.html
http://skysmart.ru/articles/chemistry/himicheskie-svojstva-kislot
[/spoiler]
Урок 35. Химические свойства кислот
В уроке 35 «Химические свойства кислот» из курса «Химия для чайников» узнаем о всех химических свойствах кислот, рассмотрим с чем они реагируют и что при этом образуется.
В состав молекулы любой кислоты обязательно входят атомы водорода, связанные с различными кислотными остатками. Такое подобие состава молекул обусловливает подобие химических свойств кислот. Оно выражается в том, что кислоты в водных растворах проявляют схожие химические свойства, называемые кислотными свойствами. Знание этих свойств очень важно для дальнейшего изучения химии, поэтому познакомимся с ними более подробно и систематизируем изученный ранее материал.
Изменение окраски индикаторов
Вы уже знаете, что для доказательства наличия кислоты или щелочи в растворе можно использовать особые вещества — индикаторы.
Вспомните, в какие цвета окрашены растворы индикаторов лакмуса, метилоранжа и фенолфталеина. Как изменяется их окраска в растворах кислот?
Взаимодействие с металлами
Из материала предыдущих тем вам известно, что в водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и выделяется газообразное простое вещество — водород:
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
Реакции этого типа, как вы уже знаете, относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.), с указанными кислотами в
водных растворах не реагируют.
Реакции с основными оксидами
Еще в младших классах, изучая математику, вы узнали, что от перемены мест слагаемых сумма не изменяется: 2 + 3 = 5; 3 + 2 = 5.
Похожее правило есть и в химии: если в уравнении реакции исходные вещества поменять местами, то ее продукты от этого не изменятся. Так, например, изучив ранее химические свойства основных оксидов, вы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, вы можете теперь смело утверждать, что кислоты реагируют с основными оксидами, образуя те же продукты — соли и воду:
Пример уравнения реакции, протекающей в соответствии с этой схемой:
Как вам уже известно, эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
Взаимодействие с основаниями
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами с образованием солей и воды. А что же тогда образуется при взаимодействии кислот с основаниями? Правильно, те же самые продукты — соли и вода! Мы еще раз убедились в том, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Итак, составим схему, согласно которой кислоты реагируют с основаниями:
Запомните, что в образующейся соли валентность атомов металла такая же, как в исходном основании, а валентность кислотного остатка такая же, как в исходной кислоте.
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
Реакции этого типа, как и предыдущего, относятся к реакциям обмена. Вспомните, как называется реакция, которую отображает последнее уравнение. Почему она так называется?
Взаимодействие с солями
Еще один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, — соли. Реакции этого типа идут по общей схеме:
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
Разложение кислот на кислотные оксиды и воду
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, которые называют неустойчивыми, относят угольную (H2CO3), сернистую (H2SO3) и кремниевую (H2SiO3) кислоты. Особенно неустойчива угольная кислота — она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
Краткие выводы урока:
- Кислоты в растворах изменяют окраску индикаторов.
- Кислоты реагируют с металлами, основными оксидами, основаниями и солями.
Надеюсь урок 35 «Химические свойства кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Кислоты. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
По растворимости в воде кислоты можно поделить на растворимые и нерастворимые . Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые) . Подробно про классификацию кислот можно прочитать здесь.
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
Например , оксид серы (VI) реагирует с водой с образованием серной кислоты:
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
Например , хлор реагирует с водородом:
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз раствора сульфата меди (II):
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
Например , соляная кислота диссоциирует почти полностью:
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
Например , сернистая кислота диссоциирует в две ступени:
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
3. Кислоты реагируют с основаниями и основными оксидами .
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
Например , гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой:
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
Например , уксусная кислота взаимодействует с гидроксидом алюминия:
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
Например , йодоводород можно окислить хлоридом меди (II):
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит . Такие реакции протекают по механизму ионного обмена.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например , соляная кислота взаимодействует с нитратом серебра в растворе:
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей .
Например , карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная):
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
Например , гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды:
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Например , гидроксокарбонат меди (II) растворяется в серной кислоте:
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Например , гидроксохлорид алюминия взаимодействует с соляной кислотой:
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Например , железо взаимодействует с соляной кислотой с образованием хлорида железа (II):
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
Азотная кислота HNO3 разлагается при нагревании или на свету:
Химические свойства кислот
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
На холоду — пассивация
Реакция не проходит
На холоду — пассивация
На холоду — пассивация
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Соляная кислота вступает в реакцию с каждым из двух веществ:
источники:
http://chemege.ru/kisloty/
http://skysmart.ru/articles/chemistry/himicheskie-svojstva-kislot
Как составлять формулы кислот(по химии)?
Профи
(956),
закрыт
13 лет назад
Бася Барбара
Знаток
(258)
13 лет назад
Они все даны.. Их просто выучить… Соляная-HCl//
По содержанию кислорода
бескислородные (HCl, H2S);
кислородосодержащие (HNO3).
По основности — количество кислых атомов водорода
Одноосновные (HPO3);
Двухосновные (H2SeO4, Азелаиновая кислота) ;
Трёхосновные (H3PO4).
Четырёхосновные (H4СO4).
По силе
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
По принадлежности к классам химических соединений
Неорганические (HBr);
Органические (HCOOH);
По летучести
Летучие (H2S, HCl);
Нелетучие (H2SO4) ;
По растворимости в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
Ирина
Гений
(88042)
13 лет назад
Их вообще-то учат. А состоят они из атомов водорода и кислотного остатка. Валентность водорода – 1. Например, H2SO4 – серная кислота
НЛО
Мыслитель
(9180)
13 лет назад
наименьшее общее кратное 2
H(+)2 SO4(2-)
раставляете сначала заряды ионов, затем находите наименьшее общее кратное и делите например в данном случае (2) разделить на 1 будет два и 2/2= 1 следовательно H2SO4