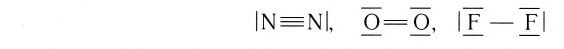Прежде, чем попытаться приблизиться непосредственно к ковалентному типу химической связи, внесём ясность относительно того, о чём собственно идёт речь. Что такое химическая связь вообще? На этот вопрос, я думаю, в массовом сознании едва ли найдётся ответ. Мы же с Вами здесь собрались для того, чтобы в том числе немного преодолеть те ограничения, которые накладывает на нас обыденное сознание.
Итак, давайте размышлять. Химическая связь – это некие силы, которые удерживают атомы (а иногда и молекулы) между собой, верно?
А какова природа этих сил?
Из курса физики мы знаем о четырёх фундаментальных типах взаимодействия: гравитационном, электромагнитном, сильном и слабом ядерном взаимодействиях. Первое из них слишком слабое, два последних действуют внутри ядра, остаётся электромагнитное взаимодействие.
И действительно, как бы ни было странно это признавать, природа химической связи на самом деле носит исключительно физический характер – всё, что удерживает атомы(а иногда и молекулы) между собой, все химические связи сводятся в конечном итоге к одному и тому же – электромагнитному взаимодействию, то есть взаимному притяжению разноимённо заряженных частиц. И, если в случае ионной связи всё достаточно очевидно (об инной связи тут), то в случае ковалентной – не очень. Итак мы выдвигаемся, чтобы понять, каким же образом разноимённо заряженным частицам нужно притягиваться друг к другу, чтобы мы назвали это ковалентной связью!
Начнём с того, что сведём всё многообразие природы атомов химических элементов до двух воплощений, а именно до металлов и неметаллов (как отличать металлы от неметаллов тут).
Металлы (Ме) характеризуются металлическими свойствами – способностью отдавать электроны, неметаллы (неМе) – неметаллическими свойствами – способностью эти электроны принимать (подробнее об этом тут).
На этом этапе мы приходим к формированию вот такой незатейливой схемы, которая в первом приближении даёт нам представление о типах химической связи.
И если в случае с ионной связью всё логично: металл отдаёт электроны, неметалл – принимает, то в случае с ковалентной связью возникает вопрос: если ковалентная связь – это связь, образованная между атомами химических элементов неметаллов, которые характеризуются неметаллическими свойствами, то есть, способностью принимать электроны, то откуда они будут принимать эти электроны?
Ответ: из обобществлённых электронных пар! Атомы химических элементов неметаллов, образуя ковалентную химическую связь, реализуют свою способность принимать электроны, воспринимая обобществлённые электронные пары.
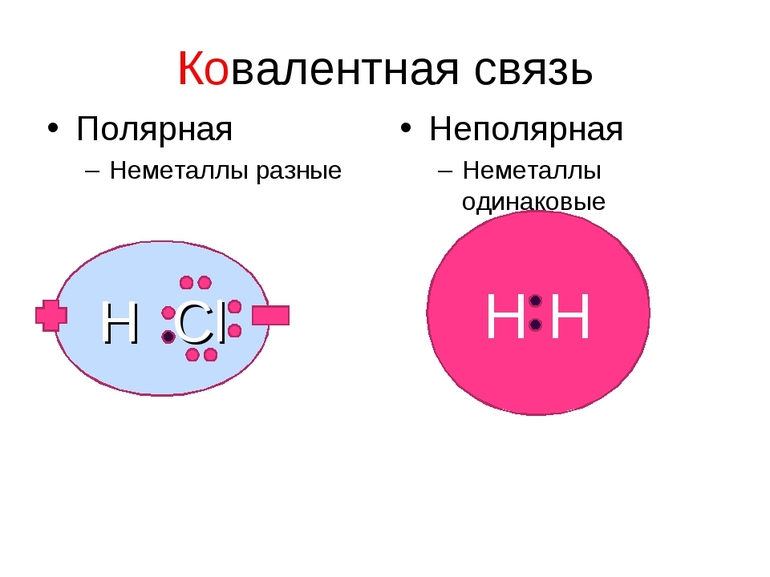
Прежде чем мы рассмотрим конкретные примеры стоит сказать, что ковалентная связь, как было видно на одной из схем выше, бывает двух типов: полярная и неполярная.
Отличить ковалентные связи друг от друга очень просто, достаточно запомнить, что в случае, если мы имеем дело с химической связью между атомами одного химического элемента неметалла, то связь ковалентная неполярная, если же разных химических элементов неметаллов, то ковалентная полярная. Объяснить, почему терминологически состоялись именно эти понятия, мы сможем ниже.
Пришло время рассмотреть конкретные примеры!
Молекула кислорода.
Как известно, газ кислород, которым мы дышим, кислород как вещество, на планете Земля представлен в виде двухатомных молекул.
Чтобы добраться до строения молекулы и понимания того, почему именно такая форма существования этого вещества отвечает и химическому и физическому смыслу, рассмотрим электронную конфигурацию атома кислорода.
Как мы видим, в составе внешнего энергетического уровня атома кислорода можно выделить две неподелённые электронные пары (НЭП) и два неспаренных электрона(подробнее об этом тут).
Далее построим модель атома кислорода, символически обозначив электрон точкой.
Как мы знаем, атомы химических элементов, образуя химические связи, стремятся приобрести электронную конфигурацию инертного благородного газа (об этом тут). В данном случае таковым является неон (Ne), у которого на внешнем энергетическом уровне 8 электронов. У нашего кислорода, я напомню, 6. Почему же атомам кислорода химически выгодно вступать во взаимодействие? Дело в том, что атомы кислорода, образуя химическую связь, обобществляют имеющиеся у них неспаренные электроны, из которых формируются две обобществлённые электронные пары, что и позволяет каждому из атомов кислорода получить в своё распоряжение 2 дополнительных электрона.
Если химический смысл может быть нам теперь понятен, то электромагнитная природа данного взаимодействия по прежнему остаётся неочевидной.
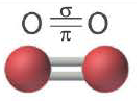
Дело в том, что в молекуле кислорода при перекрывании атомных электронных орбиталей, на прямой, соединяющей центры атомов, возникает область повышенной электронной плотности, которую условно мы обозначили как δ-, то есть область повышенной электронной плотности. Данная область, во-первых, становится центром притяжения для положительно заряженных ядер, а во-вторых, экранирует положительно заряженные ядра друг от друга, то есть снижает их силы взаимного отталкивания.
Ну, а так как данная связь образована атомами одного химического элемента неметалла, то и охарактеризовать мы её можем как ковалентную неполярную. Почему неполярную? Дело в том, что подобная связь образована атомами одного химического элемента неметалла, то есть, атомами обладающими одинаковым значением электроотрицательности (подробнее об электроотрицательности тут), то есть электронная плотность оказывается равномерно распределена по всей молекуле, что не позволяет говорить о наличии каких бы то ни было полюсов положительного и отрицательного зарядов.
Ух. В следующей части мы рассмотрим ковалентную полярную химическую связь, а потом и донорно-акцепторный механизм образования ковалентной связи, а на этом у меня всё. Спасибо. Пока.
Содержание:
Ковалентная связь:
Свойство вещества определяется его химическим составом, последовательностью соединения атомов в его молекуле и их взаимодействием. Совокупность сил, связывающих друг с другом атомы в молекуле, называется химической связью. Теория строения атома раскрывает природу химической связи и механизм образования молекулы.
Было установлено, что образование и природа химической связи строение непосредственно связаны со строением наружных электронных слоев взаимодействующих атомов элементов. Имеющиеся к настоящему времени сведения об агомах и молекулах подтверждают электронное происхождение всех химических связей. По правилу октета, при образовании химической связи наружные энергетические уровни завершаются в большинстве случаев образуются восьмиэлектронные октеты …ns2np6, а в некоторых случаях (для атомов и ионов H– , He0, Li+, Be2+, B+3) двухэпектронное дуплетное строение 1s2.
Электроны, участвующие в образовании связи, называются валентными электронами. В различных химических соединениях химические связи по механизму образования и типу отличаются друг от друга. Электроотрицательность элементов влияет на распределение электронов между взаимодействующими друг с другом атомами. По характеру распределения электронов в веществах различают четыре основных типа химической связи.
Химическая связь, возникающая в результате образования общих (связывающих) электронных пар, называется ковалентной связью. Ковалентная связь образуется между атомами неметаллов с одинаковыми или мало отличающимися друг от друга электроотрицательностями. Образование большинства молекул связано с созданием ковалентной связи.
Ковалентная связь это локализованная двухэлектронная связь с двумя центрами. Локализованная связь подразумевает такую связь, которая действует лишь между двумя атомами на ограниченном участке. Одна ковалентная связь образуется одной электронной парой. Т.е. ковалентную связь показывают парными точками или линиями. Эти электроны расположены в наружных электронных слоях обоих атомов.
Ковалентная связь в основном возникает по двум различным механизмам:
1. Механизм обмена. Каждый атом, образующий ковалентную связь, отдаёт одинаковое количество электронов для образования общей электронной пары. Общую электронную пару образуют неспаренные (одиночные |) электроны атомов, образующих связь. При этом спаренные электроны должны обладать антипараллельными спинами
2. Донорно-акцепторный механизм. Ковалентная связь образуется за счет неподеленной электронной пары одного атома и незаполненных (пустых) орбиталей другого атома. Схематически это выглядит так:
Здесь атом D, предоставляющий свою неподеленную электронную пару для общего пользования, называется донором, а атом А, имеющий свободную орбиталь, акцептором. Образованная таким путем ковалентная связь называется донорно-акцепторной или координативной связью.
 |
Этот механизм химической связи был открыт в 1893 ем году Альфредом Вернером, создавшим координационную теорию комплексных соединений. В связи с этим, донорно акцепторная связь раньше называлась координативной связью. |
Ион аммония (NH
- а) Донорно-акцепторная связь указывается стрелкой, которая всегда направлена от донора (N) в сторону акцептора (H);
- б) При образовании донорно-акцепторной связи валентность атома-донора увеличивается на одну единицу. Степень окисления не меняется.
| Молекулы и ионы | Донор-атом | |
| Валентность | Степень окисления | |
NH |
4 | -3 |
| NH3 | 3 | -3 |
| H2O | 2 | -2 |
| H3O+ | 3 | -2 |
Установлено, что все связи N H ионе аммония (NH
Механизм образования иона аммония
Все кислоты, кроме кремниевой кислоты (H2SiO3), при растворении а воде образуют ион гидроксония (H3O+). Образование иона гидроксония также происходит по донорно акцепторному механизму.
|
Механизм образования иона гидроксония: |
Механизм образования угарного газа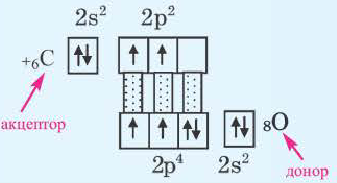 |
| Вещество или ион | Донор | Акцептор | Число электронов, участвующих в образовании связей | |
| у донора | у акцептора | |||
NH |
N | H | 5 | 3 |
| СО | O | C | 4 | 2 |
| H3O+ | O | H | 4 | 2 |
Виды ковалентной связи
Начертите схему связи и электронов, образующих эту связь.
1. H2S→ 



Какие виды ковалентной связи существуют? Чем они отличаются друг от друга?
Существует два вида ковалентной связи, образованной по механизму обмена:
Неполярная ковалентная связь
Ковалентная связь, образованная между атомами неметаллов одного вида (или между атомами с одинаковой электроотрицательностью), называется неполярной ковалентной связью:
H2, N2, O2, F2, Cl2, Br2,I2, P4, S8
Неполярная ковалентная связь
При образовании ковалентной связи между атомами с одинаковой электроотрицательностью электронные пары между ядрами атомов размещаются симметрично. В образовавшейся в результате
этого молекуле центры положительных и отрицательных зарядов совпадают.
Полярная ковалентная связь
Ковалентная связь, образованная между атомами различных видов неметаллов (или между атомами неметаллов с различными электроотрицательностями), называется полярной ковалентной связью.
Вещества с полярной ковалентной связью:
HCl, СО, SO2, NO2, P2O5, HNO3, H2CO3, H3PO4, SiO2, SiC, CS2, CH4, CF4
В большинстве полярных молекул центры положительных и отрицательных зарядов не совпадают. Одна сторона молекулы частично заряжается положительно, а другая сторона частично отрицательно. В результате создается диполь (поляризация в молекуле). Электронная пара перемещается в сторону атома с большей электроотрицательностью. Молекулы, образующие диполь, бывают полярными.
Полярная ковалентная связь
Слово «диполь» на греческом «polos» означает «полярный». +δ и δ (дельта) относительные заряды.
Их абсолютное значение бывает меньше 1.
Несмотря на то, что в молекулах некоторых веществ все связи полярноковалентные, однако из-за неспособности молекулы к поляризации (т.е. к созданию диполя), они являются неполярными (СО2, СН4).
σ (сигма) и π(пи) – связи
Сущность образования электронных пар, создающих связь, объясняется перекрыванием электронных облаков. В зависимости от направления перекрывания атомных орбиталей, ковалентные связи делятся на две части.
σ – связь. Если электронные облака перекрываются по прямой линии, соединяющей центры связывающих атомов, то такая связь называется сигма-связью. Вращение одного из атомов вокруг прямой линии, соединяющей ядра обоих атомов, не разрывает связи, σ- связь может образоваться во время перекрывания двух s-, двух р-, одного s- и одного р- электронных облаков в отдельности, а также всех гибридных электронных облаков.
При наличии между атамами одной ковалентной связи ее называют одинарной связью. Все одинарные связи σ– связи.
π– связь:
При образовании второй и третьей ковалентных связей между двумя атомами перекрывание электронных облаков происходит не по линии, соединяющей центры атомов. Электронные облака в атоме расположены в отношении друг к другу под определенным углом. И поэтому перекрывание электронных облаков происходит по обе стороны от линии, пересекающей центры атомов.
π- связь.
Ковалентная связь, созданная за счет перекрывания орбиталей по обе стороны от оси, соединяющей центры атомов, называется π- связью, π– связь образуется перекрыванием двух р- орбиталей по обе стороны от оси, соединяющей центры атомов, π– связь могут образовать негибридизированные р- орбитали (р- электроны).
В результате образования π– и σ- связей, находящихся на перпендикулярно расположенных друг к другу плоскостях в пространстве в составе одной молекулы, создаются двойные и тройные связи.
Все одинарные связи являются σ- связью, из двойных же связей одна σ- связь, а другая σ- связь, из тройных связей одна σ- связь, а две π– связи.
| Вещество | 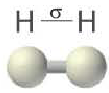 |
 |
 |
| Количество σ- связей | 1 | 1 | 1 |
| Количество π- связей | 0 | 1 | 2 |
Пространственное строение молекул и гибридизация
Определите соответствие.
Какое значение имеют гибридные орбитали в процессе гибридизации? Какие формы гибридизации вы знаете?
Пространственное строение молекулы зависит от формы и направления электронных орбиталей её атомов. Процесс образования новых орбиталей с одинаковыми энергией и формой из комбинации различных орбиталей (s- и р-) называется гибридизацией. Образовавшиеся новые орбитали называются гибридными орбиталями.
- Гибридизация орбиталей атомов происходит во время химических реакций.
- При образовании связи от гибридизированных орбиталей выделяется ещё больше энергии и связь становится более прочной.
- Число образованных гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
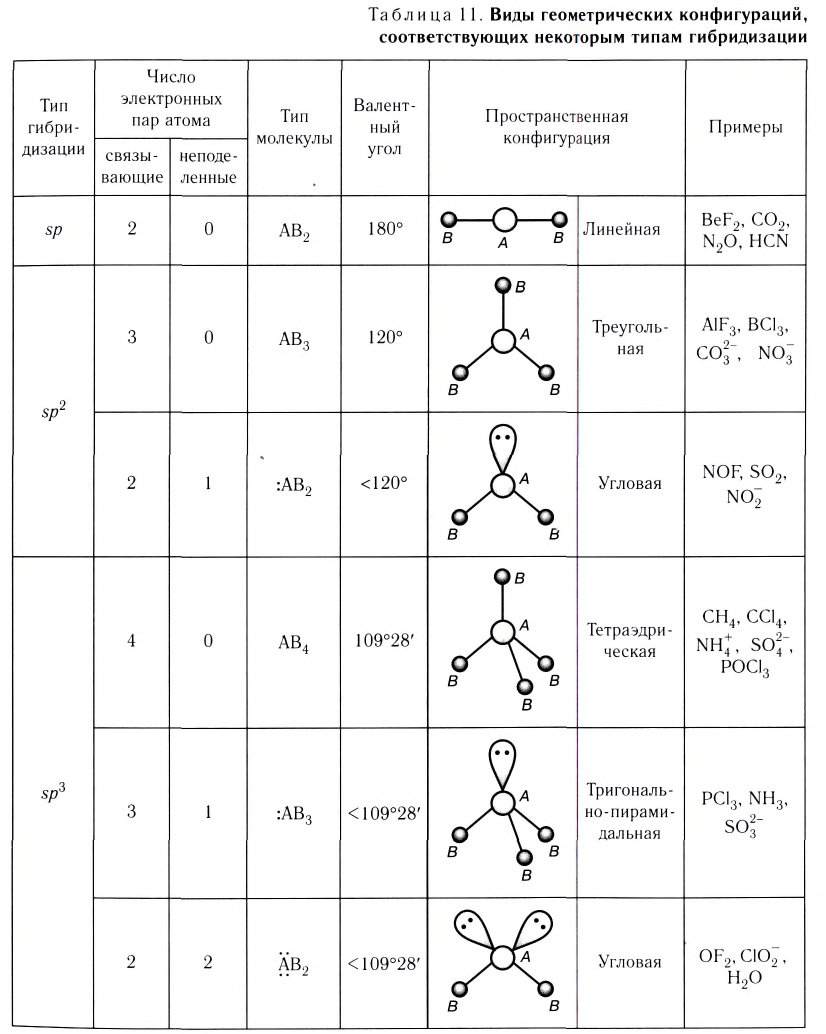
Для s- и р-орбиталей возможны три типа гибридизации.
sp- гибридизация:
При участии одной s- и одной р-орбитали образуются 2 sp- гибридные орбитали, расположенные под углом 180°. Подобная гибридизация характерна для некоторых элементов II группы: ZnCl2, BeCl2, Mgl2 и др. Электронное строение внешнего электронного слоя бериллия имеет вид 2s22p°. При возбуждении атома бериллия один из s- электронов переходит на р- подуровень, а затем, в результате гибридизации одной s- и одной р- орбиталей, образуются две sp-гибридные орбитали с одинаковой энергией,
расположенные под углом 180°.
Образовавшиеся две sp-гибридные орбитали, оттолкнувшись друг от друга, располагаются под углом 180°, т.е. вдоль прямой линии, двигаясь в противоположных направлениях. В результате перекрывания двух sp- гибридных электронных облаков атома Be р-электроными облаками атомов Cl образуется BeCl2 линейного строения.
BeF2, BeCl2, BeBr2, Bel2, СО2 это вещества линейного строения, образованные за счет перекрывания sp- гибридных орбиталей.
sp2– гибридизация:
При участии одной s- и двух р- орбиталей образуются три sp2– гибридные орбитали одинаковой формы, расположенные на одной плоскости под углом 120°. Подобный тип гибридизации характерен для некоторых элементов III группы.
Электронное строение внешнего энергетического уровня атома бора следующее: 2s22p1. При возбуждении атома бора один из электронов переходит с S- орбитали на р- орбиталь и в итоге образуются три одинаковые sp2 гибридные орбитали.
Эти три возбужденных гибридных электронных облака атома бора перекрываются р- электронными облаками атомов фтора и в результате образуется молекула BF3 треугольной формы. Все три образовавшиеся связи находятся на одной плоскости. BCl3, ВВr3, Bl3 также обладают подобным плоским строением.
sp3– гибридизация:
Процесс образования в пространстве четырех гибридных орбиталей из комбинации одной s- и трех р- орбиталей называют sp3– гибридизацией. Для некоторых элементов IV группы характерна sp3– гибридизация: СН4, CCl4, CF4 и др. В нормальном состоянии имеющиеся в наружном электронном слое атома углерода четыре электрона находятся в состоянии 2s22p2. При возбуждении атома углерода во время реакции один из электронов с 2s2– орбитали переходит на 2р- орбиталь и в результате гибридизации в возбужденном состоянии одного S- и трех р- электронных облаков образуются четыре одинаковые sp3– гибридные орбитали.
В метане все гибридные орбитали атома углерода (С), находящегося в состоянии sр3-гибридизации, образуют связь, и молекула приобретает форму тетраэдра (симметрическую), а угол связи составляет -109o28′.
Содержащийся в молекуле воды аnом кислорода не возбуждается. В результате гибридизации двух орбиталей, содержащих по одному электрону, и двух орбита-лей, содержащих по два электрона, образуются четыре sр3-гибридные орбитали.
Гибридные орбитали, содержащие электронные пары атома кислорода в молекуле воды, отталкивают другие гибридные орбитали и в результате молекула приобретает неправильную (несимметрическую) форму тетраэдра, образуя угол связи 104o5′.
В атоме азота в молекуле аммиака возбуждение не происходит. В результате гибридизации трех орбиталей, содержащих по одному электрону, и одной орбитали, содержащей два электрона, создаются 3sp3– гибридные орбитали.
Гибридные орбитали, содержащие электронные пары атома азота в молекуле аммиака, отталкивают другие гибридные орбитали и в результате молекула приобретает неправильную (несимметрическую) форму тетраэдра, а угол связи составляет 107o3′.
Свойства ковалентной связи
Основными характерными свойствами ковалентной связи являются ее прочность, энергия, насыщенность, направленность, полярность, длина и кратность.
Прочность ковалентной связи
Чем больше электронная плотность между ядрами атомов, тем прочнее будет связь. Прочность химической связи зависит от:
1) насыщенности связи; 2) длины связи; 3) полярности связи.
Энергия связи
Энергия связи это количество минимальной энергии, необходимой для того, чтобы разорвать связь. Единицей энергии связи является кДж/моль, которая предусмотрена для 1 моль связи. Энергия связи 1 моль водорода равна 436 кДж/моль. Процесс разрыва связи можно выразить в виде термохимического уравнения:
H H – 2Н 436 кДж/моль или ΔH=+436 кДж/моль
Энергия связи для 1 молекулы равна соотношению между минимальной энергией, необходимой для разрыва связи, и постоянной Авогадро.
Для вычисления энергии, необходимой для разрыва одной связи в многоатомных молекулах, следует поделить общую энергию связи на количество связей. Энергия связи в молекуле метана(СН4)
ΔH=+1647 кДж/моль Эсвязи= 1647 : 4 ≈ 412 кДж/моль
Однако действительное значение каждой отдельно взятой энергии связи несколько отличается от ее среднего значения.
Пользуясь понятием энергии связи, можно определить, являются ли химические реакции экзотермическими или эндотермическими.
Разница между суммой энергий связи между атомами продуктов реакции и суммой энергий связи между атомами веществ, вступивших в реакцию, определяет тепловой эффект химической реакции. Если эта разница положительная, то реакция экзотермическая, а при отрицательной разнице эндотермическая. При вычислении же по изменению энтальпии (ΔH) бывает наоборот.
Qpeaн.=(6 . QС H + QС С ) (4 ∙ QС H + QС=С + QH H ); ΔH= Q
В общем виде вычисляется следующим образом:
Δ H равен тепловому эффекту реакции с противоположным значением, называется изменением энтальпии. Оно находится только посредством вычислений.
Насыщенность связи
Насыщенность ковалентной связи определяется валентными возможностями атомов. Возможность образования ковалентной связи определяется числом валентных электронов (или образующих ковалентную связь орбиталей). Например, в атоме углерода, имеющем в наружном электронном слое всего 4 орбитали, в возбужденном состоянии содержится 4 одиночных электрона и поэтому атом углерода способен образовать не более 4-х ковалентных связей. Валентные возможности атомов определяются числом неподеленных электронных пар, которые могут быть отданы другим атомам с незаполненными орбиталями на наружном энергетическом уровне.
Направленность связи
Это свойство ковалентной связи обуславливает пространственное строение молекул. Направленность химических связей объясняется различным расположением электронных облаков в пространстве. Во время взаимного перекрывания электронных облаков в пространстве могут образоваться соединения, молекулы которых будут иметь линейную форму или форму угла. Н2, N2, F2, НСl, СО, NO имеют линейное строение, а H2O, SO2, NO2 форму угла.
Кратность связи определяется числом электронных пар (числом ковалентных связей), соединяющих два атома. В молекуле кислорода кратность связи равна 2. На внешнем энергетическом уровне каждого атома кислорода содержатся два неспаренных одиночных электрона: O=O
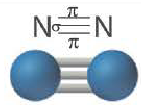
В молекуле азота кратность связи равна 3. На внешнем энергетическом уровне каждого атома азота содержатся три неспаренных одиночных электрона. N 
Длина связи это расстояние между ядрами атомов, образующих связь; измеряется в нанометрах (нм). Чем короче длина химической связи, тем прочнее будет связь.
Полярность связи зависит от смещения электронной пары, образующей ковалентную связь, в сторону одного из атомов.
В галогенидах водорода (HF, HC1, HBr, HI) в связи с увеличением радиуса по мере возрастания порядкового номера галогена, увеличивается и длина связи. Так как F (фтор) самый сильный неметалл, HF отличает большей полярностью и прочностью. В связи с увеличением длины связи в HF, HC1, HBr, HI, по мере увеличения радиуса, их полярность, прочность связи уменьшаются, а кислотность, восстановительные свойства усиливаются.
полярность, прочность связи уменьшаются, кислотность, восстановительные свойства усиливаются.
Природа и типы химической связи
При обычных условиях химические элементы существуют в форме различных атомных частиц в составе простых и сложных веществ. Из них только простые вещества благородных газов (элементов VIIIA-группы) являются одноатомными молекулами, а остальные представляют собой самые разнообразные соединения. Число атомов в таких соединениях колеблется от двух до сотен и тысяч. Силы, которые обеспечивают существование таких агрегатов (молекул, радикалов, кристаллов и др.), получили название химическая связь.
Химическая связь — это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, радикалы, кристаллы и т. д.).
Причиной образования химической связи является стремление атомов путем взаимодействия с другими атомами достичь более устойчивого состояния, т. е. состояния с минимально возможным запасом энергии. Следовательно, основным условием образования химической связи является понижение полной энергии Е многоатомной системы по сравнению с суммарной энергией изолированных атомов, т. е.
в случае образования вещества АВ из атомов А и В.
Таким образом, образование химической связи всегда сопровождается выделением энергии.
Природа сил химической связи — электростатическая, т. е. обусловлена различными видами взаимодействий положительно заряженных ядер и отрицательно заряженных электронов (рис. 15).
Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. те электроны, которые обычно находятся на внешнем энергетическом уровне и наименее прочно связаны с ядром атома. У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Завершенными, а поэтому и самыми устойчивыми, являются внешние электронные оболочки атомов благородных газов: у гелия там находится два электрона (1s2) и у остальных — по восемь электронов (ns2np6, где n — номер периода).
У атомов остальных элементов внешние энергетические уровни являются незавершенными, и поэтому в процессе химического взаимодействия атомы стремятся их завершить, т. е. приобрести электронное строение атома ближайшего благородного газа. Это соответствует нахождению двух электронов на внешнем уровне у атомов водорода, который расположен в одном периоде с гелием, и восьми электронов (октет) — у всех остальных атомов. Достичь такого электронного состояния атомы могут только за счет обобществления электронов, т. е. их совместного использования атомами, соединяющимися между собой. При этом образуются общие электронные пары, которые связывают атомы друг с другом — между ними возникает химическая связь.
В зависимости от способа обобществления электронов различают три основных типа химической связи: ковалентную, ионную и металлическую.
Ковалентная связь:
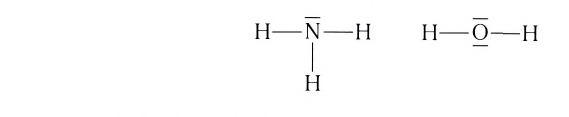
Ковалентная связь возникает обычно между двумя атомами неметаллов с одинаковыми или близкими значениями электроотрицательности. Рассмотрим образование ковалентной связи на примере простейшей молекулы — молекулы водорода Н2. У атома водорода всего один электрон, находящийся на внешнем (первом) энергетическом уровне, до завершения которого не хватает одного электрона.
При сближении двух атомов водорода за счет сил притяжения, действующих между их ядрами и электронами, происходит частичное перекрывание электронных облаков неспаренных электронов с антипараллельным спином (это одно из условий образования общей электронной пары!). В зоне их перекрывания плотность двухэлектронного облака увеличивается. Ядра атомов стягиваются к этой области повышенного отрицательного заряда до тех пор, пока не наступит равновесие между силами межъядерного отталкивания и силами притяжения. Расстояние между ядрами атомов уменьшается, энергия системы, состоящей из двух атомов водорода, также понижается. Область повышенной электронной плотности связывает два атома водорода в молекулу Н2 (рис. 16).
Образование химической связи между атомами водорода в молекуле можно показать различными способами. Например, с помощью электронных формул, в которых Указывают символы элементов и валентные электроны в виде точек:
В графических (или структурных) формулах пару электронов обозначают с помощью черточки:
В случае молекулы водорода эта единственная черточка символизирует ковалентную связь.
Химическая связь, возникающая в результате обобществления электронов с образованием общих электронных пар между атомами, называется ковалентной связью.
Образование ковалентной связи можно показать и с помощью электронно-графических схем, на которых обычно указываются только орбитали внешнего энергетического уровня:
Волнистая линия между двумя орбиталями 1s указывает на то, что каждый электрон как бы одновременно находится как на одной, так и на другой орбитали. В данном случае ковалентная связь образована в результате перекрывания двух s-opбиталей (или s-облаков) (рис. 17).
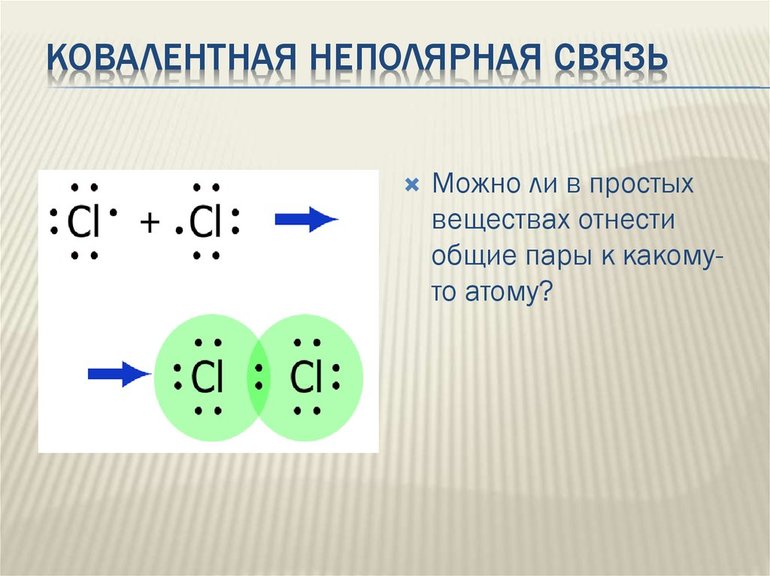
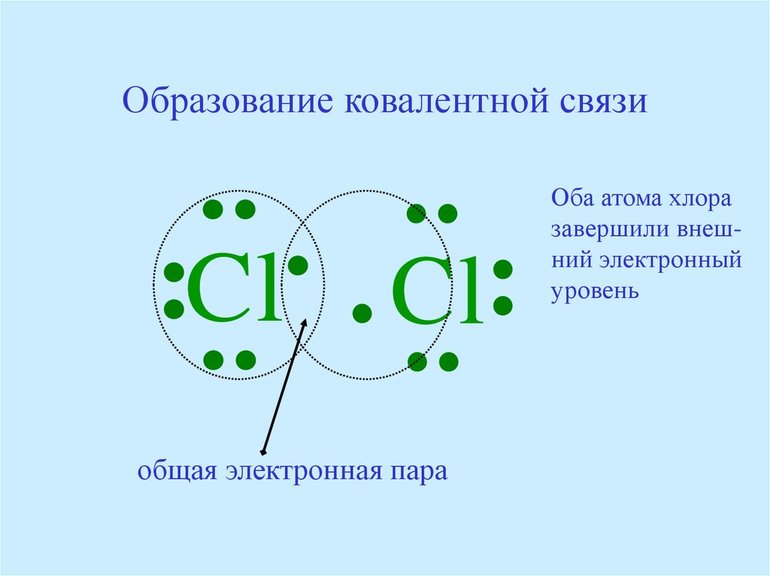
Подобным образом образуется ковалентная связь и между двумя атомами фтора в молекуле F2. Атом фтора имеет 7 электронов на внешнем электронном слое, один из них — неспаренный электрон. При сближении двух атомов фтора происходит перекрывание электронных облаков их неспаренных электронов, образуется общая электронная пара и внешний энергетический уровень каждого атома фтора завершается до октета (8 электронов):
Схема образования молекулы фтора с помощью электронных формул:
а графическая формула молекулы:
В данном случае образование ковалентной связи произошло за счет перекрывания р-электронных облаков (рис. 18).
Одинарная связь:
И в молекуле водорода, и в молекуле фтора атомы связаны электронной парой, образующей одну химическую связь, называемую одинарной. В обоих случаях перекрывание электронных облаков (как s-, так и р-) происходит вдоль линии, соединяющей центры взаимодействующих атомов. Эту условную прямую называют линией (или осью) связи.
Ковалентная связь, образованная за счет перекрывания атомных орбиталей вдоль линии связи, называется 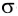
Пару электронов, образующих ковалентную связь, называют связывающей в отличие от электронных пар, которые не участвуют в образовании связей и, следовательно, являются несвязывающими. Такие пары часто также называют неподеленными, поскольку они принадлежат только одному атому.
У атомов водорода в молекуле Н2 нет несвязывающих пар, а в молекулах F2, С12, Вr2 или I2 у каждого из атомов галогенов их по три:
- Причиной образования химической связи является стремление атомов к достижению более устойчивого состояния, что приводит к выделению энергии при образовании связей.
- Природа сил химической связи — электростатическая, т. е. определяется различными видами взаимодействий электронов и ядер в системе связанных атомов.
- Различают три основных типа химической связи — ковалентную, ионную и металлическую.
- Ковалентная связь — это химическая связь, возникающая в результате образования общих электронных пар между двумя атомами.
Кратные связи. Полярная и неполярная ковалентная связь
Два атома могут быть связаны между собой не только одной, но и несколькими ковалентными связями. В таком случае говорят о кратности связи, понимая под этим термином число электронных пар, участвующих в образовании ковалентной связи.
Кратные связи
У атомов азота (элемента VA-группы) до завершения внешнего энергетического уровня не хватает трех электронов:
Поэтому при образовании молекулы N2 атомы азота обобщают уже не одну, а три пары электронов:
Схема образования молекулы азота:
а графическая формула молекулы:
Одна из ковалентных связей, образовавшаяся в результате перекрывания р-электронных облаков вдоль линии связи, представляет собой 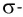
Такая ковалентная связь получила название 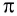
► 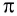
Облака s-электронов не могут образовывать 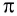
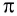
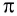
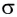
Если ковалентная связь между двумя атомами образуется двумя общими электронными парами, то такая ковалентная связь называется двойной связью, и она обозначается двумя черточками. Например, в молекуле этена С2Н4 атомы углерода соединены между собой двойной связью:
одна из которых — 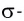
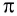
Если в молекуле имеется тройная связь, как, например, в молекуле азота N2, то одна из них — 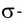
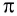
Полярная и неполярная ковалентная связь
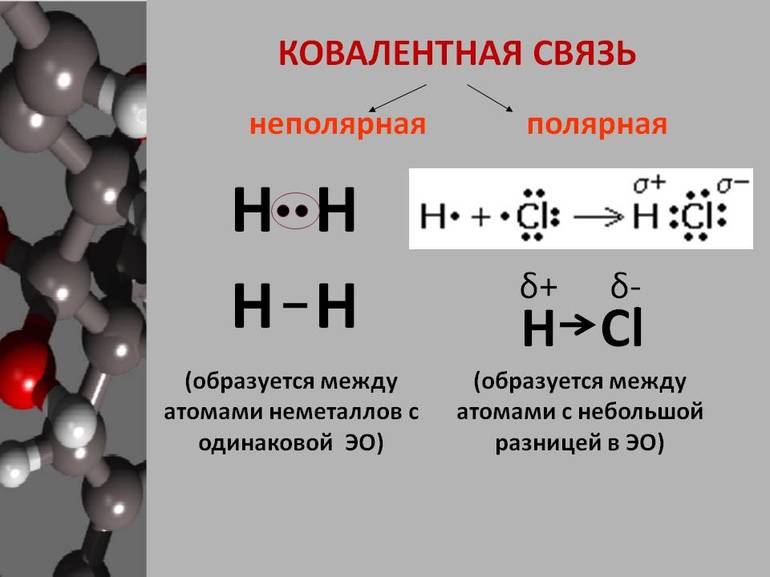
До сих пор мы рассматривали ковалентную связь, образованную атомами одного и того же элемента. В этом случае общая пара электронов располагается симметрично между двумя атомами с одинаковой электроотрицательностью. Такая ковалентная связь называется неполярной.
Если же взаимодействуют атомы с различными электроотрицательностями, т. е. атомы разных элементов, то общая электронная пара смещается к атому с большей электроотрицательностью. В таких случаях возникает полярная ковалентная связь.
Например, в молекуле хлороводорода HCI общая электронная пара смещена в сторону более электроотрицательного элемента, каким является хлор:
В данном случае перекрываются сферическое s-электронное облако атома водорода и гантелеобразное р-облако атома хлора (рис. 21).
Схема такого перекрывания:
В результате смещения общей электронной пары в молекуле HCl на атоме хлора возникает частичный отрицательный заряд, а на атоме водорода — такой же по величине, по положительный заряд:
(греческая буква 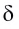
Значение заряда 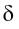
Чем больше разность электроотрицательностей связанных атомов, тем более полярна химическая связь межту ними.
С помощью ковалентной связи образуются молекулы и более сложных веществ, состоящих из трех, четырех и более атомов. В качестве примера рассмотрим образование молекулы аммиака NH3. Электронно-графическая схема взаимодействия трех атомов водорода и одного атома азота следующая:
Общая схема образования аммиака:
а графическая формула молекулы:
Таким образом, три неспаренных электрона атома азота принимают участие в образовании трех ковалентных связей с атомами водорода, а на внешнем энергетическом уровне у атома азота остается еще неподеленная пара электронов. Каждая связь N — Н является полярной. В целом вся молекула NH;i представляет собой диполь, так как она имеет форму пирамиды с атомом азота в ее вершине. Однако существует много молекул, которые содержат полярные связи, но сами являются неполярными. Это объясняется особенностями их пространственного строения. Об этом мы поговорим в следующих параграфах.
- Кратность связи определяется числом общих электронных пар между двумя связанными атомами.
- Ковалентная связь, при образовании которой области перекрывания электронных облаков находятся по обе стороны от линии, соединяющей ядра атомов, называется
-связью.
- При соединении двух атомов с разными электроотрицательностями возникает ковалентная полярная связь.
Механизмы образования ковалентной связи
Различают два основных механизма образования ковалентной связи — обменный и донорно-акцепторный.
Обменный механизм образования связи
Ковалентная связь образуется двумя атомами с помощью двух электронов с антипараллельным спином, т. е. химическая связь находится (локализована) между двумя атомами. Так как нахождение двух электронов в поле действия двух ядер энергетически выгоднее, чем пребывание каждого электрона в поле своего ядра, то в образовании ковалентной связи принимают участие все одноэлектронные орбитали внешнего энергетического уровня. Например, атом азота имеет три не-спаренных электрона на внешнем уровне:
атом кислорода — два:
а атом фтора — один:
Поэтому эти атомы могут образовывать за счет таких электронов соответственно три, две и одну ковалентные связи.
Число неспаренных электронов может увеличиваться при переходе атома в возбужденное состояние. Например, на внешнем энергетическом уровне атома углерода находится только два неспаренных электрона.
Однако в большинстве своих соединений углерод проявляет валентность, равную 4, образуя четыре ковалентные связи, например: С02, СН4, ССl4 и т.д. Такая валентность атома углерода становится возможной благодаря тому, что его атом при образовании химических связей с другими атомами переходит в возбужденное состояние (т. е. в состояние с большей энергией) за счет распаривания пары электронов 2s2 и перехода одного из них па подуровень 2р:
В возбужденном состоянии атом углерода имеет четыре неспаренных электрона, за счет которых он может образовывать четыре ковалентные связи с атомами других элементов. Распаривание электронов требует затраты энергии, но эта затрата с избытком компенсируется энергией, выделяющейся при образовании дополнительных связей. Распаривание, как правило, происходит лишь в пределах данного энергетического уровня, поскольку переход электронов на свободные орбитали другого уровня энергетически не выгоден. Поэтому в возбужденное состояние могут перейти атомы только тех элементов второго периода, у которых имеются свободные орбитали (бериллий, бор, углерод). У атомов азота, кислорода и фтора нет свободных орбиталей на втором энергетическом уровне, а переход электронов на третий уровень потребует слишком больших затрат энергии, которые не компенсируются выделением энергии при образовании дополнительных связей.
В то же время атомы элементов третьего и следующих периодов имеют на внешнем энергетическом уровне d-подуровень, на который при возбуждении могут переходить s- и р-электроны:
Благодаря этому атом хлора способен образовывать не одну, а несколько ко-валентных связей, вплоть до семи, как, например, в оксиде Сl207.
Таким образом, атомы при образовании ковалентных связей используют все свои неспаренные электроны, как находящиеся в основном состоянии, так и образовавшиеся при распаривании.
- Механизм образования ковалентной связи за счет обобществления не-спаренных электронов двух взаимодействующих атомов называется обменным.
Донорно-акцепторный механизм образования ковалентной связи
Образование ковалентной связи возможно и при взаимодействии атомов, один из которых имеет пару неподеленных электронов (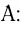

Атом, предоставляющий электронную пару для образования связи, называется донором, а участвующий в обобществлении пары за счет свободной орбитали, — акцептором. Такой механизм образования ковалентной связи получил название донорно-акцепторного.
Механизм образования ковалентной связи за счет неподеленной пары электронов одного атома и свободной орбитали другого называется донорно-акцепторным.
Примером такого механизма может служить образование иона аммония 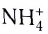
Сокращенно ионное уравнение этой реакции:
Составим электронную схему такого взаимодействия, обозначив точками электроны, принадлежащие атому азота, а звездочками — атомам водорода:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой. И хотя одна из этих связей образована по донорно-акцепторному механизму, она не отличается по своим характеристикам от остальных ковалентных связей, образованных по обменному механизму.
Донорно-акцепторный механизм позволяет объяснить существование иона гидроксония Н30+, в виде которого находится в водных растворах ион водорода. Эта частица образуется в результате гидратации иона водорода:
Электронная схема этого процесса:
- Обменным называется механизм образования ковалентной связи, при котором каждый атом предоставляет для формирования общей электронной пары один неспаренный электрон.
- Механизм образования ковалентной связи за счет электронной пары одного атома и свободной орбитали другого называется донорно-акцепторным.
Свойства ковалентной связи
Вы уже познакомились с одной из характеристик ковалентной связи — полярностью. Полярность связи и всей молекулы в целом во многом определяет физические и химические свойства вещества, такие, как температуры кипения и плавления, растворимость и даже способность вступать в химические реакции с другими веществами.
Рассмотрим еще некоторые характеристики ковалентной связи.
Энергия и длина связи
Одной из важнейших характеристик химической связи является ее прочность. Прочность связей определяет реакционную способность вещества.
Мерой прочности связи является та энергия, которую необходимо затратить на ее разрыв. Эту характеристику называют энергией связи. В случае веществ с двухатомными молекулами ее величину рассчитывают на 1 моль вещества. Так. у молекулы водорода Н2 энергия связи Н — Н равна 435 кДж/моль, у молекулы фтора F2 — 159 кДж/моль, а у молекулы азота эта характеристика равна 943 кДж/моль. Чем меньше энергия связи, тем менее прочной является ковалентная связь, тем больше реакционная способность вещества.
Еще одной характеристикой прочности связи является длина связи — расстояние между ядрами химически связанных атомов. С увеличением радиусов атомов длина связи между ними увеличивается, а прочность — уменьшается. Ковалентная связь Н—Н более прочная, чем связь F—F, так как ее длина равна 0,074 нм, а связи F—F — 0,142 нм.
Увеличение кратности связи приводит к уменьшению межъядерного расстояния и упрочнению связи между атомами (табл. 9).
Из таблицы 9 видно, что энергия двойной связи 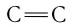


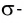
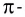
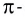
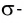
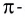
Насыщаемость
Ковалентная связь характеризуется насыщаемостью. Это свойство состоит в том, что образование связывающей два атома электронной пары исключает ее участие в других химических взаимодействиях. Благодаря этому общее число ковалентных связей, которые способен образовывать тот или иной атом, ограничено. Оно определяется числом орбиталей атома, использование которых для образования химических связей энергетически выгодно. Так, элементы второго периода, у атомов которых внешний энергетический уровень состоит только из четырех орбиталей (одна s- и три р-типа), могут образовать не более четырех ковалентных связей. У атомов следующих периодов в образовании ковалентных связей могут принимать участие и d-орбитали как внешнего, так и предвнешнего энергетических уровней.
Поэтому ковалентные соединения имеют строго определенный состав.
Направленность ковалентной связи
Ковалентная связь между двумя атомами располагается таким образом, чтобы обеспечить максимальное перекрывание электронных облаков. Поскольку в образовании связей принимают участие электронные облака различной формы и ориентации в пространстве, то и ковалентные связи, образованные этими облаками, также характеризуются определенной направленностью.
Если ковалентная связь образуется путем перекрывания сферических s-электронных облаков, как, например, в молекуле Н2, то она может располагаться в любом направлении (рис. 23) относительно центра данного атома.
А вот в молекуле Сl2, где ковалентная связь образована за счет перекрывания р-облаков, область перекрывания располагается только вдоль линии связи, определенной пространственной ориентацией р-облака (рис. 24).
Следовательно, направленность ковалентных связей объясняется различным расположением электронных облаков в пространстве.
- Основными характеристиками ковалентной связи являются ее длина, энергия, полярность, насыщаемость.
- Ковалентные химические связи характеризуются определенной направленностью.
Понятие о стереохимии и атомные кристаллические решетки
Каждая молекула представляет собой систему взаимосвязанных атомов, расположенных определенным образом относительно друг друга. Следовательно, молекула характеризуется определенным пространственным строением, или, говоря иначе, геометрией (формой).
Вопросы строения молекул рассматривает один из разделов химии, который называется стереохимией (в буквальном переводе с греческого языка — пространственная химия).
Согласно стереохимическим представлениям, когда один атом образует несколько связей, они будут направлены под определенными углами друг к другу. Угол между связями (или валентный угол) — это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов. Такие прямые, как вы уже знаете, называются линиями связи (рис. 25).
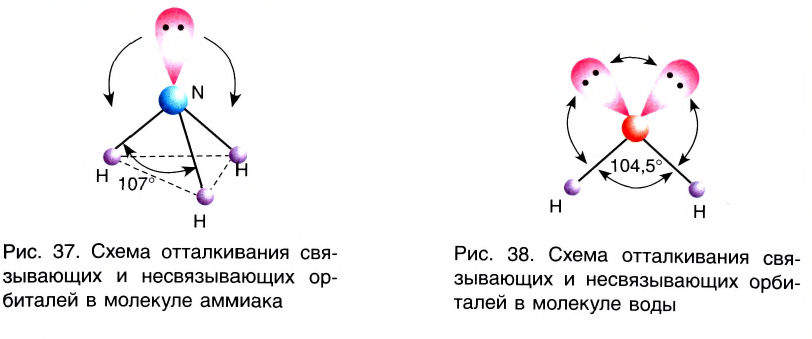
Например, в молекуле Н20 атом кислорода образует две 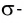
Аналогично в молекуле NH3 углы между связями N—Н, образованные тремя р-орбиталями атома азота, также должны быть близки к 90° (рис. 27), а вся молекула в целом должна иметь форму треугольной пирамиды с атомом азота в вершине.
Действительные значения углов между связями (104,5° в молекуле Н20 и 107° в молекуле NH3) отличаются от ожидаемых. Увеличение валентных углов можно объяснить взаимным отталкиванием положительно заряженных атомов водорода. Например, уже в молекуле H2S такое отталкивание слабее, чем в молекуле Н20 (так как радиус атома серы больше радиуса атома кислорода), и угол Н—S—Н ближе к 90°, чем угол Н—О—Н.
За счет ковалентной связи образуются не только молекулы. Некоторые простые и сложные вещества построены из атомов, связанных друг с другом ковалентными связями, и образуют протяженные кристаллические структуры — атомные кристаллические решетки.
Примерами таких веществ являются простые вещества — бор, алмаз, кремний. В кремнии (как и в кристалле алмаза)(рис. 28) каждый атом связан четырьмя ковалентными связями с другими атомами.
Подобное строение имеют и сложные вещества: карбид кремния SiC и оксид кремния Si02 (кварц).
Атомных кристаллов сравнительно немного. Благодаря высокой прочности ковалентных связей они имеют очень высокие температуры плавления, большую твердость. Так, самым твердым природным веществом является алмаз — его температура плавления более 3500 °С. Карбид кремния SiC также является одним из самых твердых веществ с очень высокой температурой плавления — более 2700 °С.
- Стереохимия — раздел химии, рассматривающий пространственное строение молекул или кристаллов.
- Кристаллические структуры, построенные из атомов, связанных друг с другом ковалентными связями, называются атомными кристаллическими решетками.
Гибридизация атомных орбиталей
Вы уже знаете, что в образовании ковалентных связей принимают участие как s-, так и р-электроны, орбитали которых имеют разную форму и направленность в пространстве. Вместе с тем связи, которые образуются при их участии, оказываются равноценными и расположенными симметрично.
В рамках электронной теории химической связи эти факты объясняются на основе концепции гибридизации атомных валентных орбиталей. Согласно данной концепции в образовании ковалентных связей участвуют не «чистые», а так называемые гибридные, усредненные по форме и размерам (а следовательно, и по энергии) орбитали. Число таких орбиталей равно числу исходных орбиталей. Гибридные орбитали более вытянуты в пространстве (рис. 29), что обеспечивает их более полное перекрывание с орбиталями соседних атомов при образовании связей. Гибридные орбитали, вследствие особой симметрии, в образовании 
Условия устойчивой гибридизации:
- в гибридизации могут участвовать орбитали с близкими значениями энергий, т. е. s- и р-орбитали внешнего энергетического уровня и d-орбитали внешнего или предвнешнего уровня;
- гибридная атомная орбиталь должна более полно перекрываться с орбита-лями другого атома при образовании связей;
- в гибридизации участвуют орбитали с достаточно высокой электронной плотностью, которыми в большинстве случаев являются орбитали элементов начальных периодов;
- гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга. В этом случае энергия их отталкивания (и, следовательно, энергия всей системы) минимальна.
Ориентация гибридных орбиталей определяет геометрическую структуру молекулы и молекулярных ионов. Так, при комбинации одной s- и одной р-орбитали возникают две sp-гибридные орбитали, расположенные симметрично под углом 180° (рис. 31). Соответственно связи, образованные с участием электронов этих орбиталей, также располагаются под углом 180°. Например, у атома бериллия sp-гибридизация орбиталей проявляется в молекуле ВеСl2, которая вследствие этого имеет линейную форму (рис. 32).
Комбинация трех орбиталей (одной s- и двух р-типа) приводит к образованию трех sp2-гибридных орбиталей, расположенных в одной плоскости под углом 120° (рис. 33) (например, в молекуле BF3) (рис. 34).
Комбинация четырех орбиталей (одной s- и трех р-типа) приводит к sр3-гибридизации, при которой четыре гибридные орбитали симметрично ориентированы в пространстве к четырем вершинам тетраэдра, т. е. под углом 109°28′ (рис. 35) (атом углерода в молекуле СН4) (рис. 36).
Основные характеристики указанных типов гибридизации приведены в таблице 10.
Существуют и другие типы гибридизации атомных орбиталей. Они достаточно доступны для понимания, но их рассмотрение выходит за рамки школьного курса.
- Гибридизация атомных орбиталей — усреднение по форме и энергии электронных облаков, соответствующих разным орбиталям.
- В гибридизации могут участвовать орбитали с близкими значениями энергии.
- Гибридные орбитали должны быть ориентированы в пространстве таким образом, чтобы обеспечить максимальное взаимное удаление друг от друга.
- Гибридные орбитали участвуют в образовании только
связи.
Пространственное строение молекул
Пространственное строение молекул или молекулярных ионов зависит от типа гибридизации и взаимного расположения в пространстве гибридизованных орбиталей центральных атомов.
В реальных молекулярных структурах углы между связями часто отличаются от углов, соответствующих типу гибридизации.
В чем причина таких отклонений?
Прежде чем ответить на этот вопрос, выделим несколько положений, на которых основываются подходы к рассмотрению геометрии молекул.
Линия связи (или ось связи) — это прежде всего область перекрывания электронных облаков при образовании 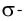
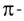
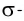
Основными причинами отклонений углов связей от углов, соответствующих типу гибридизации, являются следующие.
1. Не все гибридные орбитали участвуют в образовании связей, часть из них — несвязывающие. Электронные пары, находящиеся на этих орбиталях, также называются несвязывающими (или неподеленными). Например, у атома азота в молекуле NH3 одна пара электронов — несвязывающая, а в молекуле Н20 у атома кислорода две пары электронов являются несвязывающими:
Связывающая электронная пара локализована между двумя атомами и поэтому занимает меньше пространства, чем электронное облако несвязывающей пары. Вследствие этого отталкивающее действие несвязывающей пары проявляется в большей мере, чем связывающей. В молекулах воды и аммиака у атомов (N и О) один и тот же тип гибридизации атомных орбиталей sp3. Однако вследствие наличия одной (у азота) и двух (у кислорода) несвязывающих пар идеальный угол для этого типа гибридизации, равный 109°28′ уменьшается соответственно до 107° (угол Н — N — Н) и 104,5° (угол Н —О—Н) (рис.37, 38).
Число атомов В (в общем случае и число групп атомов), непосредственно связанных с центральным атомом А, называется его координационным числом. В соединениях с ковалентным типом связей координационное число атома равно числу 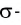
2. Наличие 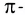
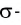
Предполагается, что электронные пары кратной связи занимают ту же область пространства, что и электронная пара простой связи. Суммарное электронное облако кратной связи (двойной или тройной) занимает больший объем пространства, чем одинарной, и поэтому обладает большим отталкивающим действием. Например, в молекуле COF2, имеющей плоскостное строение (sp2-гибридизация атома углерода), углы связи F—С—О больше угла связи F—С—F, так как связь С = 0 является двойной и обладает большим отталкивающим действием, чем одинарная связь С—F (рис. 39).
В молекуле углекислого газа С02, графическая формула которого
две ковалентные связи одинарные, т. е. являются 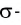
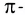
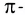
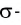
Многоцентровые связи
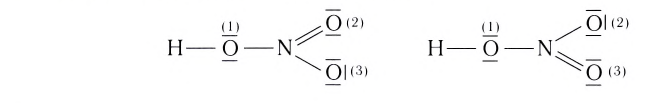
Строение многих молекул нельзя изобразить только одной графической формулой с точной локализацией кратной связи, поскольку истинные свойства молекулы оказываются промежуточными между теми, которые отражаются в каждой отдельной схеме. Например, строение молекулы HNO3 можно изобразить двумя равнозначными графическими формулами:
Поскольку в этой молекуле оба атома кислорода 
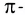
В этой формуле пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между одной и другой связями N—О. Другими словами, эта электронная пара принадлежит не двум, а трем атомам и, следовательно, образованная ею связь является трехцентровой.
Примерами структур с многоцентровыми (делокализованными) 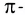
- Геометрия любой молекулы определяется в основном пространственной направленностью
связей, т. е. углами между воображаемыми прямыми, проходящими через ядра химически связанных атомов.
- На пространственное строение молекул оказывают влияние и несвязывающие (неподеленные) пары электронов, уменьшающие углы связей между
связями.
Валентность и степень окисления
Валентность и валентные возможности атомов
Мы установили, что атомы способны образовывать ковалентные связи различным образом. Количественно эта способность атомов оценивается с помощью характеристики, называемой валентностью.
Валентность — мера способности атомов данного элемента соединяться с другими атомами.
Такое толкование валентности является общим, или стехиометрическим. Оно обосновывает количественные соотношения атомов элементов в любых химических соединениях.
С развитием электронных представлений о строении веществ понятие валентности приобрело определенное физическое обоснование. В современной химии валентность химического элемента определяется числом ковалентных связей, которыми данный атом связан с другими атомами.
Ковалентные связи могут быть образованы как с помощью одноэлектронной орбитали атома, так и с помощью неподеленной пары электронов (если атом — донор) или свободной орбитали (если атом — акцептор). Следовательно, можно сказать, что валентность химического элемента также равна числу электронных орбиталей, которые данный атом использует для образования ковалентных связей.
Таким образом, валентность химического элемента определяется как числом ковалентных связей, которыми его атом связан с другими атомами, так и числом орбиталей, используемых этим атомом для образования связей.
Зная электронное строение атома того или иного элемента, можно определить его валентные возможности. Так, атом водорода всегда проявляет валентность, равную единице, поскольку у него всего одна орбиталь.
Анализируя строение простых и сложных веществ, образованных атомами элементов второго периода, нетрудно убедиться, что большинство этих элементов могут проявлять переменную валентность. Например, в молекулах простых веществ N2, 02, F2 атом азота имеет валентность, равную трем, кислорода — двум, а фтора — единице согласно графическим формулам этих молекул:
Простые вещества бора и углерода являются немолекулярными соединениями, однако атомы этих элементов связаны в кристаллах ковалентными связями: бор — тремя, а углерод — четырьмя. Поэтому их валентности равны соответственно III и IV.
В то же время в соединениях с атомами других элементов кислород, азот и фтор способны проявлять и другие валентности. Например, в молекулярном ионе 
В любом случае у элементов второго периода максимальная валентность не может быть больше четырех, так как на внешнем электронном слое у атомов этих элементов всего четыре орбитали, и, следовательно, атомы максимально могут образовать только четыре ковалентные связи.
У атомов элементов третьего периода в связи с появлением d-подуровня валентные возможности увеличиваются, так как в результате распаривания Зр- и 3s-электронов может образоваться от четырех до семи (у хлора) неспаренных электронов. Например, сера, помимо валентности II в основном состоянии:
может проявлять также валентности IV и VI:
Такое распаривание электронов проявляется обычно поддействием атома более электроотрицательного элемента, например фтора, кислорода, поэтому свои высшие валентности атомы проявляют обычно в соединениях с кислородом и фтором.
Таким образом, валентность является численной характеристикой способности атомов данного элемента образовывать ковалентные связи и поэтому может относиться только к соединениям с таким типом связи.
Степень окисления
Более универсальной характеристикой состояния атома в химическом соединении является степень окисления.
Степень окисления — это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
При определении степени окисления атомов предполагают, что все связывающие электронные пары перешли к более электроотрицательному атому. На самом деле такого полного смещения не происходит даже при взаимодействии элементов с большой разницей в электроотрицателыюстях.
Однако условно считают такое смещение электронных нар полным независимо от реальной степени смещения.
Численное значение этой характеристики выражается в единицах заряда электрона и может иметь положительное, отрицательное и нулевое значения.
Количественно степень окисления определяется числом валентных электронов, смещенных от атома данного элемента в химическом соединении (положительная степень окисления) или к нему (отрицательная степень окисления).
В основу расчета степени окисления атомов в соединениях положен принцип, согласно которому алгебраическая сумма степеней окисления атомов в соединении равна нулю, а в сложном ионе (типа 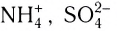
При расчетах надо знать несколько основных положений.
1. Металлы во всех сложных соединениях имеют только положительные степени окисления.
2. Неметаллы могут проявлять как положительные, так и отрицательные степени окисления.
3. Элементы, проявляющие постоянную степень окисления:
- а) щелочные металлы (Li, Na, К, Rb, Cs) — +1;
- б) металлы второй группы (А и В) — +2;
- в) алюминий — +3;
- г) фтор — -1.
Кислород практически во всех своих соединениях проявляет степень окисления —2, исключая его фторид OF2 и пероксид Н202.
4. Высшая положительная степень окисления, как правило, равна номеру группы периодической системы.
5. Низшая отрицательная степень окисления обычно равна разности:
Для большинства элементов характерно проявление переменных степеней окисления в зависимости от атомов, с которыми они связаны, и типа соединения, в котором они находятся. Например, атом азота может проявлять самые разнообразные степени окисления от —3 в молекуле аммиака NH3 до +5 в молекуле азотной кислоты HN03.
Степень окисления не следует отождествлять с валентностью элемента, хотя их численные значения часто совпадают:
В пероксиде Н — О — О — Н валентность кислорода равна двум, а степень окисления —1, в ионе Н30+ его валентность III, а степень окисления —2.
Очень часто степень окисления элемента определяется как алгебраическая сумма степеней окисления по всем связям с другими элементами. Например, в молекуле гидроксиламина NH2OH общая степень окисления азота равна —1. так как по двум связям с водородом азот проявляет суммарную степень окисления —2, а по связи с атомом кислорода +1:
Степень окисления характеризует состояние атомов элемента в сложном веществе независимо от типов связей его атомов. Особенно важна эта характеристика при составлении уравнений окислительно-восстановительных реакций.
- Валентность химического элемента определяется числом ковалентных связей, которыми его атом связан с другими атомами, или, что то же самое, числом орбиталей, используемых данным атомом для образования связей.
- Степень окисления — это условный заряд атома в химическом соединении, вычисленный из предположения, что оно состоит из ионов.
Ионная связь и металлическая связь
Ковалентная химическая связь обычно возникает между атомами неметаллов с одинаковой или не очень сильно различающейся электроотрицательностью. Если различие в электроотрицательности атомов, между которыми образуется химическая связь, велико (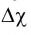
Ионная связь
Ионная связь, как правило, возникает между атомами типичных металлов и типичных неметаллов. Характерным свойством атомов металлов является то, что они легко отдают свои валентные электроны, тогда как атомы неметаллов способны легко их присоединять.
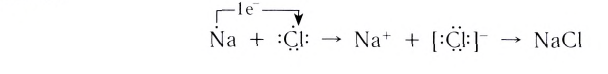
Рассмотрим возникновение ионной химической связи, например, между атомами натрия и атомами хлора в хлориде натрия NaCl.
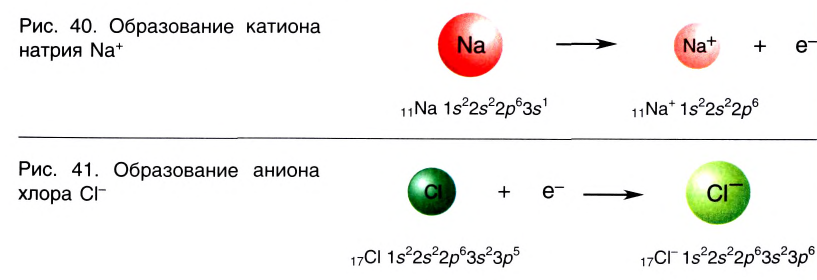
Отрыв электрона от атома натрия приводит к образованию положительно заряженного иона — катиона натрия Na+ (рис. 40).
Присоединение электрона к атому хлора приводит к образованию отрицательно заряженного иона — аниона хлора CI— (рис. 41).
Между образовавшимися ионами Na+ и Cl—, имеющими противоположный заряд, возникает электростатическое притяжение, в результате которого образуется соединение — хлорид натрия с ионным типом химической связи.
Химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов, называется ионной связью.
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершенные электронные конфигурации внешних слоев:
Экспериментально установлено, что в действительности электроны не отрываются полностью от атома металла, а лишь смещаются в сторону атома хлора. Это смещение тем значительней, чем больше разность электроотрицательностей атомов, между которыми образуется ионная связь. Однако даже в случае фторида цезия CsF, в котором разность электроотрицательностей превышает 3,0, заряд атома цезия не равен 1+ . Это означает, что электрон атома цезия не полностью переходит к атому фтора. В случае других соединений, для которых разность электроотрицательностей не так велика, смещение электрона еще меньше, и поэтому следует говорить об ионной химической связи с определенной долей ковалентной.
Соединения, в которых вклад ионной связи значителен, принято называть ионными. Большинство бинарных соединений, содержащих атомы металлов, являются ионными, т. е. в них химическая связь в значительной степени ионная. К числу таких соединений относятся галогениды, оксиды, сульфиды, нитриды и др.
Ионная связь возникает не только между простыми катионами и простыми анионами типа 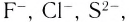
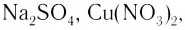
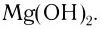
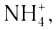
Ионные кристаллы
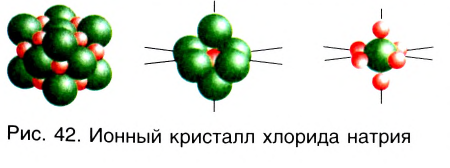
По своим свойствам ионная связь отличается от ковалентной. Так как силы электростатического взаимодействия направлены от иона во все стороны, то каждый ион может притягивать ионы противоположного знака в любом направлении. Поэтому ионное соединение представляет собой гигантскую ассоциацию ионов противоположных знаков, расположенных в определенном порядке, в форме ионного кристалла. Кристаллы ионных соединений состоят из катионов и анионов, которые определенным образом располагаются в пространстве благодаря равновесию сил притяжения и отталкивания. На рисунке 42 представлено строение кристалла хлорида натрия NaCl, состоящего из катионов натрия Na+ и анионов хлора Сl—. Каждый катион натрия окружен шестью анионами хлора, а каждый анион хлора — шестью катионами натрия.
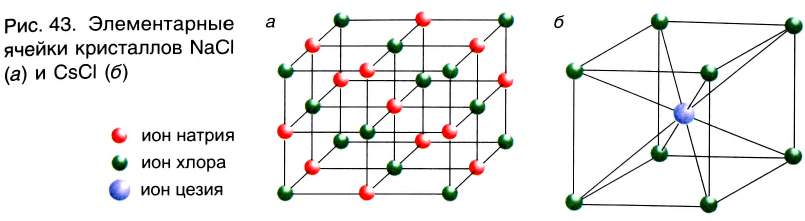
Наименьшей структурной единицей кристалла (т. е. наименьшей частью), отражающей все особенности структуры его кристаллической решетки, является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона. На рисунке 43 приведено строение элементарных ячеек хлорида натрия NaCl и хлорида цезия CsCl. Существуют и другие типы элементарных ячеек.
Если частицы в веществе связаны ионной связью, то оно относится к веществам с немолекулярным строением. В твердом агрегатном состоянии такие вещества представляют собой ионные кристаллы. Так как ионная связь является прочной, то ионные кристаллы имеют обычно высокие температуры плавления и кипения, не имеют запаха. Сильное притяжение ионов друг к другу обусловливает хрупкость таких веществ при разрушении, а отсутствие свободных заряженных частиц объясняет тот факт, что при комнатной температуре они плохо проводят электрический ток.
Металлическая связь. Металлические кристаллы
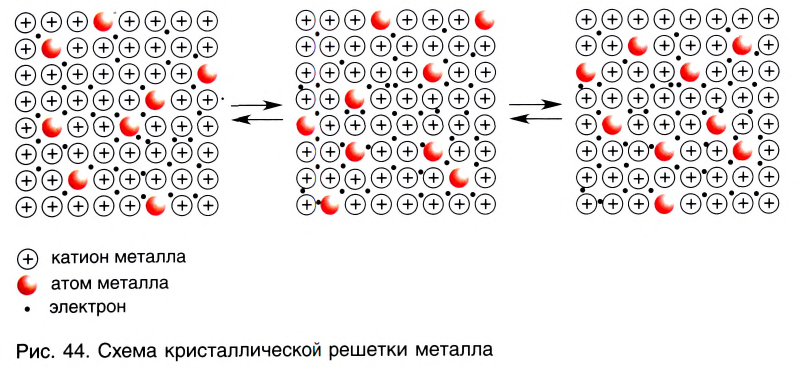
Атомы большинства металлов достаточно легко отдают свои валентные электроны, в результате чего превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими атомами, но и при образовании металлических кристаллов из одних и тех же атомов.
В кристалле металла непрерывно протекают два противоположных процесса — образование ионов металла из нейтральных атомов в результате отрыва от них валентных электронов:
и присоединение валентных электронов к ионам металла с образованием нейтральных атомов:
В узлах кристаллической решетки металлов попеременно находятся как нейтральные атомы, так и положительно заряженные катионы металла (рис. 44). Образующиеся при этом электроны свободно перемещаются внутри кристалла и компенсируют взаимное отталкивание между положительно заряженными катионами металла, а также удерживают атомы в составе кристалла. Они становятся общими для всех атомов и ионов металла, связывая их между собой.
► Химическая связь между атомами в металлическом кристалле посредством обобществления валентных электронов называется металлической связью.
Металлическая связь не имеет направленности в пространстве. Эта химическая связь является коллективной, как и ионная, в ней принимают участие все атомы кристалла металла.
Металлическая связь сходна с ковалентной связью тем, что при ее образовании так же, как и при образовании ковалентной связи, электроны обобществляются. Однако в случае металлической связи эти электроны связывают все атомы металлического кристалла, тогда как в ковалентном соединении связываются лишь находящиеся рядом атомы.
Взаимосвязь различных типов химической связи
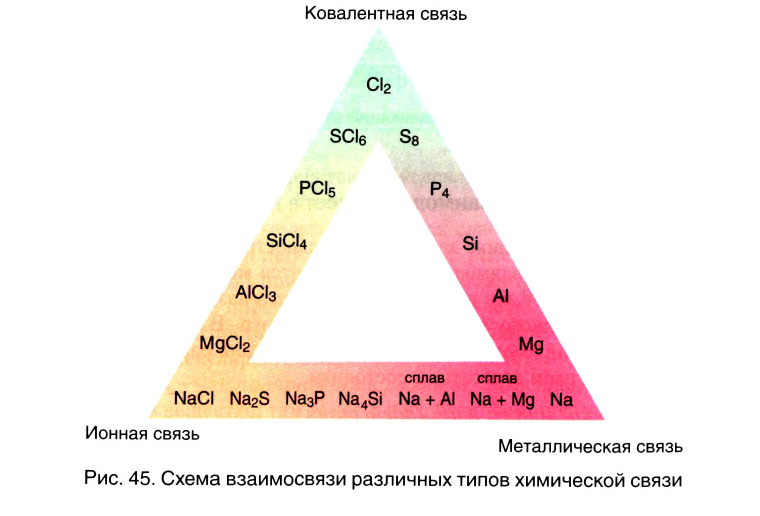
Вы познакомились с тремя типами химической связи и соответствующими веществами, которые мы характеризовали как вещества с ковалентным (02, N2, Cl2), ионным (LiF, NaCl) и металлическим типом связи (металлы). В реальности в большинстве неорганических веществ взаимодействие между различными атомами носит более сложный характер, являясь как бы комбинацией различных типов связи. Это особенно характерно проявляется в ряду простых и сложных бинарных веществ элементов III периода, который Д. И. Менделеев назвал «типическим».
В углах представленного треугольника химических связей (рис. 45) расположены вещества, являющиеся наиболее характерными представителями каждого типа связи: NaCl — соединений ионного типа, Cl2 — ковалентного, а Na — металлического. В ряду от NaCl до Cl2 находятся бинарные вещества общей формулы ЭСl, где Э — элемент третьего периода:
Как вам уже известно, в периодах от щелочного металла до галогена электроотрицательность последовательно растет и, соответственно, уменьшается величина 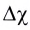
где 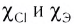
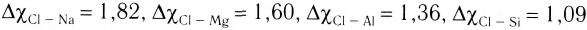
Подобные закономерности наблюдаются и в двух других рядах веществ. В ряду от Na до NaCl располагаются соединения условной формулы NaЭ, где Э — элемент третьего периода. Характер химической связи в этих веществах последовательно изменяется от металлического до ионного.
В ряду от Na до Cl2 располагаются простые вещества третьего периода. Свойства этих веществ последовательно изменяются от металлических к неметаллическим, что соответствует изменению характера химической связи от металлического к ковалентному.
Таким образом, мы можем заключить, что однозначное определение типа химической связи в большинстве неорганических соединений невозможно. В реальности химическая связь между разнородными атомами носит смешанный характер с той или иной долей ковалентной, ионной или металлической составляющей.
- Ионная связь осуществляется за счет электростатического притяжения между противоположно заряженными ионами.
- Химическая связь между атомами в металлическом кристалле посредством обобществления электронов называется металлической связью.
Межмолекулярное взаимодействие
Молекулы, несмотря на свою электронейтральность, способны взаимодействовать между собой. Такое взаимодействие называется межмолекулярным. Силы, за счет которых возникает это взаимодействие, часто называют ван-дер-ваальсовыми в честь голландского ученого И. Д. Ван-дер-Ваальса. Эти силы обусловливают притяжение молекул данного вещества (или разных веществ) друг к другу в жидком и твердом агрегатном состоянии.
Природа межмолекулярного взаимодействия
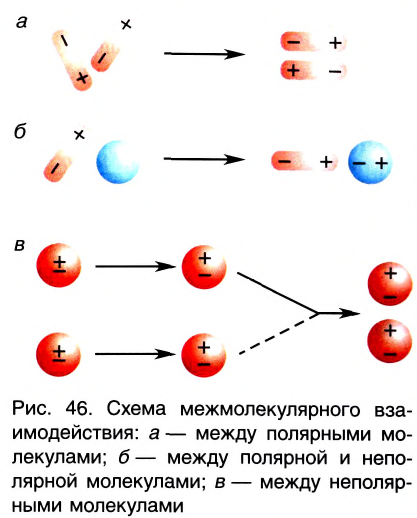
Межмолекулярное взаимодействие, как и химическая связь между атомами, имеет электростатическую природу. Несимметричность распределения электронов и ядер атомов в молекуле приводит к появлению у нее электрических полюсов — положительного с той стороны, где электронная плотность понижена, и отрицательного, где она повышена. Образовавшиеся полярные молекулы притягиваются друг к другу разноименными полюсами (рис. 46, а).
Взаимодействие может осуществляться также между полярной и неполярной молекулами. При этом в неполярной молекуле под действием электрического поля полярной молекулы возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу (рис. 46, б).
В неполярных молекулах вследствие непрерывного движения частиц с различными электрическими зарядами (ядер и электронов) также непрерывно возникают, перемещаются и исчезают электрические полюсы. Поэтому в разные моменты времени возникают мгновенные диполи, между которыми также действуют силы притяжения (рис. 46, в).
В этом и состоит объяснение существования притяжения между любыми молекулами, как полярными, так и неполярными.
Прочность межмолекулярного взаимодействия и агрегатное состояние вещества
Межмолекулярное взаимодействие обусловливает переход вещества из газообразного в жидкое, а затем и в твердое состояние. Но по сравнению с ковалентной связью межмолекулярные взаимодействия слабые, связи между молекулами относительно непрочные и легко разрываются. Именно поэтому молекулярные вещества плавятся и кипят при относительно низких температурах. Межмолекулярное взаимодействие определяет также механические свойства подобных веществ, их теплопроводность, электрическую проводимость и др.
Энергия межмолекулярного взаимодействия зависит в основном от двух характеристик молекулы — ее полярности и размера. Чем сильнее межмолекулярное взаимодействие в веществе, тем выше у него будут температуры плавления и кипения. Например, кислород из-за более прочного межмолекулярного взаимодействия кипит при более высокой температуре, чем азот, что и используется при получении этих газов из воздуха. Углеводороды с большой молекулярной массой кипят при более высокой температуре, чем низкомолекулярные углеводороды. Это свойство углеводородов лежит в основе процесса перегонки нефти.
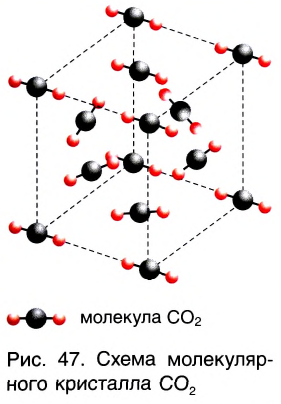
Молекулярные кристаллы
В узлах молекулярной кристаллической решетки расположены молекулы, связанные между собой слабыми межмолекулярными связями (рис. 47). Молекулярные кристаллические решетки образуют водород, азот, кислород, сера, йод, вода, углекислый газ, многие органические вещества. Кристаллы благородных газов также молекулярные, они построены из одноатомных молекул.
Для веществ, образующих молекулярные кристаллы, характерны низкие температуры плавления и кипения, значительная сжимаемость, небольшая твердость. Нагревание некоторых молекулярных кристаллов, например иода, углекислого газа, приводит к переходу вещества из твердого состояния сразу в газообразное, минуя жидкую фазу. Этот процесс называется возгонкой или сублимацией.
В то же время многие органические вещества с большими молекулами, содержащими десятки тысяч и более атомов, вообще не плавятся, так как прочность связей между молекулами в сумме оказывается выше прочности связей внутри молекулы. Попробуйте расплавить, например, крахмал, целлюлозу, вату. Вы убедитесь в том, что вещество начнет разрушаться раньше, чем плавиться.
Однако надо иметь в виду, что реакционная способность молекулярных веществ зависит от прочности не межмолекулярных, а внутримолекулярных связей. Ведь при химическом взаимодействии разрываются именно внутримолекулярные связи. Например, парафин — механически непрочное вещество, связи между молекулами в нем слабые. Но это вещество химически достаточно устойчиво.
Водородная связь
Одной из разновидностей межмолекулярного взаимодействия является водородная связь. Она осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы:
где X — атом одного из наиболее электроотрицательных элементов — F, О, N, реже CI и S.
Возникновение водородной связи (на схеме она показывается тремя точками) обусловлено прежде всего тем, что у атома водорода имеется только один электрон, который при образовании полярной ковалентной связи с атомом сильно электроотрицательного элемента смещается в сторону атома этого элемента. На атоме водорода возникает высокий эффективный положительный заряд, что в сочетании с отсутствием внутренних электронных слоев позволяет другому атому сближаться до расстояний, близких к длинам атомных связей.
В первом приближении образование водородной связи можно объяснить электростатическим взаимодействием между молекулами. Определенный вклад в образование водородной связи вносит донорно-акцепторное взаимодействие «свободной» 1s-орбитали атома водорода и орбитали с неподеленной парой электронов электроотрицательного атома. Поэтому водородная связь обладает свойством направленности, во многом определяя структуру вещества в конденсированном состоянии.
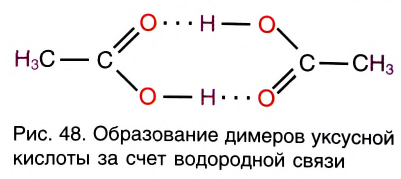
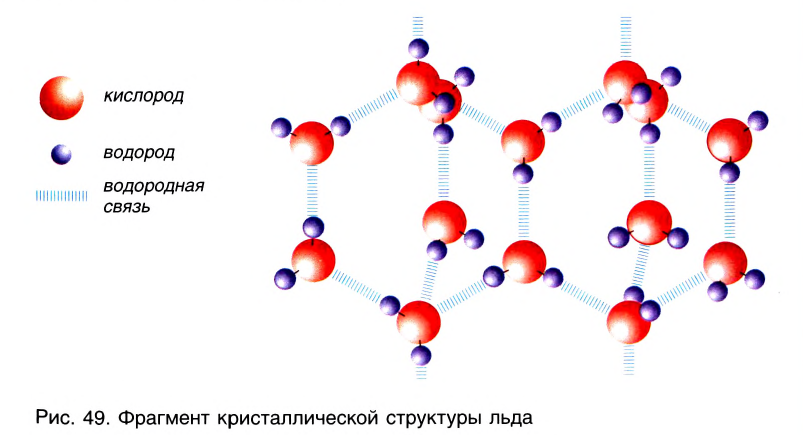
Благодаря водородным связям молекулы объединяются в ассоциаты, например молекулы уксусной кислоты образуют димеры (рис. 48). Водородные связи определяют кристаллическую структуру льда, где каждый атом кислорода в молекулах Н20 связан с четырьмя атомами водорода — двумя ковалентными и двумя водородными связями (рис. 49).
Водородная связь в несколько раз сильнее, чем обычное межмолекулярное взаимодействие, но слабее ковалентной связи. С повышением температуры прочность водородной связи уменьшается. Поэтому водородная связь более характерна для веществ в твердом и жидком состояниях.
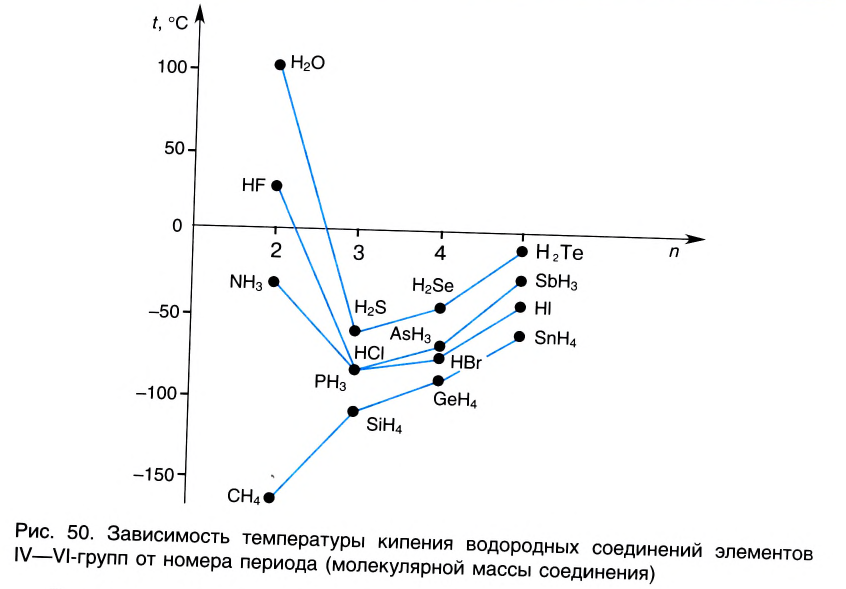
Наличие водородной связи существенно влияет на физические свойства веществ. Так, аномально высокие температуры кипения H2O, HF, HN3 по сравнению с аналогичными веществами, образованными элементами этих же групп других периодов (рис.50), объясняются образованием ассоциатов за счет водородных связей.
Во дородная связь О…Н наиболее распространена в природе. Именно ее наличием обусловлены аномальные свойства воды, в том числе высокие температуры кипения и плавления, необычайно высокие теплоемкость и диэлектрическая проницаемость. Благодаря своей ажурной структуре (см.рис.49) лед имеет меньшую плотность, чем жидкая вода. Поэтому зимой лед находится на поверхности воды, и глубокие водоемы не промерзают до дна.
Светло-голубой цвет чистой воды и толстого слоя льда обусловлен водородными связями. Когда одна молекула воды колеблется, то она заставляет колебаться и другие, связанные с ней молекулы. В результате этого молекулы H2O частично поглощают красный цвет, а вода приобретает голубоватый оттенок.
Водородная связь может возникать и между атомами одной молекулы. Чаще всего внутримолекулярная водородная связь возникает в молекулах органических веществ, содержащих в своем составе такие группы атомов как —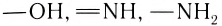
Особенно велика роль водородных связей в биохимических процессах с участием высокомолекулярных соединений (белки, ДНК и др.), пространственная структура которых определяется наличием водородных связей.
Межмолекулярное взаимодействие возникает между любыми молекулами, как полярными, так и неполярными, и имеет электростатическую природу.
Межмолекулярное взаимодействие обусловливает переход вещества из газообразного в жидкое, а затем и в твердое состояние.
Водородная связь осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом фтора, кислорода, азота (реже хлора и серы), принадлежащим другой молекуле.
- Валентность и степень окисления
- Ионная связь
- Химические реакции
- Теория электролитической диссоциации
- Физические и химические явления
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
Тема урока «Химическая связь.
Схема образования ковалентной связи»
Цели урока:
- На
основании знаний о строении атома начать формирование понятий «химическая
связь», «ковалентная связь», «электроотрицательность», «ковалентная
полярная и неполярная связь». - Научить
школьников записывать схемы образования ковалентной связи для двухатомных
молекул. - Сформировать
понятие о кратности ковалентной связи. - Разъяснить
смысл электронных и структурных формул.
Тип урока: Формирование новых знаний
Вид урока: Мультимедиа урок.
Оборудование: компьютер, проектор,
мультимедийные ресурсы, периодическая система химических элементов
Д.И.Менделеева.
ХОД УРОКА
I. Организационный момент
II.Актуализация знаний
Прежде чем рассматривать механизм ковалентной связи, учитель
предлагает повторить с учащимися строение атома и распределение электронов по
энергетическим уровням; объяснить на основании строения атома причину
химической инертности атомов благородных газов; рассмотреть, что такое
завершенный электронный слой. (Презентация 1)
Несколько учащихся на макете составляют электронные формулы (Презентация
4)
III. Изучение нового материала
Основными объектами окружающего нас мира являются атомы и
молекулы. Наверняка многие из вас знают, что из атомов и молекул состоят все
вещи в мире. Тогда как вы объясните, чем они отличаются? Если бы все атомы
были одинаковыми, в мире существовал бы лишь один вид материи.
Вам известно, что в настоящее время, существует более ста разновидностей
атомов, которые могут соединяться между собой. Если соединяются несколько
атомов одного вида, они образуют простые вещества. Существуют и такие вещества,
молекулы которых состоят из двух-трех и более атомов разного вида – их называют
сложными. Каждое вещество имеет свое название и обладает уникальными свойствами.
Каким же образом атомы соединяются между собой?
Далее обсуждаем, все ли атомы химических элементов соединяются. Нет ли в
природе одиночных атомов? Оказывается, есть – это атомы благородных
газов.
Электроны в атоме располагаются на энергетических уровнях. Электроны наружного
слоя называют валентными. Полностью заполненным энергетическим уровнем обладают
элементы VIII А группы – благородные (инертные) газы.
Сравниваем электронное строение атомов благородных газов, выясняем особенность
завершенных и устойчивых внешних энергетических уровней:
Чем объяснить устойчивость внешнего восьмиэлектронного уровня?
Причина этого заключается в том, что все электроны на внешних энергетических
уровнях элементов спарены, то есть уже в атомах связаны попарно.
Поскольку электронная конфигурация благородного газа очень
устойчива, то её стремятся достичь и атомы других элементов. Все атомы,
объединяясь в молекулы, сделать это могут либо, отдав электроны, либо приняв
электроны, либо обобществив свои электроны с электронами других атомов.
Число электронов, необходимых атомам разных химических элементов до завершения
внешнего электронного слоя, различно.
Внешние электронные слои атомов других химических элементов
могут содержать как спаренные, так и не спаренные электроны.
Предлагаем учащимся подсчитать, сколько электронов не хватает
атомам каждого из химических элементов второго периода для завершения внешнего
электронного слоя.
Вывод: если в атоме нет
непарных электронов и нет возможности для их распаривания, как у инертных
газов, они не образуют химической связи и соединений не образуют, потому и
инертны. В образовании химической связи участвуют в основном непарные электроны
наружного слоя атома. Сущность образования химической связи состоит в спаривании
непарных электронов.
Ребята, мы ответили на один вопрос, поставленный в задачу нынешнего
урока.
– Что заставляет атомы соединяться друг с другом в молекулы?
А вот как происходит это спаривание, нам предстоит разобраться.
Интересно, например, как осуществляется связь между атомами
элементов-неметаллов, которые имеют сходную тенденцию к присоединению
электронов? Рассмотрим вначале, как образуется связь между атомами одного и
того же химического элемента, например в веществах, имеющих двухатомные молекулы.
Два одинаковых атома элемента-неметалла могут объединяться в молекулу только
одним способом: обобществив свои внешние электроны, то есть, сделав их общими
для обоих атомов.
Когда атомы обобществляют свои электроны, образуется ковалентная связь.
Ковалентная связь – это химическая связь,
возникающая в результате образования общей электронной пары между
взаимодействующими атомами.
Для наглядности изображения того как образуется ковалентная связь используются
электронные формулы. В ней каждый атом обозначается буквенными символами
соответствующего элемента, а вокруг этого символа точками обозначают все
валентные электроны, в том числе и не участвующие в образовании связи. Одна
точка обозначает один электрон.
Например: электронная формула водорода
электронная формула хлора
электронная формула кислорода
электронная формула азота
Для образования связи каждый атом предоставляет в общее
пользование по одному электрону. Ковалентную связь образует только пара
электронов, находящаяся между атомами. Она называется поделенной парой.
Остальные пары электронов называют неподеленными парами. Они
заполняют оболочки и не принимают участие в связывании. При этом образующаяся
пара электронов принадлежит одновременно двум атомам.
Механизм возникновения ковалентной связи рассмотрим на примере
образования молекулы водорода:
Ядро атома водорода окружено сферическим электронным облаком,
образованным 1 s-электроном. При сближении атомов до определенного
расстояния начинают действовать силы притяжения между ядром одного атома и
электроном другого атома, а так же силы отталкивания между ядрами и между
электронами
Ковалентная связь бывает двух видов – ковалентная
неполярная и ковалентная полярная. Связано такое деление с тем, где именно
между ядрами будут располагаться общие электронные пары – ровно посередине или
будут смещены в сторону одного из ядер.
Расположение общих электронных пар между ядрами связывающихся
атомов зависит от электроотрицательности атома.
Электроотрицательность – это способность атомов химического
элемента оттягивать к себе общие электронные пары, участвующие в образовании
химической связи.
У элементов рассчитали значение электроотрицательности и расположили их по
возрастанию этого значения в ряд электроотрицательности (приводится не полностью):
|
Элемент |
K |
Na |
Сa |
Mg |
Al |
Si |
B |
H |
C |
S |
I |
Br |
Cl |
N |
O |
F |
|
χ |
0.9 |
0.93 |
1.0 |
1.2 |
1.47 |
1.74 |
2.01 |
2.1 |
2.5 |
2.58 |
2.66 |
2.74 |
2.83 |
3.07 |
3.5 |
4.0 |
Используя периодическую систему химических элементов Д.И.
Менделеева, объясняем, что в периодах, слева направо, электроотрицательность
увеличивается, в главных подгруппах сверху
вниз – уменьшается. Что касается ряда то, правее стоящий в этом ряду
элемент обладает большей электроотрицательностью и лучше оттягивает в свою
сторону общие электронные пары. Фтор самый электроотрицательный элемент.
Если молекула состоит из атомов одного вида,
электроотрицательность которых равна, то общие электронные пары будут
находиться посередине между ядрами двух связывающихся атомов, поскольку ядра
притягивают общие электронные пары в равной степени. В этом случае между атомами
образуется ковалентная неполярная связь. Ковалентная неполярная
связь образуется в таких молекулах как Н2,
F2, N2 и
т.д.
Пример образования ковалентной неполярной связи вмолекуле фтора.
Рассмотрим образование ковалентной связи в молекуле фтора F2.
Электронная формула внешнего слоя атома фтора: 1s22s22p5,
электронно-графическая формула:
Один из р-электронов в атоме
фтора является неспаренным.
При образовании молекулы неспаренные электроны двух атомов фтора
образуют одну общую электронную пару; в результате каждый атом фтора
приобретает электронную структуру 2s22p6,
т.е. на внешнем энергетическом уровне помещается по восемь электронов.
Демонстрация схемы образования ковалентной неполярной химической
связи в молекуле фтора. (Презентация 3, слайд 2)
Связь между атомами может быть образована и несколькими
электронными парами. Существуют молекулы, в которых между двумя атомами
возникают две или три общие электронные пары. Такие ковалентные связи
называются двойными и тройными, а общее их название – кратные связи. При
увеличении числа общих электронных пар прочность ее увеличивается.
Например, в молекулах водорода H2 и
фтора F2 связь между атомами водорода и
фтора соответственно – одинарная (однократная), в молекуле кислорода O2 –
двойная, а в молекуле азота N2 –
тройная. (Презентация 3, слайды 3, 4)
Подводим учащихся к выводу о том, что кратность связи в молекуле
определяется (в основном) числом непарных электронов.
При соединении атомов одного элемента никакого смещения
электронов не происходит, т.к. их электроотрицательность одинакова.
Если ковалентная связь образуется между атомами с различной ЭО, то общая
электронная пара смещается в сторону атома с большей ЭО.
Схематично образование ковалентной полярной связи в молекуле НF
можно изобразить так:
Молекула фтороводорода образована элементами, отличающимися по
своей ЭО.
Δ Э.О. = 3,98 – 2,20 = 1,78
Общая электронная пара оказывается смещенной в сторону фтора, в
результате на атоме фтора возникает частичный отрицательный заряд δ– (дельта
минус), а на атоме водорода – частичный положительный δ+ (дельта
плюс) Нδ+Fδ–.
Таким образом, молекула становится полярной. Чем больше различается
электроотрицательность взаимодействующих атомов, тем больше смещена общая
электронная пара к наиболее электроотрицательному атому, тем полярнее
химическая связь между атомами. (Презентация 3, слайд 5)
Направление смещения электронов обозначается также стрелкой:
C ––> Cl, C ––> О,
C ––> N, О <–– Н,
C <–– Mg
Ковалентная химическая связь между
атомами разных элементов, при которой общая электронная пара (пары) смещена в
сторону более ЭО элемента (разность ЭО < 1,9), называется ковалентной
полярной.
Молекулы хлороводорода, воды, аммиака также являются полярными.
Их еще называют диполями (имеющими два полюса).
Общую пару электронов иногда обозначают черточкой, которая
символизирует химическую связь. Если общие электронные пары обозначать
чертой, то электронная формула превращается в структурную:
H:Cl
H–Cl
Электронные и структурные формулы показывают последовательность
соединения атомов в молекуле. Например, в молекуле аммиака атомы водорода
соединяются с атомами азота, но между собой не соединяются.
Под числом химических связей подразумевают число общих пар
электронов. В структурной формуле соединения, число черточек, отходящих от
данного атома, равно его валентности.
IV. Закрепление
Составление схемы образования ковалентной полярной связи в
молекуле Н2O. (Презентация 3,
слайд 6)
Выполнение тренировочного теста по теме. (Презентация 2)
V. Домашнее задание
§ 40, § 41, с 141 – 144. Составить схемы образования
ковалентной связи в молекулах Сl2 и
HCl.
Общие электронные пары, образующиеся в простых веществах
H2,O2,Cl2,F2,N2
, в одинаковой степени принадлежат обоим атомам. Такая ковалентная связь называется неполярной.
Ковалентная неполярная связь соединяет атомы в простых веществах-неметаллах.
Если ковалентная связь образуется между разными атомами, то общая электронная пара смещается к тому из них, который имеет более высокую электроотрицательность (ЭО). Он получает частичный отрицательный заряд. Атом, имеющий меньшую ЭО, становится заряжённым положительно. В этом случае образуется полярная ковалентная связь.
Ковалентная полярная связь образуется между атомами неметаллов в сложных веществах.
Рассмотрим образование ковалентных связей в сложных веществах.
1. Образование молекулы хлороводорода.
У атома водорода на внешнем уровне — один электрон. У хлора на внешнем уровне — семь электронов, один из которых неспаренный.
Образуется одна общая электронная пара, которая смещена к атому хлора. В результате
появляются частичные заряды: на атоме хлора — отрицательный, а на атоме водорода — положительный. Сдвиг электронной плотности принято обозначать греческой буквой дельта
δ
:
Рис. (1). Образование молекулы хлороводорода
Структурная формула хлороводорода
H−Cl
Подобным образом соединяются атомы в молекулах других галогеноводородов:
2. Образование молекулы воды.
На внешнем уровне атома кислорода — шесть электронов, два из которых неспаренные.
Атом кислорода образует две общие электронные пары с двумя атомами водорода.
Электронная плотность этих общих пар сдвинута к более электроотрицательному кислороду. Атом кислорода имеет отрицательный заряд, а атомы водорода — положительный.
Рис. (2). Образование молекулы воды
Сходное строение имеет молекула сероводорода. Структурные формулы воды и сероводорода:
H−OH−S||HH
3. Образование молекулы аммиака.
У атома азота — пять внешних электронов, три из которых неспаренные.
Атом азота присоединяет к себе три атома водорода.
Азот — более электроотрицательный элемент, поэтому на его атоме будет отрицательный заряд, а на атомах водорода — положительные заряды.
Рис. (3). Образование молекулы аммиака
Структурная формула аммиака:
H−N−H|H
Для того чтобы определить знаки частичных зарядов на атомах в веществе, надо сравнить ЭО неметаллов.
Пример:
определим частичные заряды атомов в соединении
CCl4
.
Вспомним положение углерода и хлора в ряду ЭО:
По положению элементов в этом ряду видно, что более электроотрицательный элемент в этой паре — хлор. Его атом оттягивает к себе общие электронные пары от атома углерода. Значит, на атоме хлора будет частичный отрицательный заряд, а на атоме углерода — частичный положительный:
Полярную ковалентную связь часто изображают стрелкой:
H→Cl
. Стрелка показывает направление смещения общей электронной плотности.
Источники:
Рис. 1. Образование молекулы хлороводорода © ЯКласс
Рис. 2. Образование молекулы воды © ЯКласс
Рис. 3. Образование молекулы аммиака © ЯКласс
Концепции и немного истории
Валентность показывает на присутствие конкретной силы. Появление подобной связи случается через обобщение атомных электронов, у которых нет «пары». Ковалентная связь случается между атомами неметаллов и может быть замечена как в молекулах, так и в кристаллах.
В первый раз ковалентность была открыта в 1916 г. химиком из Америки Дж. Льюисом, и прошло некоторое время, пока сформировалась гипотеза, а потом её смогли обобществить, и она была доказана опытным путём. Химики узнали, что это за прецедент, при котором выявили: электроотрицательность неметаллов довольно велика, и при содействии 2-х физических атомов притягивание электронов может быть сложной задачей и даже неосуществимой, поскольку они в 2-х атомах соединяются, и между ними случается ковалентность атомов.
Типы ковалентной связи
Характеристика ковалентности — это действие, которое случается в веществах с неметаллическими качествами. Выявляется она при совместном участии атомных электронов в различных элементах. Схема образования ковалентной полярной связи — взаимодействующие атомы имеют различный способ электроотрицательности, а открытые электроны не принадлежат тождественно 2 атомам.
Большую часть времени электроны приближаются к первому атому, чем ко второму. Случаем ковалентности полярной могут быть взаимодействия, которые выявляются в молекуле хлористого водорода, где раскрытые электроны в ответе за ковалентность и ближе к атому хлора, чем водород. И дело в том, что электроотрицательный показатель у первого вещества выше, чем у второго. Хорошим примером ковалентной полярной связи будет вода.
Эти одинарные химические взаимодействия происходят из-за появления накопительных молекулярных частей электронов, которые являются общими для двух взаимодействующих частей. Появление электронных пар связано с перекрытием орбиталей. Такие типы взаимодействий в химии происходят между частями обоих элементов.
Вещества со строением такой структуры:
- газы;
- вода;
- алкоголь;
- углеводы;
- белковая пища;
- кислотная органика.
Ковалентность появляется методом открытия пар электронов в несложных субстанциях или же сложных соединениях.
Чтобы квалифицировать природу кристаллической химической связи, надо взглянуть на атомную составляющую частиц, находящихся в формуле. Взаимодействия описанного типа образуются лишь только между веществами, в которых доминируют неметаллические качества. В случае если слияние имеет атомы похожих или же различных неметаллов, то взаимодействия между ними считаются ковалентными.
Полюсное взаимодействие
Когда в соединении совместно есть металл и неметалл, выявляется, что элементы образуют ионное соединение. Ковалентная полярность связывает решётку атомов всевозможных неметаллов друг с другом.
Это бывают атомы:
- хлора и водорода;
- фосфора и кислорода;
- аммиака.
Есть другое определение таких веществ. Это говорит о том, что кратная цепь возникает между неметаллами с разными показателями электроотрицательного появления. В 2-х случаях возможно выделить многообразие атомов, где была замечена эта связь.
Выставленные соединения в нормальных критериях наличествуют в водянистом или же газообразном агрегатном состоянии. Формулы Дж. Льюиса могут помочь понять устройство и насыщаемость связывания атомных ядер.
Действие получения ковалентности для атомов с разными значениями электроотрицательности объединяется к образованию совместной плотности электрического состояния. Как правило, он сдвинут к составляющей, что содержит самую возвышенную степень электроотрицательности. По причине возникающего смещения всей пары в направленности вещества с большим числом электроотрицательности в нём отчасти появляется негативный заряд. Вследствие этого, появляется слияние с 2-мя по-разному заряженными полюсами. Нередко при формировании полярных отношений применяется акцепторный или же донорно-акцепторный механизм.
Путь образования ковалентных связей:
- Акцепторный (обмена). Любой атом выделяет 1 неспаренный электрон.
- Донорно-акцепторный ковалентный тип. Один атом (донор) гарантирует электрическую пару, а акцептор орбиталь для неё.
Устройство образования ковалентных связей описывается как конфигурация взаимодействия, свойственная не для всех полярных соединений. Примерами считаются вещества органического и неорганического происхождения.
Неполярная структура
Неполярная ковалентность связывает составляющие с неметаллическими качествами, что точно так же равно электроотрицательному значению. Другими словами, элементы с неполярностью предполагают собой соединения, состоящие из различных чисел похожих неметаллов. Формула вещества с ковалентной неполярной связью: N2.
Примером ковалентной неполярной связи считаются вещества простой структуры: О2, N2, Cl2. Составление этого типа взаимодействия и других неметаллических частей включает экстремальные электроны. Валентность относится к количеству электронов, важных для окончания обычной наружной оболочки. Атом имеет возможность предоставить или же получить негативно заряженные частички.
Эта работа относится к уровню двухэлектронных или же двухцентровых цепей. В этом случае пара электронов занимает общую долю между 2-мя орбиталями. В структурных формулах пара электронов записывается в виде части по горизонтали. Каждая связь демонстрирует количество общих пар электронов в молекуле. Потребуется затратить наибольшее число энергии для разрушения с помощью этой связи, вследствие чего эти вещества станут одними из самых мощных по шкале крепости.
По донорно-акцепторному механизму неполярные части буквально не связаны. Ковалентная неполярная связь представляет собой структуру, образующуюся совместными электронными парами. Эти пары в равной степени принадлежат 2 атомам.
Однообразие ковалентных неполярных и полярных связей заключается в возникновении абсолютной электрической плотности. Лишь только в ином случае приобретённые электрические совместные части в равной степени принадлежат 2 атомам, занимающим центральное состояние. В итоге выборочные положительные и отрицательные заряды не образуются, что значит полученные цепочки считаются неполярными.
Неполярность приводит к образованию совместной пары, в итоге конечная степень атома будет законченной. Качества этих веществ, имеющих определённые структуры, выделяются от тех, что с металлическими или же ионными взаимодействиями. В обменном процессе ковалентности между атомами любой из них представляет собой один неспаренный электрон, образующий электрическую ковалентность. В этом случае они могут иметь обратные заряды.
Случаем подобной ковалентной связи могут быть взаимодействия, которые видятся в молекуле водорода. Когда атомы вещества намереваются совместно действовать, их электрические части попадают друг в друга. В итоге плотность между ядрами возрастает, они сами притягиваются, а энергия системы миниатюризируется. Впрочем, в случае если ядра делаются очень близкими, они начинают отталкиваться, и, таким образом, между ними появляется подходящее расстояние.
Что касается донорно-акцепторного вида ковалентности, то это случается, когда 1 из частиц, донор, предположит собственную электрическую пару для связи, а 2-я, акцептор, считается свободной орбиталью.
Квалифицирование ковалентности
Смысл ковалентной неполярной связи такой — это взаимодействие, которое появляется между похожими атомами. В молекулах с неполярной ковалентностью совместные пары электронов находятся на равных расстояниях от атомных ядер. К примеру, в молекуле воздуха атомы имеют 8 электрических конфигураций, в то время как они имеют 4 совместные электрические пары. Препараты с неполярной ковалентностью, как правило, предполагают собой газы, воду или же сравнительно низколегированные твёрдые вещества.
Чтобы верно квалифицировать ковалентную полярную и неполярную связь, достаточно понять свойство и формулу молекул, в случае, если они состоят из атомов различных составляющих, взаимодействие будет полярным, а если из 1-го, то станет неполярным. Ещё надо знать, что неполярные связи в целом могут встречаться лишь только между неметаллами, и это связано с механизмом ковалентных взаимодействий.
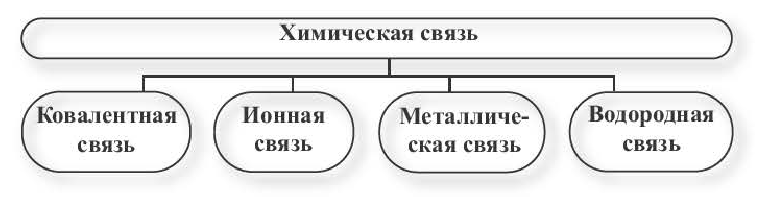

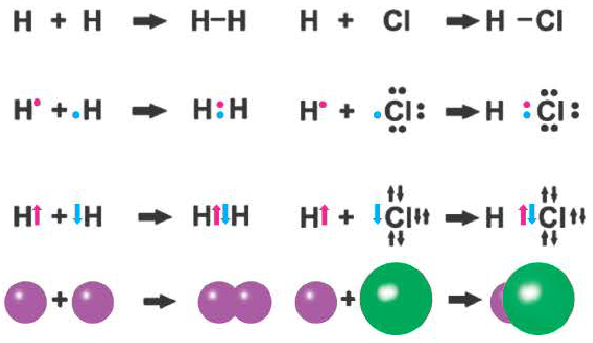
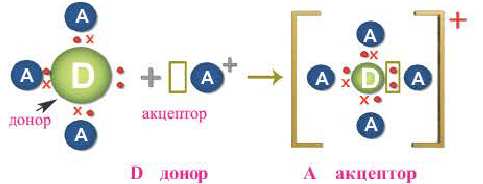
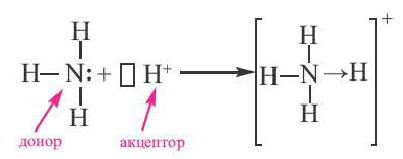
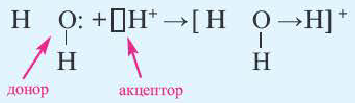

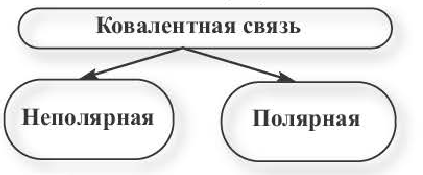


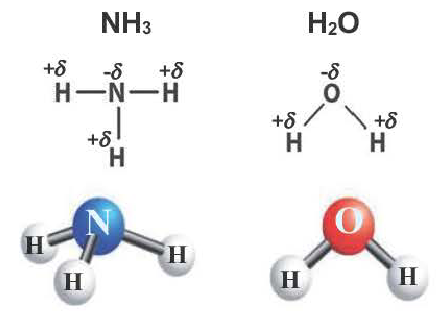
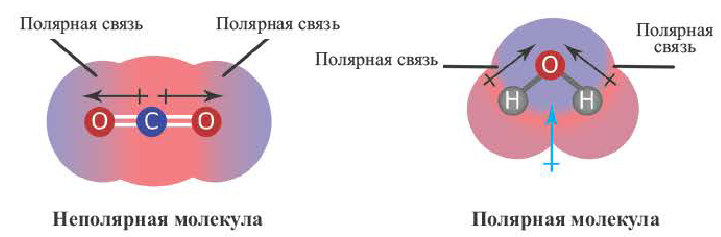
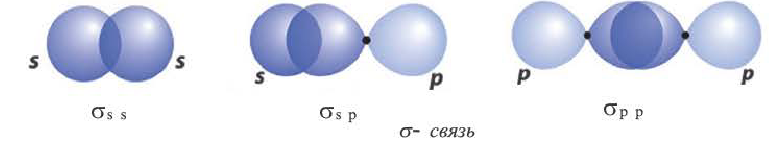
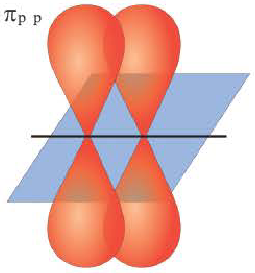
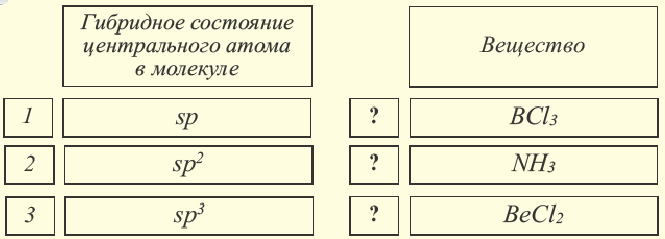
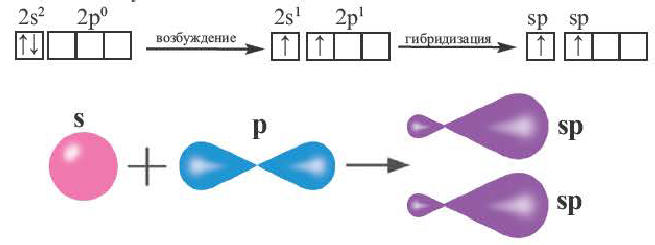

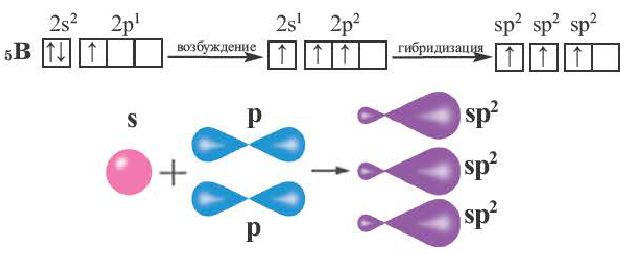
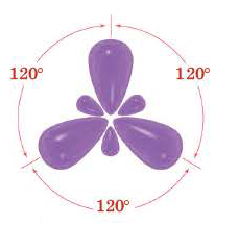
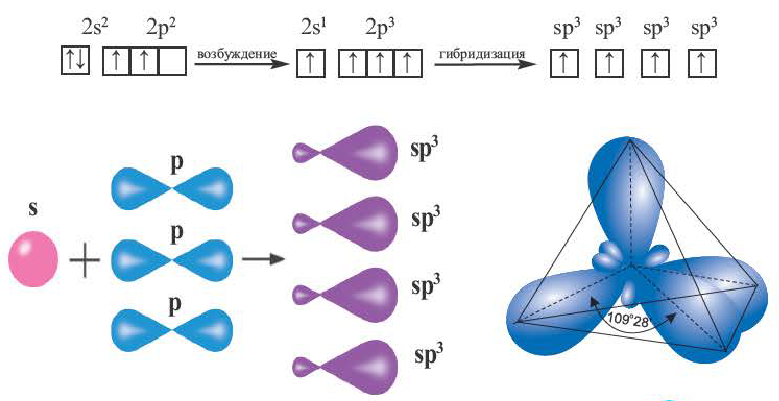
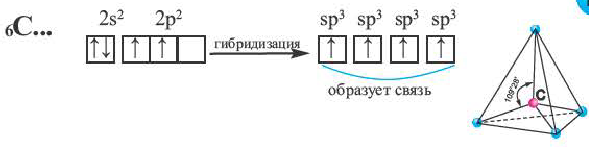
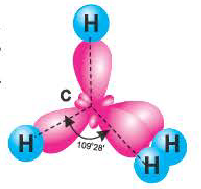
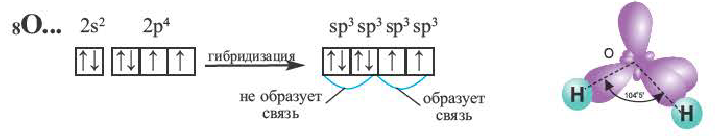
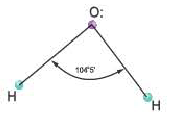
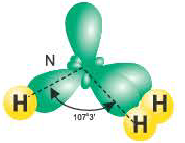
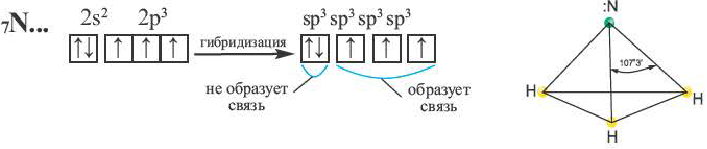
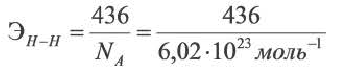
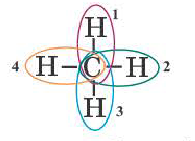
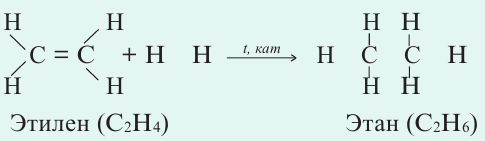



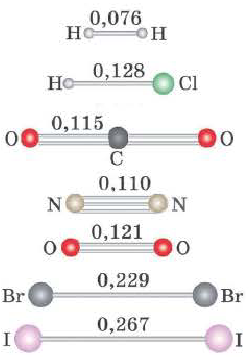
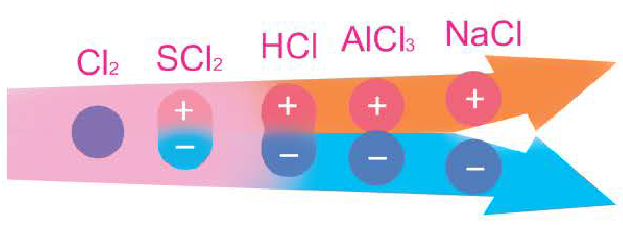
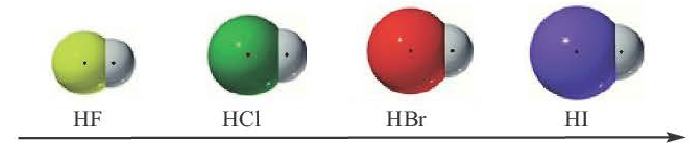

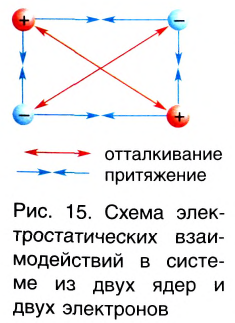
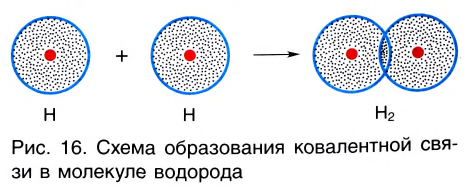
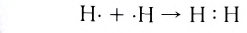

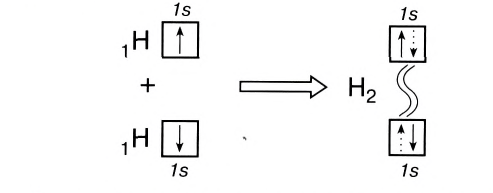
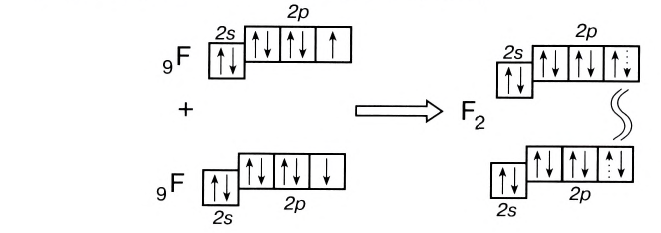
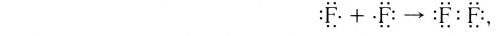


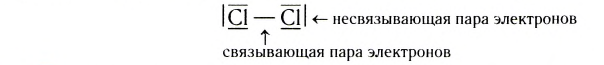
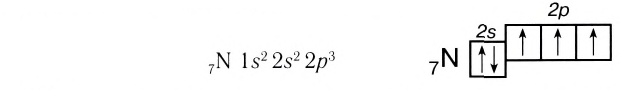
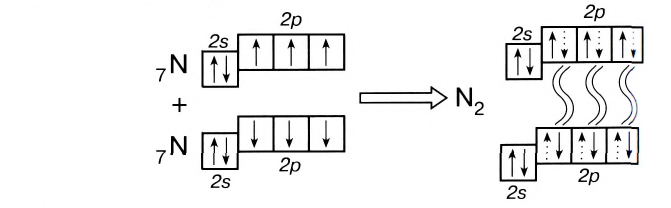


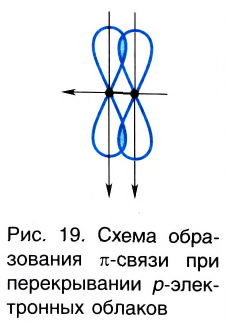

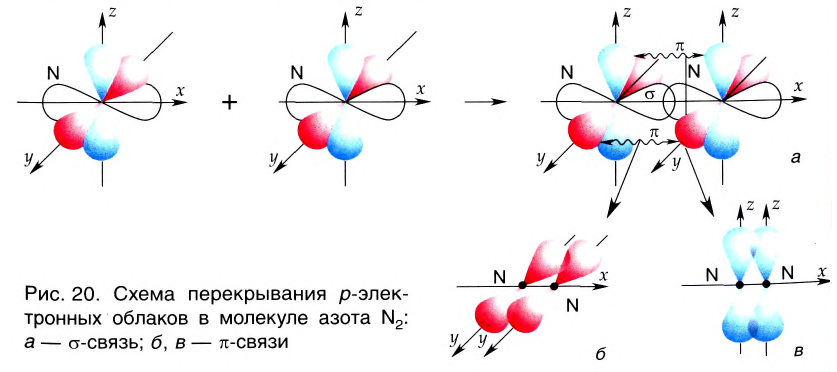


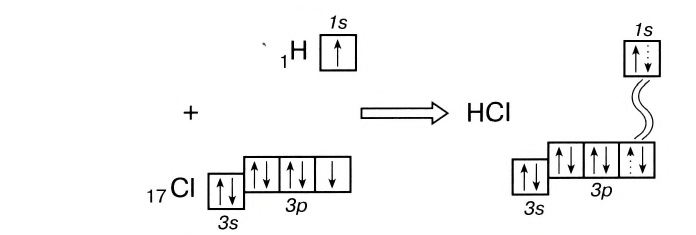

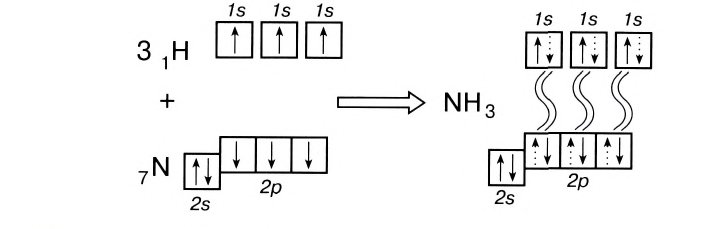


 -связью.
-связью.


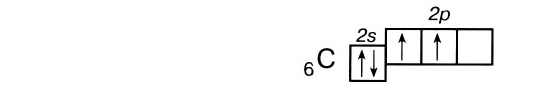
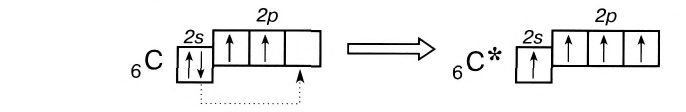
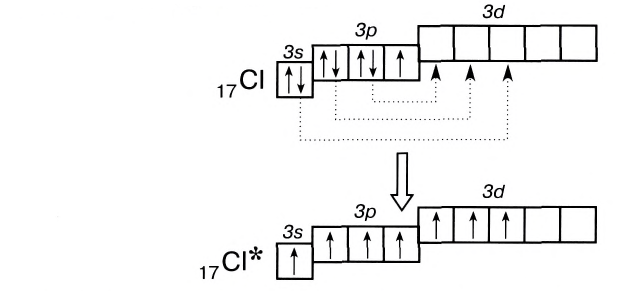



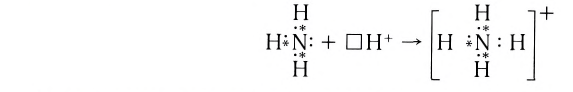

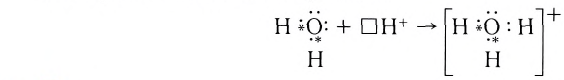
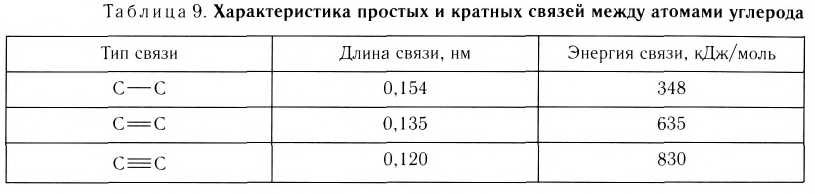
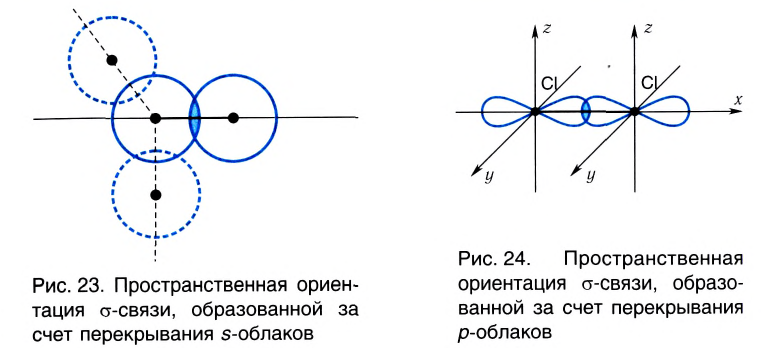

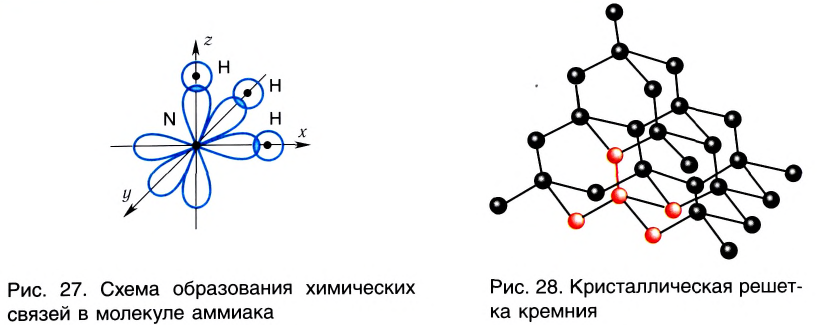
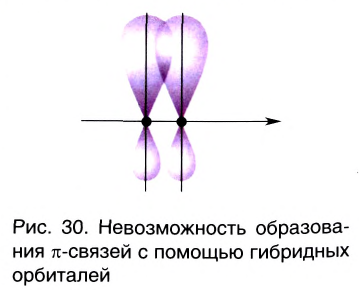
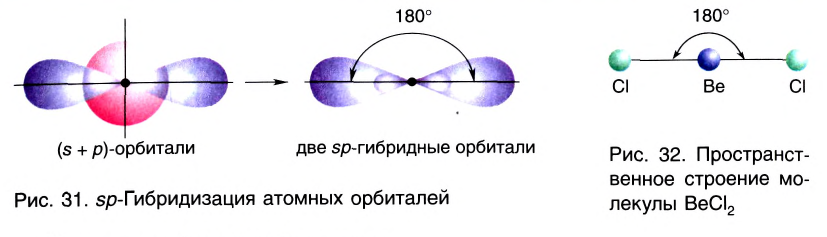
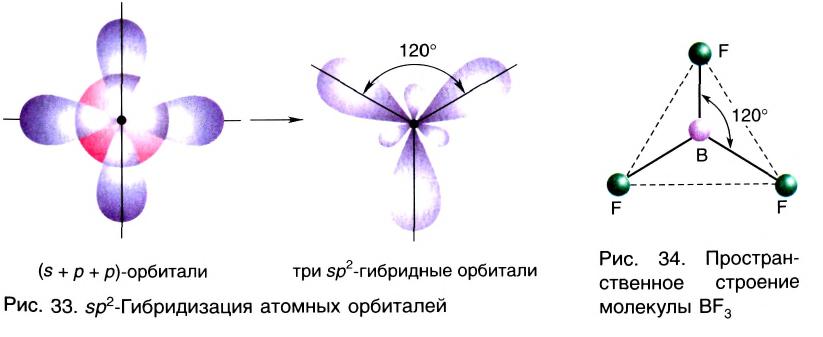
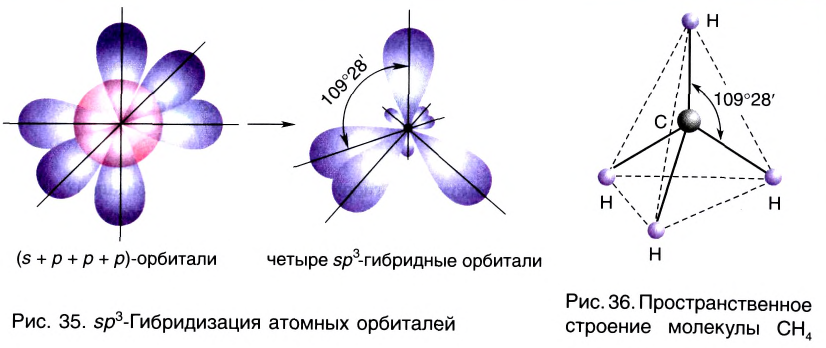

 связи.
связи.