В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.

Содержание
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
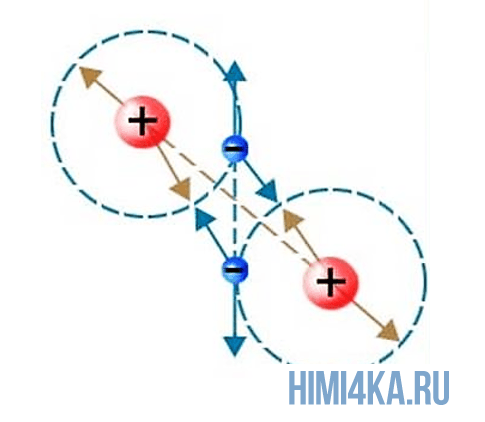
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
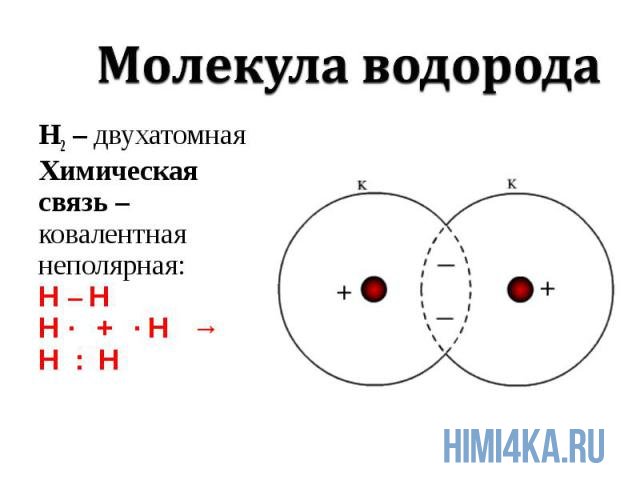
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
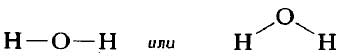
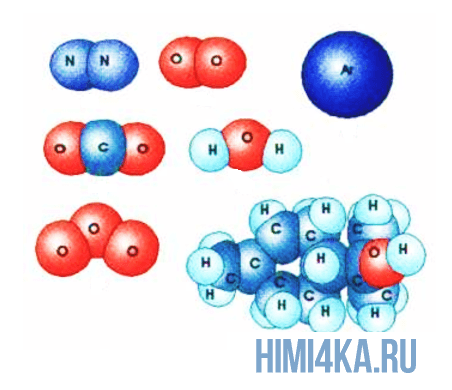
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
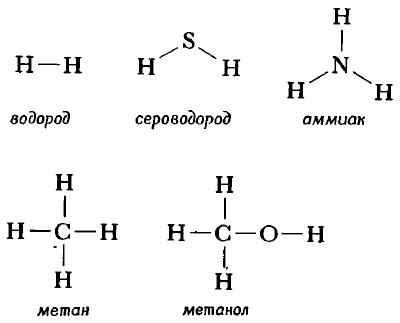
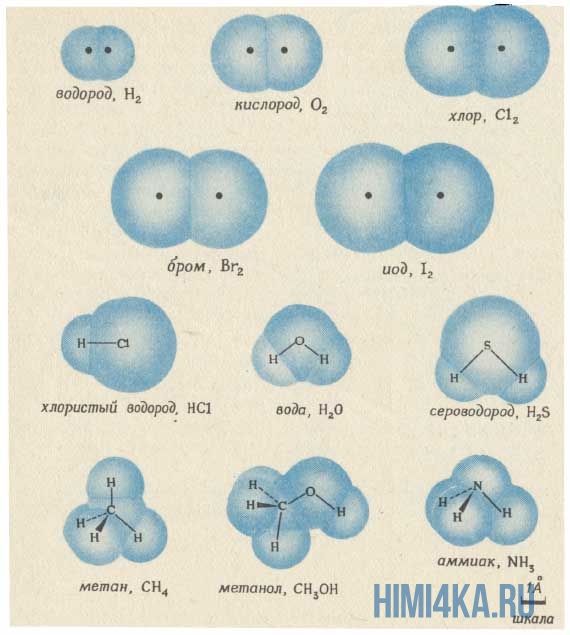
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
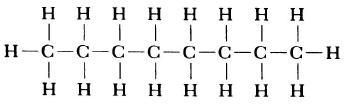
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
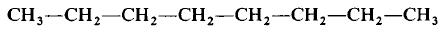
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
- 1×2 + 16 = 18
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Схемы образования химических элементов


4.6
Средняя оценка: 4.6
Всего получено оценок: 300.
4.6
Средняя оценка: 4.6
Всего получено оценок: 300.
В настоящее время открыто 118 химических элементов. Все они способны образовывать химические вещества с помощью химических связей. Что такое химический элемент, и с помощью каких связей образуются новые вещества?
Что такое химический элемент?
Определенный вид атомов называют химическим элементом. В настоящее время известно 118 химических элементов. Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, водород обозначают латинской буквой H – первой буквой латинского названия этого элемента Hydrogenium.
Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в Периодической системе, где все они расположены в определенном порядке.
Главным свойством атома, относящим его к определенному элементу, является заряд ядра
Химические связи
Образование химических веществ происходит с помощью химических связей. Химической связью называют силы, удерживающие атомы в молекулах или кристаллах. Эти силы носят электростатический характер, ядра связанных атомов притягиваются вследствие наличия области повышенной электронной плотности между ними.
Увеличение электронной плотности происходит вследствие перекрывания электронных орбиталей в области связывания, так как расстояние между ядрами связанных атомов меньше, чем сумма радиусов атомов. Межъядерное расстояние принимают за длину химической связи. Образование связи происходит только в том случае, если этот процесс энергетически выгоден, поэтому образование связи всегда сопровождается выделением энергии.
Энергия химической связи – это то значение энергии (в кДж/моль), которое необходимо затратить для разрыва связи и которое выделяется при ее образовании.
При образовании связей, как правило, достраивается октет (восемь) электронов для связанных атомов, то есть их внешняя электронная оболочка становится завершенный, что и придает стабильность молекуле или кристаллу и делает эту систему равновесной.
Схемы образования химических элементов бывают атомные или ковалентные (полярные и неполярные), ионные, металлические, водородные:
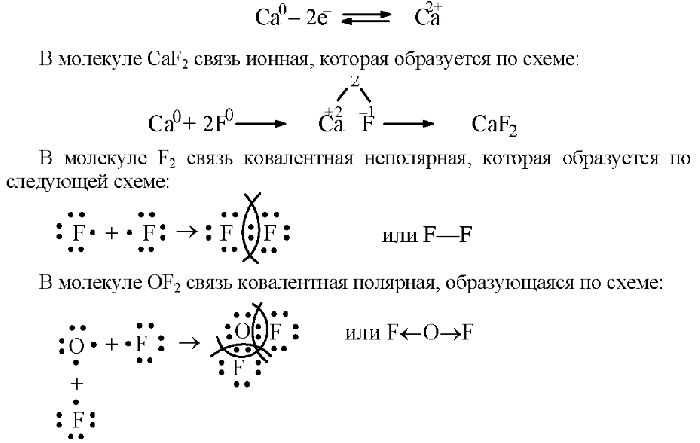
- ковалентная химическая связь – это связь, осуществляемая за счет образования общих электронных пар. Неполярная ковалентная связь образуется между атомами с одинаковой электроотрицательностью. полярная ковалентная связь образуется между атомами, электроотрицательности которых незначительно отличаются.
- ионная связь – химическая связь, возникающая между ионами в результате действия электростатических сил притяжения
- металлическая связь – характерна для элементов, атомы которых на внешнем уровне имеют мало валентных электронов, слабо удерживающихся в атоме, и большое количество энергетически близких свободных орбиталей.
- водородная связь – слабая связь физической природы, которая образуется между молекулами, содержащими электроотрицательные атомы (кислород О, азот N), которые имеют неподеленную электронную пару, и молекулами, в которых атом водорода имеет небольшой положительный заряд.

Что мы узнали?
Химический элемент – вид атомов с одинаковым положительным зарядом ядра. Химические вещества образуются из элементов, которые вступают в химические связи. Эти связи могут быть ковалентными, водородными, ионными, металлическими.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Gulchekhra Suyundukova
5/5
-

Александр Котков
5/5
-

Александр Котков
5/5
-

Лидия Маслова
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 300.
А какая ваша оценка?
Вещества состоят из молекул, а они, в свою очередь, сформированы химическими элементами. Схемы образования таких связей зависят от типа материй. В любом виде связывания участвуют свободные электроны, находящиеся на внешнем уровне атомов. Зная механизм образования молекул, можно составить их структурную формулу.
Оглавление:
- Электронная пара
- Ионная схема
- Металлическая решетка

Электронная пара
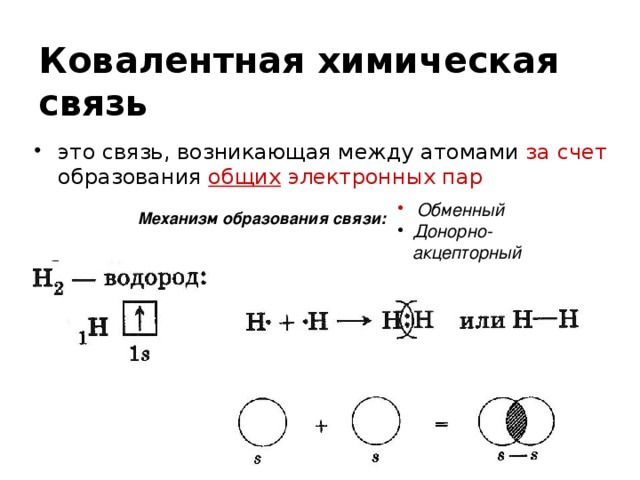
Ковалентная (атомная) химическая связь осуществляется между двумя атомами при помощи общей электронной пары. В этом случае электронные облака элементов перекрываются, каждый получает электроны, нужные для завершения своего внешнего энергетического уровня. Благодаря этому объединению атомы удерживаются вместе. Есть два механизма образования атомной связи:
- Обменный — оба атома предоставляют по одному неспаренному электрону для образования общей пары.
- Донорно-акцепторный — один элемент отдает неподеленную электронную пару, а второй предоставляет свободную орбиталь.
В зависимости от электроотрицательности элементы могут владеть электронной парой в равной степени или один из атомов будет сильнее притягивать ее.
Атомная неполярная
Это вид связи возникает между одинаковыми атомами. Для нее характерно равномерное владение электронами обоими элементами. Их заряд не меняется. Таким способом образуются простые вещества, например, Cl2.
Схему образования молекулы хлора можно описать следующим образом: на внешнем уровне у атома хлора расположены семь электронов, то есть для завершения не хватает одного. Любой элемент отдает по одному электрону для образования общей пары. Происходит перекрывание р-орбиталей и образование молекулы Cl2.

Электроотрицательность элементов, участвующих в создании ковалентной неполярной связи, одинаковая. Дипольный момент здесь равен 0. Атомы владеют электронами в равной степени, поэтому ни один не имеет заряда.
Ковалентная полярная
Этот тип ковалентной связи образуется между двумя элементами, электроотрицательность которых отличается незначительно. Как правило, это два неметалла. Полярной связь называют, поскольку общая пара смещается в сторону более электроотрицательного элемента. Сильный атом приобретает отрицательный заряд, а более слабый — положительный. Электроотрицательность атомов можно определить по специальной шкале. Вещества, образованные полярной связью, могут состоять из двух и более элементов, например:

- Бромистоводородная кислота HBr. Водород расположен в первом периоде, то есть у него есть только один энергетический уровень, на котором находится один электрон. У брома на внешнем уровне 7 электронов и требуется еще один. Оба атома отдают свои неспаренные частицы, получается общая пара. Но бром сильнее водорода, поэтому он тянет эту пару на себя, приобретая отрицательный заряд. Водород же становится положительно заряженным.
- Сероводород H2S. Сера находится в VI группе, значит, на внешнем уровне у нее шесть электронов, два из которых неспаренные. Каждый из них участвует в образовании общей пары с двумя атомами водорода. Атом серы, как самый электроотрицательный, оттягивает на себя обе пары, получая уловный заряд -2. Аналогично можно записать схему образования молекулы воды H2O.
- Аммиак NH3. У азота на внешней р-орбитали расположены три неспаренных электрона. Каждый из них связывается с одним атомом водорода. То есть молекула аммиака образована тремя ковалентными связями, смещенными в сторону азота.
В молекуле могут присутствовать два электроотрицательных атома, которые будут оттягивать на себя электронную плотность. Примером такого вещества служит фторид кислорода OF2. Кислород отдает по одному электрону в общую пару с атомами фтора, притягивающими отрицательный заряд к себе. Таким образом, фтор имеет условный заряд -1, у кислорода этот показатель равен +2.
Если схема образования ковалентной полярной связи протекает по донорно-акцепторному механизму, то связь будет двойной. Для примера можно рассмотреть молекулу углекислого газа CO2. Углерод на внешнем уровне имеет 4 электрона, а кислород — 6. Две неподеленные электронные пары от углерода соединяются со свободными орбиталями атомов кислорода. Структуральная формула линейна: О=С=О. Связь полярна, смещена в сторону кислорода. На углероде сосредоточен заряд +4, а на кислороде -2.
Ионная схема
Связь, которая возникает между ионами (частицами, приобретающими заряд в результате принятия или отдачи электронов) и имеет электростатическую природу, называется ионной. Схема образования химической связи ионного типа основана на передаче электронов от одного атома другому. После этого элементы превращаются в ионы с положительным и отрицательным зарядом. Противоположно заряженные частицы притягиваются друг к другу.
Ионное связывание образуется между металлом и неметаллом. Ярким примером их соединения является хлорид калия. Хлор, как все галогены, должен принять один электрон для завершения внешнего энергетического уровня. Калий — щелочной металл — на внешнем уровне имеет один электрон, который и отдает хлору. Потеряв отрицательную частицу, калий получает заряд +1, а хлор наоборот. Положительный ион притягивается к отрицательному, вместе они образуют соль KCl.

Другой пример ионной схемы связывания — это оксид марганца MgO. Марганец — элемент второй группы главной подгруппы, на внешнем уровне у него 2 электрона. Их забирает кислород для заполнения своей орбитали. После этого появляются ионы Mg (+2) и О (-2). Притягиваясь, они образуют оксид.
Электростатическое притяжение ионов очень сильное, поэтому температуры кипения и плавления этих веществ высокие.
Молекула с ионной связью имеет четкую структуру, где каждый ион окружен противоположно заряженными частицами. Этот тип характерен для солей, оксидов металлов и оснований. Соли аммония, не имеющие металла в составе, тоже образованы ионной связью.
Структура всех металлов представляет собой металлическую решетку с общими электронами. Такая связь носит название металлической. Атомы металлов имеют на внешнем уровне малое число электронов. Связь их с ядром ослабевает с ростом периода в таблице Менделеева. Из-за слабых сил притяжения неспаренные электроны могут легко отрываться от атома металла, превращая его в катион. Схема описывается уравнением Me(0) – ne = Me (+n), где n — число внешних электронов.

Металлическая связь представлена структурированной решеткой, на вершинах которой расположены атомы и катионы металла. Между этими вершинами движутся свободные электроны. Они то присоединяются к катиону, превращая его обратно в атом, то снова отрываются и передвигаются к следующему катиону. Эта динамическая система удерживается благодаря электростатическому притяжению.
Химическая связь — сила, удерживающая элементы вместе, образуя молекулу или кристалл. В ее образовании всегда задействованы неспаренные электроны и свободные орбитали атомов. Существует ионная связь, объединяющая металлы и неметаллы. Она может быть ковалентной или атомной, образующейся между двумя неметаллами, или металлической, удерживающей металлические решетки.
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Cм. в № 13, 18, 23/2007;
6/2008
Глава 4. Понятие о химической связи
В предыдущих главах данного пособия были
обсуждения того, что вещество состоит из молекул,
а молекулы – из атомов. А не возникал ли у
вас вопрос: почему атомы, составляющие молекулу,
не разлетаются в разные стороны?
Что удерживает атомы в молекуле?
Их удерживает химическая связь.
Для того чтобы понять природу химической связи,
достаточно вспомнить простой физический опыт.
Два шарика, висящие рядом на ниточках, никак не
«реагируют» друг на друга. Но если придать
одному шарику положительный заряд, а другому –
отрицательный, они притянутся друг к другу.
Не эта ли сила притягивает атомы друг к
другу? Действительно, исследования показали, что химическая
связь имеет электрическую природу.
Откуда же возникают заряды в нейтральных
атомах?
Статья опубликована при поддержке онлайн курса подготовки к ЕГЭ “Экзамер”. На сайте Вы найдёте все необходимые материалы для самостоятельной подготовки к ЕГЭ – составление уникального плана подготовки для каждого пользователя, отслеживание прогресса по каждой теме предмета, теория и задачи. Все задания соответствуют последним изменениям и дополнениям. Есть также возможность отправлять задания из письменной части ЕГЭ на проверку экспертам для получения баллов и разбора работы по критериям оценивания. Задания в виде квестов с накоплением опыта, прохождением уровней, получением бонусов и наград, соревнования с друзьями на ЕГЭ Арене. Чтобы начать подготовку перейдите по ссылке: https://examer.ru.
При описании строения атомов было показано, что
все атомы, за исключением атомов благородных
газов, стремятся присоединить или отдать
электроны. Причина – образование устойчивого
восьмиэлектронного внешнего уровня (как у
благородных газов). При приеме или отдаче
электронов возникают электрические заряды и, как
следствие, электростатическое взаимодействие
частиц. Так возникает ионная связь, т.е.
связь между ионами.
Ионы – это устойчивые заряженные частицы,
которые образуются в результате приема или
отдачи электронов.
Например, в реакции участвует атом активного
металла и активного неметалла:
Na + S ![]() ?
?
В этом процессе атом металла (натрия) отдает
электроны:
![]()
а) Устойчива ли такая частица?
б) Сколько всего электронов осталось в атоме
натрия?
в) Будет ли эта частица иметь заряд?
Таким образом, в этом процессе образовалась
устойчивая частица (8 электронов на внешнем
уровне), которая имеет заряд, т.к. у ядра атома
натрия заряд по-прежнему +11, а оставшиеся
электроны имеют суммарный заряд –10. Поэтому
заряд иона натрия +1. Кратко запись этого процесса
выглядит так:
![]()
Что происходит с атомом серы? Этот атом
принимает электроны до завершения внешнего
уровня:
![]()
Простой подсчет показывает, что эта частица
имеет заряд:
![]()
Кратко:
![]()
Разноименно заряженные ионы притягиваются, в
результате чего возникает ионная связь и «ионная
молекула»:
![]()
Существуют и другие способы образования ионов,
о которых будет сказано в главе 6.
Формально сульфиду натрия приписывают именно
такой состав молекулы, хотя вещество, состоящее
из ионов, имеет приблизительно следующее
строение (рис. 1):
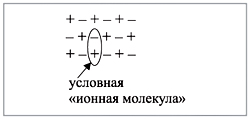 |
Рис. 1.
|
Таким образом, вещества, состоящие из
ионов, не содержат отдельных молекул! В этом
случае можно говорить лишь об условной «ионной
молекуле».
Задание 4.1. Покажите, как происходит переход
электронов при возникновении ионной связи между
атомами:
а) кальция и хлора;
б) алюминия и кислорода.
П о м н и т е! Атом металла отдает внешние
электроны; атом неметалла принимает недостающие
электроны.
Вывод. Ионная связь по описанному выше
механизму образуется между атомами активных
металлов и активных неметаллов.
Исследования, однако, показывают, что полный
переход электронов от одного атома к другому
происходит далеко не всегда. Очень часто
химическая связь образуется не при отдаче-приеме
электронов, а в результате образования общих
электронных пар*. Такая связь
называется ковалентной.
Ковалентная связь возникает за счет
образования общих электронных пар. Этот вид
связи образуется, например, между атомами
неметаллов. Так, известно, что молекула азота
состоит из двух атомов – N2.
Как возникает ковалентная связь между этими
атомами? Чтобы ответить на этот вопрос,
необходимо рассмотреть строение атома азота:
![]()
В о п р о с. Сколько электронов не хватает до
завершения внешнего уровня?
О т в е т. Не хватает трех электронов. Поэтому,
обозначив каждый электрон внешнего уровня
точкой, получим:
![]()
В о п р о с. Почему три электрона обозначены
одиночными точками?
О т в е т. Дело в том, что мы хотим показать
образование общих пар электронов. А пара – это
два электрона. Такая пара возникает, в частности,
если каждый атом предоставит по одному электрону
для образования пары. Атому азота не хватает трех
электронов до завершения внешнего уровня.
Значит, он должен «приготовить» три одиночных
электрона для образования будущих пар (рис. 2).
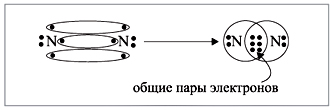 |
Рис. 2.
|
Получена электронная формула
молекулы азота, которая показывает, что у
каждого атома азота имеется теперь восемь
электронов (шесть из них обведены в овал плюс по 2
электрона своих); между атомами возникли три
общие пары электронов (место пересечения
кружков).
Каждая пара электронов соответствует одной
ковалентной связи. Сколько ковалентных связей
возникло? Три. Каждую связь (каждую общую пару
электронов) покажем при помощи черточки
(валентный штрих):
![]()
Все эти формулы не дают, однако, ответа на
вопрос: что же связывает атомы при образовании
ковалентной связи? Электронная формула
показывает, что общая пара электронов
располагается между атомами. В этой области
пространства возникает избыточный
отрицательный заряд. А ядра атомов, как
известно, имеют положительный заряд. Таким
образом, ядра обоих атомов притягиваются к
общему отрицательному заряду, который возник
благодаря общим электронным парам (точнее,
пересечению электронных облаков) (рис. 3).
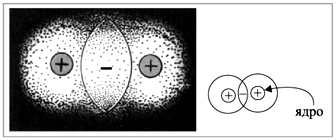 |
Рис. 3.
|
Может ли возникнуть такая связь
между разными атомами? Может. Пусть атом азота
взаимодействует с атомами водорода:
![]()
Строение атома водорода показывает, что атом
имеет один электрон. Сколько таких атомов нужно
взять, чтобы атом азота «получил желаемое» – три
электрона? Очевидно, три атома водорода
(рис. 4):
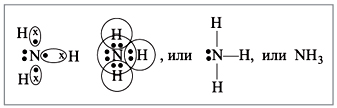 |
Рис. 4.
|
Крестиком на рис. 4 обозначены
электроны атома водорода. Электронная формула
молекулы аммиака показывает, что у атома азота
стало восемь электронов, а у каждого атома
водорода получилось по два электрона (а больше на
первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота
имеет валентность три (три черточки, или три
валентных штриха), а каждый атом водорода –
валентность один (по одной черточке).
Хотя в состав обеих молекул N2 и NН3
входит один и тот же атом азота, химические
связи между атомами отличаются друг от друга.
В молекуле азота N2 химические связи
образуют одинаковые атомы, поэтому общие
пары электронов находятся посередине между
атомами. Атомы сохраняют нейтральный характер.
Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь
образуют разные атомы. Поэтому один из атомов
(в данном случае – атом азота) сильнее
притягивает общую пару электронов. Общие пары
электронов смещаются в сторону атома азота, и на
нем возникает небольшой отрицательный заряд, а
на атоме водорода – положительный, возникли
полюса электричества – связь полярная
(рис. 5).
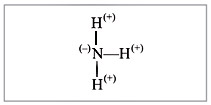 |
Рис. 5.
|
Большинство веществ, построенных при
помощи ковалентной связи, состоят из отдельных
молекул (рис. 6).
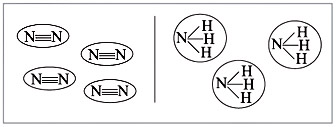 |
Рис. 6.
|
Из рис. 6 видно, что между атомами
химические связи есть, а между молекулами они
отсутствуют или незначительны.
Тип химической связи влияет на свойства
вещества, на его поведение в растворах. Так, чем
больше, значительнее притяжение между частицами,
тем труднее их оторвать друг от друга и сложнее
перевести твердое вещество в газообразное или
жидкое состояние. Попробуйте определить на
схеме, приведенной ниже, между какими частицами
силы взаимодействия больше и какая химическая
связь при этом образуется (рис. 7).
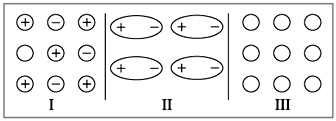 |
Рис. 7.
|
Если вы внимательно прочитали главу,
ответ у вас будет следующим: максимальное
взаимодействие между частицами осуществляется в
случае I (ионная связь). Поэтому все такие
вещества – твердые. Наименьшее взаимодействие
между незаряженными частицами (случай III –
неполярная ковалентная связь). Такие вещества
чаще всего газы.
Задание 4.2. Определите, какая химическая
связь осуществляется между атомами в веществах:
NаСl, НСl, Сl2, АlСl3, Н2О. Дайте
пояснения.
Задание 4.3. Составьте электронные и
графические формулы для тех веществ из задания
4.2, в которых вы определили наличие
ковалентной связи. Для ионной связи составьте
схемы перехода электронов.
Глава 5. Растворы
Нет на Земле человека, который не видел бы
растворов. А что это такое?
Раствор – это однородная смесь из двух или
более компонентов (составных частей или веществ).
Что такое однородная смесь? Однородность смеси
предполагает, что между составляющими ее
веществами отсутствует поверхность раздела.
В этом случае невозможно, по крайней мере
визуально, определить, сколько веществ
образовало данную смесь. Например, глядя на
водопроводную воду в стакане, трудно
предположить, что в ней, кроме молекул воды,
содержится еще добрый десяток ионов и молекул (О2,
СО2, Са2+ и др.). И никакой микроскоп
не поможет увидеть эти частицы.
Но отсутствие поверхности раздела – не
единственный признак однородности.
В однородной смеси состав смеси в любой
точке одинаков. Поэтому для получения раствора
нужно тщательно перемешать образующие его
компоненты (вещества).
Растворы могут иметь разное агрегатное
состояние:
• газообразные растворы (например, воздух –
смесь газов О2, N2, СО2, Аr);• жидкие растворы (например, одеколон, сироп,
рассол);• твердые растворы (например, сплавы).
Одно из веществ, которые образуют раствор,
называется растворителем. Растворитель
имеет то же агрегатное состояние, что и
раствор. Так, для жидких растворов – это
жидкость: вода, масло, бензин и т.д. Чаще всего на
практике применяются водные растворы. О них и
пойдет речь далее (если не будет сделана
соответствующая оговорка).
Что происходит при растворении различных
веществ в воде? Почему одни вещества хорошо
растворяются в воде, а другие – плохо? От чего
зависит растворимость – способность вещества
растворяться в воде?
Представим себе, что в стакан с теплой водой
положили кусочек сахара. Полежал он, уменьшился в
размерах и… исчез. Куда? Неужели нарушается
закон сохранения вещества (его массы, энергии)?
Нет. Сделайте глоток полученного раствора,
и вы убедитесь, что вода сладкая, сахар не
исчез. Но почему его не видно?
Дело в том, что в ходе растворения происходит
дробление (измельчение) вещества. В данном
случае кусочек сахара распался на молекулы, а их
мы видеть не можем. Да, но почему сахар, лежащий на
столе, не распадается на молекулы? Почему кусочек
маргарина, опущенный в воду, тоже никуда не
исчезает? А потому, что дробление
растворяемого вещества происходит под действием
растворителя, например воды. Но растворитель
сможет «растащить» кристалл, твердое вещество на
молекулы, если сумеет «уцепиться» за эти частицы.
Другими словами, при растворении вещества должно
быть взаимодействие между веществом и
растворителем.
Когда возможно такое взаимодействие? Только в
том случае, когда строение веществ (и
растворяемого, и растворителя) похоже, подобно.
Издавна известно правило алхимиков: «подобное
растворяется в подобном». В наших примерах
молекулы сахара полярны и между ними и полярными
молекулами воды существуют определенные силы
взаимодействия. Такие силы отсутствуют между
неполярными молекулами жира и полярными
молекулами воды. Поэтому жиры в воде не
растворяются. Таким образом, растворимость
зависит от природы растворяемого вещества и
растворителя.
В результате взаимодействия между
растворяемым веществом и водой образуются
соединения – гидраты. Это могут быть очень
прочные соединения:
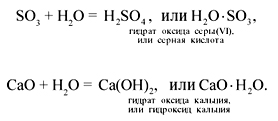
Такие соединения существуют как
индивидуальные вещества: основания,
кислородсодержащие кислоты. Естественно, при
образовании этих соединений возникают прочные
химические связи, выделяется теплота. Так при
растворении СаО (негашеная известь) в воде
выделяется так много теплоты, что смесь закипает.
Но почему при растворении сахара или соли в
воде полученный раствор не нагревается?
Во-первых, далеко не все гидраты так прочны, как
серная кислота или гидроксид кальция. Существуют
гидраты солей (кристаллогидраты), которые
легко разлагаются при нагревании:
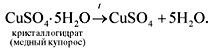
Во-вторых, при растворении, как уже упоминалось,
идет процесс дробления. А на это затрачивается
энергия, поглощается теплота.
Поскольку оба процесса происходят
одновременно, раствор может нагреваться или
охлаждаться, в зависимости от того, какой процесс
преобладает.
Задание 5.1. Определите, какой процесс –
дробление или гидратация – преобладает в каждом
случае:
а) при растворении серной кислоты в воде,
если раствор нагрелся;б) при растворении нитрата аммония в воде,
если раствор охладился;в) при растворении поваренной соли в воде,
если температура раствора практически не
изменилась.
Поскольку при растворении изменяется
температура раствора, естественно предположить,
что растворимость зависит от температуры.
Действительно, растворимость большинства
твердых веществ увеличивается при нагревании.
Растворимость газов при нагревании уменьшается.
Поэтому твердые вещества обычно растворяют в
теплой или горячей воде, а газированные напитки
хранят на холоде.
Растворимость (способность растворяться)
веществ не зависит от измельчения вещества или
интенсивности перемешивания. Но, повышая
температуру, измельчая вещество, перемешивая
готовый раствор, можно ускорить процесс
растворения. Изменяя условия получения раствора,
можно получать растворы разных составов.
Естественно, существует предел, достигнув
который, легко обнаружить, что вещество больше не
растворяется в воде. Такой раствор называется насыщенным.
Для хорошо растворимых веществ насыщенный
раствор будет содержать много растворенного
вещества. Так, насыщенный раствор KNO3 при 100
°С содержит 245 г соли на 100 г воды (в 345 г раствора),
это концентрированный раствор. Насыщенные
растворы плохо растворимых веществ содержат
ничтожные массы растворенных соединений. Так,
насыщенный раствор хлорида серебра содержит 0,15
мг AgCl в 100 г воды. Это очень разбавленный
раствор.
Таким образом, если раствор содержит много
растворенного вещества по отношению к
растворителю, он называется концентрированным,
если вещества мало – разбавленным. Очень часто
от состава раствора зависят его свойства, а
значит, и применение.
Так, разбавленный раствор уксусной кислоты
(столовый уксус) используют как вкусовую
приправу, а концентрированный раствор этой
кислоты (уксусная эссенция при приеме внутрь)
может вызвать смертельный ожог.
Для того чтобы отразить количественный состав
растворов, используют величину, называемую массовой
долей растворенного вещества ![]() :
:
![]()
где m(в-ва) – масса растворенного вещества в
растворе; m(р-ра) – общая масса раствора,
содержащая растворенное вещество и
растворитель.
Так, если 100 г уксуса содержат 6 г уксусной
кислоты, то речь идет о 6%-м растворе уксусной
кислоты (это столовый уксус). Способы решения
задач с использованием понятия массовой доли
растворенного вещества будут рассмотрены в
главе 8.
Выводы по главе 5. Растворы – это однородные
смеси, состоящие не менее чем из двух веществ,
одно их которых называется растворитель, другое
– растворенное вещество. При растворении
происходит взаимодействие этого вещества с
растворителем, благодаря чему растворяемое
вещество измельчается. Состав раствора выражают
при помощи массовой доли растворенного вещества
в растворе.
* Эти электронные пары
возникают в месте пересечения электронных
облаков.
Продолжение следует

CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
