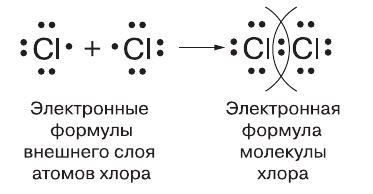
Запишите схему образования ковалентной связи на примере молекулы хлора.
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §35. Проверьте свои знания. Номер №3
Решение
Каждый атом хлора, как и любого другого галогена, содержит на внешнем электронном слое семь электронов: три электронные пары и один непарный электрон, что условно отражает следующая электронная формула его внешнего слоя:
Следовательно, каждому атому не хватает до завершения одного электрона. При сближении двух атомов хлора непарные электроны объединяются в общую электронную пару, которая и связывает их в молекулу.
Для того чтобы изобразить образование ковалентной связи, используют условное обозначение — общую электронную пару обозначают чёрточкой, или валентным штрихом. Формулу, в которой ковалентные связи обозначены валентным штрихом, называют структурной формулой. Для молекулы хлора структурную формулу записывают так: Cl − Cl
Ковалентная связь образуется при взаимодействии неметаллов. Атомы неметаллов имеют высокую электроотрицательность и стремятся заполнить внешний электронный слой за счёт чужих электронов. Два таких атома могут перейти в устойчивое состояние, если объединят свои электроны.
Ковалентная связь — это связь между атомами неметаллов, образованная за счёт общих электронных пар.
Рассмотрим возникновение ковалентной связи в простых веществах.
1. Образование молекулы водорода.
Каждый атом водорода имеет один электрон. Для перехода в устойчивое состояние ему необходим ещё один электрон.
При сближении двух атомов электронные облака перекрываются. Образуется общая электронная пара, которая связывает атомы водорода в молекулу.
В пространстве между двумя ядрами общие электроны бывают чаще, чем в других местах. Там формируется область с повышенной электронной плотностью и отрицательным зарядом. Положительно заряженные ядра притягиваются к ней, и образуется молекула.
При этом каждый атом получает завершённый двухэлектронный внешний уровень и переходит в устойчивое состояние.
Рис. (1). Образование молекулы водорода
Ковалентная связь за счёт образования одной общей электронной пары называется одинарной.
Общие электронные пары (ковалентные связи) образуются за счёт неспаренных электронов, расположенных на внешних энергетических уровнях взаимодействующих атомов.
У водорода — один неспаренный электрон. Для других элементов их число равно 8 – № группы.
Неметаллы VIIА группы (галогены) имеют на внешнем слое один неспаренный электрон.
У неметаллов VIА группы (кислород, сера) таких электронов два.
У неметаллов VА группы (азот, фосфор) — три неспаренных электрона.
2. Образование молекулы хлора.
Атом хлора на внешнем уровне имеет семь электронов. Шесть из них образуют пары, а седьмой неспаренный.
При соединении атомов образуется одна общая электронная пара, то есть возникает одна ковалентная связь. Каждый атом получает завершённый восьмиэлектронный внешний слой. Связь в молекуле хлора тоже одинарная. Такие же одинарные связи существуют в молекулах фтора, брома и иода.
Рис. (2). Образование молекулы хлора
Если атомы имеют несколько неспаренных электронов, то образуются две или три общие пары.
3. Образование молекулы кислорода.
У атома кислорода на внешнем уровне — два неспаренных электрона.
При взаимодействии двух атомов кислорода возникают две общие электронные пары. Каждый атом заполняет свой внешний уровень до восьми электронов. Связь в молекуле кислорода двойная.

Рис. (3). Образование молекулы кислорода
4. Образование молекулы азота.
Атом азота имеет три неспаренных электрона на внешнем уровне.
В молекуле образуются три общие электронные пары. Связь в молекуле азота тройная.
Рис. (4). Образование молекулы азота
Образование ковалентных связей показывают структурные (графические) формулы, в которых общая электронная пара обозначается чертой. Одна черта между атомами обозначает одинарную связь, две черты — двойную, три черты — тройную:
Источники:
Рис. 1. Образование молекулы водорода © ЯКласс
Рис. 2. Образование молекулы хлора © ЯКласс
Рис. 3. Образование молекулы кислорода © ЯКласс
Рис. 4. Образование молекулы азота © ЯКласс
|
Как изобразить схему образования связи В Молекулах O2,F2,N2,HBr,Cl2? Проще всего с ковалентными соединениями, в молекулах которых нет неспаренных электронов. Например, химическую одинарную связь в молекуле хлора можно изобразить просто черточкой: Cl-Cl. То же – в молекуле фтора и бромоводорода. Можно использовать также льюисовские структуры, рисуя кружочки и крестики в качестве электронов, принадлежащих разными атомам. В молекуле азота можно нарисовать тройную связь N≡N. У каждой черточки тоже можно нарисовать пару электронов (только электроны должны быть маленькими, иначе они там не поместятся). Сложнее обстоит дело с молекулой кислорода, потому что в основном состоянии она триплетная, то есть имеет два неспаренных электрона. Поэтому можно или схематически обозначить эти неспаренные электроны двумя точками над каждым атомом (а между ними тройная связь), или же обозначить все молекулярные орбитали в этой молекуле – связывающие и разрыхляющие (подробности можно посмотреть в учебнике химии; наверное, и в сети все эти рисунки и схемы есть). Знаете ответ? |
-
Геннадьич
20 августа, 00:57
0
Во всех молекулах связь ковалетная неполярная связь
– H2
H * + * H = H – H
– Cl2
Cl * + * Cl = Cl – Cl
– N2
N”‘ + “‘N = N=-N здесь тройная связь
– S2
S: + : S = S=S
- Комментировать
- Жалоба
- Ссылка
Найди верный ответ на вопрос ✅ «Составьте схемы образования химической связи в молекулах: а) водорода; б) хлора; в) азота; г) серы S2 (пар) …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Составьте схемы образования химической связи в молекулах: а) водорода; б) хлора; в) азота; г) серы S2 (пар)
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,658 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,962 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.