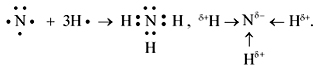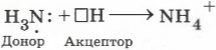- Учебники
- 9 класс
- Химия 👍
- Габриелян
- №1
авторы: Габриелян, Остроумов, Сладков.
издательство: “Просвещение”
Раздел:
- ГЛАВА III. Неметаллы и их соединения
- §17. Аммиак. Соли аммония
- Проверьте свои знания
ГДЗ учебник по химии 9 класс класс Габриелян. §17. Проверьте свои знания. Номер №1
- Предыдущее
- Следующее
Составьте схему образования химической связи в молекуле аммиака.
reshalka.com
ГДЗ учебник по химии 9 класс класс Габриелян. §17. Проверьте свои знания. Номер №1
Решение
Схема образования химической связи в молекуле аммиака:
- Предыдущее
- Следующее
Нашли ошибку?
Если Вы нашли ошибку, неточность или просто не согласны с ответом, пожалуйста сообщите нам об этом
|
Как изобразить схему образования связи в молекуле аммиака?Karman 10 лет назад
Как изобразить схему образования связи в молекуле аммиака? бонус за лучший ответ (выдан): 1 кредит Екатерина95 10 лет назад В молекуле азота имеются 3 неподеленных электрона. У водорода 1 электрон. Электрон азота и электрон водорода притягиваются и образуется связь. Берем три молекулы водорода, все три электрона соединяются с электронами азота и образуется тройная связь. Изобразить схему образования связи в молекуле аммиака можно таким образом. автор вопроса выбрал этот ответ лучшим комментировать
в избранное
ссылка
отблагодарить Знаете ответ? |
Строение молекулы аммиака и иона аммония. Донорно-акцепторная связь
Формула аммиака — NH3. Рассмотрим, как образуются ковалентные связи в молекуле аммиака. На внешнем электронном слое атома азота имеется три неспаренных электрона:
В атоме водорода — один неспаренный электрон:
Тогда схему образования ковалентных связей в молекуле аммиака можно представить следующим образом:
Из схемы видно, что три неспаренных электрона атома азота участвуют в образовании трёх ковалентных связей N—H. В то же время на внешнем слое атома азота остаётся электронная пара. Такая электронная пара называется неподелённой электронной парой. Структурная формула аммиака:
или
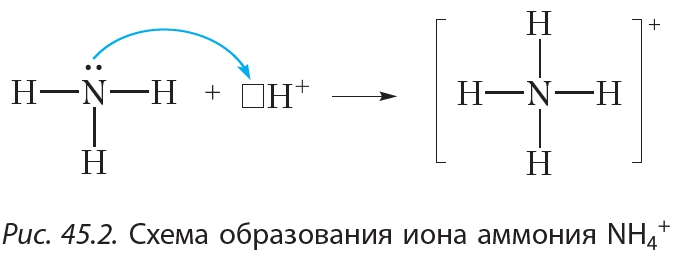
Из рисунка 45.2 видно, что все четыре ковалентные связи N—H в ионе аммония одинаковы. Они образованы посредством общих электронных пар между атомами азота и водорода. Однако механизм образования этих связей различается. Три связи N—H образуются за счёт неспаренных электронов атомов азота и водорода (рис. 45.1). Такой способ образования ковалентной связи называется обменным. Четвёртая связь N—H в ионе аммония образуется за счёт неподелённой электронной пары атома азота и свободной орбитали катиона H+ (рис. 45.2). Такой способ образования ковалентной связи называется донорно-акцепторным. При этом атом азота, предоставляющий электронную пару, называется донором, а катион водорода, принимающий электронную пару на свою свободную орбиталь, — акцептором.
Вещества, способные присоединять катион водорода H+, являются основаниями. Следовательно, аммиак — основание. Оснóвные свойства аммиака проявляются в реакциях с кислотами. В этих реакциях образуются соли аммония:
или
Видно, что в реакции с HCl молекула NH3 присоединяет катион H+ и превращается в ион аммония NH4+. В ионе аммония атом азота образует четыре ковалентные связи N—H, поэтому валентность азота равна IV. В хлориде аммония кроме ковалентных связей N—H имеется ионная связь между катионом NH+ и анионом Cl–.
Аммиак проявляет оснóвные свойства не только при взаимодействии с кислотами, но и с водой. Так, при растворении аммиака в воде протекает обратимая реакция:
или
Видно, что при взаимодействии с водой молекула аммиака присоединяет катион водорода. При этом образуются ион аммония NH+ и гидроксид-ион OH–. Наличие ионов OH– обусловливает щелочную реакцию водных растворов аммиака.
Перейдём к рассмотрению строения органических азотсодержащих веществ — аминов.
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:
Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:
У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:
Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поскольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–
Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §30 АММИАК. СОЛИ АММОНИЯ
Красным цветом приводится решение, а фиолетовым ― объяснение.
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1 Составьте схему образования химической связи в молекуле аммиака.
Упражнение 2 Охарактеризуйте физические и химические свойства аммиака. Свяжите их с областями применения этого соединения.
Физические свойства аммиака.
Аммиак ― бесцветный газ с резким характерным запахом, легче воздуха, хорошо растворяется в воде.
Водный раствор аммиака используется в медицине и в быту под названием аммиачная вода, а 10%-ный раствор аммиака в воде более известен под названием нашатырный спирт. Аммиак используется в качестве хладагента в промышленных холодильных установках, т.к. легко сжижается при повышении давления, а испарение сопровождается поглощением теплоты, в результате чего и происходит охлаждение.
Химические свойства аммиака.
1. Водный раствор аммиака изменяет окраску индикатора, т.к. гидрат аммиака – слабый электролит, он незначительно диссоциирует на катион аммония и гидроксид-анион:
NH3•H2O ⇄ NH4+ + OH–
2. Горит в избытке кислорода, при этом образуется азот и водяные пары:
4HN3 + 3O2 = 2N2 + 6H2O
3. Восстанавливает металлы с их оксидов:
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Схема окислительно-восстановительной реакции.
N-3H3 + Cu+2O → N20 + Cu0 + H2O
2N-3 -6ē → N20 |6|6|1 ― процесс окисления
Cu+2 +2ē → 2Cu0 |2| |3 ― процесс восстановления
В приведённой реакции аммиак (за счёт атомов азота в степени окисления -3) — восстановитель.
4. Водный раствор аммиака реагирует с кислотами, образуя соли аммония:
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
Аммиак ― исходное вещество для солей аммония, которые используют в качестве удобрений (фосфаты, хлорид, нитрат аммония), как компоненты взрывчатых веществ (нитрат аммония или аммиачная селитра), в пищевой промышленности (гидрокарбонат, карбонат, хлорид аммония), при выделке кож и (сульфат аммония).
Упражнение 3 Почему аммиак в окислительно-восстановительных реакциях проявляет свойства восстановителя? В аммиаке атом азота обладает минимальной степенью окисления (-3), поэтому он проявляет только восстановительные свойства.
Упражнение 4 В чём состоит донорно-акцепторный механизм образования ковалентной связи? Подтвердите свои рассуждения рассмотрением строения катиона аммония.
Донорно-акцепторный механизм образования ковалентной связи состоит в том, что связь формируется за счёт неподелённой пары электронов атома-донора и свободной орбитали атома-акцептора.
Например, образование катиона аммония происходит в результате возникновения ковалентной связи между атомом азота, имеющим свободную электронную пару (она называется неподелённой), и катионом водорода, который переходит к аммиаку от молекул кислоты. Первый атом называется донором, а второй ― акцептором.
Какой ещё механизм образования ковалентной связи вам известен? Обменный механизм образования ковалентной связи. Например, образование молекулы хлороводорода.
Упражнение 5 Запишите сокращённое ионное уравнение качественной реакции на катион аммония.
NH4+ + OH– = NH3↑ + H2O
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите уравнения реакций получения нитрида натрия и его взаимодействия с водой.
6Na + N2 = 2Na3N
Na3N + 3H2O = 3NaOH + NH3↑
Какая из этих реакций является окислительно-восстановительной?
Реакция получения нитрида натрия, т.к. в ходе химического превращения происходит изменение степени окисления атомов элементов натрия и азота:
6Na + N2 = 2Na3N
Схема окислительно-восстановительной реакции.
Na0 + N20 ⟶ Na3+1N-3
Восстановитель Na0 – 1ē ⟶ Na+1 |1|6|6 ― процесс окисления
Окислитель N20 + 6ē ⟶ 2N-3 |6| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы натрия и азота. Находим наименьшее общее кратное для чисел 1 и 6 . Это число 6, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 1 и 6, записываем результат за третьей чертой в строках, касающихся элементов натрия и азота. Множители 6 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и разными являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 6 перед формулой натрия Na и коэффициент 1 (который обычно не пишем) перед формулой азота N2. Подбираем коэффициенты для остальных соединений.
Упражнение 2 С какими из перечисленных веществ реагирует аммиак: водород, азотная кислота, кислород, гидроксид натрия, вода, хлорид калия, оксид меди (II), железо, сульфат аммония? Запишите уравнения соответствующих реакций.
NH3 + HNO3 = NH4NO3
4NH3 + 3O2 = 2N2 + 6H2O
NH3 + H2O ⇄ NH4OH
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Упражнение 3 В двух пробирках без подписи находятся растворы хлорида аммония и хлорида натрия. Какими способами можно распознать эти вещества? Распознать хлорид аммония можно с помощью щелочи NaOH. В пробирке с раствором хлорида аммония выделяющийся аммиак обнаруживают по запаху или посинению влажной красной лакмусовой бумаги. В пробирке с хлоридом натрия никаких изменений не наблюдаем.
Ответ подтвердите уравнениями соответствующих реакций.
NH4Cl + NaOH = NaCl + H2O + NH3↑
NH4+ + Cl– + Na+ + OH– = Na+ + Cl– + H2O + NH3↑
NH4+ + OH– = H2O + NH3↑
Упражнение 4 В 150 мл воды растворили 67,2 л аммиака (н.у.). Рассчитайте массовую долю аммиака в полученном растворе.
Дано: V(H2O)=150 мл, V(NH3)=67,2 л
Найти: ω(NH3)-?
Решение
1. Вычисляем количество вещества аммиака объёмом 67,2 л по формуле: ʋ=V:VM, где VM=22,4 л/моль при н.у.
ʋ(NH3)=V(NH3):VM=67,2 л : 22,4 л/моль=3 моль
2. Вычисляем массу аммиака в количестве вещества 3 моль по формуле: ʋ=m/M, где M=Mr г/моль.
M(NH3)=17 г/моль
m(NH3)=ʋ(NH3)•M(NH3)=3 моль • 17 г/моль=51 г
3. Рассчитываем массу воды:
m(H2O)=V(H2O)•ρ(H2O)=150 мл•1 г/мл=150 г. Поскольку ρ(Н2О)=1 г/мл, то для воды объём численно равен массе, поэтому данное действие не является обязательным.
4. Рассчитываем массу раствора:
m(раствора)=m(H2O)+m(NH3)=150 г + 51 г = 201 г
5. Вычисляем массовую долю аммиака в полученном растворе:
ω(NH3)=m(NH3):m(раствора)•100%=51 г : 201 г • 100%=25,4%
Ответ: 25,4%
ВЫРАЗИТЕ МНЕНИЕ
Упражнение 1 Постройте круговые диаграммы, отражающие массовые доли химических элементов в следующих солях: нитрат калия, нитрат аммония, нитрат кальция, сульфат аммония.
Mr(KNO3)=101, Mr(NH4NO3)=80, Mr(Ca(NO3)2)=164, Mr((NH4)2SO4)=132
ω1(N)=Ar(N):Mr(KNO3)=14:101=0,139, или 13,9%
ω2(N)=2•Ar(N):Mr(NH4NO3)=2•14:80=0,35, или 35%
ω3(N)=2•Ar(N):Mr(Ca(NO3)2)=2•14:164=0,171, или 17,1%
ω4(N)=2•Ar(N):Mr((NH4)2SO4)=2•14:132=0,212, или 21,2%
ω3(N)<ω1(N)<ω4(N)<ω2(N)
Какую из этих солей вы бы рекомендовали использовать в качестве азотного удобрения? Лучше всего использовать нитрат аммония, т.к. в нем наибольшее содержание азота (35%).