- Учебники
- 9 класс
- Химия 👍
- Габриелян
- №1

авторы: Габриелян, Остроумов, Сладков.
издательство: “Просвещение”
Раздел:
- ГЛАВА III. Неметаллы и их соединения
- §14. Сероводород и сульфиды
- Проверьте свои знания
ГДЗ учебник по химии 9 класс класс Габриелян. §14. Проверьте свои знания. Номер №1
- Предыдущее
- Следующее
Составьте схему образования химической связи в молекуле сероводорода.

reshalka.com
ГДЗ учебник по химии 9 класс класс Габриелян. §14. Проверьте свои знания. Номер №1
Решение
Схема образования химической связи в молекуле сероводорода:

- Предыдущее
- Следующее
![]()
Нашли ошибку?
Если Вы нашли ошибку, неточность или просто не согласны с ответом, пожалуйста сообщите нам об этом
S2
Электронная формула серы 1s22s22p63s23p4
На внешнем энергетическом уровне у серы 6 электронов, из которых 2 неспаренных на p-орбиталях:

До устойчивой электронной конфигурации сере не хватает двух электронов, поэтому между двумя атомами серы образуется две общие пары электронов (двойная связь):

Структурная формула: S=S
Такая связь является ковалентной неполярной.
K2O
Калий – это элемент IA группы 4-го периода с одним электроном на внешнем энергетическом уровне. Ему проще всего отдать электрон, чем принимать чужие.
Кислород – это элемент VIA группы 2-го периода с шестью электронами на внешнем энергетическом уровне. Для завершения уровня ему не хватает всего 2 электрона. Поэтому кислород – активный неметалл с высокой окислительной способностью.
Схема образования ионной связи:

H2S
Электронная формула водорода 1s1 и, казалось бы, ему легко отдать электрон. Однако не будем забывать, что водород находится в первом периоде, где всего 1 энергетический уровень, способный принять лишь 2 электрона. Таким образом, до завершения энергетического уровня водороду не хватает также одного электрона. Это объясняет высокую электроотрицательность водорода (ОЭО = 2,1) по сравнению с щелочными металлами. Тем не менее ОЭО серы выше (2,58) поэтому связь будет ковалентно полярная.
Электронная формула серы 1s22s22p63s23p4
Сере до завершения энергетического уровня не хватает двух электронов, поэтому она соединяется с двумя атомами водорода:

Структурная формула H-S-H, связь ковалентная полярная.
N2
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Между атомами азота образуется три общие электронные пары (тройная связь):

Эта связь ковалентная неполярная.
Li3N
Литий – это элемент IA группы 2-го периода с одним электроном на внешнем энергетическом уровне. Относительно легко отдаёт электрон.
Электронная формула лития 1s22s1
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Схема образования ионной связи:

Cl3N
Хлор имеет семь электронов на внешнем энергетическом уровне и до устойчивой электронной конфигурации ему не хватает всего одного электрона.
Электронная формула 1s22s22p63s23p7
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Относительная электроотрицательность хлора 2,83, азота 3,07 поэтому связь будет ковалентная полярная.
Схема образования связи:

Лабораторный опыт №4
1. У атомов водорода и фосфора почти одинаковые значения ЭО. Каков тип химической связи в молекуле фосфина PH3?
3. В какой из молекул – хлороводорода HCl или фтороводорода HF – ковалентная химическая связь более полярна?
4. В следующих предложениях впишите пропущенные слова и выражения: «Ковалентная химическая связь образуется за счёт … . По числу общих электронных пар она бывает … . По ЭО ковалентную связь делят на … и … ».
5. Определите валентности элементов в соединениях с формулами: PbS, PbO2, FeS2, Fe2S3, SF6.
6. Запишите формулы хлоридов – соединений элементов с одновалентным хлором: железа (III), меди (I), меди (II), марганца (IV), фосфора (V).
Составьте схемы образования химической связи между атомами в молекулах :
а) фтора F2 ; б) фтороводорода HF ; в) сероводорода H2S.
Составьте электронные и структурные формулы этих молекул.
Укажите вид химической связи и валентность атома каждого элемента.
Заранее огромное СПАСИБО♥))).
На этой странице находится вопрос Составьте схемы образования химической связи между атомами в молекулах :а) фтора F2 ; б) фтороводорода HF ; в) сероводорода H2S?, относящийся к категории
Химия. По уровню сложности данный вопрос соответствует знаниям
учащихся 5 – 9 классов. Здесь вы найдете правильный ответ, сможете
обсудить и сверить свой вариант ответа с мнениями пользователями сайта. С
помощью автоматического поиска на этой же странице можно найти похожие
вопросы и ответы на них в категории Химия. Если ответы вызывают
сомнение, сформулируйте вопрос иначе. Для этого нажмите кнопку вверху.
Изобразите схему образования химической связи и напишите все её характеристики в молекуле сероводорода
Ученик
(88),
закрыт
15 лет назад
Инна
Просветленный
(22493)
15 лет назад
Вокруг атома серы на последнем уровне находятся 6 электронов (как могла я их нарисовала кавычками и запятыми) . Как все элементы (кроме водорода) сера стремится к устойчивому числу электронов на последнем уровне — к 8-ми. Ей не хватает еще 2-х. Атомы водорода имеют только по одному электрону, а стремятся к 2-м. Каждому не хватает по одному. Они выходят из положения, объединяя свои электроны и получают общие пары электронов. У серы 2 пары собственных эл-нов и 2 пары общих с водородом. Так как сера сильнее водорода притягивает эл-ны, они ближе к ней, чем к водороду. В рез-те у серы возникает отрицательный заряд, а у атома водорода — положительный.
Это ковалентная связь, причем полярная (возникают два полюса + и -).
Это о газе сероводороде, а если газ растворить в воде, то часть молекул сероводорода под влиянием молекул воды распадется (диссоциирует) на положит. ионы водорода (катионы) с зарядом +1 и отриц. ионы серы (анионы) с зарядом -2. Это уже ионная связь: катионы притягиваются к анионам. 
ГДЗ Химия 9 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А., 2018, §27 СЕРОВОДОРОД И СУЛЬФИДЫ
Во всех упражнениях
красным цветом приводится решение,
а фиолетовым ― объяснение.
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1 Составьте схему образования химической связи для молекулы сероводорода.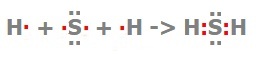
Упражнение 2 Охарактеризуйте физические и химические свойства сероводорода.
Сероводород ― бесцветный газ, обладающий запахом тухлых яиц, немного тяжелее воздуха, растворяется в воде с образованием серной кислоты, ядовит.
Химические свойства сероводорода.
Реагирует со щелочами:
H2S + 2NaOH = Na2S + 2H2O
Проявляет сильные восстановительные свойства:
Очищают промышленные выбросы от сероводорода, окисляя его до серы оксидом серы (IV):
2H2S + SO2 = 3S + 2H2O
H2S-2 + S+4O2 ⟶ S0 + H2O
S-2 -2ē ⟶ S0 |2|4|2 ― процесс окисления
S+4 +4ē ⟶ S0 |4| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
Очищают промышленные выбросы от сероводорода, окисляя его до серы кислородом в недостатке:
2H2S + O2(недостаток) = 2S↓ + 2H2O
H2S-2 + O20 ⟶ S0 + H2O-2
S-2 -2ē ⟶ S0 |2|4|2 ― процесс окисления
О20 +4ē ⟶ 2О-2 |4| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
В избытке кислорода сероводород горит:
2H2S + 3O2(избыток) = 2SO2 + 2H2O
H2S-2 + O20 ⟶ S+4O2-2 + 2H2O
S-2 -6ē ⟶ S+4 |6|12|2 ― процесс окисления
О20 +4ē ⟶ 2О-2 |4| |3 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
Проявляет сильные восстановительные свойства и в растворах (сероводородная кислота):
H2S + Br2 = S↓ + 2HBr
H2S-2 + Br20 ⟶ S0 + 2HBr-1
S-2 -2ē ⟶ S0 |2|2|1 ― процесс окисления
Br20 +2ē ⟶ 2Br-1 |2| |1 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а бром — окислитель.
Более сильные окислители способны окислять сероводород до оксида серы (IV) и даже серной кислоты:
H2S + 3H2SO4 (конц.) = 4SO2↑ + 4H2O
H2S-2 + H2S+6O4 ⟶ S+4O2 + H2O
S-2 -6ē ⟶ S+4 |6|6|1 ― процесс окисления
S+6 +2ē ⟶ S+4 |2| |3 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а серная кислота (за счёт атомов серы в степени окисления +6) — окислитель.
H2S + 8HNO3 (конц.) = H2SO4 + 8NO2↑ + 4H2O
H2S-2 + HN+5O3 ⟶ H2S+6O4 + N+4O2 + H2O
S-2 -8ē ⟶ S+6 |8|8|1 ― процесс окисления
N+5 +1ē ⟶ N+4 |1| |8 ― процесс восстановления
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а азотная кислота (за счёт атомов азота в степени окисления +5) — окислитель.
Упражнение 3 Запишите сокращённое ионное уравнение качественной реакции на сульфид-ион.
Для обнаружения сероводородной кислоты и её солей в растворе используется растворимая соль свинца, в результате реакции образуется чёрный осадок сульфида свинца (II):
Pb2+ + S2- = PbS↓
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите молекулярные и ионные уравнения реакций сероводородной кислоты с хлорной водой, гидроксидом лития, нитратом свинца (II), оксидом серы (IV). В окислительно-восстановительных реакциях расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.
H2S + Cl2 = S↓ + 2HCl
Схема окислительно-восстановительной реакции.
H2S-2 + Cl20 → S0 + 2HCl-1
S-2 -2ē ⟶ S0 |2|2|1 ― процесс окисления
Cl20 +2ē ⟶ 2Cl-1 |2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и хлора. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов серы и хлора. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы элемента серы в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений серы (H2S, S), а разными являются индексы элемента хлора в формуле исходного вещества и продукта реакции – коэффициент 1 (который обычно не пишем) только перед формулой хлора Сl2. Подбираем коэффициенты для остальных соединений.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а хлор — окислитель.
H2S + 2LiOH = Li2S + 2H2O
H2S + 2Li+ + 2OH– = 2Li+ + S2- + 2H2O
H2S + 2OH– = S2- + 2H2O
H2S + Pb(NO3)2 = 2HNO3 + PbS↓
H2S + Pb2+ + 2NO3– = 2H+ + 2NO3– + PbS↓
H2S + Pb2+ = 2H+ + PbS↓
2H2S+ SO2 = 3S + 2H2O
Схема окислительно-восстановительной реакции.
H2S-2 + S+4O2 ⟶ S0 + H2O
S-2 -2ē ⟶ S0 |2|4|х2 ― процесс окисления
S+4 +4ē ⟶ S0 |4| |х1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы. Находим наименьшее общее кратное для чисел 2 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы. Числа в последнем столбце ― 2 и 1― это дополнительные множители в схемах соответствующих процессов:
2S-2 -4ē ⟶ 2S0
S+4 +4ē ⟶ S0
Добавим почленно эти уравнения, получим суммарную схему:
2S-2 + S+4 ⟶ 3S0
Эти коэффициенты переносим в уравнение реакции:
2H2S + SO2 ⟶ 3S + H2O
Проверяем, уравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов водорода разное, уравниваем его, поэтому ставим коэффициент 2 перед формулой Н2О:
2H2S + SO2 ⟶ 3S + 2H2O
Число атомов кислорода одинаковое: по 2 атома.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
Упражнение 2 Напишите уравнения реакций, с помощью которых можно осуществить превращения по схеме:
ZnS ⟶ H2S ⟶ S ⟶ FeS ⟶ SO2. Для окислительно-восстановительных реакций расставьте коэффициенты методом электронного баланса, укажите окислители и восстановители.
ZnS + 2HCl = ZnCl2 + H2S↑
ZnS + 2H+ + 2Cl– = Zn2+ + 2Cl– + H2S↑
ZnS + 2H+ = Zn2+ + H2S↑
2H2S+ SO2 = 3S + 2H2O
Схема окислительно-восстановительной реакции.
H2S-2 + S+4O2 ⟶ S0 + H2O
S-2 -2ē ⟶ S0 |2|4|х2 ― процесс окисления
S+4 +4ē ⟶ S0 |4| |х1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы. Находим наименьшее общее кратное для чисел 2 и 4. Это число 4, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы. Числа в последнем столбце ― 2 и 1― это дополнительные множители в схемах соответствующих процессов:
2S-2 -4ē ⟶ 2S0
S+4 +4ē ⟶ S0
Добавим почленно эти уравнения, получим суммарную схему:
2S-2 + S+4 ⟶ 3S0
Эти коэффициенты переносим в уравнение реакции:
2H2S + SO2 ⟶ 3S + H2O
Проверяем, уравнялось ли число атомов элементов, которых не было в схемах окисления и восстановления. Число атомов водорода разное, уравниваем его, поэтому ставим коэффициент 2 перед формулой Н2О:
2H2S + SO2 ⟶ 3S + 2H2O
Число атомов кислорода одинаковое: по 2 атома.
В приведённой реакции сероводород (за счёт атомов серы в степени окисления -2) — восстановитель, а оксид серы (IV) (за счёт атомов серы в степени окисления +4) — окислитель.
S + Fe = FeS
Схема окислительно-восстановительной реакции.
S0 + Fe0 ⟶ Fe+2S-2
Восстановитель Fe0 – 2ē ⟶ Fe+2 |2|2|1 ― процесс окисления
Окислитель S0 + 2ē ⟶ S-2 |2| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы железа и серы. Находим наименьшее общее кратное для чисел 2 и 2. Это число 2, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 2 и 2, записываем результат за третьей чертой в строках, касающихся элементов железа и серы. Множители 1 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой всех соединений (S, Fe, FeS).
2FeS + 3O2 = 2FeO + 2SO2
Схема окислительно-восстановительной реакции.
FeS-2 + O20 ⟶ FeO + S+4O2-2
S-2 -6ē ⟶ S+4 |6|12|2 ― процесс окисления
O20 +4ē ⟶ 2O-2 |4| |3 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 6 и 4. Это число 12, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 6 и 4, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 2 и 3 являются искомыми коэффициентами. Поскольку элемент сера изменил степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этого элемента в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 2 перед формулой двух соединений серы (FeS, SO2). Поскольку часть атомов кислорода не восстановилась, а вошла в состав FeO, поэтому ставим коэффициент 3 перед формулой кислорода О2.
2FeS + 3O2 ⟶ FeO + 2SO2. Подбираем коэффициенты для остальных соединений.
В приведённой реакции сульфид железа (II) (за счёт атомов серы в степени окисления -2) — восстановитель, а кислород — окислитель.
Упражнение 3 Напишите по одному молекулярному уравнению реакции, соответствующему каждому из следующих ионных уравнений:
а) H2S + OH– = HS– + H2O;
В левой части уравнения записана формула ионов, поэтому соединение, которое взаимодействует, должно быть растворимым и сильным электролитом. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы OН– (LiOH, KOH, NaOH).
H2S + NaOH = NaHS + H2O
H2S + KOH = KHS + H2O
б) H2S + 2OH– = S2- + 2H2O;
В левой части уравнения записана формула ионов, поэтому соединение, которое взаимодействует, должно быть растворимым и сильным электролитом. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы OН– (LiOH, KOH, NaOH).
H2S + 2NaOH = Na2S + 2H2O
H2S + 2KOH = K2S + 2H2O
в) HS– + OH– = S2- + H2O;
В левой части уравнения записано только формулы ионов, поэтому соединения, которые взаимодействуют, должны быть растворимыми и сильными электролитами. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы HS–(LiHS, KHS, NaHS) и OH- (LiOH, NaOH, KOH).
NaHS + NaOH = Na2S + H2O
KHS + KOH = K2S + H2O
г) S2- + Cu2+ = CuS↓.
В левой части уравнения записано только формулы ионов, поэтому соединения, которые взаимодействуют, должны быть растворимыми и сильными электролитами. По таблице растворимости определяем в каких соединениях (берем во внимание только сильные электролиты) могут содержаться ионы HS–(Li2S, K2S, Na2S) и Cu2+ (CuF2, CuCl2, CuI2, CuSO4, Cu(NO3)2).
K2S + CuSO4 = K2SO4 + CuS↓
Na2S + CuSO4 = Na2SO4 + CuS↓
K2S + CuCl2 = 2KCl + CuS↓
Na2S + CuCl2 = 2NaCl + CuS↓
Na2S + Cu(NO3)2 = 2NaNO3 + CuS↓
K2S + Cu(NO3)2 = 2KNO3 + CuS↓
Упражнение 4 В химической реакции, протекающей по уравнению 2Н2S+Сl2=2S+2НСl, концентрация газообразного хлора за 3 минуты уменьшилась с 0,063 моль/л до 0,027 моль/л. Рассчитайте скорость химической реакции в данный промежуток времени.
1. Рассчитаем изменение концентрации вещества:
Δс=0,063 моль/л – 0,027 моль/л=0,036 моль/л
2. Рассчитаем промежуток времени:
Δt=3 мин=3●60 с=180 с
3. Вычисляем скорость химической реакции по формуле v= Δс/Δt, где Δс — изменение концентрации вещества; Δt — промежуток времени, за который произошло данное изменение концентрации.
v=0,036 моль/л : 180 с=0,0002 моль/л●с=0,2 моль/л●с
Ответ: 0,2 ммоль/л●с
Упражнение 5 В состав белой краски (свинцовых белил), нередко использовавшейся ранее для написания икон, входил сульфат свинца (II). Спустя длительное время белая краска таких икон чернела из-за взаимодействия с сероводородом. Образующийся сульфид свинца (II) – соль чёрного цвета. Для восстановления белых тонов икону обрабатывали раствором пероксида водорода, при этом сульфид свинца (II) вновь окислялся до сульфата свинца (II). Составьте уравнение этой реакции, расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
PbS + 4H2O2 = PbSO4 + 4H2O
Схема окислительно-восстановительной реакции.
PbS-2 + H2O2-1 ⟶ PbS+6O4-2 + H2O
S-2 -8ē ⟶ S+6 |8|8|1 ― процесс окисления
O-1 +2ē ⟶ O-2 |2| |4 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы серы и кислорода. Находим наименьшее общее кратное для чисел 8 и 2. Это число 8, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 8 и 2, записываем результат за третьей чертой в строках, касающихся элементов серы и кислорода. Множители 1 и 4 являются искомыми коэффициентами. Поскольку элемент сера изменил степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и одинаковыми являются индексы этого элемента в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 1 (который обычно не пишем) перед формулой двух соединений серы (PbS, PbSO4). Поскольку часть атомов кислорода не восстановилась, а вошла в состав H2O, поэтому ставим коэффициент 4 только перед формулой пероксида водорода H2О2.
PbS + 4H2O2 = PbSO4 + H2O. Подбираем коэффициенты для остальных соединений.
В приведённой реакции сульфид железа (II) (за счёт атомов серы в степени окисления -2) — восстановитель, а пероксид водорода (за счёт атомов кислорода в степени окисления -1) — окислитель.
