Ковалентная связь образуется при взаимодействии неметаллов. Атомы неметаллов имеют высокую электроотрицательность и стремятся заполнить внешний электронный слой за счёт чужих электронов. Два таких атома могут перейти в устойчивое состояние, если объединят свои электроны.
Ковалентная связь — это связь между атомами неметаллов, образованная за счёт общих электронных пар.
Рассмотрим возникновение ковалентной связи в простых веществах.
1. Образование молекулы водорода.
Каждый атом водорода имеет один электрон. Для перехода в устойчивое состояние ему необходим ещё один электрон.
При сближении двух атомов электронные облака перекрываются. Образуется общая электронная пара, которая связывает атомы водорода в молекулу.
В пространстве между двумя ядрами общие электроны бывают чаще, чем в других местах. Там формируется область с повышенной электронной плотностью и отрицательным зарядом. Положительно заряженные ядра притягиваются к ней, и образуется молекула.
При этом каждый атом получает завершённый двухэлектронный внешний уровень и переходит в устойчивое состояние.

Рис. (1). Образование молекулы водорода
Ковалентная связь за счёт образования одной общей электронной пары называется одинарной.
Общие электронные пары (ковалентные связи) образуются за счёт неспаренных электронов, расположенных на внешних энергетических уровнях взаимодействующих атомов.
У водорода — один неспаренный электрон. Для других элементов их число равно 8 – № группы.
Неметаллы VIIА группы (галогены) имеют на внешнем слое один неспаренный электрон.
У неметаллов VIА группы (кислород, сера) таких электронов два.
У неметаллов VА группы (азот, фосфор) — три неспаренных электрона.
2. Образование молекулы хлора.
Атом хлора на внешнем уровне имеет семь электронов. Шесть из них образуют пары, а седьмой неспаренный.
При соединении атомов образуется одна общая электронная пара, то есть возникает одна ковалентная связь. Каждый атом получает завершённый восьмиэлектронный внешний слой. Связь в молекуле хлора тоже одинарная. Такие же одинарные связи существуют в молекулах фтора, брома и иода.

Рис. (2). Образование молекулы хлора
Если атомы имеют несколько неспаренных электронов, то образуются две или три общие пары.
3. Образование молекулы кислорода.
У атома кислорода на внешнем уровне — два неспаренных электрона.
При взаимодействии двух атомов кислорода возникают две общие электронные пары. Каждый атом заполняет свой внешний уровень до восьми электронов. Связь в молекуле кислорода двойная.

Рис. (3). Образование молекулы кислорода
4. Образование молекулы азота.
Атом азота имеет три неспаренных электрона на внешнем уровне.
В молекуле образуются три общие электронные пары. Связь в молекуле азота тройная.

Рис. (4). Образование молекулы азота
Образование ковалентных связей показывают структурные (графические) формулы, в которых общая электронная пара обозначается чертой. Одна черта между атомами обозначает одинарную связь, две черты — двойную, три черты — тройную:
Источники:
Рис. 1. Образование молекулы водорода © ЯКласс
Рис. 2. Образование молекулы хлора © ЯКласс
Рис. 3. Образование молекулы кислорода © ЯКласс
Рис. 4. Образование молекулы азота © ЯКласс
1. Положение азота в периодической системе химических элементов
2. Строение атома азота
3. Физические свойства и нахождение в природе
4. Строение молекулы
5. Соединения азота
6. Способы получения
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и кремнием
7.1.3. Взаимодействие с водородом и фосфором
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с активными металлами
Аммиак
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с серной кислотой
3.2. Взаимодействие с азотной кислотой
3.3. Взаимодействие с солями
Соли аммония
Способы получения солей аммония
Химические свойства солей аммония
Оксиды азота
1. Оксид азота (I)
2. Оксид азота (II)
3. Оксид азота (III)
4. Оксид азота (IV)
5. Оксид азота (V)
Азотная кислота
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Диссоциация азотной кислоты
2.3. Взаимодействие с основными и амфотерными оксидами и гидроксидами
2.4. Вытеснение более слабых кислот из солей
2.5. Взаимодействие с металлами
2.6. Взаимодействие с неметаллами
2.7. Окисление сложных веществ
2.8. Взаимодействие с белками
Азотистая кислота
Соли азотной кислоты — нитраты
Соли азотистой кислоты — нитриты
Азот
Положение в периодической системе химических элементов
Азот расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение азота
Электронная конфигурация азота в основном состоянии:
![]()
Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях — III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Физические свойства и нахождение в природе
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха (79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислот в живых организмах.
Строение молекулы
Связь между атомами в молекуле азота – тройная, т.к. у каждого атома в молекуле по 3 неспаренных электрона. Одна σ-связь (сигма-связь) и две — π-связи.
Структурная формула молекулы азота:

Структурно-графическая формула молекулы азота: N≡N.
Схема перекрывания электронных облаков при образовании молекулы азота:

Соединения азота
Типичные соединения азота:
| Степень окисления | Типичные соединения |
| +5 | оксид азота (V) N2O5
азотная кислота HNO3 нитраты MeNO3 |
| +4 | оксид азота (IV) NO2 |
| +3 | оксид азота (III)
азотистая кислота нитриты MeNO2 |
| +2 | оксид азота (II) NO |
| +1 | оксид азота (I) |
| -3 | аммиак NH3
нитриды металлов MeN бинарные соединения азота с неметаллами |
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Видеоопыт взаимодействия нитрита натрия с хлоридом аммония можно посмотреть здесь.
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидов щелочных металлов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре ~700 °C:
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методы разделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разделения газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000оС-5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом.
1.3. Азот взаимодействует с водородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения-нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Аммиак
Строение молекулы и физические свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:

Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3о:

У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:

Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск
ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например, аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
2NH4Cl + Са(OH)2 → CaCl2 + 2NH3 + 2Н2O
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например, гидролиз нитрида кальция:
Ca3N2 + 6H2O → ЗСа(OH)2 + 2NH3
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
N2 + 3Н2 ⇄ 2NH3
Процесс проводят при температуре 500-550оС и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H+), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:
:NH3 + H2O ⇄ NH4+ + OH–

Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание. При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например, аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
NH3 + H2SO4 → NH4HSO4
2NH3 + H2SO4 → (NH4)2SO4
Еще один пример: аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
NH3 + H2O + CO2 → NH4HCO3
2NH3 + H2O + CO2 → (NH4)2CO3
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов, образуя нерастворимые гидроксиды.
Например, водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
FeSO4 + 2NH3 + 2H2O → Fe(OH)2 + (NH4)2SO4
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – амминокомплексы.
Например, хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
4NH3 + CuCl2 → [Cu(NH3)4]Cl2
Гидроксид меди (II) растворяется в избытке аммиака:
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
5. Аммиак горит на воздухе, образуя азот и воду:
4NH3 + 3O2 → 2N2 + 6H2O
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
4NH3 + 5O2 → 4NO + 6H2O
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя, например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием. С металлами реагирует только жидкий аммиак.
Например, жидкий аммиак реагирует с натрием с образованием амида натрия:
2NH3 + 2Na → 2NaNH2 + H2
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например, аммиак окисляется хлором до молекулярного азота:
2NH3 + 3Cl2 → N2 + 6HCl
Пероксид водорода также окисляет аммиак до азота:
2NH3 + 3H2O2 → N2 + 6H2O
Оксиды металлов, которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например, оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Соли аммония
Соли аммония – это соли, состоящие из катиона аммония и аниона кислотного остатка.
Способы получения солей аммония
1. Соли аммония можно получить взаимодействием аммиака с кислотами. Реакции подробно описаны выше.
2. Соли аммония также получают в обменных реакциях между солями аммония и другими солями.
Например, хлорид аммония реагирует с нитратом серебра:
NH4Cl + AgNO3 → AgCl + NH4NO3
3. Средние соли аммония можно получить из кислых солей аммония. При добавлении аммиака кислая соль переходит в среднюю.
Например, гидрокарбонат аммония реагирует с аммиаком с образованием карбоната аммония:
NH4НCO3 + NH3 → (NH4)2CO3
Химические свойства солей аммония
1. Все соли аммония – сильные электролиты, почти полностью диссоциируют на ионы в водных растворах:
NH4Cl ⇄ NH4+ + Cl–
2. Соли аммония проявляют свойства обычных растворимых солей –вступают в реакции обмена с щелочами, кислотами и растворимыми солями, если в продуктах образуется газ, осадок или образуется слабый электролит.
Например, карбонат аммония реагирует с соляной кислотой. При этом выделяется углекислый газ:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
Соли аммония реагируют с щелочами с образованием аммиака.
Например, хлорид аммония реагирует с гидроксидом калия:
NH4Cl + KOH → KCl + NH3 + H2O
Взаимодействие с щелочами — качественная реакция на ионы аммония. Выделяющийся аммиак можно обнаружить по характерному резкому запаху и посинению лакмусовой бумажки.
3. Соли аммония подвергаются гидролизу по катиону, т.к. гидроксид аммония — слабое основание:
NH4Cl + Н2O ↔ NH3 ∙ H2O + HCl
NH4+ + HOH ↔ NH3 ∙ H2O + H+
4. При нагревании соли аммония разлагаются. При этом если соль не содержит анион-окислителя, то разложение проходит без изменения степени окисления атома азота. Так разлагаются хлорид, карбонат, сульфат, сульфид и фосфат аммония:
NH4Cl → NH3 + HCl
NH4HCO3 → NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3
NH4HS → NH3 + H2S
Если соль содержит анион-окислитель, то разложение сопровождается изменением степени окисления атома азота иона аммония. Так протекает разложение нитрата, нитрита и дихромата аммония:
NH4NO2 → N2 + 2H2O
190 – 245° C:
NH4NO3 → N2O + 2H2O
При температуре 250 – 300°C:
2NH4NO3 → 2NO + 4H2O
При температуре выше 300°C:
2NH4NO3 → 2N2 + O2 + 4H2O
Разложение бихромата аммония («вулканчик»). Оранжевые кристаллы дихромата аммония под действием горящей лучинки бурно реагируют. Дихромат аммония – особенная соль, в ее составе – окислитель и восстановитель. Поэтому «внутри» этой соли может пройти окислительно-восстановительная реакция (внутримолекулярная ОВР):
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
Окислитель – хром (VI) превращается в хром (III), образуется зеленый оксид хрома. Восстановитель – азот, входящий в состав иона аммония, превращается в газообразный азот. Итак, дихромат аммония превращается в зеленый оксид хрома, газообразный азот и воду. Реакция начинается от горящей лучинки, но не прекращается, если лучинку убрать, а становится еще интенсивней, так как в процессе реакции выделяется теплота, и, начавшись от лучинки, процесс лавинообразно развивается. Оксид хрома (III) – очень твердое, тугоплавкое вещество зеленого цвета, его используют как абразив. Температура плавления – почти 2300 градусов. Оксид хрома – очень устойчивое вещество, не растворяется даже в кислотах. Благодаря устойчивости и интенсивной окраске окись хрома используется при изготовлении масляных красок.
Видеоопыт разложения дихромата аммония можно посмотреть здесь.
Оксиды азота
| Оксиды азота | Цвет | Фаза | Характер оксида |
| N2O Оксид азота (I), закись азота, «веселящий газ» | бесцветный | газ | несолеобразующий |
| NO Оксид азота (II) | бесцветный | газ | несолеобразующий |
| N2O3 Оксид азота (III), азотистый ангидрид | синий | жидкость | кислотный |
| NO2 Оксид азота (IV), диоксид азота, «лисий хвост» | бурый | газ | кислотный (соответствуют две кислоты) |
| N2O5 Оксид азота (V), азотный ангидрид | бесцветный | твердый | кислотный |
Оксид азота (I)
Оксид азота (I) – это несолеобразующий оксид. Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз.
Строение молекулы оксида азота (I) нельзя описать методом валентных связей. Так как оксид азота (I) состоит из двух, так называемых резонансных структур, которые переходят одна в другую:
![]()
Общую формулу в таком случае можно задать, обозначая изменяющиеся связи в резонансных структурах пунктиром:
![]()
Получить оксид азота (I) в лаборатории можно разложением нитрата аммония:
NH4NO3 → N2O + 2H2O
Химические свойства оксида азота (I):
1. При нормальных условиях оксид азота (I) инертен. При нагревании проявляет свойства окислителя. Оксид азота (I) при нагревании окисляет водород, аммиак, металлы, сернистый газ и др. При этом азот восстанавливается в простое вещество.
N2O + H2 → N2 + H2O
N2O + Mg → N2 + MgO
N2O + 2Cu → N2 + Cu2O
3N2O + 2NH3 → 4N2 + 3H2O
N2O + H2O + SO2 → N2 + H2SO4
Еще пример: оксид азота (I) окисляет углерод и фосфор при нагревании:
N2O + C → N2 + CO
5N2O + 2Р → 5N2 + Р2O5
2. При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя.
Например, N2O окисляется раствором перманганата в серной кислоте:
5N2O + 3H2SO4 + 2KMnO4 → 10NO + 2MnSO4 + K2SO4 + 3H2O
Оксид азота (II)
Оксид азота (II) – это несолеобразующий оксид. В нормальных условиях это бесцветный ядовитый газ, плохо растворимый в воде. На воздухе коричневеет из-за окисления до диоксида азота. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Способы получения.
1. В лаборатории оксид азота (II) получают действием разбавленной азотной кислоты (30%) на неактивные металлы.
Например, при действии 30 %-ной азотной кислоты на медь образуется NO:
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO + 4H2O
Также NO можно получить при окислении хлорида железа (II) или иодоводорода азотной кислотой:
3FeCl2 + NaNO3 + 4HCl → 3FeCl3 + NaCl + NO + 2H2O
2HNO3 + 6HI → 2NO + I2 + 4H2O
2. В природе оксид азота (II) образуется из азота и кислорода под действием электрического разряда, например, во время грозы:
N2 + O2 → 2NO
3. В промышленности оксид азота (II) получают каталитическим окислением аммиака:
4NH3 + 5O2 → 4NO + 6H2O
Химические свойства.
1. Оксид азота (II) легко окисляется под действием окислителей.
Например, горит в атмосфере кислорода:
2NO + O2 → 2NO2
Оксид азота (II) легко окисляется под действием хлора или озона:
2NO + Cl2 → 2NOCl
NO + O3 → NO2 + O2
2. В присутствии более сильных восстановителей проявляет свойства окислителя. В атмосфере оксида азота (II) могут гореть водород, углерод и т.п.
Например, оксид азота (II) окисляет водород и сернистый газ:
2NO + 2H2 → N2 + 2H2O
2NO + 2SO2 → 2SO3 + N2
Оксид азота (III)
Оксид азота (III), азотистый ангидрид – кислотный оксид. За счет азота со степенью окисления +3 проявляет восстановительные и окислительные свойства. Устойчив только при низких температурах, при более высоких температурах разлагается.
Способы получения: можно получить при низкой температуре из оксидов азота:
NO2 + NO ↔ N2O3
Химические свойства:
1. Оксид азота (III) взаимодействует с водой с образованием азотистой кислоты:
N2O3 + H2O ↔ 2HNO2
2. Оксид азота (III) взаимодействует с основаниями и основными оксидами:
Например, оксид азота (III) реагирует с гидроксидом и оксидом натрия с образованием нитрита натрия и воды:
N2O3 + 2NaOH → 2NaNO2 + H2O
N2O3 + Na2O → 2NaNO2
Оксид азота (IV)
Оксид азота (IV) — бурый газ. Очень ядовит! Для NO2 характерна высокая химическая активность.
Способы получения.
1. Оксид азота (IV) образуется при окислении оксида азота (I) и оксида азота (II) кислородом или озоном:
2NO + O2 → 2NO2
2. Оксид азота (IV) образуется при действии концентрированной азотной кислоты на неактивные металлы.
Например, при действии концентрированной азотной кислоты на медь:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
3. Оксид азота (IV) образуется также при разложении нитратов металлов, которые в ряду электрохимической активности расположены правее магния (включая магний) и при разложении нитрата лития.
Например, при разложении нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2
Химические свойства.
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
2NO2 + H2O → HNO3 + HNO2
Если растворение NO2 в воде проводить в избытке кислорода, то образуется только азотная кислота:
4NO2 + 2H2O + O2 → 4HNO3
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
3NO2 + H2O → 2HNO3 + NO
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O
4NO2 + 2Ca(OH)2 → Ca(NO2)2 + Ca(NO3)2 + 2H2O
В присутствии кислорода образуются только нитраты:
4NO2 + 4NaOH + O2 → 4NaNO3 + 2H2O
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор, уголь, сера, оксид серы (IV) окисляется до оксида серы (VI):
2NO2 + 2S → N2 + 2SO2
2NO2 + 2C → N2 + 2CO2
10NO2 + 8P → 5N2 + 4P2O5
NO2 + SO2 → SO3 + NO
4. Оксид азота (IV) димеризуется:
2NO2 ⇄ N2O4
Оксид азота (V)
N2O5 – оксид азота (V), ангидрид азотной кислоты – кислотный оксид.
Получение оксида азота (V).
1. Получить оксид азота (V) можно окислением диоксида азота:
2NO2 + O3 → N2O5 + O2
2. Еще один способ получения оксида азота (V) – обезвоживание азотной кислоты сильным водоотнимающим веществом, оксидом фосфора (V):
2HNO3 + P2O5 → 2HPO3 + N2O5
Химические свойства оксида азота (V).
1. При растворении в воде оксид азота (V) образует азотную кислоту:
N2O5 + H2O → 2HNO3
2. Оксид азота (V), как типичный кислотный оксид, взаимодействует с основаниями и основными оксидами с образованием солей-нитратов.
Например, оксид азота (V) реагирует с гидроксидом натрия:
N2O5 + 2NaOH → 2NaNO3 + H2O
Еще пример: оксид азота (V) реагирует с оксидом кальция:
N2O5 + CaO → Ca(NO3)2
3. За счет азота со степенью окисления +5 оксид азота (V) – сильный окислитель.
Например, он окисляет серу:
2N2O5 + S → SO2 + 4NO2
4. Оксид азота (V) легко разлагается при нагревании (со взрывом):
2N2O5 → 4NO2 + O2
Азотная кислота
Строение молекулы и физические свойства
Азотная кислота HNO3 – это сильная одноосновная кислота-гидроксид. При обычных условиях бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении). Азотная кислота смешивается с водой во всех соотношениях. На свету частично разлагается.
Валентность азота в азотной кислоте равна IV, так как валентность V у азота отсутствует. При этом степень окисления атома азота равна +5. Так происходит потому, что атом азота образует 3 обменные связи и одну донорно-акцепторную, является донором электронной пары.
Поэтому строение молекулы азотной кислоты можно описать резонансными структурами:


Обозначим дополнительные связи между азотом и кислородом пунктиром. Этот пунктир по сути обозначает делокализованные электроны. Получается формула:

Способы получения
В лаборатории азотную кислоту можно получить разными способами:
1. Азотная кислота образуется при действии концентрированной серной кислоты на твердые нитраты металлов. При этом менее летучая серная кислота вытесняет более летучую азотную.
Например, концентрированная серная кислота вытесняет азотную из кристаллического нитрата калия:
KNO3 + H2SO4(конц) → KHSO4 + HNO3
2. В промышленности азотную кислоту получают из аммиака. Процесс осуществляется стадийно.
1 стадия. Каталитическое окисление аммиака.
4NH3 + 5O2 → 4NO + 6H2O
2 стадия. Окисление оксида азота (II) до оксида азота (IV) кислородом воздуха.
2NO + O2 → 2NO2
3 стадия. Поглощение оксида азота (IV) водой в присутствии избытка кислорода.
4NO2 + 2H2O + O2 → 4HNO3
Химические свойства
Азотная кислота – это сильная кислота. За счет азота со степенью окисления +5 азотная кислота проявляет сильные окислительные свойства.
1. Азотная кислота практически полностью диссоциирует в водном растворе.
HNO3 → H+ + NO3–
2. Азотная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, азотная кислота взаимодействует с оксидом меди (II):
CuO + 2HNO3 → Cu(NO3)2 + H2O
Еще пример: азотная кислота реагирует с гидроксидом натрия:
HNO3 + NaOH → NaNO3 + H2O
3. Азотная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов, сульфитов).
Например, азотная кислота взаимодействует с карбонатом натрия:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
4. Азотная кислота частично разлагается при кипении или под действием света:
4HNO3 → 4NO2 + O2 + 2H2O
5. Азотная кислота активно взаимодействует с металлами. При этом никогда не выделяется водород! При взаимодействии азотной кислоты с металлами окислителем всегда выступает азот +5. Азот в степени окисления +5 может восстанавливаться до степеней окисления -3, 0, +1, +2 или +4 в зависимости от концентрации кислоты и активности металла.
металл + HNO3 → нитрат металла + вода + газ (или соль аммония)
С алюминием, хромом и железом на холоду концентрированная HNO3 не реагирует – кислота «пассивирует» металлы, т.к. на их поверхности образуется пленка оксидов, непроницаемая для концентрированной азотной кислоты. При нагревании реакция идет. При этом азот восстанавливается до степени окисления +4:
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3NO2 + 3H2O
Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Золото и платина не реагируют с азотной кислотой, но растворяются в «царской водке» – смеси концентрированных азотной и соляной кислот в соотношении 1 : 3 (по объему):
HNO3 + 3HCl + Au → AuCl3 + NO + 2H2O
Концентрированная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (IV), азот восстанавливается минимально:
4HNO3(конц.) + Cu → Cu(NO3)2 + 2NO2 + 2H2O
С активными металлами (щелочными и щелочноземельными) концентрированная азотная кислота реагирует с образованием оксида азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Разбавленная азотная кислота взаимодействует с неактивными металлами и металлами средней активности (в ряду электрохимической активности после алюминия). При этом образуется оксид азота (II).
8HNO3 (разб.) + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
С активными металлами (щелочными и щелочноземельными), а также оловом и железом разбавленная азотная кислота реагирует с образованием молекулярного азота:
12HNO3(разб) + 10Na → 10NaNO3 + N2 + 6H2O
При взаимодействии кальция и магния с азотной кислотой любой концентрации (кроме очень разбавленной) образуется оксид азота (I):
10HNO3 + 4Ca → 4Ca(NO3)2 + 2N2O + 5H2O
Очень разбавленная азотная кислота реагирует с металлами с образованием нитрата аммония:
10HNO3 + 4Zn → 4Zn(NO3)2 + NH4NO3 + 3H2O
Таблица. Взаимодействие азотной кислоты с металлами.
| Азотная кислота | ||||
| Концентрированная | Разбавленная | |||
| с Fe, Al, Cr | с неактивными металлами и металлами средней активности (после Al) | с щелочными и щелочноземельными металлами | с неактивными металлами и металлами средней активности (после Al) | с металлами до Al в ряду активности, Sn, Fe |
| пассивация при низкой Т | образуется NO2 | образуется N2O | образуется NO | образуется N2 |
6. Азотная кислота окисляет и неметаллы (кроме кислорода, водорода, хлора, фтора и некоторых других). При взаимодействии с неметаллами HNO3 обычно восстанавливается до NO или NO2, неметаллы окисляются до соответствующих кислот, либо оксидов (если кислота неустойчива).
Например, азотная кислота окисляет серу, фосфор, углерод, йод:
6HNO3 + S → H2SO4 + 6NO2 + 2H2O
Безводная азотная кислота – сильный окислитель. Поэтому она легко взаимодействует с красным и белым фосфором. Реакция с белым фосфором протекает очень бурно. Иногда она сопровождается взрывом.
5HNO3 + P → H3PO4 + 5NO2 + H2O
5HNO3 + 3P + 2H2O → 3H3PO4 + 5NO
Видеоопыт взаимодействия фосфора с безводной азотной кислотой можно посмотреть здесь.
4HNO3 + C → CO2 + 4NO2 + 2H2O
Видеоопыт взаимодействия угля с безводной азотной кислотой можно посмотреть здесь.
10HNO3 + I2 → 2HIO3 + 10NO2 + 4H2O
7. Концентрированная азотная кислота окисляет сложные вещества (в которых есть элементы в отрицательной, либо промежуточной степени окисления): сульфиды металлов, сероводород, фосфиды, йодиды, соединения железа (II) и др. При этом азот восстанавливается до NO2, неметаллы окисляются до соответствующих кислот (или оксидов), а металлы окисляются до устойчивых степеней окисления.
Например, азотная кислота окисляет оксид серы (IV):
2HNO3 + SO2 → H2SO4 + 2NO2
Еще пример: азотная кислота окисляет йодоводород:
6HNO3 + HI → HIO3 + 6NO2 + 3H2O
Азотная кислота окисляет углерод до углекислого газа, т.к. угольная кислота неустойчива.
3С + 4HNO3 → 3СО2 + 4NO + 2H2O
Сера в степени окисления -2 окисляется без нагревания до простого вещества, при нагревании до серной кислоты.
Например, сероводород окисляется азотной кислотой без нагревания до молекулярной серы:
2HNO3 + H2S → S + 2NO2 + 2H2O
При нагревании до серной кислоты:
2HNO3 + H2S → H2SO4 + 2NO2 + 2H2O
8HNO3 + CuS → CuSO4 + 8NO2 + 4H2O
Соединения железа (II) азотная кислота окисляет до соединений железа (III):
4HNO3 + FeS → Fe(NO3)3 + NO + S + 2H2O
8. Азотная кислота окрашивает белки в оранжево-желтый цвет («ксантопротеиновая реакция»).
Ксантопротеиновую реакцию проводят для обнаружения белков, содержащих в своем составе ароматические аминокислоты. К раствору белка прибавляем концентрированную азотную кислоту. Белок свертывается. При нагревании белок желтеет. При добавлении избытка аммиака окраска переходит в оранжевую.

Видеоопыт обнаружения белков с помощью азотной кислоты можно посмотреть здесь.
Азотистая кислота
Азотистая кислота HNO2 — слабая, одноосновная, химически неустойчивая кислота.
Получение азотистой кислоты.
Азотистую кислоту легко получить вытеснением из нитритов более сильной кислотой.
Например, соляная кислота вытесняет азотистую кислоту из нитрита серебра:
AgNO2 + HCl → HNO2 + AgCl
Химические свойства.
1. Азотистая кислота HNO2 существует только в разбавленных растворах, при нагревании она разлагается:
3HNO2 → HNO3 + 2NO + H2O
без нагревания азотистая кислота также разлагается:
2HNO2 → NO2 + NO + H2O
2. Азотистая кислота взаимодействует с сильными основаниями.
Например, с гидроксидом натрия:
HNO2 + NaOH → NaNO2 + H2O
3. За счет азота в степени окисления +3 азотистая кислота проявляет слабые окислительные свойства. Окислительные свойства HNO2 проявляет только при взаимодействии с сильными восстановителями.
Например, HNO2 окисляет иодоводород:
2HNO2 + 2HI → 2NO + I2 + 2H2O
Азотистая кислота также окисляет иодиды в кислой среде:
2НNO2 + 2KI + 2H2SO4 → K2SO4 + I2 + 2NO + 2H2O
Азотистая кислота окисляет соединения железа (II):
2HNO2 + 3H2SO4 + 6FeSO4 → 3Fe2(SO4)3 + N2 + 4H2O
4. За счет азота в степени окисления +3 азотистая кислота проявляет сильные восстановительные свойства. Под действием окислителей азотистая кислота переходит в азотную.
Например, хлор окисляет азотистую кислоту до азотной кислоты:
HNO2 + Cl2 + H2O → HNO3 + 2HCl
Кислород и пероксид водорода также окисляют азотистую кислоту:
2HNO2 + O2 → 2HNO3
HNO2 + H2O2 → HNO3 + H2O
Соединения марганца (VII) окисляют HNO2:
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O
Соли азотной кислоты — нитраты
Нитраты металлов — это твердые кристаллические вещества. Большинство очень хорошо растворимы в воде.
1. Нитраты термически неустойчивы, причем все они разлагаются на кислород и соединение, характер которого зависит от положения металла (входящего в состав соли) в ряду напряжений металлов:
- Нитраты щелочных и щелочноземельных металлов (до Mg в электрохимическом ряду) разлагаются до нитрита и кислорода.
Например, разложение нитрата натрия:
2KNO3 → 2KNO2 + O2
Исключение – литий.
Видеоопыт разложения нитрата калия можно посмотреть здесь.
- Нитраты тяжелых металлов (от Mg до Cu, включая магний и медь) и литий разлагаются до оксида металла, оксида азота (IV) и кислорода:
Например, разложение нитрата меди (II):
2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Нитраты малоактивных металлов (правее Cu) – разлагаются до металла, оксида азота (IV) и кислорода.
Например, нитрат серебра:
2AgNO3 → 2Ag + 2NO2 + O2

Исключения:
Нитрит железа (II) разлагается до оксида железа (III):
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Нитрат марганца (II) разлагается до оксида марганца (IV):
Mn(NO3)2 → MnO2 + 2NO2
2. Водные растворы не обладают окислительно-восстановительными свойствами, расплавы – сильные окислители.
Например, смесь 75% KNO3, 15% C и 10% S называют «черным порохом»:
2KNO3 + 3C + S → N2 + 3CO2 + K2S
Соли азотистой кислоты — нитриты
Соли азотистой кислоты устойчивее самой кислоты, и все они ядовиты. Поскольку степень окисления азота в нитритах равна +3, то они проявляют как окислительные свойства, так и восстановительные.
Кислород, галогены и пероксид водорода окисляют нитриты до нитратов:
2KNO2 + O2 → 2KNO3
KNO2 + H2O2 → KNO3 + H2O
KNO2 + H2O + Br2 → KNO3 + 2HBr
Лабораторные окислители — перманганаты, дихроматы — также окисляют нитриты до нитратов:
5KNO2 + 3H2SO4 + 2KMnO4 → 5KNO3 + 2MnSO4 + K2SO4 + 3H2O
3KNO2 + 4H2SO4 + K2Cr2O7 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
В кислой среде нитриты выступают в качестве окислителей.
При окислении йодидов или соединений железа (II) нитриты восстанавливаются до оксида азота (II):
2KNO2 + 2H2SO4 + 2KI → 2NO + I2 + 2K2SO4 + 2H2O
2KNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + K2SO4 + 2H2O
При взаимодействии с очень сильными восстановителями (алюминий или цинк в щелочной среде) нитриты восстанавливаются максимально – до аммиака:
NaNO2 + 2Al + NaOH + 6H2O → 2Na[Al(OH)4] + NH3
Смесь нитратов и нитритов также проявляет окислительные свойства. Например, смесь нитрата и нитрита калия окисляет оксид хрома (III) до хромата калия:
3KNO2 + Cr2O3 + KNO3 → 2K2CrO4 + 4NO
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Cм. в № 13, 18, 23/2007;
6/2008
Глава 4. Понятие о химической связи
В предыдущих главах данного пособия были
обсуждения того, что вещество состоит из молекул,
а молекулы – из атомов. А не возникал ли у
вас вопрос: почему атомы, составляющие молекулу,
не разлетаются в разные стороны?
Что удерживает атомы в молекуле?
Их удерживает химическая связь.
Для того чтобы понять природу химической связи,
достаточно вспомнить простой физический опыт.
Два шарика, висящие рядом на ниточках, никак не
«реагируют» друг на друга. Но если придать
одному шарику положительный заряд, а другому –
отрицательный, они притянутся друг к другу.
Не эта ли сила притягивает атомы друг к
другу? Действительно, исследования показали, что химическая
связь имеет электрическую природу.
Откуда же возникают заряды в нейтральных
атомах?
Статья опубликована при поддержке онлайн курса подготовки к ЕГЭ “Экзамер”. На сайте Вы найдёте все необходимые материалы для самостоятельной подготовки к ЕГЭ – составление уникального плана подготовки для каждого пользователя, отслеживание прогресса по каждой теме предмета, теория и задачи. Все задания соответствуют последним изменениям и дополнениям. Есть также возможность отправлять задания из письменной части ЕГЭ на проверку экспертам для получения баллов и разбора работы по критериям оценивания. Задания в виде квестов с накоплением опыта, прохождением уровней, получением бонусов и наград, соревнования с друзьями на ЕГЭ Арене. Чтобы начать подготовку перейдите по ссылке: https://examer.ru.
При описании строения атомов было показано, что
все атомы, за исключением атомов благородных
газов, стремятся присоединить или отдать
электроны. Причина – образование устойчивого
восьмиэлектронного внешнего уровня (как у
благородных газов). При приеме или отдаче
электронов возникают электрические заряды и, как
следствие, электростатическое взаимодействие
частиц. Так возникает ионная связь, т.е.
связь между ионами.
Ионы – это устойчивые заряженные частицы,
которые образуются в результате приема или
отдачи электронов.
Например, в реакции участвует атом активного
металла и активного неметалла:
Na + S ![]() ?
?
В этом процессе атом металла (натрия) отдает
электроны:
![]()
а) Устойчива ли такая частица?
б) Сколько всего электронов осталось в атоме
натрия?
в) Будет ли эта частица иметь заряд?
Таким образом, в этом процессе образовалась
устойчивая частица (8 электронов на внешнем
уровне), которая имеет заряд, т.к. у ядра атома
натрия заряд по-прежнему +11, а оставшиеся
электроны имеют суммарный заряд –10. Поэтому
заряд иона натрия +1. Кратко запись этого процесса
выглядит так:
![]()
Что происходит с атомом серы? Этот атом
принимает электроны до завершения внешнего
уровня:
![]()
Простой подсчет показывает, что эта частица
имеет заряд:
![]()
Кратко:
![]()
Разноименно заряженные ионы притягиваются, в
результате чего возникает ионная связь и «ионная
молекула»:
![]()
Существуют и другие способы образования ионов,
о которых будет сказано в главе 6.
Формально сульфиду натрия приписывают именно
такой состав молекулы, хотя вещество, состоящее
из ионов, имеет приблизительно следующее
строение (рис. 1):
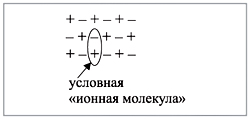 |
Рис. 1.
|
Таким образом, вещества, состоящие из
ионов, не содержат отдельных молекул! В этом
случае можно говорить лишь об условной «ионной
молекуле».
Задание 4.1. Покажите, как происходит переход
электронов при возникновении ионной связи между
атомами:
а) кальция и хлора;
б) алюминия и кислорода.
П о м н и т е! Атом металла отдает внешние
электроны; атом неметалла принимает недостающие
электроны.
Вывод. Ионная связь по описанному выше
механизму образуется между атомами активных
металлов и активных неметаллов.
Исследования, однако, показывают, что полный
переход электронов от одного атома к другому
происходит далеко не всегда. Очень часто
химическая связь образуется не при отдаче-приеме
электронов, а в результате образования общих
электронных пар*. Такая связь
называется ковалентной.
Ковалентная связь возникает за счет
образования общих электронных пар. Этот вид
связи образуется, например, между атомами
неметаллов. Так, известно, что молекула азота
состоит из двух атомов – N2.
Как возникает ковалентная связь между этими
атомами? Чтобы ответить на этот вопрос,
необходимо рассмотреть строение атома азота:
![]()
В о п р о с. Сколько электронов не хватает до
завершения внешнего уровня?
О т в е т. Не хватает трех электронов. Поэтому,
обозначив каждый электрон внешнего уровня
точкой, получим:
![]()
В о п р о с. Почему три электрона обозначены
одиночными точками?
О т в е т. Дело в том, что мы хотим показать
образование общих пар электронов. А пара – это
два электрона. Такая пара возникает, в частности,
если каждый атом предоставит по одному электрону
для образования пары. Атому азота не хватает трех
электронов до завершения внешнего уровня.
Значит, он должен «приготовить» три одиночных
электрона для образования будущих пар (рис. 2).
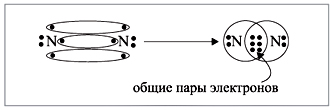 |
Рис. 2.
|
Получена электронная формула
молекулы азота, которая показывает, что у
каждого атома азота имеется теперь восемь
электронов (шесть из них обведены в овал плюс по 2
электрона своих); между атомами возникли три
общие пары электронов (место пересечения
кружков).
Каждая пара электронов соответствует одной
ковалентной связи. Сколько ковалентных связей
возникло? Три. Каждую связь (каждую общую пару
электронов) покажем при помощи черточки
(валентный штрих):
![]()
Все эти формулы не дают, однако, ответа на
вопрос: что же связывает атомы при образовании
ковалентной связи? Электронная формула
показывает, что общая пара электронов
располагается между атомами. В этой области
пространства возникает избыточный
отрицательный заряд. А ядра атомов, как
известно, имеют положительный заряд. Таким
образом, ядра обоих атомов притягиваются к
общему отрицательному заряду, который возник
благодаря общим электронным парам (точнее,
пересечению электронных облаков) (рис. 3).
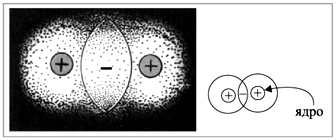 |
Рис. 3.
|
Может ли возникнуть такая связь
между разными атомами? Может. Пусть атом азота
взаимодействует с атомами водорода:
![]()
Строение атома водорода показывает, что атом
имеет один электрон. Сколько таких атомов нужно
взять, чтобы атом азота «получил желаемое» – три
электрона? Очевидно, три атома водорода
(рис. 4):
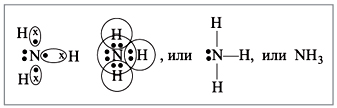 |
Рис. 4.
|
Крестиком на рис. 4 обозначены
электроны атома водорода. Электронная формула
молекулы аммиака показывает, что у атома азота
стало восемь электронов, а у каждого атома
водорода получилось по два электрона (а больше на
первом энергетическом уровне и быть не может).
Графическая формула показывает, что атом азота
имеет валентность три (три черточки, или три
валентных штриха), а каждый атом водорода –
валентность один (по одной черточке).
Хотя в состав обеих молекул N2 и NН3
входит один и тот же атом азота, химические
связи между атомами отличаются друг от друга.
В молекуле азота N2 химические связи
образуют одинаковые атомы, поэтому общие
пары электронов находятся посередине между
атомами. Атомы сохраняют нейтральный характер.
Такая химическая связь называется неполярной.
В молекуле аммиака NH3 химическую связь
образуют разные атомы. Поэтому один из атомов
(в данном случае – атом азота) сильнее
притягивает общую пару электронов. Общие пары
электронов смещаются в сторону атома азота, и на
нем возникает небольшой отрицательный заряд, а
на атоме водорода – положительный, возникли
полюса электричества – связь полярная
(рис. 5).
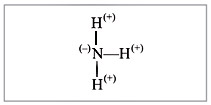 |
Рис. 5.
|
Большинство веществ, построенных при
помощи ковалентной связи, состоят из отдельных
молекул (рис. 6).
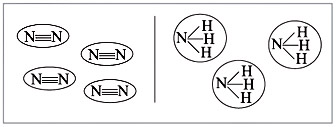 |
Рис. 6.
|
Из рис. 6 видно, что между атомами
химические связи есть, а между молекулами они
отсутствуют или незначительны.
Тип химической связи влияет на свойства
вещества, на его поведение в растворах. Так, чем
больше, значительнее притяжение между частицами,
тем труднее их оторвать друг от друга и сложнее
перевести твердое вещество в газообразное или
жидкое состояние. Попробуйте определить на
схеме, приведенной ниже, между какими частицами
силы взаимодействия больше и какая химическая
связь при этом образуется (рис. 7).
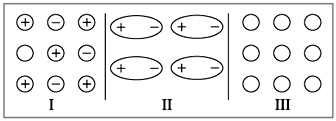 |
Рис. 7.
|
Если вы внимательно прочитали главу,
ответ у вас будет следующим: максимальное
взаимодействие между частицами осуществляется в
случае I (ионная связь). Поэтому все такие
вещества – твердые. Наименьшее взаимодействие
между незаряженными частицами (случай III –
неполярная ковалентная связь). Такие вещества
чаще всего газы.
Задание 4.2. Определите, какая химическая
связь осуществляется между атомами в веществах:
NаСl, НСl, Сl2, АlСl3, Н2О. Дайте
пояснения.
Задание 4.3. Составьте электронные и
графические формулы для тех веществ из задания
4.2, в которых вы определили наличие
ковалентной связи. Для ионной связи составьте
схемы перехода электронов.
Глава 5. Растворы
Нет на Земле человека, который не видел бы
растворов. А что это такое?
Раствор – это однородная смесь из двух или
более компонентов (составных частей или веществ).
Что такое однородная смесь? Однородность смеси
предполагает, что между составляющими ее
веществами отсутствует поверхность раздела.
В этом случае невозможно, по крайней мере
визуально, определить, сколько веществ
образовало данную смесь. Например, глядя на
водопроводную воду в стакане, трудно
предположить, что в ней, кроме молекул воды,
содержится еще добрый десяток ионов и молекул (О2,
СО2, Са2+ и др.). И никакой микроскоп
не поможет увидеть эти частицы.
Но отсутствие поверхности раздела – не
единственный признак однородности.
В однородной смеси состав смеси в любой
точке одинаков. Поэтому для получения раствора
нужно тщательно перемешать образующие его
компоненты (вещества).
Растворы могут иметь разное агрегатное
состояние:
• газообразные растворы (например, воздух –
смесь газов О2, N2, СО2, Аr);• жидкие растворы (например, одеколон, сироп,
рассол);• твердые растворы (например, сплавы).
Одно из веществ, которые образуют раствор,
называется растворителем. Растворитель
имеет то же агрегатное состояние, что и
раствор. Так, для жидких растворов – это
жидкость: вода, масло, бензин и т.д. Чаще всего на
практике применяются водные растворы. О них и
пойдет речь далее (если не будет сделана
соответствующая оговорка).
Что происходит при растворении различных
веществ в воде? Почему одни вещества хорошо
растворяются в воде, а другие – плохо? От чего
зависит растворимость – способность вещества
растворяться в воде?
Представим себе, что в стакан с теплой водой
положили кусочек сахара. Полежал он, уменьшился в
размерах и… исчез. Куда? Неужели нарушается
закон сохранения вещества (его массы, энергии)?
Нет. Сделайте глоток полученного раствора,
и вы убедитесь, что вода сладкая, сахар не
исчез. Но почему его не видно?
Дело в том, что в ходе растворения происходит
дробление (измельчение) вещества. В данном
случае кусочек сахара распался на молекулы, а их
мы видеть не можем. Да, но почему сахар, лежащий на
столе, не распадается на молекулы? Почему кусочек
маргарина, опущенный в воду, тоже никуда не
исчезает? А потому, что дробление
растворяемого вещества происходит под действием
растворителя, например воды. Но растворитель
сможет «растащить» кристалл, твердое вещество на
молекулы, если сумеет «уцепиться» за эти частицы.
Другими словами, при растворении вещества должно
быть взаимодействие между веществом и
растворителем.
Когда возможно такое взаимодействие? Только в
том случае, когда строение веществ (и
растворяемого, и растворителя) похоже, подобно.
Издавна известно правило алхимиков: «подобное
растворяется в подобном». В наших примерах
молекулы сахара полярны и между ними и полярными
молекулами воды существуют определенные силы
взаимодействия. Такие силы отсутствуют между
неполярными молекулами жира и полярными
молекулами воды. Поэтому жиры в воде не
растворяются. Таким образом, растворимость
зависит от природы растворяемого вещества и
растворителя.
В результате взаимодействия между
растворяемым веществом и водой образуются
соединения – гидраты. Это могут быть очень
прочные соединения:
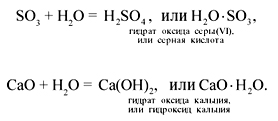
Такие соединения существуют как
индивидуальные вещества: основания,
кислородсодержащие кислоты. Естественно, при
образовании этих соединений возникают прочные
химические связи, выделяется теплота. Так при
растворении СаО (негашеная известь) в воде
выделяется так много теплоты, что смесь закипает.
Но почему при растворении сахара или соли в
воде полученный раствор не нагревается?
Во-первых, далеко не все гидраты так прочны, как
серная кислота или гидроксид кальция. Существуют
гидраты солей (кристаллогидраты), которые
легко разлагаются при нагревании:
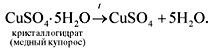
Во-вторых, при растворении, как уже упоминалось,
идет процесс дробления. А на это затрачивается
энергия, поглощается теплота.
Поскольку оба процесса происходят
одновременно, раствор может нагреваться или
охлаждаться, в зависимости от того, какой процесс
преобладает.
Задание 5.1. Определите, какой процесс –
дробление или гидратация – преобладает в каждом
случае:
а) при растворении серной кислоты в воде,
если раствор нагрелся;б) при растворении нитрата аммония в воде,
если раствор охладился;в) при растворении поваренной соли в воде,
если температура раствора практически не
изменилась.
Поскольку при растворении изменяется
температура раствора, естественно предположить,
что растворимость зависит от температуры.
Действительно, растворимость большинства
твердых веществ увеличивается при нагревании.
Растворимость газов при нагревании уменьшается.
Поэтому твердые вещества обычно растворяют в
теплой или горячей воде, а газированные напитки
хранят на холоде.
Растворимость (способность растворяться)
веществ не зависит от измельчения вещества или
интенсивности перемешивания. Но, повышая
температуру, измельчая вещество, перемешивая
готовый раствор, можно ускорить процесс
растворения. Изменяя условия получения раствора,
можно получать растворы разных составов.
Естественно, существует предел, достигнув
который, легко обнаружить, что вещество больше не
растворяется в воде. Такой раствор называется насыщенным.
Для хорошо растворимых веществ насыщенный
раствор будет содержать много растворенного
вещества. Так, насыщенный раствор KNO3 при 100
°С содержит 245 г соли на 100 г воды (в 345 г раствора),
это концентрированный раствор. Насыщенные
растворы плохо растворимых веществ содержат
ничтожные массы растворенных соединений. Так,
насыщенный раствор хлорида серебра содержит 0,15
мг AgCl в 100 г воды. Это очень разбавленный
раствор.
Таким образом, если раствор содержит много
растворенного вещества по отношению к
растворителю, он называется концентрированным,
если вещества мало – разбавленным. Очень часто
от состава раствора зависят его свойства, а
значит, и применение.
Так, разбавленный раствор уксусной кислоты
(столовый уксус) используют как вкусовую
приправу, а концентрированный раствор этой
кислоты (уксусная эссенция при приеме внутрь)
может вызвать смертельный ожог.
Для того чтобы отразить количественный состав
растворов, используют величину, называемую массовой
долей растворенного вещества ![]() :
:
![]()
где m(в-ва) – масса растворенного вещества в
растворе; m(р-ра) – общая масса раствора,
содержащая растворенное вещество и
растворитель.
Так, если 100 г уксуса содержат 6 г уксусной
кислоты, то речь идет о 6%-м растворе уксусной
кислоты (это столовый уксус). Способы решения
задач с использованием понятия массовой доли
растворенного вещества будут рассмотрены в
главе 8.
Выводы по главе 5. Растворы – это однородные
смеси, состоящие не менее чем из двух веществ,
одно их которых называется растворитель, другое
– растворенное вещество. При растворении
происходит взаимодействие этого вещества с
растворителем, благодаря чему растворяемое
вещество измельчается. Состав раствора выражают
при помощи массовой доли растворенного вещества
в растворе.
* Эти электронные пары
возникают в месте пересечения электронных
облаков.
Продолжение следует
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,896 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
S2
Электронная формула серы 1s22s22p63s23p4
На внешнем энергетическом уровне у серы 6 электронов, из которых 2 неспаренных на p-орбиталях:

До устойчивой электронной конфигурации сере не хватает двух электронов, поэтому между двумя атомами серы образуется две общие пары электронов (двойная связь):

Структурная формула: S=S
Такая связь является ковалентной неполярной.
K2O
Калий – это элемент IA группы 4-го периода с одним электроном на внешнем энергетическом уровне. Ему проще всего отдать электрон, чем принимать чужие.
Кислород – это элемент VIA группы 2-го периода с шестью электронами на внешнем энергетическом уровне. Для завершения уровня ему не хватает всего 2 электрона. Поэтому кислород – активный неметалл с высокой окислительной способностью.
Схема образования ионной связи:

H2S
Электронная формула водорода 1s1 и, казалось бы, ему легко отдать электрон. Однако не будем забывать, что водород находится в первом периоде, где всего 1 энергетический уровень, способный принять лишь 2 электрона. Таким образом, до завершения энергетического уровня водороду не хватает также одного электрона. Это объясняет высокую электроотрицательность водорода (ОЭО = 2,1) по сравнению с щелочными металлами. Тем не менее ОЭО серы выше (2,58) поэтому связь будет ковалентно полярная.
Электронная формула серы 1s22s22p63s23p4
Сере до завершения энергетического уровня не хватает двух электронов, поэтому она соединяется с двумя атомами водорода:

Структурная формула H-S-H, связь ковалентная полярная.
N2
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Между атомами азота образуется три общие электронные пары (тройная связь):

Эта связь ковалентная неполярная.
Li3N
Литий – это элемент IA группы 2-го периода с одним электроном на внешнем энергетическом уровне. Относительно легко отдаёт электрон.
Электронная формула лития 1s22s1
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Схема образования ионной связи:

Cl3N
Хлор имеет семь электронов на внешнем энергетическом уровне и до устойчивой электронной конфигурации ему не хватает всего одного электрона.
Электронная формула 1s22s22p63s23p7
У азота на внешнем энергетическом уровне 5 электронов и до устойчивой электронной конфигурации ему не хватает трёх электронов.
Электронная формула азота 1s22s22p3
Относительная электроотрицательность хлора 2,83, азота 3,07 поэтому связь будет ковалентная полярная.
Схема образования связи:

Лабораторный опыт №4
1. У атомов водорода и фосфора почти одинаковые значения ЭО. Каков тип химической связи в молекуле фосфина PH3?
3. В какой из молекул – хлороводорода HCl или фтороводорода HF – ковалентная химическая связь более полярна?
4. В следующих предложениях впишите пропущенные слова и выражения: «Ковалентная химическая связь образуется за счёт … . По числу общих электронных пар она бывает … . По ЭО ковалентную связь делят на … и … ».
5. Определите валентности элементов в соединениях с формулами: PbS, PbO2, FeS2, Fe2S3, SF6.
6. Запишите формулы хлоридов – соединений элементов с одновалентным хлором: железа (III), меди (I), меди (II), марганца (IV), фосфора (V).
