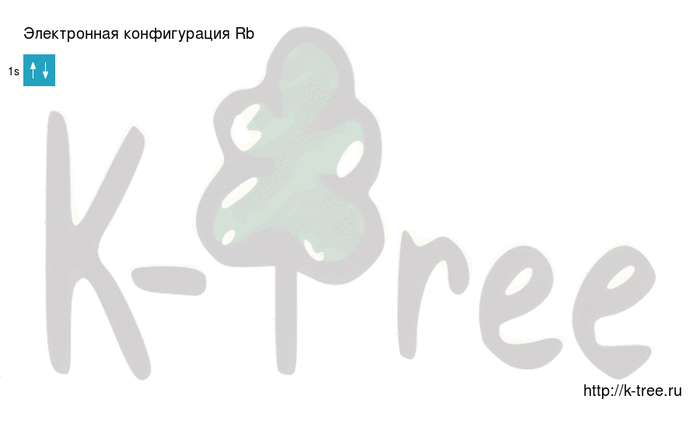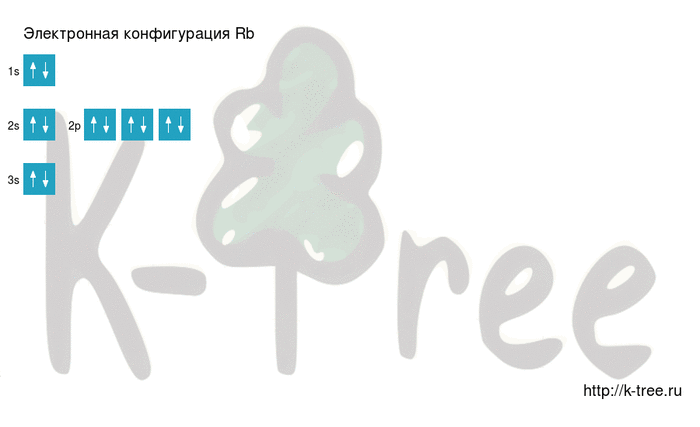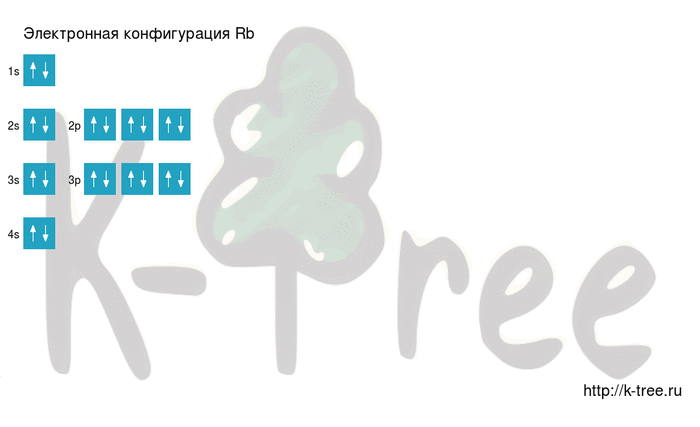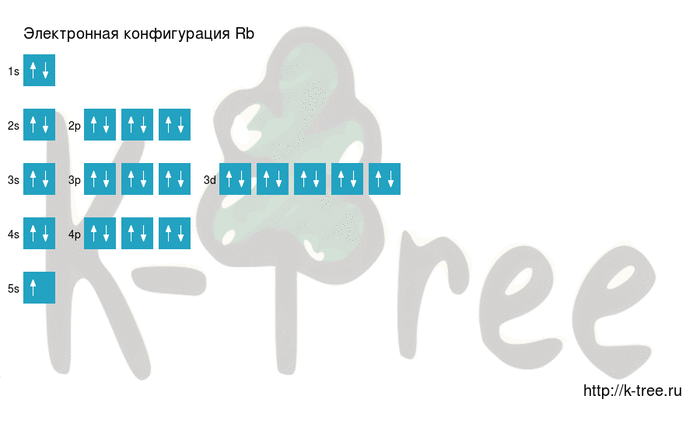Электронное строение атома рубидия
Электронное строение нейтрального атома рубидия в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме рубидия.
Rb
+37
2
8
18
8
1
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме рубидия.
| 5 | ↑ | |||||||||||
| 4 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 1 | ↑↓ | |||||||||||
| s | p | d |
Валентные орбитали атома рубидия выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома рубидия.
37Rb 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s1
Сокращённая электронная конфигурация атома рубидия.
37Rb [Kr] 5s1
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома рубидия.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 5s | 5 | 0 | 0 | +½ |
Rb (рубидий) – элемент с прядковым номером 37 в периодической системе.
Находится в V периоде. Температура плавления: 39 ℃. Плотность: 1.53 г/см3.
Электронная формула атома рубидия в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Электронная формула атома рубидия в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s1
Сокращенная электронная конфигурация Rb:
[Kr] 5s1
Ниже приведена электронно-графическая схема атома рубидия
Распределение электронов по энергетическим уровням в атоме Rb
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 18
4-й уровень (N): 8
5-й уровень (O): 1
Валентные электроны рубидия
Количество валентных электронов в атоме рубидия – 1.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 5 | 0 | 0 | +1/2 |
Степени окисления, которые может проявлять рубидий: +1
Рубидий в таблице менделеева занимает 37 место, в 5 периоде.
| Символ | Rb |
| Номер | 37 |
| Атомный вес | 85.4678000 |
| Латинское название | Rubidium |
| Русское название | Рубидий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема рубидия
Rb: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1
Короткая запись:
Rb: [Kr]5s1
Одинаковую электронную конфигурацию имеют
атом рубидия и
Y+2, Zr+3, Tc+6
Порядок заполнения оболочек атома рубидия (Rb) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Рубидий имеет 37 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
1 электрон на 5s-подуровне
Степень окисления рубидия
Атомы рубидия в соединениях имеют степени окисления 1, -1.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы рубидия
Валентность Rb
Атомы рубидия в соединениях проявляют валентность I.
Валентность рубидия характеризует способность атома Rb к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Rb
Квантовые числа определяются последним электроном в конфигурации,
для атома Rb эти числа имеют значение N = 5, L = 0, Ml = 0, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Rb:
Eo = 403 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Rb в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,658 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,962 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Содержание
- Рубидий, свойства атома, химические и физические свойства
- Рубидий, свойства атома, химические и физические свойства.
- Атом и молекула рубидия. Формула рубидия. Строение атома рубидия:
- Изотопы и модификации рубидия:
- Свойства рубидия (таблица): температура, плотность, давление и пр.:
- Рубидий Rb
- Электронная схема рубидия
- Степень окисления рубидия
- Ионы рубидия
- Валентность Rb
- Квантовые числа Rb
- Энергия ионизации
Рубидий, свойства атома, химические и физические свойства
Рубидий, свойства атома, химические и физические свойства.
85,4678(3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1
Рубидий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 37. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), пятом периоде периодической системы.
Физические свойства рубидия
Атом и молекула рубидия. Формула рубидия. Строение атома рубидия:
Рубидий (лат. Rubidium, от лат. rubidus – «красный», «тёмно-красный») – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Rb и атомным номером 37. Расположен в 1-й группе (по старой классификации – главной подгруппе первой группы), пятом периоде периодической системы.
Рубидий – щелочной металл. Относится к группе легких металлов.
Рубидий обозначается символом Rb.
Как простое вещество рубидий при нормальных условиях представляет собой мягкий, легкоплавкий, щелочной металл серебристо-белого цвета.
Молекула рубидия одноатомна.
Химическая формула рубидия Rb.
Электронная конфигурация атома рубидия 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1 . Потенциал ионизации (первый электрон) атома рубидия равен 403,03 кДж/моль (4,1771280(12) эВ).
Строение атома рубидия. Атом рубидия состоит из положительно заряженного ядра (+37), вокруг которого по пяти оболочкам движутся 37 электронов. При этом 36 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку рубидий расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью. Вторая и четвертая – внутренние оболочки представлены s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома рубидия на 5s-орбитали находится один неспаренный электрон. В свою очередь ядро атома рубидия состоит из 37 протонов и 48 нейтронов. Рубидий относится к элементам s-семейства.
Радиус атома рубидия (вычисленный) составляет 265 пм.
Атомная масса атома рубидия составляет 85,4678(3) а. е. м.
Рубидий является первым щелочным металлом в группе, плотность которого выше, чем у воды, поэтому он тонет, в отличие от металлов над ним в группе.
Изотопы и модификации рубидия:
Свойства рубидия (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Рубидий |
| 102 | Прежнее название | |
| 103 | Латинское название | Rubidium |
| 104 | Английское название | Rubidium |
| 105 | Символ | Rb |
| 106 | Атомный номер (номер в таблице) | 37 |
| 107 | Тип | Металл |
| 108 | Группа | Лёгкий, щелочной металл |
| 109 | Открыт | Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф, Германия, 1861 г. |
| 110 | Год открытия | 1861 г. |
| 111 | Внешний вид и пр. | Мягкий, серебристо-белый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | 85 Rb, 87 Rb |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,006 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000012 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 1,0·10 -6 % |
| 122 | Содержание в Солнце (по массе) | 3,0·10 -6 % |
| 123 | Содержание в метеоритах (по массе) | 0,00032 % |
| 124 | Содержание в организме человека (по массе) | 0,00046 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 85,4678(3) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1 |
| 203 | Электронная оболочка | K2 L8 M18 N8 O1 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 265 пм |
| 205 | Эмпирический радиус атома* | 235 пм |
| 206 | Ковалентный радиус* | 220 пм |
| 207 | Радиус иона (кристаллический) | Rb +
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 303 пм |
| 209 | Электроны, Протоны, Нейтроны | 37 электронов, 37 протонов, 48 нейтронов |
| 210 | Семейство (блок) | элемент s-семейства |
| 211 | Период в периодической таблице | 5 |
| 212 | Группа в периодической таблице | 1-ая группа (по старой классификации – главная подгруппа 1-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | -1, 0, +1 |
| 302 | Валентность | I |
| 303 | Электроотрицательность | 0,82 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 403,03 кДж/моль (4,1771280(12) эВ) |
| 305 | Электродный потенциал | Rb + + e – → Rb, E o = -2,925 В |
| 306 | Энергия сродства атома к электрону | 46,884(3) кДж/моль (0,485916(21) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность | 1,532 г/см 3 (при 0 °C/20 °C и иных стандартных условиях , состояние вещества – твердое тело),
1,475 г/см 3 (при 39 °C и иных стандартных условиях , состояние вещества – твердое тело), |
| 402 | Температура плавления* | 39,30 °C (312,45 K, 102,74 °F) |
| 403 | Температура кипения* | 688 °C (961 K, 1270 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 2,19 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 69 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,36 Дж/г·K (при 25 °C), 0,379 Дж/г·K (при 50 °C) |
| 410 | Молярная теплоёмкость* | 31,060 Дж/(K·моль) |
| 411 | Молярный объём | 55,78838 см³/моль |
| 412 | Теплопроводность | 58,2 Вт/(м·К) (при стандартных условиях ),
58,2 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 5,710 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 56 К |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-17-7 |
205* Эмпирический радиус атома рубидия согласно [1] и [3] составляет 248 пм.
206* Ковалентный радиус рубидия согласно [1] и [3] составляет 220±9 пм и 216 пм соответственно.
402* Температура плавления рубидия согласно [3] составляет 39,05 °С (312,2 K, 102,29 °F).
403* Температура кипения рубидия согласно [4] составляет 690 °С (963,15 K, 1274 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) рубидия согласно [3] и [4] составляет 2,20 кДж/моль и 2,18 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) рубидия согласно [3] и [4] составляет 75,8 кДж/моль и 75,77 кДж/моль соответственно.
410* Молярная теплоёмкость рубидия согласно [3] составляет 31,1 Дж/(K·моль).
Источник
Рубидий Rb
Рубидий в таблице менделеева занимает 37 место, в 5 периоде.
| Символ | Rb |
| Номер | 37 |
| Атомный вес | 85.4678000 |
| Латинское название | Rubidium |
| Русское название | Рубидий |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема рубидия
Rb: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 1
Одинаковую электронную конфигурацию имеют атом рубидия и Y +2 , Zr +3 , Tc +6
Порядок заполнения оболочек атома рубидия (Rb) электронами: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ — до 6, на ‘d’ — до 10 и на ‘f’ до 14
Рубидий имеет 37 электронов, заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
1 электрон на 5s-подуровне
Степень окисления рубидия
Атомы рубидия в соединениях имеют степени окисления 1, -1.
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Ионы рубидия
Валентность Rb
Атомы рубидия в соединениях проявляют валентность I.
Валентность рубидия характеризует способность атома Rb к образованию хмических связей. Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Rb
Квантовые числа определяются последним электроном в конфигурации, для атома Rb эти числа имеют значение N = 5, L = 0, Ml = 0, Ms = ½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома — тем больше энергии необходимо, что бы его оторвать. Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo. Если не указано иное, то энергия ионизации — это энергия отрыва первого электрона, также существуют энергии ионизации для каждого последующего электрона.
Перейти к другим элементам таблицы менделеева
Источник