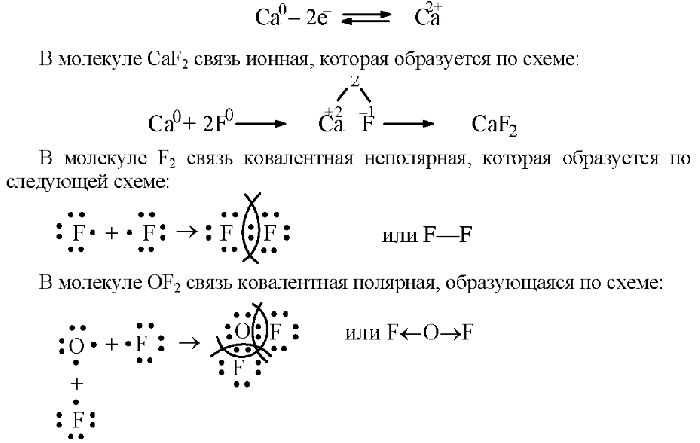
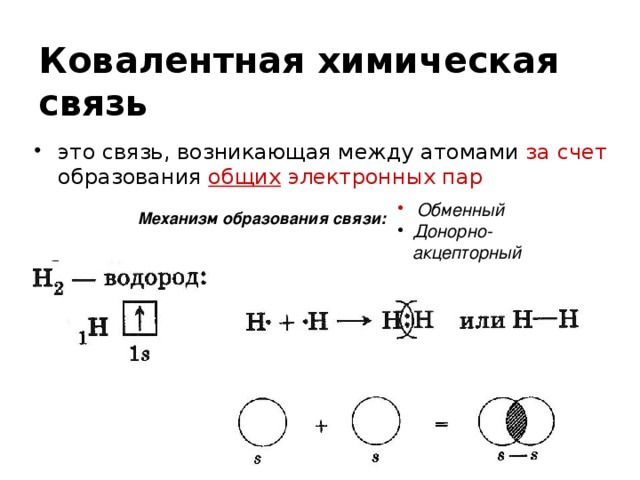
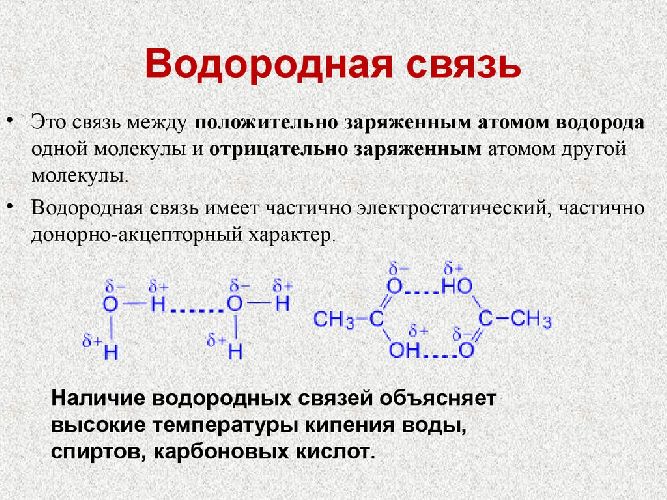
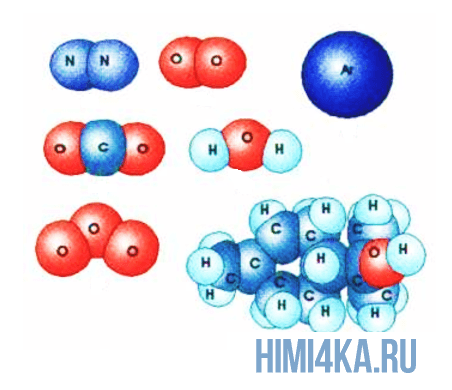
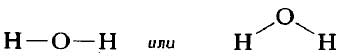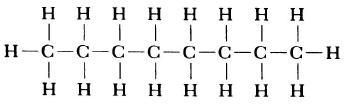План урока:
Ковалентная связь
Ионная связь
Металлическая связь
Водородная связь
Типы кристаллических решёток
Словно компоненты конструктора, атомы соединяются между собой. И как бы, Вы не старались, но с единичным блоком можно соединить, только один блок. Деталь на 4 ячейки, может удержать не больше четырёх. Этот принцип сохраняется и в химии. За количество свободных ячеек отвечает валентность атомов элементов.
Результатом взаимодействия атомов является получение веществ. Виды химической связи атомов зависят от природы составляющих элементов.
Металлы отличаются малым количеством электронов на внешнем уровне сравнительно с неметаллами более низким значением электроотрицательности. Теперь наша задача вспомнить, как происходит изменение ЭО в таблице Менделеева или воспользоваться таблицей «Относительная электроотрицательность». Чем активнее неметалл, тем она выше и это говорит о том, что этот элемент, при образовании связи, будет забирать электроны.

Веществ насчитывается миллионы. Это могут быть простые вещества: металлы железо Fe, золото Au, ртуть Hg; неметаллы сера S, фосфор Р, азот N2. Так и сложные вещества: H2S, Ca3(PO4)2, (C6H10O5)n, молекулы белков и т.д.Комбинация элементов, входящих в состав веществ, определяет какие типы связей будут существовать между ними.
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
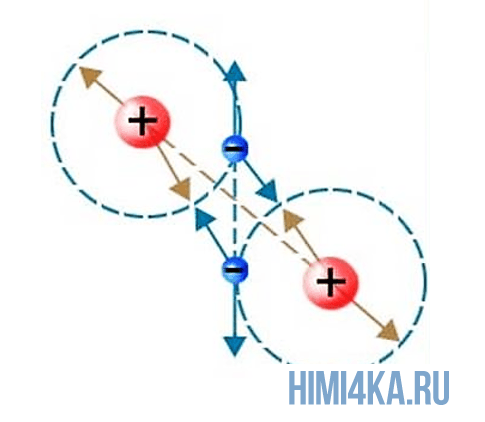
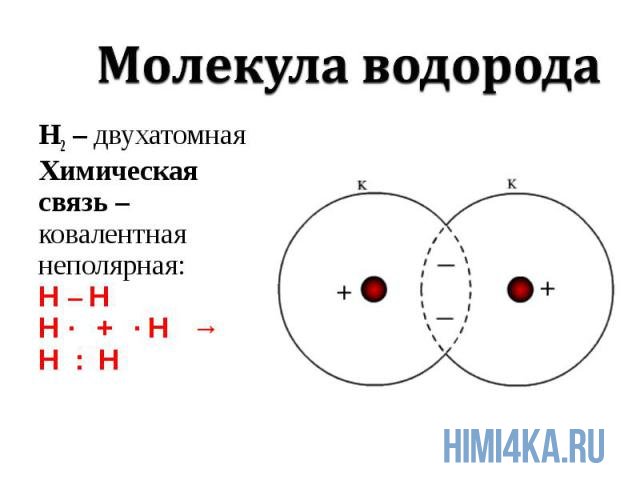
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:
Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
Источник
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.
Таким образом, азот трёхвалентен, а степень
окисления по-прежнему остаётся равна 0. За счёт общей электронной пары азот завершает внешний слой 2s22p6.
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Н 1s1
Cl 3s2 3p5
Проанализировав значения, Э(Н) < Э(Cl), приходим к выводу, чтобы принять конфигурацию благородного газа, хлор будет притягивать на себя единственный электрон водорода.
Схема ковалентной связи, образованной разными элементами, записывается в таком виде.
Столь важно отметить, что в этой ситуации Cl и Н не будут равноправными партнёрами, поскольку общая плотность электронов сосредоточена у Cl. Водород в неравном бою, уступает 1 электрон хлору, у которого в наличии их целых 7. Водород приобретает положительный заряд, хлор – отрицательный. Валентности Н и Cl равны I.В то время степени окисления будут Н+Cl−.
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) <ЭО (С) <ЭО(O). Определим степени окисления каждого элемента. Н+2С+4О−23. Это означает, что кислород будет притягивать на себя электроны углерода и водорода. Схематически это можно записать в следующем виде.
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2+С+4О3−2 (+1 ∙ 2) + (+4 ∙ 1) + (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
H 1s1
N 2s2 2p3
Из 5 электронов, находящиеся в распоряжении атома N, связываются только 3. Валентность атома N приобретает значение III. При этом степень окисления N−3 (оттянув на себя 3 электрона от каждого атома Н, становится отрицательным), водород, наоборот совершив «благородный поступок», отдав электрон, приобретает положительный заряд Н+. Два электрона никак не задействованы, они выделены красным цветом. Они способны поселиться в свободной ячейке иона Н+. Это место займут электроны азота, которые обозначены красным цветом. Образуется катион аммония по донорно-акцепторному механизму.
Незадействованные до этого «красные» электроны N «заселяются» в пустой s-орбитали, принадлежащей катиону водорода. Ион аммония имеет 3 связи, которые происходят по обменному механизму, а также одну, по донорно-акцепторному. Именно поэтому NH3 легко взаимодействует с кислотами и водой.
Ионная связь
Ионная химическая связь является пограничной ковалентной полярной. Отличаются тем, что для веществ, в которых локализуется ковалентная связь, характерно существование совместной электронной пары, тогда как для ионной связи свойственна полная отдача электронов. Следствием отдачи является образование заряженных частиц – ионов.
Определить тип связи помогут вычисления. Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь. Если значение меньше 1,7, то свойственная полярная связь. Рассмотрим два вещества NaCl и СаС2. Оба они образованы металлом (Na и Са) и неметаллом (Clи С). Однако в одном случае связь будет ионная, во втором – ковалентная полярная.
Постулат физики гласит, что противоположности притягиваются. Т.е. положительные ионы притягивают отрицательные и наоборот.
Допустим, что необходимо получить вещество с атомов калия и фтора. Каждый атом стремится заполучить конфигурацию благородного газа. Достигнуть этого возможно двумя способами отдав или приняв электроны, образуя при этом ионы с желаемой конфигурацией.
Атому калия гораздо проще отдать 1 электрон, чем забрать у фтора 7. Принимая 1 электрон, F имеет завершённый уровень.
Аналогично калий, который с лёгкостью отдал свой электрон, его катион принял электронную формулу аргона.
Кальций двухвалентный металл, то для взаимодействия необходимо два атома фтора, поскольку он способен принять только один электрон. Схема образования ионной связи имеет вид.
Данный вид связи локализуется во всех солях, между металлом и кислотным остатком. В выше приведённом примере для угольной кислоты, кислотным остатком будет СО32−, если вместо водорода поставить атомы натрия, то схема образования связи имеет вид.
Следует отметить, что ионная связь будет существовать между Naи О, а между С и О ковалентная полярная.
Металлическая связь
Металлы существуют в разных цветах: чёрные (железо), красные (медь), жёлтые (золото), серые (серебро), плавятся при разных температурах. Однако их всех объединяет наличие блеска, твёрдости, электропроводимости.
Металлическая связь имеет черты сходства с ковалентной неполярной. Металлы бедны электронами на внешнем уровне, поэтому при образовании связи, они не способны притягивать на себя их, для них свойственна отдача. Так как атомный радиус в металлах большой, это даёт возможность легко оторваться электронам, образовав катионы.
Me0 – ne = Men+
Электроны постоянно перемещаются от атома к иону и наоборот. Сами катионы можно сравнить с айсбергами, окружёнными отрицательными частицами.
Схема металлической связи
Источник
Водородная связь
Элементы-неметаллы II периода (N, O, F) обладают высоким значением электроотрицательности. Это влияет на способность образования водородной связи между поляризованным Н+ одной молекулы и анионом N3-, O-2, F–. Водородная связь способна объединить две разные молекулы. К примеру, если взять две молекулы воды, то они соединяются между собой за счёт атомов Н и О.
Водородная химическая связь изображена …… пунктиром. Соединяясь между собою молекулы, играют и находят важную роль в живых организмах. С помощью водородной связи строится вторичная структура молекулы ДНК.
Источник
Типы кристаллических решёток
Чтобы получить вещество, а не просто набор молекул, необходимо частицы «запаковать» в своеобразный каркас – кристаллическую решётку.
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие. Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
Ковалентная полярная химическая связь также характерна для молекулярных соединений. Сюда входят как органические: сахароза, спирты, метан так и неорганические соединения: кислоты, аммиак, оксиды неметаллов. Существование их бывает как в жидком (Н2О), твёрдом (сера) так и газообразном виде (СО2).
Источник
В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.
Источник
Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.
Источник
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
Источник
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.
Итак, из вышесказанного сделаем вывод.
Перед началом данной статьи хочу напомнить, что все материалы по химии, написанные мной, можно найти в данном каталоге.
Итак, я давно заметил, что для многих учащихся химии, понятие химической связи является чем-то непостижимым, ну а её виды и как научиться их различать – за гранью возможности понимания. Давайте по порядку.
Что такое химическая связь?
Это связь между атомами (химически неделимыми частицами), которая обуславливает целостность молекулы. То есть, возьмём какую-нибудь молекулу.
В ней есть атомы углерода, водорода и кислорода. Чёрточки на схеме показывают химические связи. Именно благодаря им атомы держат такую вот целостную структуру молекулы.
Это максимально упрощённое объяснение. Полное даётся в курсе квантовой химии. У кого есть желание – можете почитать. Моя же задача сделать это коротко и понятно, поэтому едем дальше.
Виды химической связи:
Существует всего 6 видов химической связи. Я объясню вам логику каждой из них и, на практических примерах, покажу где и почему это работает именно так.
Металлическая связь:
Металлическая связь, если совсем кратко, характеризуется наличием кристаллической решётки. Этот тип связи характерен для каждого металла. Ну а что есть металл? Вспоминаем школьный лайфхак:
Берём таблицу Менделеева, проводим диагональ от бора к астату, и всё, что ниже – это металлы. И да, в седьмом периоде только металлы. Все лантаноиды и актиноиды – тоже металлы.
Безусловно, металлическая связь делится ещё на подвиды. Тетрагональная, ромбоэдрическая и так далее. Но в школе такое не спрашивают, а студенты химических ВУЗов и без меня знают. Кому это надо будет – может дополнительно погуглить, или спросить в комментариях, тут я задерживаться не буду. Запомнили: вижу строго металл – связь металлическая.
Ковалентная связь:
А вот тут у всех возникает геморрой. Мало определить ковалентную связь. Она ж ещё бывает полярная и неполярная. Давайте разберёмся.
Начну с неполярной, потому что объяснить её проще некуда. У нас есть 2 атома неметалла, которые соединены между собой.
Скажем, хлорин, он же Cl2. Как и О2, F2 и другие молекулы, в которых связаны 2 одноимённых атома неметалла – это ковалентная неполярная.
Полярная же связь возникает у атомов с разной электроотрицательностью. И вот тут надо пояснить, что ковалентные связи возникают только среди неметаллов.
Перед вами молекула серной кислоты. В ней нет ни одной связи между одноимёнными неметаллами. При этом в серной кислоте металлов, всё-таки, нет. Вот вам самый явный пример ковалентной полярной связи. Конечно, тут ещё надо бы упомянуть про донорно-акцепторный механизм. Но это я оставлю на следующий раз.
Ионная связь:
Во-первых, ионная связь, по-научному, это связь элементов с большой разницей электроотрицательности. Большой считается разница более 1,7. Определяется по шкале Полинга. Она охватывает значения от 0,7 для франция, до 4,0 для фтора. Хотя, в апреле этого года были исследования, и есть вероятность, что скоро эта информация станет неактуальной. Ну, когда станет, тогда подредактирую)
Говоря же о школьных знаниях, то вполне достаточно запомнить: металл + неметалл = ионная связь. (И ещё амины с амидами: ЕГЭ очень любит на такое ловить).
Для примера возьмём сульфид алюминия. Алюминий – металл, сера…
Итого: ионная связь.
Водородная связь:
Строго говоря, водородная связь – это подвид ковалентной полярной связи. Ну, либо неполярной в молекуле H2. Выделение данного вида обусловлено ещё и тем, что водородная связь, помимо внутримолекулярной, может быть и межмолекулярной.
На данной диаграмме вы видите, что молекулы воды соединяются с помощью именно водородных связей. С внутримолекулярной всё малость сложнее. Тут нужно чтобы водород и электроотрицательный атом находились близко друг к другу, как в этих белках на схеме. Ну, либо варианты попроще.
2-гидробензальальдегид, этиленгликоль, дигидроксибензол и 2-аминофенол. Такие вещи уже больше относятся к органике и понять их можно только нарисовав структурную схему вещества. Понятное дело, что прочность такой связи очень мала, и в школьном курсе она почти ничего не решает. Но… Чем глубже в органику – тем важнее её эффект.
Ну и остались 2 типа связи, которые и в школе не проходят, да и в институте не сказать что. Поэтому объединю их в один раздел, просто для общего развития:
Силы Ван-дер-Ваальса и Двухэлектронная трёхцентровая связь:
Тут уже рил тёмный лес для обывателя. Силы Ван-дер-Ваальса объясняют возникновение дипольных моментов при поляризации атомов химического вещества. Где вам это понадобится в школе? Я более чем уверен, что нигде. Однако, забавный факт:
Именно благодаря силам Ван-дер-Ваальса, химическое вещество, выделяемое присосками геккона, позволяет ему карабкаться по стеклу. Объяснить, что там происходит, в двух словах, невозможно. А долгое разглагольствование – не наш сегодняшний формат – так что ловите ссылку.
Двухэлектронная трёхцентровая связь – это вообще вспомогательный тип. Появился он из-за того, что долгое время не могли понять: как трёхвалентный бор может образовать диборан? История об этом в данной статье.
Собственно, это всё. Можете задавать вопросы в комментариях, с радостью на них отвечу.
Записаться ко мне на бесплатное пробное занятие можно здесь. Либо написав мне на почту repetitorgns@yandex.ru .
Ну а так лайки и подписки приветствуются – до скорых встреч.
Схемы образования химических элементов

4.6
Средняя оценка: 4.6
Всего получено оценок: 300.
4.6
Средняя оценка: 4.6
Всего получено оценок: 300.
В настоящее время открыто 118 химических элементов. Все они способны образовывать химические вещества с помощью химических связей. Что такое химический элемент, и с помощью каких связей образуются новые вещества?
Что такое химический элемент?
Определенный вид атомов называют химическим элементом. В настоящее время известно 118 химических элементов. Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, водород обозначают латинской буквой H – первой буквой латинского названия этого элемента Hydrogenium.
Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в Периодической системе, где все они расположены в определенном порядке.
Главным свойством атома, относящим его к определенному элементу, является заряд ядра
Химические связи
Образование химических веществ происходит с помощью химических связей. Химической связью называют силы, удерживающие атомы в молекулах или кристаллах. Эти силы носят электростатический характер, ядра связанных атомов притягиваются вследствие наличия области повышенной электронной плотности между ними.
Увеличение электронной плотности происходит вследствие перекрывания электронных орбиталей в области связывания, так как расстояние между ядрами связанных атомов меньше, чем сумма радиусов атомов. Межъядерное расстояние принимают за длину химической связи. Образование связи происходит только в том случае, если этот процесс энергетически выгоден, поэтому образование связи всегда сопровождается выделением энергии.
Энергия химической связи – это то значение энергии (в кДж/моль), которое необходимо затратить для разрыва связи и которое выделяется при ее образовании.
При образовании связей, как правило, достраивается октет (восемь) электронов для связанных атомов, то есть их внешняя электронная оболочка становится завершенный, что и придает стабильность молекуле или кристаллу и делает эту систему равновесной.
Схемы образования химических элементов бывают атомные или ковалентные (полярные и неполярные), ионные, металлические, водородные:
- ковалентная химическая связь – это связь, осуществляемая за счет образования общих электронных пар. Неполярная ковалентная связь образуется между атомами с одинаковой электроотрицательностью. полярная ковалентная связь образуется между атомами, электроотрицательности которых незначительно отличаются.
- ионная связь – химическая связь, возникающая между ионами в результате действия электростатических сил притяжения
- металлическая связь – характерна для элементов, атомы которых на внешнем уровне имеют мало валентных электронов, слабо удерживающихся в атоме, и большое количество энергетически близких свободных орбиталей.
- водородная связь – слабая связь физической природы, которая образуется между молекулами, содержащими электроотрицательные атомы (кислород О, азот N), которые имеют неподеленную электронную пару, и молекулами, в которых атом водорода имеет небольшой положительный заряд.
Что мы узнали?
Химический элемент – вид атомов с одинаковым положительным зарядом ядра. Химические вещества образуются из элементов, которые вступают в химические связи. Эти связи могут быть ковалентными, водородными, ионными, металлическими.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
5/5
-
Gulchekhra Suyundukova
5/5
-
Александр Котков
5/5
-
Александр Котков
5/5
-
Лидия Маслова
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 300.
А какая ваша оценка?
В уроке 3 «Схема образования молекул» из курса «Химия для чайников» выясним из чего состоят молекулы и как образуется ковалентная химическая связь; кроме того рассмотрим структурную и молекулярную формулы молекулы; научимся вычислять относительную молекулярную массу веществ. Настоятельно рекомендую перед тем, как приступить к прочтению данного урока, внимательно изучить предыдущие, так как они содержат необходимые основы химии для начинающих и буду весьма полезны в изучении курса. Напомню, что в прошлом уроке мы обсуждали изотопы элементов.
Содержание
- Молекулы состоят из атомов
- Связь атомов в молекулах
- Ковалентная химическая связь
- Молекулярная и структурная формула
- Относительная молекулярная масса вещества
Молекулы состоят из атомов
Здесь все просто и понятно: все вещества во вселенной состоят из молекул, в свою очередь молекулы состоят из атомов, а атомы состоят из положительно заряженного ядра и электронных оболочек, на которых расположены отрицательно заряженные электроны.
Представьте, что два атома достаточно сблизились друг с другом. В таком случае электроны на внешней оболочке одного атома начинают взаимодействовать с внешними электронами другого. Подобное взаимодействие внешних электронов и образует молекулы, так как оно способно удерживать взаимодействующие атомы вместе, притягивая их друг к другу.
Связь атомов в молекулах
Как было сказано выше, образование молекул происходит из-за внешних электронов взаимодействующих атомов, так как они создают силы притяжения между ними. Когда образуются данные силы притяжения происходит образование химической связи. В природе существует несколько видов химической связи атомов в молекулах, но пока рассмотрим простейший из них.
Ковалентная химическая связь
Химическая связь, возникающая при обобществлении внешних электронов взаимодействующих атомов, называется ковалентной химической связью. Обобществленные электроны называются электронной парой. Объяснение ковалентной химической связи простыми словами: два атома положили в общую копилку по монетке (электрону) и схватились за нее «руками», причем оба атома не хотят отдавать копилку друг другу, поэтому так и продолжают держаться за нее.
Ковалентная химическая связь подразделяется на два вида: неполярную и полярную. В этом уроке рассмотрим ковалентную неполярную химическую связь, которая возникает, когда в состав молекулы входят два абсолютно одинаковых атома неметалла, потому как одинаковые атомы владеют электронной парой в равной степени. А «Неполярная» — означает что заряд атомов не изменился, после образовании ковалентной связи. Приведем примеры молекул, образованных ковалентной неполярной химической связью: H2, O2, N2, Cl2. В редких случаях ковалентная химическая связь может образовываться между атомами разных неметаллов, но подробнее об этом в следующем уроке, где мы изучим электроотрицательность, и вам станет понятнее механизм образования химических связей атомов в молекулах.
Молекулярная и структурная формула
Графическое изображение структуры молекулы называется структурной формулой. Обычно ковалентная химическая связь в структурных формулах молекул изображается прямой линией, которая соединяет связанные атомы.
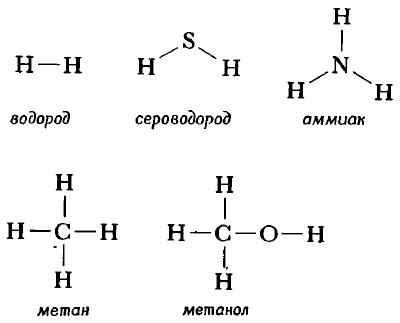
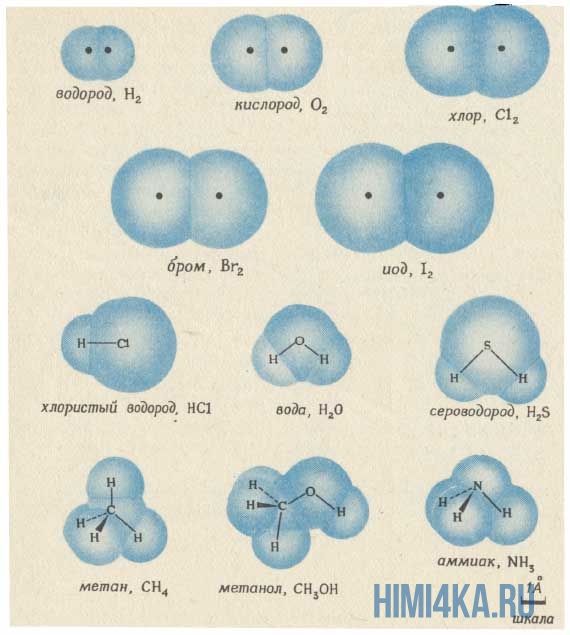
Структурную формулу молекулы воды H2O, к примеру, изображают двумя способами. Второй вариант структурной формулы воды, учитывает тот факт, что на самом деле молекула воды не линейна; две связи Н—О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Структурная формула молекулы лишь схематично изображает связи между атомами, но не дает информации о реальной форме молекулы. Заметим, что угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. Так, угол между связями в молекуле воды равен 105°, а угол в молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане и метаноле, направлены к четырем вершинам тетраэдра. Структурная формула неразветвленного октана, одного из компонентов бензина, такова:
Изображение ниже дает более реальное представление о форме и относительном объеме некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя.
Каждая из указанных выше структурных формул может быть сведена к сжатой молекулярной формуле, которая указывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2O, сероводорода H2S, аммиака NH3, метана СН4, метанола (метилового спирта) СН3ОН или СН4O, а октана С8Н18. Формула октана может быть также записана в такой форме:
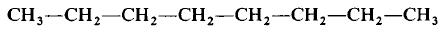
Относительная молекулярная масса вещества
Под молекулярной массой вещества понимается масса молекулы, вычисленная через сумму всех атомных масс, входящих в нее атомов; измеряется, как и атомная масса, в а.е.м. Если молекулярную массу вещества вычислять через относительные атомные массы, то и называться масса молекулы будет относительной молекулярной массой вещества. Относительная молекулярная масса — величина безразмерная.
Пример 1: Какая относительная молекулярная масса у воды?
Решение: Заходим в таблицу Менделеева и выписываем относительные атомные массы водорода и кислорода, округляя до целого значения. У водорода = 1, а у кислорода = 16. Так как молекулярная формула воды имеет вид H2O, то ее молекулярная масса равна:
- 1×2 + 16 = 18
Ответ: относительная молекулярная масса воды равна 18.
Пример 2: Вычислите молекулярную массу метанола (метилового спирта).
Решение: Молекулярная формула метанола СН3ОН или СН4O. Следовательно,
- 1 углерод: 1 × 12,011 а.е.м. = 12,011 а.е.м.
- 4 водорода: 4 × 1,008 а.е.м. = 4,032 а.е.м.
- 1 кислород: 1 × 15,999 а.е.м. = 15,999 а.е.м.
Ответ: Суммарная молекулярная масса равна 32,04 а.е.м.
В примере 2 следует обратить внимание на то, что естественная атомная масса углерода равна не 12,000, а 12,011 а.е.м., поскольку природный углерод представляет собой смесь, содержащую 98,89% углерода-12 и 1,11% углерода-13, а также следы углерода-14.
Пример 3: Чему равна молекулярная масса чистого октана?
Решение: Молекулярная формула октана С8Н18, поэтому его молекулярная масса равна
- (8 × 12,011) + (18 × 1,008) = 114,23 а.е.м.
Надеюсь урок 3 «Схема образования молекул» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.
Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.
2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2). Определим число атомов фтора, которые примут два электрона от атома кальция: (2) (:) (1) (=) (2).
4. Составим схему образования ионной связи:
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.
2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2) (:) (1) (=) (2). Определим число атомов натрия, которые отдадут два электрона атому кислорода: (2).
4. Составим схему образования ионной связи:
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
.
Значит, ионная связь существует также в солях и основаниях.
Обрати внимание!
Соли аммония
NH4NO3,NH4Cl,NH4SO42
не содержат металла, но образованы ионной связью.
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.
Рис. (1). Ионный кристалл
Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:
|
|
|
 |
|
Рис. (2). Питьевая сода |
Рис. (3). Железный купорос |
Рис. (4). Поваренная соль |
Источники:
Рис. 1. Ионный кристалл https://upload.wikimedia.org/wikipedia/commons/e/eb/Sodium_chloride_crystal.png
Рис. 2. Питьевая сода https://pixabay.com/images/id-768950/ 8.06.2021
Рис. 3. Железный купорос https://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/Iron%28II%29-sulfate-heptahydrate-sample.jpg/1280px-Iron%28II%29-sulfate-heptahydrate-sample.jpg
Рис. 4. Поваренная соль https://upload.wikimedia.org/wikipedia/commons/9/93/Chlorid_sodn%C3%BD.JPG