Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:
Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:
Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.
2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:
3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |
Найди девять отличий |
Правила составления изомеров на примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:
4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность С – IV. В результате получают изомер а):
5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):
Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):
6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4с углеродным заместителем при С-2 и С-3:
Записывают структурные формулы новых изомеров:
7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:
8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:
Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.
Комитет образования и науки Курской области
Областное бюджетное образовательное учреждение
среднего профессионального образования
«Железногорский горно-металлургический колледж»

Бильдина Е. А.
Методические указания для студентов при написании формул и названий органических соединений и их гомологов
2018
ОДОБРЕНА
цикловой комиссией
требованиями
общеобразовательных дисциплин
Протокол заседания комиссии
№ от
Председатель
цикловой комиссии
___________Н.Г. Заносова
Автор _____________ Е.А.Бильдина
преподаватель химии и биологии
Рецензенты: _____________ А.С. Илюшин
Директор МОУ Средняя школа №7
Учитель химии
_____________ Н.А. Иванова
преподаватель химии
РЕЦЕНЗИЯ
на методическую разработку «Методические указания для студентов при написании формул и названий органических соединений и их гомологов»
преподавателя ФГОУ СПО ЖГМК Е.А.Бильдина
Представленная на рецензию методическая разработка предназначена для студентов при написании формул и названий органических соединений и их гомологов. В работе представлены рекомендации для выполнения различных заданий.
Данная методическая разработка поможет студентам правильнее и более эффективно выполнить полученные задания. В работе представлены указания для написания формул всех классов органических соединений, их названий и правильного написания изомеров.
Студенты при помощи данной методической разработки быстрее смогут понять, как правильно написать формулу органического вещества и назвать его.
Директор МОУ Средняя школа №7 А.С. Илюшин.
Преподаватель химии Н.А. Иванова.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Данная разработка «Методические указания для студентов при написании формул и названий органических соединений и их гомологов» предназначена для студентов при выполнении заданий по органической химии.
В работе представлены рекомендации для выполнения различных заданий. Пособие помогает наиболее эффективно выполнить задания.
Целью данной методической разработки является: развитие самостоятельной работы, логическое мышление, активизацию познавательной деятельности, способность анализировать и делать выводы. Кроме того, данная методическая разработка научит студентов как быстро и правильно называть органические вещества, составлять их формулы, строить изомеры.
1.Написние названий различных органических веществ.
-
Номенклатура алканов.
Алканы (предельные углеводороды) -это органические вещества в которых каждый атом углерода соединен одинарными связями с четырьмя другими атомами.
Общая формула – СпН2п+2
Простейший алкан – СН4 – метан, его гомологический ряд представлен в приложении А.
Для того чтобы дать названия алканам нужно выполнить следующие правила:
|
правило |
пример |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН3-СН2-СН-СН2-СН-СН3 | | СН3 СН3 |
|
2. нумеруем выбранную цепочку с того края, где ближе ответвление |
6 5 4 3 2 1 СН3-СН2-СН-СН2-СН-СН3 | | СН3 СН3 |
|
3.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
6 5 4 3 2 1 СН3-СН2-СН-СН2-СН-СН3 | | СН3 СН3 2,4-…. |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
6 5 4 3 2 1 СН3-СН2-СН-СН2-СН-СН3 | | СН3 СН3 2,4- диметил… |
|
5.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода. |
6 5 4 3 2 1 СН3-СН2-СН-СН2-СН-СН3 | | СН3 СН3 2,4-диметилгексан |
1.2Номенклатура алкенов.
Алкены – непредельные углеводороды, в молекуле которых имеется одна двойная связь.
Общая формула – СпН2п
Простейший алкен – С2Н4 –этен (этелен), его гомологический ряд представлен в приложении В.
Для того чтобы дать названия алкенам нужно выполнить следующие правила:
|
правило |
пример |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН3-СН2-СН=С-СН2-СН3 | | C2H5 CН3 |
|
2. нумеруем выбранную цепочку с того края, где ближе двойная связь |
1 2 3 4 5 6 СН3-СН2-СН=С-СН2-СН3 | | C2H5 CН3 |
|
3.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
1 2 3 4 5 6 СН3-СН2-СН=С-СН2-СН3 | | C2H5 CН3 4-…. -5-…… |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
1 2 3 4 5 6 СН3-СН2-СН=С-СН2-СН3 | | C2H5 CН3 4-этил-5-метил… |
|
5.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода + -ен. |
1 2 3 4 5 6 СН3-СН2-СН=С-СН2-СН3 | | C2H5 CН3 4- этил-5-метилгексен-… |
|
6.В конце названия ставится номер того атома, после которого стоит двойная связь. |
1 2 3 4 5 6 СН3-СН2-СН=С-СН2-СН3 | | C2H5 CН3 4- этил-5-метилгексен-3 |
1.3 Номенклатура алкинов.
Алкины – непредельные углеводороды, в молекуле которых присутствует одна тройная связь.
Общая формула – СпН2п-2
Простейший алкин – С2Н2 –этин (ацетилен), его гомологический ряд представлен в приложении Г.
Для того чтобы дать названия алкинам нужно выполнить следующие правила:
|
правило |
пример |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН3-СН-С≡С-СН2-СН3 | | СН3 CН3 |
|
2. нумеруем выбранную цепочку с того края, где ближе тройная связь |
1 2 3 4 5 6 7 СН3-СН-С≡С-СН2-СН2-СН3 | | СН3 CН3 |
|
3.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
1 2 3 4 5 6 7 СН3-СН-С≡С-СН2-СН2-СН3 | | СН3 CН3 2,5 –… |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
1 2 3 4 5 6 7 СН3-СН-С≡С-СН2-СН2-СН3 | | СН3 CН3 2,5 –диметил… |
|
5.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода + -ин |
1 2 3 4 5 6 7 СН3-СН-С≡С-СН2-СН2-СН3 | | СН3 CН3 2,5 –диметилгептин-… |
|
6.В конце названия ставится номер того атома, после которого стоит тройная связь |
1 2 3 4 5 6 7 СН3-СН-С≡С-СН2-СН2-СН3 | | СН3 CН3 2,5 –диметилгептин-3 |
1.4Номенклатура алкодиенов.
Алкодиены – непредельные углеводороды, в молекуле которых присутствуют две двойные связи.
Общая формула – СпН2п-2
Простейший алкодиен – С3Н4 –пропадиен, его гомологический ряд представлен в приложении Д.
Для того чтобы дать названия алкодиенам нужно выполнить следующие правила:
|
правило |
пример |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН2=СН-СН2-СН=СН-СН-СН3 | C2H5 |
|
2. нумеруем выбранную цепочку с того края, где ближе двойная связь |
1 2 3 4 5 6 7 8 СН2=СН-СН2-СН=СН-СН-СН3 | C2H5 |
|
3.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
1 2 3 4 5 6 7 8 СН2=СН-СН2-СН=СН-СН-СН3 | C2H5 7-… |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
1 2 3 4 5 6 7 8 СН2=СН-СН2-СН=СН-СН-СН3 | C2H5 7-этил… |
|
5.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода + -адиен |
1 2 3 4 5 6 7 8 СН2=СН-СН2-СН=СН-СН-СН3 | C2H5 7-этилоктадиен… |
|
6.В конце названия ставится номера тех атомов, после которых стоят двойные связи |
1 2 3 4 5 6 7 8 СН2=СН-СН2-СН=СН-СН-СН3 | C2H5 7-этилоктадиен -1,5 |
1.5 Номенклатура спиртов.
Спирты – органические вещества, молекулы которых содержат гидроксильные группы.
Общая формула спиртов – R-OH
Простейший представитель спиртов – СН3ОН – метиловый спирт, его гомологический ряд представлен в приложении Е.
Для того чтобы дать названия спиртам нужно выполнить следующие правила:
|
правило |
формула |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН3-СН-СН2-СН-СН2-ОН | | СН3 С2Н5 |
|
2. нумеруем выбранную цепочку с того края, где ближе гидроксогруппа |
5 4 3 2 1 СН3-СН-СН2-СН-СН2-ОН | | СН3 С2Н5 |
|
3.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
5 4 3 2 1 СН3-СН-СН2-СН-СН2-ОН | | СН3 С2Н5 2-…-4…. |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
5 4 3 2 1 СН3-СН-СН2-СН-СН2-ОН | | СН3 С2Н5 2-этил-4-метил…. |
|
5.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода + -ол |
5 4 3 2 1 СН3-СН-СН2-СН-СН2-ОН | | СН3 С2Н5 2-этил-4-метилпентанол-.. |
|
6.В конце названия ставится номер того атома, после которого стоит гидроксогруппа |
5 4 3 2 1 СН3-СН-СН2-СН-СН2-ОН | | СН3 С2Н5 2-этил-4-метилпентанол-1 |
|
7. Если гидроксогрупп несколько, то указываются все номера атомов, возле которых они находятся и добавляется греческое числительное: Ди- 2 Три – 3 Оно ставится перед окончанием – ол |
СН3-СН-СН-СН3 | | ОН ОН Бутандиол-2,3 |
1.6Номенклатура фенолов.
Фенолы – это гидроксильные соединения, в которых гидроксильная группа соединена непосредственно с атомом углерода бензольного кольца (С6Н5-)
ОН


1.Атомы нумеруют сверху по часовой стрелке.
2.Затем записывают цифры, под которыми стоят радикалы.
3.Называют радикалы, если нужно используются греческие числительные.
4. Если фенол двухатомный (т.е. содержит две гидроксогруппы), то название его зависит от расположения гидроксогрупп.

| | |


-ОН
|
OH
пара- орта- мета-
1.7 Номенклатура простых эфиров
Простые эфиры – органические соединения, имеющие в своем составе два радикала соединенные атомом кислорода.
Общая формула – R-O-R1, где – R и R1 – одинаковые или разные радикалы.
-
Названия простых эфиров складываются из названия радикалов (приложение Б), и слова «эфир».
-
Если радикалы в эфире одинаковые, то добавляем числительное ди-
Например, СН3-О-СН3 диметиловый эфир.
1.8 Номенклатура альдегидов.
Альдегиды – это кислородосодержащие органические вещества, которые имеют в своем составе карбонильную группу.
Общая формула альдегидов – R- C=О
|
H
Простейший представитель – СН3=О, его гомологический
|
H
ряд представлен в приложении Ж.
Для того чтобы дать названия альдегидам нужно выполнить следующие правила:
|
правило |
формула |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН3-СН-СН2-СН-С=О | | | СН3 С2Н5 H |
|
2. нумеруем выбранную цепочку с того края, где ближе карбонильная группа |
5 4 3 2 1 СН3-СН-СН2-СН-С=О | | | СН3 С2Н5 H |
|
3.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
5 4 3 2 1 СН3-СН-СН2-СН-С=О | | | СН3 С2Н5 H 2-…-4…. |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
5 4 3 2 1 СН3-СН-СН2-СН-С=О | | | СН3 С2Н5 H 2-этил-4-метил…. |
|
5.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода + -аль |
5 4 3 2 1 СН3-СН-СН2-СН-С=О | | | СН3 С2Н5 H 2-этил-4-метилпентаналь-.. |
|
6.В конце названия ставится номер того атома, после которого стоит карбонильная группа |
5 4 3 2 1 СН3-СН-СН2-СН-С=О | | | СН3 С2Н5 H 2-этил-4-метилпентаналь-1 |
Кроме этого можно называть альдегиды по традиционной номенклатуре. Эти названия аналогичны названиям карбоновых кислот (приложение З) с добавлением слова «альдегид».
1.9 Номенклатура кетонов.
Кетон – кислородосодержащее органическое вещество, в молекуле которого карбонильная группа соединена с двумя одинаковыми или разными радикалами.
Общая формула – R-C-R1
||
O
Простейший представитель кетонов – СН3-C-СН3 – ацетон
||
O
Для того чтобы дать названия кетонам нужно выполнить следующие правила:
|
правило |
формула |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН3-СН-СН2-С-СН2-СН3 | || CH3 O |
|
2. нумеруем выбранную цепочку с того края, где ближе ответвление |
1 2 3 4 5 6 СН3-СН-СН2-С-СН2-СН3 | || CH3 O |
|
3.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
1 2 3 4 5 6 СН3-СН-СН2-С-СН2-СН3 | || CH3 O 2-…. |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
1 2 3 4 5 6 СН3-СН-СН2-С-СН2-СН3 | || CH3 O 2-метил… |
|
5.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода + -он |
1 2 3 4 5 6 СН3-СН-СН2-С-СН2-СН3 | || CH3 O 2-метилгексанон-.. |
|
6.В конце названия ставится номер того атома, после которого стоит кетонная группа |
1 2 3 4 5 6 СН3-СН-СН2-С-СН2-СН3 | || CH3 O 2-метилгексанон – 4 |
Названия кетонов по традиционной номенклатуре складываются от названий радикалов (приложение Б) связанных с карбонильной группой с добавлением слова «кетон». Например, СН3-С-С3Н7
||
O метилпропилкетон
1.10 Номенклатура карбоновых кислот.
Карбоновые кислоты – органические вещества, в состав которых входит карбоксильная группа (СООН).
Общая формула – R-СООН
Простейшим представителем карбоновых кислот является – НСООН – муравьиная кислота, ее гомологический ряд представлен в приложении З.
Для того чтобы дать названия карбоновым кислотам
нужно выполнить следующие правила:
|
правило |
формула |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН3-СН-СН2-СН-СН2-СOOH | | CH3 C2H5 |
|
2. нумеруем выбранную цепочку с того края, где ближе карбоксильная группа |
6 5 4 3 2 1 СН3-СН-СН2-СН-СН2-СOOH | | CH3 C2H5 |
|
3.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
6 5 4 3 2 1 СН3-СН-СН2-СН-СН2-СOOH | | CH3 C2H5 3-….-5-… |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
6 5 4 3 2 1 СН3-СН-СН2-СН-СН2-СOOH | | CH3 C2H5 3-этил-5-метил… |
|
5.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода + -овая + кислота |
6 5 4 3 2 1 СН3-СН-СН2-СН-СН2-СOOH | | CH3 C2H5 3-этил-5-метилгексановая кислота |
Для некоторых карбоновых кислот используются тривиальные названия (приложение З).
1.11. Номенклатура сложных эфиров.
Сложные эфиры – это органические вещества, полученные в результате взаимодействия карбоновых кислот со спиртами.
Общая формула – R-C-О-R1, где R – радикал от кислоты, а
||
O
R1– радикал от спирта.
По современной номенклатуре названия эфиров строят из названий радикала соответствующего спирту и корня латинского названия кислоты с добавлением окончания –ат.
Н-С-О-С2Н5
||
О этилформиат
СН3-С-О-С2Н5
||
O этилацетат
Применяют также названия, состоящие из названий спирта и кислоты. Сначала пишется название радикала спирта + овый + эфир, затем тривиальное название карбоновой кислоты в родительном падеже (приложение З).
Н-С-О-С2Н5 этиловый эфир муравьиной кислоты
||
О
СН3-С-О-С2Н5 этиловый эфир уксусной кислоты
||
O
1.12 Номенклатура жиров.
Жиры – органические вещества, представляющие собой сложные эфиры глицерина и высших предельных карбоновых кислот (триглицериды).
Общая формула:
CH2-CO-O-R
|
CH-CO-O-R1
|
CH2-CO-O-R2, где R, R1, R2– одинаковые или разные радикалы
Названия жиров происходят от сочетания слова «триглицерид» и названия соответствующей высшей карбоновой кислоты (приложение З).
CH2-CO-O-С15Н31
|
CH-CO-O- С15Н31
|
CH2-CO-O- С15Н31 триглицерид пальмитиновой кислоты.
Если жиры образованы несколькими карбоновыми кислотами, то указываются все их названия.
CH2-CO-O-С15Н31
|
CH-CO-O- С15Н31
|
CH2-CO-O- С15Н35 триглицерид пальмитиновой и стеариновой кислот.
1.13 Номенклатурамылов.
Мыла – это натриевые или калиевые соли высших карбоновых кислот.
Общая формула – R-СОО-Na или R-COO-K
Названия производятся от сочетания названий соответствующих карбоновых кислот + -ат и названия металла, образующего мыло. Например, С17Н35СООNa –стеарат натрия, или C17H31COOK-памьмиат калия.
1.14 Номенклатура углеводов.
Углеводы – органические вещества состава Сп(Н2О)m, где n и m больше или равны 3.
Общая формула – Сп(Н2О)m
Название углеводов зависит от количества атомов углерода и + -оза. Например:
Н
|
H-C-OH
|
H-C-OH
|
H-C-OH
|
H триоза
Н
|
H-C-OH
|
H-C-OH
|
H-C-OH
|
H-C-OH
|
H тетроза
Н
|
H-C-OH
|
H-C-OH
|
H-C-OH
|
H-C-OH
|
H пентоза
В зависимости от расположения карбонильной группы добавляют приставки : альдо- – если карбонильная группа в конце или кето- – если карбонильная группа в середине.
Н
|
H–C=O
|
H-C-OH
|
H-C-OH
|
H-C-OH
|
H альдотетроза
Н
|
H-C-OH
|
C=O
|
ОН-С-H
|
H-C-OH
|
Н-С-ОH
|
H-C-OH
|
H кетогексоза
1.15. Номенклатура аминов.
Амины – органические производные аммиака, в котором один, два или три атома водорода замещены на радикалы.
Общая формула R-NH2
В зависимости от количества атомов замещенных в аммиаке на радикалы выделяют первичный, вторичный и третичный амин.
R-NH2 первичный амин
R-NH-R вторичный амин
R-N-R третичный амин
|
R
Радикалы в формулах могут быть различными или одинаковыми.
Название амина образуется из названия радикала + -амин.
Например, СН3-NH2 метиламин
Если радикалов несколько, то используются греческие числительные:
Ди – два
Три – три
Тетро – четыре
Например, СН3-NH-СН3 диметиламин.
Если радикалы разные, то называется каждый радикал по часовой стрелке + -амин. Например,
СН3-N-С2Н5
|
С3Н7 метилэитлпропиламин
1.16. Номенклатура аминокислот.
Аминокислоты – органические вещества в состав которых входят две функциональные группы: карбоксильноая (СООН) и аминогруппа (NH2).
Общая формула – СООН-R-NH2
Для того чтобы дать названия карбоновым кислотам
нужно выполнить следующие правила:
|
правило |
формула |
|
1. в формуле выбираем самую длинную углеводородную цепочку. |
СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 |
|
2. нумеруем выбранную цепочку с того края, где ближе аминогруппа |
1 2 3 4 5 6 СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 |
|
3.записываем номнр атома углерода под которым стоит аминогруппа + -амино |
1 2 3 4 5 6 СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 2 –амино… |
|
4.записываем цифры, под которыми стоят ответвления: -если несколько одинаковых радикалов, то перечисляем все цифры, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его номер указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то номер каждого указываем по отдельности |
1 2 3 4 5 6 СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 2-амино-4-… |
|
5. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
1 2 3 4 5 6 СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 2-амино-4-этил… |
|
6.Называем длинную цепь углерода в зависимости от того, сколько в ней атомов углерода + -овая + кислота |
1 2 3 4 5 6 СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 2-амино-4-этилгексановая кислота |
Кроме того, для аминокислот широко используются рациональные названия. Для этого применяются греческие буквы (α,β,γ).При построении таких названий выполняются следующие правила:
|
1.Буквами обозначаются атомы углерода, в цепи начиная с того атома, с которым соединена карбоксильная группа. |
ε δ γ β α СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 |
|
2.Выписатьбукву под которой стоит аминогруппа + -амино |
ε δ γ β α СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 δ-амино… |
|
3.Выписать букву под которой стоит радикал: -если несколько одинаковых радикалов, то перечисляем всебуквы, под которыми они стоят; -если одинаковые радикалы стоят под одним и тем же атомом углерода, то его букву указываем столько раз, сколько радикалов под ним стоит; – если радикалы разные, то букву каждого указываем по отдельности |
ε δ γ β α СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 δ-амино- β-… |
|
4. Записываем названия радикалов: – если радикалов несколько, то используем греческое числительное: Ди- 2 Три – 3 Тетро – 4 – название радикалов можно смотреть в приложении Б |
ε δ γ β α СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 δ-амино- β-этил… |
|
5 Называем длинную цепь углерода при помощи традиционного названия карбоновой кислоты (при этом учитываются только пронумерованные атомы, т.е. атом углерода в карбоксильной группе не считается) |
ε δ γ β α СН3-СН-СН2-СН-СН2-СOOH | | NH2 C2H5 δ-амино- β-этилкапроновая кислота |
Существуют также аминокислоты, содержащие несколько аминогрупп и карбоксильных групп. При их названии используются греческие числительные.
Если несколько аминогрупп, то греческое числительное указывается после номеров атомов, под которыми они стоят.
1 2 3 4 5 6
СН3-СН-СН2-СН-СН2-СOOH
| |
NH2 NH2 2,4 –диаминогексановая кислота
Если несколько карбоксильных групп, то греческое числительное ставится перед окончанием –овая. Нумерация при этом идет с того конца где ближе разветвление.
4 3 2 1
НООС-СН2-СН-СООН
|
NH2 2-аминобутандиовая кислота
Выделяют аминокислоты из природных соединений – белков, их названия приведены в приложении И.
2. Написание формул органических веществ по их названиям.
Для того чтобы правильно писать формулы органические вещества нужно использовать следующие рекомендации.
|
правило |
пример |
|
1.Выписываем название вещества |
2,3- диэтил- 4-метилгексан |
|
2.Обращаем внимание на последнее слово и в соответствии с ним строим цепочку из атомов углерода |
2,3- диэтил- 4-метилгексан С-С-С-С-С-С |
|
3. Затем нумеруем эту цепочку с того края, с которого удобнее |
1 2 3 4 5 6 С-С-С-С-С-С |
|
4.Ставим ответвления под указанными в названии цифрами |
2,3– диэтил- 4-метилгексан 1 2 3 4 5 6 С-С-С-С-С-С | | | |
|
5.Подписываем под ними соответствующие формулы радикалов (приложение Б) |
2,3- диэтил- 4-метилгексан 1 2 3 4 5 6 С – С – С – С – С – С | | | СН3 СН3 С2Н5 |
|
6.Дописывает недостающие атомы водорода, с условием того, что валентность углерода IV |
2,3- диэтил- 4-метилгексан 1 2 3 4 5 6 СН3-СН – СН – СН2 –СН2-СН3 | | | СН3 СН3 С2Н5 |
|
7.Если окончание названия: ен – ставится двойная связь ин – тройная связь диен – две двойные связи ол – гидроксогруппа. Связи и функциональные группы ставятся после тех атомов углерода, номера которых указаны в конце названия |
3.Построение изомеров и написание их названий.
Изомерия – проявление различных свойств веществами, имеющими одинаковый состав.
Выделяют несколько типов изомерии
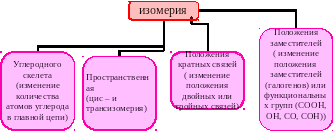
Для того чтобы правильно составить изомеры следует выполнить следующие правила:
|
правило |
Пример |
|
1.Написать формулу данного вещества в структурном виде |
СН3-СН2-СН2-СН2-СН2-СН3 |
|
2.Укоротить данную цепь на один атом углерода и записать полученную углеродную цепочку |
С – С – С – С – С |
|
3.Недостающиий атом углерода подставить к любому из средних атомов. |
С – С – С – С – С | С |
|
4.Дописать недостающие атомы водорода, при условии что валентность углерода IV |
СН3– СН – СН2 – СН2 – СН3 | СН3 |
|
5.Назвать полученное вещество (см. пункт1) |
2-метилпентан |
|
6.Далее укорачиваем цепочку до тех пор, пока возможно, т. е. учитывая, что валентность углерода IV. Называем каждое полученное вещество. |
СН3– СН – СН– СН3 | | СН3 СН3 1,2-диметилбутан |
|
7.Кроме того, радикалы можно писать различные, с учетом того, что общее количество атомов углерода не должно меняться |
СН3– СН2 – СН– СН3 | С2Н5 2-этилбутан |
|
8.Для вывода структурных формул изомеров по положению заместителей (галогенов) или функциональных групп (СО, ОН, СООН, СОН) нужно изменять положение заместителей и функциональных групп во всех структурных изомерах |
|
|
9.Для написания изомеров по положению кратных связей нужно: -написать все структурные изомеры и назвать их -перемещать кратную связь по углеродной цепочке с учетом того, что валентность углерода IV |
C4Н8 СН2=СН-СН2-СН3 бутен-1 СН2=С-СН3 2- метилпропен-1 | СН3 СН3-СН=СН-СН3 бутен-2 |
|
10. Для составления изомеров циклоалканов нужно: -укоротить цикл на 1,2…п атомов углерода -записать радикалы с учетом валентности углерода -нумерация производится таким образом, чтобы радикал имел наименьший номер |
СН2-СН2 | | СН2-СН2 циклобутан 3 СН2 2/ 1 СН2– СН- СН3 1-метилциклопропан |
|
11.Для составления пространственных изомеров используются следующие принципы: -если одинаковые атомы или группы атомов стоят по одну сторону от двойной связи, это цисизомер – если одинаковые атомы или группы атомов стоят по разные стороны от двойной связи, это трансизомер |
А А / С=С / В В А В / С=С / В А |
СПИСОК ЛИТЕРАТУРЫ
1.Аугуст Л.Г.Химия – Киев: «Вища школа»,1971
2.Ерохин Ю.М.Химия.- М.: «Академия»,2002.
3.Потапов В.М. Органическая химия.- М.: «Просвещение»,1970
4.Хомченко Ю.Г. Общая химия. – М.: «Издательство Новая волна», 1999
ПРИЛОЖЕНИЕ А.
Гомологический ряд алканов
|
формула |
Название |
|
СН4 |
Метан |
|
С2Н6 |
Этан |
|
С3Н8 |
Пропан |
|
С4Н10 |
Бутан |
|
С5Н12 |
Пентан |
|
С6Н14 |
Гексан |
|
С7Н16 |
Гептан |
|
С8Н18 |
Октан |
|
С9Н20 |
Нонан |
|
С10Н22 |
Декан |
ПРИЛОЖЕНИЕ Б.
Гомологический ряд радикалов
|
формула |
Название |
|
СН3– |
Метил |
|
С2Н5– |
Этил |
|
С3Н7– |
Пропил |
|
С4Н9– |
Бутил |
|
С5Н11– |
Пентил |
|
С6Н13– |
Гексил |
|
С7Н15– |
Гептил |
|
С8Н17– |
Октил |
|
С9Н19– |
Нонил |
|
С10Н21– |
Декил |
ПРИЛОЖЕНИЕ В.
Гомологический ряд алкенов
|
Формула |
Название |
|
С2Н4 |
Этен |
|
С3Н6 |
Пропен |
|
С4Н8 |
Бутен |
|
С5Н10 |
Пентен |
|
С6Н12 |
Гексен |
|
С7Н14 |
Гептен |
|
С8Н16 |
Октен |
|
С9Н18 |
Нонен |
|
С10Н20 |
Декен |
ПРИЛОЖЕНИЕ Г.
Гомологический ряд алкинов
|
Формула |
Название |
|
С2Н2 |
Этин |
|
С3Н4 |
Пропин |
|
С4Н6 |
Бутин |
|
С5Н8 |
Пентин |
|
С6Н10 |
Гексин |
|
С7Н12 |
Гептин |
|
С8Н14 |
Октин |
|
С9Н16 |
Нонин |
|
С10Н18 |
Декин |
ПРИЛОЖЕНИЕ Д.
Гомологический ряд алкодиенов
|
Формула |
Название |
|
С3Н4 |
Пропадиен |
|
С4Н6 |
Бутадиен |
|
С5Н8 |
Пентадиен |
|
С6Н10 |
Гексадиен |
|
С7Н12 |
Гептадиен |
|
С8Н14 |
Октадиен |
|
С9Н16 |
Нонадиен |
|
С10Н18 |
Декадиен |
ПРИЛОЖЕНИЕ Е.
Гомологический ряд одноатомных спиртов
|
формула |
Название |
|
СН3-ОН |
Метанол |
|
С2Н5-ОН |
Этанол |
|
С3Н7-ОН |
Пропанол |
|
С4Н9-ОН |
Бутанол |
|
С5Н11-ОН |
Пентанол |
|
С6Н13-ОН |
Гексанол |
|
С7Н15-ОН |
Гептанол |
|
С8Н17-ОН |
Октанол |
|
С9Н19-ОН |
Нонанол |
|
С10Н21-ОН |
Деканол |
ПРИЛОЖЕНИЕ Ж
Гомологический ряд альдегидов
|
формула |
Название |
|
|
НСОН |
Метаналь |
Формальдегид, муравьиный альдегид |
|
СН3-СНО |
Этаналь |
Уксусный альдегид |
|
С2Н5-СНО |
Пропаналь |
Пропионовый альдегид |
|
С3Н7-СНО |
Бутаналь |
Масляный альдегид |
|
С4Н9-СНО |
Пентаналь |
Валериановый альдегид |
|
С5Н11-СНО |
Гексаналь |
Капроновый альдегид |
|
С6Н13-СНО |
Гептаналь |
Энантовый альдегид |
|
С7Н15-СНО |
Октаналь |
|
|
С8Н17-СНО |
нонаналь |
|
|
С9Н19-СНО |
Деканаль |
ПРИЛОЖЕНИЕ З
Гомологический ряд предельных одноосновных карбоновых кислот
|
формула |
Название |
|
|
НСООН |
Метановая |
Муравьиная |
|
СН3СООН |
Этановая |
Уксусная |
|
С2Н5-СООН |
Пропановая |
Пропионовая |
|
С3Н7-СООН |
Бутановая |
Масляная |
|
С4Н9-СООН |
Пентановая |
Валериановая |
|
С5Н11-СООН |
Гексановая |
Капроновая |
|
С6Н13-СООН |
Гептановая |
Энантовая |
|
С7Н15-СООН |
Октановая |
|
|
С8Н17-СООН |
Нонановая |
|
|
С9Н19-СООН |
Декановая |
|
|
С15Н31СООН |
пентадиекановая |
Пальмитиновая |
|
С16Н33СООН |
гексадекановая |
Маргариновая |
|
С17Н35СООН |
гептадекановая |
стеариновая |
ПРИЛОЖЕНИЕ И.
|
формула |
Названия |
||
|
По заместительной номенклатуре |
По рациональной номенклатуре |
тривиальное |
|
|
NH2-CH2-COOH |
Аминоэнантовая |
Аминоуксусная |
глицин |
|
CH3-CHNH2-COOH |
2-аминопропановая |
α-аминопропионовая |
α-аланин |
|
CH3-CH(CH3)-CHNH2-COOH |
3-амино-3-метилбутановая |
α-аминоизовалериановая |
валин |
|
CH3-CH2-CH(CH3)-CHNH2-COOH |
2-амино-3-метилпентановая |
α-амино-βметил-β-пропионовая |
изолейцин |
|
CH3-CH(OH)-CH(NH2)-COOH |
2-амино-2-гидрокси-3-бутановая |
α-амино-β-гидроксимасляная |
Треонин |
|
CH2(SH)-CH(NH2)-COOH |
2-амино-3-тиопропановая |
α-амино-β-тиопропионовая |
Цистеин |
|
CH2(NH2)-(CH2)3-CH(NH2)-COOH |
2,6-диаминогексановая |
α,ε-диаминокапроновая |
Лизин |
|
HOOC-CH2-CH(NH2)-COOH |
2-аминобутандиовая |
α-аминоянтарная |
Аспарагин |
48
В этой статье мы разберем, как составлять молекулярные формулы основных классов органических соединений из информации об особенностях строения (наличие кратных связей, циклов, функциональных групп), и наоборот — как определять общую формулу гомологического ряда веществ с определенными функциональными группами, кратными связями или циклами.
Углеводороды
За основу берем формулу алканов — предельных нециклических углеводородов с одинарными связями между атомами углерода.
В молекуле линейных алканов на каждый атом углерода приходится по два атома водорода плюс по одному дополнительному атому водорода на концах углеродной цепи:
Таким образом, общая формула предельных нециклических углеводородов (алканов) — CnH2n+2.
В алкенах присутствует одна двойная связь. Двойная связь «отщипывает» от молекулы два атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна двойная связь (алкенов) CnH2n+2-2 — CnH2n.
Формулы алкенов отличаются от формул алканов с таким же количеством атомов углерода на 2 атома водорода:
C3H8 — C3H6 = 2H
Каждая пара атомов водорода определяет степень ненасыщенности молекулы. Степень ненасыщенности алкенов равна одному.
В алкинах присутствует одна тройная связь. Тройная связь «отщипывает» от молекулы уже четыре атома водорода:
| Ацетилен, этин | H-C≡C-H |
| Пропин | H-C≡C-СH3 |
| Бутин-1 | H-C≡C-СH2-СH3 |
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть одна тройная связь (алкинов): CnH2n+2-4 — CnH2n-2.
Формулы алкинов отличаются от формул алканов с таким же количеством атомов углерода на 4 водорода:
C3H8 — C3H4 = 4H
Степень ненасыщенности алкинов равна двум.
В алкадиенах присутствуют две двойные связи. Две двойные связи «отщипывают» от молекулы уже четыре атома водорода:
Таким образом, общая формула нециклических углеводородов, в молекулах которых есть две двойные связи (алкадиенов): CnH2n+2-4 — CnH2n-2.
Степень ненасыщенности алкадиенов также равна двум.
В циклоалканах присутствуют только одинарные связи и атомы углерода образуют замкнутый цикл. Наличие цикла также уменьшает количество атомов водорода на два:
Таким образом, общая формула циклических углеводородов, в молекулах которых есть только одинарные связи (циклоалканов): CnH2n+2-2 — CnH2n.
В циклоалкенах присутствует одна одинарная связь и атомы углерода образуют замкнутый цикл. Наличие цикла и двойной связи уменьшает количество атомов водорода на четыре:
| Циклобутен |  |
Таким образом, общая формула циклических углеводородов, в молекулах которых есть одна двойная связь (циклоалкенов): CnH2n+2-4 — CnH2n-2.
Этот ряд можно продолжить и дальше:
Алкатриены — содержат три двойные связи, общая формула: CnH2n+2-6 = CnH2n-4
Алкенины — содержат одну двойную и одну тройную связь, общая формула:
CnH2n+2-6 = CnH2n-4
и так далее.
| Класс/группа | Тип связей и наличие цикла | Степень ненасыщенности | Общая формула |
| Алканы |
одинарные связи |
0 | CnH2n+2 |
| Алкены | двойная связь | 1 | CnH2n |
| Алкины | тройная связь | 2 | CnH2n-2 |
| Алкадиены | две двойные связи | 2 | CnH2n-2 |
| Циклоалканы | одинарные связи, цикл | 2 | CnH2n |
| Циклоалкены | двойная связь, цикл | 2 | CnH2n-2 |
| Циклоалкины | тройная связь, цикл | 6 | CnH2n-4 |
| Циклоалкадиены | две двойные связи, цикл | 6 | CnH2n-4 |
Определите молекулярную формулу и степень ненасыщенности гомологического ряда следующих классов органических веществ:
а) алкадиенины
б) циклоалкины
в) циклоалкатриены
г) алкендиины
а) CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
б) CnH2n-4, степень ненасыщенности 3, не хватает 6 атомов Н до алкана
в)CnH2n-6, степень ненасыщенности 4, не хватает 8 атомов Н до алкана
г) CnH2n-8, степень ненасыщенности 5, не хватает 10 атомов Н до алкана
Эта система работает и наоборот: знание молекулярной формулы можно определить возможный состав вещества.
Например, проанализируем формулу С3Н6.
До формулы алкана не хватает С3Н8 — С3Н6 = 2Н два атома водорода.
Степень непредельности равна одному. То есть в молекуле органического вещества есть либо цикл, либо двойная связь.
Определите возможную структуру (наличие кратных связей, циклов) молекул, которым соответствуют следующие формулы:
а) CnH2n-2
б) CnH2n-4
в) CnH2n-6
г) CnH2n-8
а) CnH2n-2, степень ненасыщенности 4, в молекуле либо две двойные связи, либо цикл и двойная связь, либо тройная связь
б) CnH2n-4, степень ненасыщенности 6, в молекуле либо три двойные связи; цикл и тройная связь; тройная связь и двойная связь и др.
в) CnH2n-6, степень ненасыщенности 8:
4 двойные связи; цикл и 3 двойные связи; две тройные связи; тройная связь и две двойные связи и др.
г) CnH2n-8, степень ненасыщенности 10:
5 двойных связей; цикл и 4 двойные связи и др.
Немного необычные задачи на нахождение формулы органического вещества.
Задание №1
При сжигании 8,9 г неизвестного органического вещества было получено 1,12 л азота (н.у.), 6,3 г воды и 6,72 л углекислого газа (н.у.). Известно, что 1 моль этого вещества может прореагировать с 3 моль железа в кислой среде, а его молекула имеет несимметричное строение.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком алюминия в растворе соляной кислоты (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: C3H7NO2
2) структурная формула вещества, которая однозначно определяет порядок связи атомов в его молекуле:
CH3-CH2-CH2-NO2
3) уравнение реакции искомого вещества с избытком алюминия в растворе соляной кислоты:
CH3-CH2-CH2-NO2 + 2Al + 7HCl → CH3-CH2-CH2-NH3Cl + 2AlCl3 + 2H2O
Решение:
1) Поскольку в продуктах сгорания вещества присутствуют азот, вода и углекислый газ, то можно представить его молекулярную формулу в виде CxHyOzNk.
Вычислим количества и массы элементов, составляющих искомое органическое вещество:
ν(N2) = V/Vm = 1,12 л/22,4 л/моль = 0,05 моль;
ν(N) = 2ν(N2) = 2 · 0,05 моль = 0,1 моль;
m(N) = M · ν = 14 г/моль · 0,1 моль = 1,4 г;
ν(H2O) = m/M = 6,3 г/18 г/моль = 0,35 моль;
ν(H) = 2ν(H2O) = 2 · 0,35 моль = 0,7 моль;
m(H) = M · ν = 1 г/моль · 0,7 моль = 0,7 г;
ν(CO2) = V/Vm = 6,72 л/22,4 л/моль = 0,3 моль;
ν(C) = ν(CO2) = 0,3 моль;
m(C) = M · ν = 12 г/моль · 0,3 моль = 3,6 г.
Далее по разности проверим наличие в веществе кислорода:
m(O) = m(CxHyOzNk) − m(N) − m(H) − m(C) = 8,9 г − 1,4 г − 0,7 г − 3,6 г = 3,2 г.
Вычислим количество кислорода:
ν(O) = m/M = 3,2 г/16 г/моль = 0,2 моль.
Запишем соотношение по молям для элементов, составляющих структуру CxHyOzNk:
x : y : z : k = ν(C) : ν(H) : ν(O) : ν(N) = 0,3 : 0,7 : 0,2 : 0,1 = 3 : 7 : 2 : 1.
Следовательно, C3H7NO2 – молекулярная формула искомого органического соединения.
2) Далее по описанию в задаче попытаемся установить структурную формулу вещества. Общая формула CnH2n+1NO2 может соответствовать предельной аминокислоте, либо мононитроалкану. По условию вещество реагирует с железом в кислой среде в соотношении 1:3, что характерно для процесса восстановления нитрогруппы до амина, следовательно, искомым органическим веществом является мононитроалкан, для которого характерно два изомера – 1-нитропропан и 2-нитропропан. Поскольку молекула вещества имеет несимметричное строение, следовательно, этим веществом является 1-нитропропан.
Структурная формула органического соединения (1-нитропропан):
CH3-CH2-CH2-NO2
3) Запишем уравнение взаимодействия этого вещества с избытком алюминия в растворе соляной кислоты:
CH3-CH2-CH2-NO2 + 2Al + 7HCl → [CH3-CH2-CH2-NH3]+Cl— + 2AlCl3 + 2H2O
Задание №2
Неизвестное органическое соединение содержит 54,24% кислорода, 5,08% водорода и углерод. Определите молекулярную формулу данного соединения и установите его строение, если известно, что при взаимодействии 0,5 моль данного соединения с избытком гидрокарбоната натрия выделяется 22,4 л (н.у.) газа, а в его структуре отсутствуют третичные атомы углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком раствора гидроксида бария (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: С4Н6О4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение реакции искомого вещества с избытком раствора гидроксида бария:
Решение:
1) Поскольку в составе вещества присутствуют кислород, водород и углерод, то можно представить его молекулярную формулу в виде CxHyOz.
Пусть масса навески искомого органического вещества CxHyOz составляет 100 г. Вычислим массы и количества кислорода и водорода в его составе:
m(О) = m(CxHyOz) · ω(О)/100% = 100 г · 54,24%/100% = 54,24 г;
ν(О) = m/M = 54,24 г/16 г/моль = 3,39 моль;
m(Н) = m(CxHyOz) · ω(Н)/100% = 100 г · 5,08%/100% = 5,08 г;
ν(Н) = m/M = 5,08 г/1 г/моль = 5,08 моль.
Далее вычислим массу и количество углерода:
m(С) = m(CxHyOz) − m(О) − m(Н) = 100 г − 54,24 г − 5,08 г = 40,68 г;
ν(С) = m/M = 40,68 г/12 г/моль = 3,39 моль.
Запишем соотношение по молям для элементов, составляющих структуру CxHyOz:
x : y : z = ν(C) : ν(H) : ν(O) = 3,39 : 5,08 : 3,39 = 1 : 1,5 : 1 = 2 : 3 : 2; следовательно,
С2Н3О2 – простейшая формула искомого органического соединения.
Предположим, что n = 2, тогда формула вещества имеет состав С4Н6О4. Для данной формулы существует несколько изомеров. Поскольку по описанию вещество реагирует с гидрокарбонатом натрия с образованием газа, то в нем содержатся карбоксильные группы. Исходя из молекулярной формулы, их может быть одна или две. Вычислим количество газа и установим соотношения для моно− и дикарбоновой кислот:
ν(CO2) = V/Vm = 22,4 л/22,4 л/моль = 1 моль.
Реакция гидрокарбоната натрия с монокарбоновой кислотой:
R-COOH + NaHCO3 = R-COONa + CO2 + H2O, тогда
ν(CO2)/ν(R-COOH) = 1/1.
Реакция гидрокарбоната натрия с дикарбоновой кислотой:
HOOC-R-COOH + 2NaHCO3 = NaOOC-R-COONa + 2CO2 + 2H2O, тогда
ν(CO2)/ν(HOOC-R-COOH) = 2/1.
В нашем случае соотношение будет следующим:
ν(CO2)/ν(CxHyOz) = 1/0,5 = 2/1; следовательно, делаем вывод, что искомое органическое вещество − дикарбоновая кислота.
2) Поскольку в ее структуре нет третичных атомов углерода, то она имеет линейное строение.
Структурная формула дикарбоновой кислоты выглядит следующим образом (янтарная кислота):
3) Запишем реакцию искомого вещества с избытком раствора гидроксида бария:
Задание №3
При сжигании 7,375 г неизвестного органического вещества, не содержащего кислород, был получен хлороводород, 0,9 г воды и 6,6 г углекислого газа. Известно, что 1 моль этого вещества может прореагировать с 320 г 50%-ного водного раствора гидроксида натрия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком раствора гидроксида бария (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: C3H5Cl3
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
CH3-CH2-CCl3
3) уравнение взаимодействия этого вещества с избытком раствора гидроксида бария:
Пояснение:
1) Поскольку в продуктах сгорания органического вещества содержатся хлороводород, вода и углекислый газ, а кислород отсутствует, то можно представить его молекулярную формулу в виде CxHyClz.
Далее вычислим количества и массы водорода и углерода, присутствующих в составе искомого органического вещества (водород присутствует в молекуле воды (I) и хлороводорода (II)):
ν(H2O) = m/M = 0,9 г/18 г/моль = 0,05 моль;
νl(H) = 2ν(H2O) = 2 · 0,05 моль = 0,1 моль;
ml(H) = M · ν = 1 г/моль · 0,1 моль = 0,1 г;
ν(CO2) = m/M = 6,6 г/44 г/моль = 0,15 моль;
ν(C) = ν(CO2) = 0,15 моль;
m(C) = M · ν = 12 г/моль · 0,15 моль = 1,8 г.
Далее необходимо найти массу и количество в веществе хлора и части водорода, которая связалась с ним при сгорании исходного соединения. Их суммарную массу можно найти по разности:
m(Cl + H) = m(CxHyClz) − m(C) − ml(H) = 7,375 г − 1,8 г − 0,1 г = 5,475 г.
Поскольку соотношение хлора и водорода в HCl равно 1:1, можно обозначить количество элементов за х и решить уравнение:
M(Cl) · ν(Cl) + M(H) · ν(H) = m(Cl + H); следовательно,
35,5х + 1х = 5,475;
36,5х = 5,475;
х = 0,15 моль; следовательно,
ν(Cl) = 0,15 моль;
νll(H) = 0,15 моль.
Вычислим общее количество водорода в составе соединения:
ν(H) = νll(H) + νl(H) = 0,15 моль + 0,1 моль = 0,25 моль.
Запишем соотношение по молям для элементов, составляющих структуру CxHyOz:
x : y : z = ν(C) : ν(H) : ν(Cl) = 0,15 : 0,25 : 0,15 = 3 : 5 : 3; следовательно,
C3H5Cl3 – молекулярная формула искомого органического вещества.
2) Предположим, что n = 1, тогда получаем молекулярную формулу C3H5Cl3.
Существует несколько изомерных трихлорпропанов и все они реагируют с водным раствором щелочи. Рассмотрим возможные варианты:
CH2Cl-CHCl-CH2Cl + 3NaOH = CH2OH-CHOH-CH2OH + 3NaCl;
CH3-CHCl-CHCl2 + 3NaOH = CH3-CHOH-CHO + 3NaCl + H2O;
CH2Cl-CH2-CHCl2 + 3NaOH = CH2OH-CH2-CHO + 3NaCl + H2O;
CH3-CCl2-CH2Cl + 3NaOH = CH3-C(O)-CH2ОН + 3NaCl + H2O;
при этом ν(NaOH)/ν(C3H5Cl3) = 3/1.
CH3-CH2-CCl3 + 4NaOH = CH3-CH2-COONa + 3NaCl + 2H2O;
при этом ν(NaOH)/ν(C3H5Cl3) = 4/1.
Вычислим количество гидроксида натрия по данным условия и определим соотношение количеств вещества и щелочи:
m(NaOH) = m(р-ра NaOH) · ω(NaOH)/100% = 320 г · 50%/100% = 160 г;
ν(NaOH) = m/M = 160 г/40 г/моль = 4 моль;
ν(NaOH)/ν(C3H5Cl3) = 4/1.
Таким образом, приходим к выводу, что искомое органическое вещество − 1,1,1-трихлорпропан.
Структурная формула органического вещества (1,1,1-трихлорпропан):
CH3-CH2-CCl3
3) Запишем уравнение взаимодействия 1,1,1-трихлорпропана с с избытком раствора гидроксида бария:
Задание №4
Неизвестное органическое соединение содержит 18,25% натрия, 50,79% кислорода, 2,38% водорода и углерод. Определите молекулярную формулу данного соединения и установите его строение, если известно, что 1 моль данного соединения может прореагировать с 1 моль хлороводорода или 1 моль гидрокарбоната калия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком бромэтана (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: С3Н3О4Na
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:
3) уравнение взаимодействия этого вещества с избытком бромэтана:
Пояснение:
1) Поскольку в составе искомого органического вещества присутствуют натрий, кислород, водород и углерод, то можно представить его молекулярную формулу в виде CxHyOzNak. Пусть масса навески неизвестного вещества CxHyOzNak составляет 100 г, тогда вычислим массы и количества натрия, кислорода и водорода в его составе:
m(Na) = m(CxHyOzNak) · ω(Na)/100% = 100 г · 18,25%/100% = 18,25 г;
ν(Na) = m/M = 18,25 г/23 г/моль = 0,7935 моль;
m(О) = m(CxHyOzNak) · ω(О)/100% = 100 г · 50,79%/100% = 50,79 г;
ν(О) = m/M = 50,79 г/16 г/моль = 3,174 моль;
m(Н) = m(CxHyOzNak) · ω(Н)/100% = 100 г · 2,38%/100% = 2,38 г;
ν(Н) = m/M = 2,38 г/1 г/моль = 2,38 моль.
Далее вычислим массу и количество углерода, входящего в состав искомого органического вещества:
m(С) = m(CxHyOzNak) − m(Na) − m(О) − m(Н) = 100 г − 18,25 г − 50,79 г − 2,38 г = 28,58 г;
ν(С) = m/M = 28,58 г/12 г/моль = 2,382 моль.
Запишем соотношение по молям для элементов, составляющих структуру органического вещества:
x : y : z : k = ν(C) : ν(H) : ν(O) : ν(Na) = 2,382 : 2,38 : 3,174 : 0,7935 = 3 : 3 : 4 : 1.
С3Н3О4Na – простейшая формула искомого органического вещества.
2) Пусть n = 1, тогда молекулярная формула органического вещества − С3Н3О4Na. Поскольку данное вещество реагирует с гидрокарбонатом калия в соотношении 1:1, то предположим наличие одной карбоксильной группы в структуре:
R-COOH + KHCO3 = R-COOК + CO2 + H2O,
ν(CO2)/ν(R-COOH) = 1/1.
Тогда остается определить положение в структуре органического вещества 2 атомов кислорода и атома натрия. Поскольку данное вещество реагирует с хлороводородом в соотношении 1:1, то предположим наличие одного карбоксилат-аниона, связанного с катионом натрия:
R-COONa + HCl = R-COOH + NaCl;
ν(R-COONa)/ν(HCl) = 1/1.
Таким образом, в искомой структуре присутствуют одновременно карбоксильная группа и карбоксилат-анион.
Структурная формула органического вещества (мононатриевая соль малоновой кислоты):
3) Запишем уравнение взаимодействия этого вещества с избытком бромэтана:
Задание №5
При сжигании 5,2 г неизвестного органического вещества было получено 1,8 г воды и 3,36 л (н.у.) углекислого газа. Известно, что 1 моль этого вещества может прореагировать с 1 моль гидроксида бария или 0,5 моль порошка магния.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия этого вещества с избытком метанола в присутствии кислоты (используйте структурные формулы органических веществ).
Решение
Ответ:
1) молекулярная формула органического вещества: С3Н4О4
2) структурная формула вещества, которая однозначно отражает порядок связи атомов в его молекуле:3) уравнение реакции этого вещества с избытком метанола в присутствии кислоты:
Пояснение:
1) Поскольку в продуктах сгорания вещества присутствуют вода и углекислый газ, то можно представить его молекулярную формулу в виде CxHyOz. Далее вычислим количества и массы водорода и углерода, входящих в состав искомого органического соединения:
ν(H2O) = m/M = 1,8 г/18 г/моль = 0,1 моль;
ν(H) = 2ν(H2O) = 2 · 0,1 моль = 0,2 моль;
m(H) = M · ν = 1 г/моль · 0,2 моль = 0,2 г;
ν(CO2) = V/Vm = 3,36 л/22,4 л/моль = 0,15 моль;
ν(C) = ν(CO2) = 0,15 моль;
m(C) = M · ν = 12 моль · 0,15 моль = 1,8 г.
Далее по разности проверим наличие в веществе кислорода:
m(O) = m(CxHyOz) − m(H) − m(C) = 5,2 г − 0,2 г − 1,8 г = 3,2 г.
По расчету получилось, что в соединении присутствует кислород. Вычислим его количество:
ν(O) = m/M = 3,2 г/16 г/моль = 0,2 моль.
Запишем соотношение по молям для элементов, составляющих структуру искомого органического вещества:
x : y : z = ν(C) : ν(H) : ν(O) = 0,15 : 0,2 : 0,2 = 1,5 : 2 : 2 = 3 : 4 : 4.
С3Н4О4 – простейшая формула искомого органического вещества.
2) Пусть n = 1, тогда молекулярная формула С3Н4О4. Поскольку данное соединение реагирует с металлическим магнием, то можно предположить наличие в нем карбоксильных групп. Исходя из молекулярной формулы, их может быть одна или две. Установим соотношения моль реагентов для моно− и дикарбоновой кислот:
Для монокарбоновой кислоты:
2R-COOH + Mg = Mg(R-COO)2 + H2;
тогда ν(R-COOH)/ν(Mg) = 2/1.
Для дикарбоновой кислоты:
HOOC-R-COOH + Mg = Mg(OOC-R-COO) + H2;
тогда ν(HOOC-R-COOH)/ν(Mg) = 1/1.
В нашем случае соотношение будет следующим:
ν(CxHyOz)/ν(Mg) = 1/0,5 = 2/1.
Делаем вывод, что искомое вещество содержит только одну карбоксильную группу. Тогда оставшиеся два атома кислорода могут входить в состав сложноэфирной группы. Проверим гипотезу по соотношению моль веществ в реакции с гидроксидом бария:
RlOOC-R-COOH + Ba(OH)2 = Ba(OOC-R-COO) + RlOH + H2O;
тогда ν(RlOOC-R-COOH)/ν(Ba(OH)2) = 1/1.
В нашем случае соотношение по данным задачи будет следующим: ν(CxHyOz)/ν(Ba(OH)2) = 1/1.
Таким образом, в структуре искомого соединения присутствуют и карбоксильная, и сложноэфирная группы.
Структурная формула искомого органического вещества (монометиловый эфир щавелевой кислоты):
3) Запишем уравнение реакции этого вещества с избытком метанола в присутствии кислоты:
[adsp-pro-3]
Как написать структурную формулу
Структурная формула – это графическое изображение химического строения молекулы вещества, в котором показывается порядок связи атомов, их геометрическое расположение. Кроме того, она наглядно показывает валентность атомов входящих в ее состав.
Вам понадобится
- – ручка;
- – бумага;
- – периодическая система элементов.
Инструкция
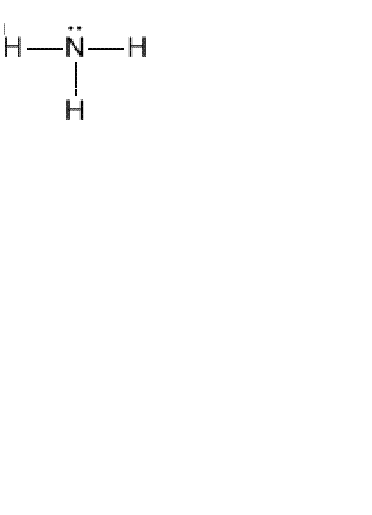
Для правильного написания структурной формулы того или иного химического вещества вы должны хорошо знать и представлять, что такое способность атомов образовывать определенное количество электронных пар с другими атомами. Ведь именно валентность поможет вам нарисовать химические связи. Например, дана молекулярная формула аммиака NH3. Вы должны написать структурную формулу. Учитывайте то, что водород всегда одновалентен, поэтому его атомы не могут быть связаны между собой, следовательно, они будут соединены с азотом.
Чтобы правильно написать структурные формулы органических соединений, повторите основные положения теории А.М. Бутлерова, согласно которой существуют изомеры – вещества с одинаковым элементарным составом, но с разными химическими свойствами. Например, изобутан и бутан. Молекулярная формула у них одинаковая: C4H10, а структурные – отличаются.
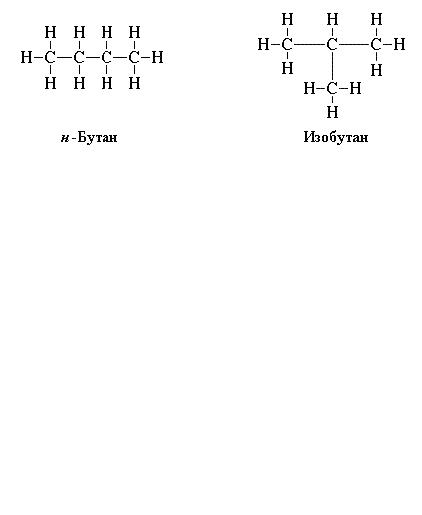
В линейной формуле каждый атом записывается отдельно, поэтому такое изображение занимает много места. Однако при составлении структурной формулы, вы можете указать общее число атомов водорода при каждом атоме углерода. А между соседними углеродами нарисуйте химические связи в виде линий.

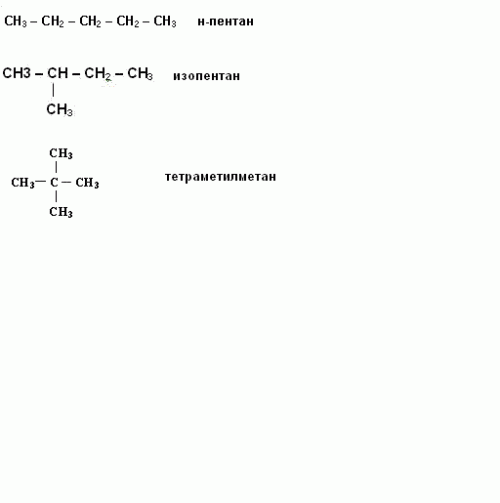
Написание изомеров начните с углеводорода нормального строения, то есть с неразветвленной цепью углеродных атомов. Затем сократите на один атом углерода, который присоедините к другому, внутреннему углероду. Исчерпав все варианты написания изомеров с данной длиной цепи, сократите ее еще на один углеродный атом. И опять присоедините его к внутреннему углеродному атому цепи. Например, структурные формулы н-пентана, изопентана, тетраметилметана. Таким образом, углеводород с молекулярной формулой C5H12 имеет три изомера.
Полезный совет
Для определения валентности атомов при составлении структурных формул используйте периодическую систему. Показать точно расстояние атомов в молекуле поможет трехмерная структурная формула.
Источники:
- структурная формула веществ
- Составление формул комплексных соединений
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.













