Смешанные соли
Смешанные
соли – это продукты замещения гидроксогрупп
многокислотного основания на кислотные
остатки разных кислот, например CaOClCl.
Смешанные
соли образованы одним и тем же катионом,
но разными анио-нами.
Например
:
|
BaClNO3 |
|
CaCl(OCl) |
Диссоциация
:
Смешанные
соли диссоциируют одноступенчато.
|
CaClBr |
Номенклатура Номенклатура средних солей
Международное
название средних солей состоит из двух
слов : названия аниона в именительном
падеже и названия катиона в родительном
падеже.
Например
|
K |
|
NaCl |
|
Na2SO4 |
|
СаCl2 |
|
(NH4)2SO4 |
Число
анионов и катионов, как правило, не
указывается. Но если один и тот же металл
проявляет различную степень окисления,
то её указывают в скобках римской цифрой
без пробела.
Например
:
|
FeSO4 |
|
Fe(SO4)3 |
Построение
названий средних солей.
|
Кислота |
Кислотный |
Валентность |
Название |
Примеры |
|
Азотная HNO3 |
NO3– |
I |
нитраты |
Ca(NO3)2
нитрат |
|
Кремниевая H2SiO3 |
SiO32- |
II |
силикаты |
Na2SiO3
силикат |
|
Серная H2SO4 |
SO42- |
II |
сульфаты |
PbSO4
сульфат |
|
Угольная H2CO3 |
CO32- |
II |
карбонаты |
Na2CO3
карбонат |
|
Фосфорная H3PO4 |
PO43- |
III |
фосфаты |
AlPO4
фосфат алюминия |
|
Сернистая H2SO3 |
SO32- |
II |
сульфиты |
Na2SO3
сульфит |
|
Марганцовая HMnO4 |
MnO4– |
I |
перманганатыы |
KMnO4
калия |
|
Хромовая H2CrO4 |
CrO42- |
II |
хроматы |
Na2CrO4
хромат |
|
Двухромовая H2CrO2 |
Cr2O72- |
II |
бихроматы |
Na2Cr2O7
бихромат |
Названия
кислородосодержащих средних солей
имеют окончания “ат“,
а названия бескислородных солей –
окончания “ид“.
В
некоторых случаях для кислородсодержащих
солей может использоваться окончание
“ит“.
Например:
|
Na2SO3 |
|
Na2SO4 |
|
Na2S |
Международные,
русские и традиционные названия некоторых
важных солей.
|
Соль |
Международное название |
Русское название |
Традиционное название |
|
Na2CO3 |
Карбонат |
Натрий углекислый |
Сода |
|
NaHCO3 |
Гидрокарбонат натрия |
Натрий
углекислый кислый |
Питьевая |
|
K2CO3 |
Карбонат |
Калий углекислый |
Поташ |
|
Na2SO4 |
Сульфат |
Натрий сернокислый |
Глауберова |
|
MgSO4 |
Сульфат |
Магний сернокислый |
Английская |
|
KClO3 |
Хлорат |
Калий Хлорноватокислыйый |
Бертолетова |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
$begingroup$
I suppose the formula of the Sulphate salt of Sodium & Potassium is $ce{KNaSO4}$ as the Pubchem site says so.
So, is there any rule that in the formulae such mixed metal salts we need to write the metals in the order of electropositivity?
![]()
andselisk♦
37.1k14 gold badges126 silver badges212 bronze badges
asked Jun 24, 2020 at 16:59
$endgroup$
0
$begingroup$
“$ce{KNaSO4}$” is correct, but not because of electronegativity order, but rather the alphabetical one.
From IUPAC “Red Book”, section IR-2.15 ORDERING PRINCIPLES [1, p. 40]:
IR-2.15.2 Alphabetical order
Alphabetical order is used in formulae as follows.(a) Within the group of cations and within the group of anions, respectively, in formulae of salts and double salts.
Deviations from this rule may be acceptable if it is desired to convey specific structural information, as in Example 5 below.Examples:
- $ce{BiClO}$ (anions $ce{Cl-}$ and $ce{O^2-})$
- $ce{NaOCl}$ (the anion is $ce{OCl-},$ cf. Section IR-4.4.3.1)
- $ce{KNa4Cl(SO4)2}$
- $ce{CaTiO3}$ (perovskite type)
- $ce{SrFeO3}$ (perovskite type)
Reference
- IUPAC “Red Book” Nomenclature of Inorganic Chemistry, 1st ed.; Connelly, N. G., Damhus, T., Hartshorn, R. M., Hutton, A. T., Eds.; IUPAC Recommendations; Royal Society of Chemistry: Cambridge, UK, 2005. (PDF)
answered Jun 24, 2020 at 17:12
![]()
andselisk♦andselisk
37.1k14 gold badges126 silver badges212 bronze badges
$endgroup$
1
- Курс
Меня зовут Быстрицкая Вера Васильевна.
Я репетитор по Химии
![[[pictureof]]](https://dist-tutor.info/s3/dist-tutor/user/20094/ava/thumbnails/mQ6siSVtAT1Szar.jpg)
Вам нужны консультации по Химии по Skype?
Если да, подайте заявку. Стоимость договорная.
Чтобы закрыть это окно, нажмите “Нет”.

СРЕДНИЕ СОЛИ
Катионы металла +анионы кислотного остатка
Названия средних солей состоят из двух частей: названия аниона (кислотного остатка) в именительном падеже и катиона в родительном.
Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой.
Например,
CuSO4 – сульфат меди (II);
NaCl – хлорид натрия.
КИСЛЫЕ СОЛИ
Катионы металла + катионы водорода + анионы кислотного остатка
Названия кислых солей образуются добавлением к аниону приставки гидро-, и, если необходимо, то с соответствующим числительным.
Например,
NaHSO4 – гидросульфат натрия;
KH2PO4 – дигидрофосфат калия.
ОСНОВНЫЕ СОЛИ
Катионы металла + анионы гидроксильных групп +анионы кислотного остатка
Названия основных солей образуются добавлением к аниону приставки гидроксо-, и, если необходимо, то с соответствующим числительным.
Например,
AlOHSO4 – гидроксосульфат алюминия;
Fe(OH)2Cl – дигидроксохлорид железа (III).
ДВОЙНЫЕ СОЛИ
Содержат два химически разных катиона;
например: CaMg(CO3)2, KAl(SO4)2, Fe(NH4)2(SO4)2.
Названия двойных солей состоят из двух частей: названия аниона в именительном падеже и катионов в родительном в алфавитном порядке.
Число катионов и анионов, как правило, не указывается. Если один и тот же металл проявляет различную степень окисления, то её указывают в скобках римской цифрой.
Например,
KAl(SO4)2 – сульфат алюминия – калия;
(NH4)2Fe(SO4)2 – сульфат железа (II) – аммония.
СМЕШАННЫЕ СОЛИ
Содержат два химически разных аниона; например: Mg₂SO₄CO3, K₃ClSO4, FeNO₃SO3.
Названия смешанных солей состоят из двух частей: названия 2 анионов в именительном падеже и катиона в родительном падеже.
Число катионов и анионов, как правило, не указывается. Если металл проявляет различную степень окисления, то её указывают в скобках римской цифрой.
КОМПЛЕКСНЫЕ СОЛИ
Содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
например:
K4[Fe(CN)6]- гексацианоферрат (II) калия (или желтая кровяная соль),
K3[Fe(CN)6] – гексацианоферрат (III) калия (или красная кровяная соль).

При названии соединений с комплексным анионом комплексообразователь называют по латински, добавляя суффикс -ат.
Валентность комплексообразователя указывают римскими цифрами в скобках после названия комплексного аниона.
Число лигандов обозначают с помощью греческих числительных: 1 – моно-, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса.
Название катиона указывают в родительном падеже.
Например,
Na[Al(OH)4] – тетрагидроксоалюминат натрия;
K3[Cu(CN)4] –
(NH4)2[Hg(NCS)4] – тетрароданомеркурат (II) аммония.
Наиболее часто встречаемые анионы
CN- – циано;
CO32- – карбонато;
OH- – гидроксо;
Cl- – хлоро;
F- – фторо;
I- – иодо;
CH3COO- – ацетато;
CNS- – родано и т.д.
Некоторые нейтральные лиганды имеют специальные названия: CO – карбонил; H2O – аква; NH3 – аммин.

КРИСТАЛЛОГИДРАТЫ
кристаллические гидраты определенного состава (Na2CO3× 10H2O – декагидрат карбоната натрия).





Содержание:
Понятие о солях:
В предыдущем параграфе продукты замещения атомов водорода атомами металла имели формулы 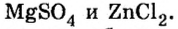
Для этого разделим каждую формулу черточкой на две части:
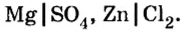
Легко заметить, что первая составная часть формулы представлена металлическими элементами, а вторая — кислотными остатками. Кроме рассмотренных примеров, существует много веществ, формулы которых содержат металлические и кислотные остатки. Все они относятся к классу соединений, который получил название соли.
Соли — это сложные вещества, образованные атомами металлов и кислотными остатками
В отличие от кислот, представители класса солей имеют немолекулярное строение, их структурными частями являются ионы — катионы металлов и анионы кислотных остатков.
Формулу солей в общем виде можно записать так:

Номенклатура солей
Номенклатура солей (речь пойдет о так называемых средних солях, которые соответствуют приведенной общей формуле и являются продуктами полного замещения атомов водорода в кислоте). Название солей состоит из двух слов: названия металлического элемента и названия кислотного остатка в именительном падеже, например  — хлорид натрия.
— хлорид натрия.
Если металл имеет переменную валентность, ее указывают в круглых скобках после его символа без интервала, например: 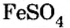 — сульфат железа
— сульфат железа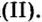
Кроме современных названий солей, которые отвечают указанным правилам, за некоторыми солями сохранились исторические названия, например: 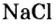 — поваренная соль.
— поваренная соль.
Определение валентности металлов в формулах солей и составление формул солей по валентности. Определяя валентность металла в формуле соли или составляя формулы солей, придерживаются общего правила, как при определении валентности элементов в бинарных соединениях и составлении их формул.
Сумма единиц валентности одной части формулы соли (атомов металла) равна сумме единиц валентности второй ее части (кислотного остатка).
Пример №
Определить валентность хрома в солях, формулы которых: 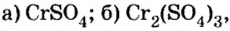 и назвать их.
и назвать их.
Решение
Обе соли содержат двухвалентный кислотный остаток серной кислоты.
Сумма единиц валентности кислотного остатка в первой формуле равна 2. Такой же должна быть и сумма валентностей атомов хрома. Поскольку атом хрома в этой формуле один, то обе валентности принадлежат ему. Следовательно, хром в формуле 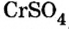 двухвалентен.
двухвалентен.
Во второй формуле кислотных остатков — три. Поэтому сумма единиц их валентностей составляет 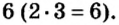 Атомов хрома в этой формуле два, а сумма единиц их валентностей также равна 6. Значит, валентность одного атома хрома в соединении составляет
Атомов хрома в этой формуле два, а сумма единиц их валентностей также равна 6. Значит, валентность одного атома хрома в соединении составляет 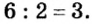
Ответ: 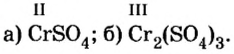
Пример №
Составить формулу нитрата алюминия.
Решение
1. Записываем символы металла и кислотного остатка: 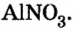
2. Над металлом и кислотным остатком проставляем валентность:
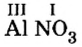
3. Для единиц валентности металла и кислотного остатка находим наименьшее общее кратное: это число 3.
4. Делением общего кратного 3 на валентность металла и кислотного остатка находим индексы:
а) 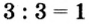 (индекс алюминия);
(индекс алюминия);
б) 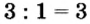 (индекс кислотного остатка).
(индекс кислотного остатка).
Полученные индексы вписываем в формулу нитрата алюминия: 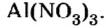
Ответ: 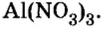
Из общей формулы солей следует, что индекс металла совпадает с валентностью кислотного остатка, а индекс кислотного остатка — с валентностью металла. Однако, как и у оксидов, в формулах кислот четных индексов нет. Поэтому при составлении формул кислот по валентности проводят сокращение четных индексов.
Физические свойства солей
При нормальных условиях соли находятся только в твердом состоянии. Это тугоплавкие кристаллические вещества, поэтому, чтобы перевести их в жидкое состояние, а тем более в парообразное, нужны высокие температуры. Так, температура плавления сульфида бария равна 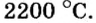
По способности растворяться в воде соли делят на растворимые (хлорид натрия, нитрат калия), малорастворимые (сульфит магния, хлорид свинца и нерастворимые (карбонат кальция, сульфат бария). Информация о растворимости солей и кислот содержится в таблице растворимости этих соединений в воде (см. Приложение).
и нерастворимые (карбонат кальция, сульфат бария). Информация о растворимости солей и кислот содержится в таблице растворимости этих соединений в воде (см. Приложение).
Соли — это вещества без запаха, разного вкуса. Может показаться, что класс веществ «Соли» получил такое название благодаря соленому вкусу его соединений. В действительности же с «чистым» соленым вкусом существует лишь одна соль, и вам она хорошо известна, это — хлорид натрия. Врачи предостерегают от избыточного употребления поваренной соли, однако в жизненно необходимых порциях хлорида натрия нуждается организм и человека, и животных. Она нужна для поддержания состава крови, а также вырабатывания желудочного сока. Физраствор, который используется для лечения больных,— ничто иное, как раствор хлорида натрия.
Соли бериллия — сладкие на вкус, соли магния — горькие, карбонат кальция (мел) — безвкусный. В большинстве своем соли имеют смешанный вкус — кисло-сладкий, горько-соленый.
Помните! В химическом кабинете соли ни в коем случае не пробуют на вкус!
Большинство солей белого цвета. Цвет перманганата калия 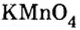 фиолетовый,хлорида железа
фиолетовый,хлорида железа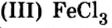 — коричнево-красный, ортофосфата серебра
— коричнево-красный, ортофосфата серебра 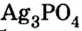 — желтый.
— желтый.
Внимательно рассмотрите образцы солей, которые учитель демонстрирует вам на урюке, и определите цвет и растворимость каждой из них.
Итоги:
- К классу солей относятся сложные вещества, образованные атомами металлов и кислотными остатками.
- В формулах солей сумма единиц валентности металла равна сумме единиц валентности кислотного остатка.
- Составляя формулу соли, необходимо знать валентность металла и кислотного остатка.
- По современной номенклатуре, названия солей образуют из названия металла и названия кислотного остатка и проставляют валентность металлов, у которых она имеет несколько значений.
Наиболее распространенной из солей угольной кислоты является карбонат кальция 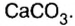 Кроме того, что эта соль — основная составляющая мрамора, мела, известняка, доломита, существует также несколько необычная форма нахождения ее в природе — из карбоната кальция и незначительного количества других веществ в теле некоторых моллюсков формируются жемчужины. Это округлые, гладкие, с перламутровым отблеском образования, в состав которых входит 86—90 % карбоната кальция, 6—12 % органического клейкого вещества конхиолина, выделяемого моллюском, когда в его раковину попадет посторонний предмет, и вода. Конхиолин крепко склеивает тоненькие пластинки карбоната кальция.
Кроме того, что эта соль — основная составляющая мрамора, мела, известняка, доломита, существует также несколько необычная форма нахождения ее в природе — из карбоната кальция и незначительного количества других веществ в теле некоторых моллюсков формируются жемчужины. Это округлые, гладкие, с перламутровым отблеском образования, в состав которых входит 86—90 % карбоната кальция, 6—12 % органического клейкого вещества конхиолина, выделяемого моллюском, когда в его раковину попадет посторонний предмет, и вода. Конхиолин крепко склеивает тоненькие пластинки карбоната кальция.
Жемчужина формируется в раковине моллюска вокруг раздражителей — чаще всего песчинок — и приблизительно за 12 лет вырастает величиной с горошину. Большие жемчужины правильной формы — чрезвычайная редкость.
Жемчуг издавна используют в качестве украшений. Особенно ценятся жемчужины правильной шарообразной формы. Они очень дорогостоящие: жемчужина диаметром 1 см стоит около 4000 долларов.
Средняя продолжительность хранения жемчужин составляет от 250 до 500 лет, после чего они теряют блеск и их легко измельчить в порошок.
Скелет других водных обитателей — коралловых полипов — по составу близок к жемчугу. Большие скопления коралловых полипов образуют коралловые рифы. В результате археологических раскопок обнаружилось, что люди издавна изготавливают украшения из кораллов (так называется скелет коралловых полипов). Благодаря несколько иному составу, чем у жемчужин, такие изделия сохраняются дольше. В зависимости от содержания органических веществ, кораллы бывают разного цвета: розовые, красные и даже черные. Изготовленные из таких кораллов украшения — ожерелья, серьги, кольца — считаются самыми дорогими. Владельцам кораллов нужно знать, что даже при легком нагревании эти драгоценности теряют свой цвет.
Что такое соли
К классу солей принадлежит соединение, которое мы употребляем ежедневно вместе с пищей. Это — поваренная соль 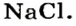 Вам известно, что она состоит из ионов
Вам известно, что она состоит из ионов 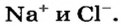
Соль — соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка.
Ион кислотного остатка имеет отрицательный заряд; его значение совпадает со значением валентности этого остатка:
- кислота
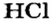
- кислотный остаток
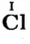
- анион кислотного остатка
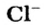
Формулы солей. Для солей, как и кислот, существуют две общие формулы — 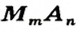 и
и 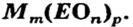 Первой формуле соответствуют соли, которые содержат анионы кислотных остатков безоксигеновых кислот, а второй — соли, анионы которых происходят от оксиген-содержащих кислот.
Первой формуле соответствуют соли, которые содержат анионы кислотных остатков безоксигеновых кислот, а второй — соли, анионы которых происходят от оксиген-содержащих кислот.
Примеры формул солей
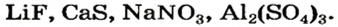
Для того чтобы составить формулу соли, необходимо знать заряды катиона и аниона, а также учитывать то, что соединение электро-нейтрально. Для выяснения значений зарядов ионов можно использовать таблицу, размещенную на форзаце 2 (так называемая таблица растворимости).
Составим формулу соли, которая содержит катионы 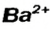 и анионы
и анионы 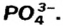 В состав соли входят ионы, значения зарядов которых не одинаковы: 2 и 3. Наименьшее число, которое делится без остатка на 2 и 3, — число 6. Делим его на значения зарядов катиона (6 : 2 = 3) и аниона (6:3 = 2). Получаем количество этих ионов в формульной единице соединения, т. е. соответствующие индексы в химической формуле соли:
В состав соли входят ионы, значения зарядов которых не одинаковы: 2 и 3. Наименьшее число, которое делится без остатка на 2 и 3, — число 6. Делим его на значения зарядов катиона (6 : 2 = 3) и аниона (6:3 = 2). Получаем количество этих ионов в формульной единице соединения, т. е. соответствующие индексы в химической формуле соли:
Графические формулы для солей, как и для других ионных соединений, не составляют.
Названия солей
Для каждой соли существует химическое название, а для некоторых солей — еще и тривиальные названия (табл. 2). Химическое название соли состоит из двух слов. Первое слово — название металлического элемента, а второе происходит от химического названия соответствующей кислоты.
Формулы и названия некоторых солей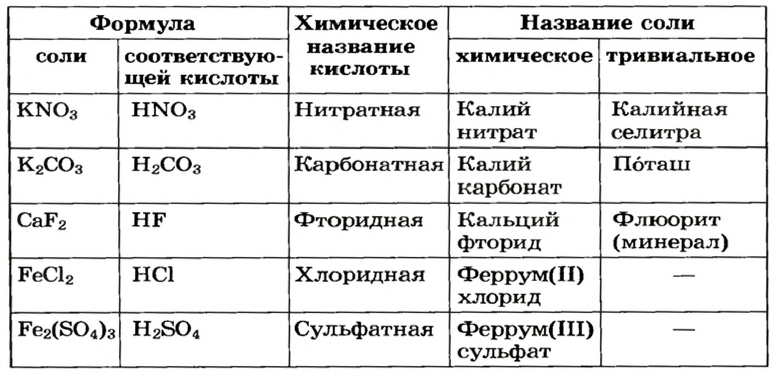
Если элемент имеет переменную валентность, то ее значение указывают после названия элемента (табл. 2, рис. 12). Склоняется только второе слово химического названия соли.

Существуют соли, образованные только неметаллическими элементами. В их состав входят катионы аммония 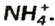 Примеры формул и названий таких соединений:
Примеры формул и названий таких соединений:
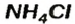 — аммоний хлорид;
— аммоний хлорид;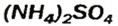 — аммоний сульфат;
— аммоний сульфат;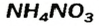 — аммоний нитрат.
— аммоний нитрат.
Два последних соединения применяют в качестве азотных удобрений.
Соли аммония происходят от основания 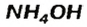 (§ 11).
(§ 11).
Распространенность в природе
В земной коре содержится много солей (рис. 13). В основном, это силикаты. Среди них встречаются и драгоценные камни: голубой топаз (алюминий силикат), золотистый циркон (цирконий силикат), бесцветный фенакит (бериллий силикат) и др.

Существует много залежей натрий хлорида NaCl (каменная соль), калий хлорида КС1, кальций карбоната СаС03 (мел, мрамор, известняк). Последнее соединение составляет основу ракушек, яичной скорлупы (рис. 14). Сульфиды 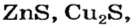
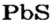 и другие являются рудами; из них получают металлы.
и другие являются рудами; из них получают металлы.

Различные соли находятся в растворенном состоянии в гидросфере. В морской воде преобладают хлориды Натрия и Магния, а в пресной — соли Кальция и Магния (в основном карбонатной и сульфатной кислот).
Выводы:
Соль — ионное соединение, в состав которого входят катионы металлического элемента и анионы кислотного остатка. Для солей существуют общие формулы 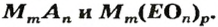
Каждая соль имеет химическое название, а некоторые соли — еще и тривиальные названия. Соли очень распространены в природе.
Свойства и применение солей
Физические свойства солей: Соли, как и другие ионные соединения, при обычных условиях являются кристаллическими веществами. Они обычно имеют высокие температуры плавления:
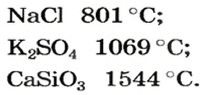
Часть солей растворяется в воде, некоторые являются малорастворимыми (рис. 31), а остальные — нерастворимые. Соответствующая информация помещена в таблице растворимости (форзац 2).

Образование растворов солей часто сопровождается тепловыми эффектами. Например, при растворении натрий карбоната выделяется небольшое количество теплоты и раствор немного нагревается. А во время приготовления раствора натрий нитрата можно зафиксировать незначительное понижение температуры.
Лишь одна соль — натрий хлорид — имеет соленый вкус. Многие другие растворимые соли горькие, а соли Плюмбума и Бериллия сладкие, но чрезвычайно ядовитые. Определяя вкус различных солей, некоторые алхимики, вероятно, поплатились за это жизнью.
Соли по-разному влияют на растения, животных, человека. Среди них есть соединения, которые содержат необходимые для растений элементы; их применяют в качестве удобрений. А поваренную соль мы ежедневно употребляем вместе с пищей, чтобы пополнить ее запасы в организме (это соединение постоянно выводится из организма вместе с потом и мочой).
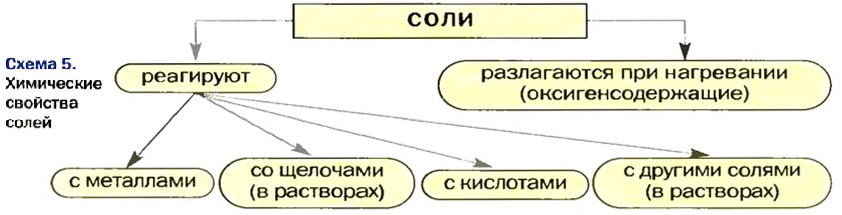
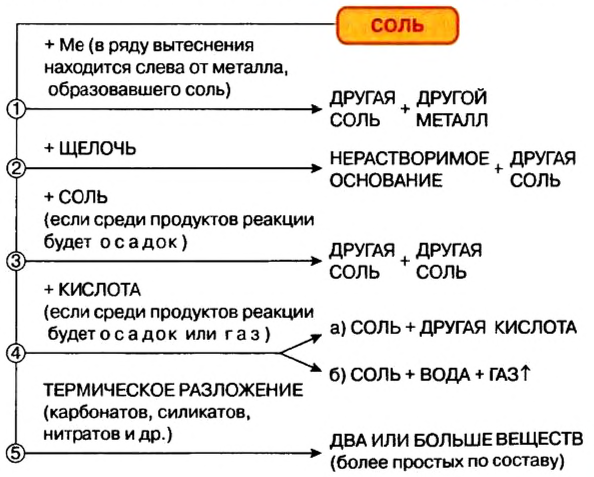
Химические свойства солей: Соли вступают в разнообразные реакции с простыми и сложными веществами.

Реакции с металлами
Соль в водном растворе может реагировать с металлом с образованием новой соли и другого металла (рис. 32). Часто говорят, что один металл «вытесняет» другой из раствора соли. Реакция происходит, если металл-реагент активнее, чем металл-продукт, т. е. находится в ряду активности слева от него (форзац 2):
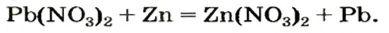
Изучая основания и кислоты, вы узнали о реакциях этих соединений с солями. Кроме того, соли также могут взаимодействовать друг с другом. Все упомянутые реакции относят к реакциям обмена.
Реакции со щелочами
Реакция между солью и щелочью происходит лишь в растворе (нерастворимые соли со щелочами не взаимодействуют). Она возможна, если один из ее продуктов — основание или соль — выпадает в осадок (рис. 33):
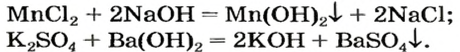
Для прогнозирования возможности таких реакций используют таблицу растворимости (форзац 2).
Если к раствору купрум(II) сульфата добавить столько раствора щелочи, сколько необходимо для полного превращения соли в купрум(II) гидроксид, то после отстаивания над осадком увидим бесцветный раствор. Он будет содержать лишь натрий сульфат (ионы 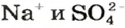 ).
).
Реакции с кислотами
Соль (как растворимая, так и нерастворимая) может взаимодействовать с кислотой с образованием новой соли и новой кислоты. Такие реакции часто сопровождаются выделением осадка (рис. 34) или газа
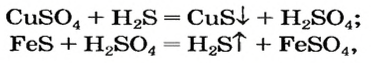
но иногда остаются незаметными:
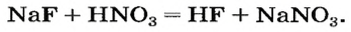
Случаи, в которых реакция между солью и кислотой возможна, указаны в §12(с. 81).


Реакции с другими солями
Взаимодействие между двумя солями происходит лишь в растворе (реагенты должны быть растворимыми в воде) с образованием двух новых солей. Реакция возможна, если один из ее продуктов выпадает в осадок (рис. 35), т. е. является нерастворимым или малорастворимым соединением.
Примеры реакций между двумя солями:
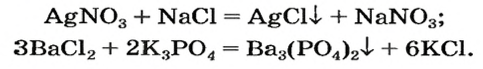
Термическое разложение солей
Оксиген-содержащие соли, образованные газообразными, летучими или неустойчивыми оксидами, при нагревании разлагаются. Продуктами этих реакций, как правило, являются два соответствующих оксида:
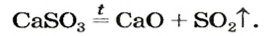
Нитраты, как и нитратная кислота, происходят от нитроген(V) оксида 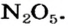 Однако при нагревании нитратов этот оксид не образуется, поскольку он термически неустойчив:
Однако при нагревании нитратов этот оксид не образуется, поскольку он термически неустойчив:
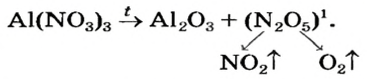
Соли щелочных элементов либо не разлагаются (карбонаты, сульфаты), либо их разложение происходит своеобразно. Некоторые из таких реакций используют в лаборатории для получения кислорода:
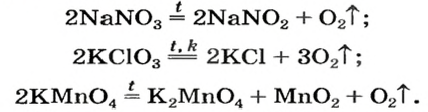
Изложенный материал обобщен в схеме 5.
1 – Так разлагаются нитраты металлических элементов от Магния до Купрума включительно (см. ряд активности металлов).
Применение солей
Многие соли применяются на практике. Натрий хлорид является сырьем для промышленного получения хлора, хлоридной кислоты, натрий гидроксида, соды. Это соединение незаменимо для приготовления пищи, консервирования. Хлорид, сульфат, нитрат Калия, фосфаты Кальция, некоторые другие соли применяют в качестве минеральных удобрений (рис. 36). Кальций карбонат в виде камня известняка используют в строительстве, а на заводах из него производят известь.

На основе искусственно полученной соли изготовляют зубную пасту. В школе пишут на доске мелом, а это — также кальций карбонат. Кальций сульфат (гипс) применяют в строительстве и медицине. Простым средством для мытья и чистки посуды, предметов домашнего обихода, смягчения воды перед стиркой является кальцинированная сода, или натрий карбонат. Кальцинированную соду вместе с мелом или известняком используют в производстве стекла.
Выводы:
Соли — ионные вещества. Они имеют высокие температуры плавления, различную растворимость в воде.
Соли взаимодействуют с металлами с образованием другой соли и другого металла. Такие реакции происходят, если металл-реагент более активный, чем металл-продукт (это определяют с помощью ряда активности металлов).
Соли вступают в реакции обмена со щелочами, кислотами, другими солями. Некоторые оксигенсодержащие соли при нагревании разлагаются на соответствующие оксиды. Многие соли используются на практике.
Кислые соли
Вы знаете, что при реакции кислоты со щелочью атомы Гидрогена каждой молекулы кислоты «заменяются» атомами (точнее — ионами) металлического элемента:
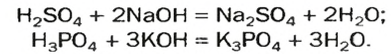
А возможна ли замена только части атомов Гидрогена в молекуле многоосновной кислоты? Да. В результате соответствующих реакций образуются так называемые кислые соли:
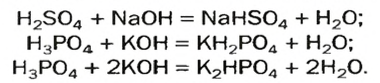
Кислые соли  содержатся в растворенном состоянии в пресной воде. При ее кипячении эти соединения разлагаются
содержатся в растворенном состоянии в пресной воде. При ее кипячении эти соединения разлагаются
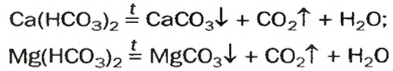
и на стенках сосуда образуется накипь — смесь карбонатов 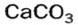 и
и 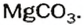
Кислые соли Кальция и ортофосфатной кислоты
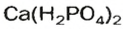 составляют основу фосфорных удобрений — преципитата и суперфосфата соответственно. Кислая соль Натрия и карбонатной кислоты
составляют основу фосфорных удобрений — преципитата и суперфосфата соответственно. Кислая соль Натрия и карбонатной кислоты  известна каждой домохозяйке, зто — питьевая (пищевая) сода (рис. 37).
известна каждой домохозяйке, зто — питьевая (пищевая) сода (рис. 37).

Способы получения солей
Соли можно получать значительно большим количеством способов, чем оксиды, основания или кислоты.
Три способа получения солей предполагают проведение химических реакций с участием металлов.
Способ 1: металл + неметалл 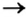 соль. Этим способом можно получать безоксиге-новые соли:
соль. Этим способом можно получать безоксиге-новые соли:
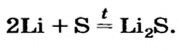
Способ 2: металл + кислота (раствор) 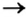 соль + водород.
соль + водород.
В такие реакции вступают сульфатная (в разбавленном растворе), хлоридная, некоторые другие кислоты и металлы, находящиеся в ряду активности слева от водорода:
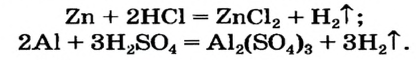
Способ 3: металл 1 + соль 1 (в растворе) 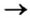 металл 2 + соль 2.
металл 2 + соль 2.
Вам известно, что такая реакция возможна, если металл 1 активнее металла 2, т. е. металл 1 находится в ряду активности слева от металла 2:
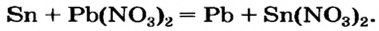
Несколько других способов получения солей предусматривают использование реакций между соединениями, которые проявляют основные и кислотные свойства (§ 9, 11 —13).
Способ 4: основание (амфотерный гидроксид) + кислота (амфотерный гидроксид)  соль + вода (рис. 42):
соль + вода (рис. 42):
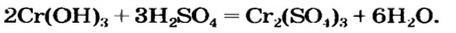
Способ 5: основный (амфотерный) оксид + кислотный (амфотерный) оксид  соль:
соль:
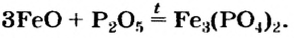
Способ 6: основание + кислотный (амфотерный) оксид  соль + вода:
соль + вода:
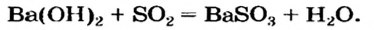
Способ 7: кислота + основный (амфотерный) оксид  соль + вода:
соль + вода:
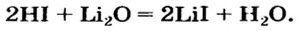
Соли также получают с помощью реакций обмена с участием солей (§ 14).
Способ 8: соль 1 + кислота 1  соль 2 + кислота 2:
соль 2 + кислота 2:
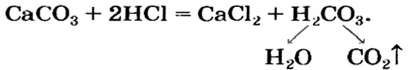
Способ 9: соль 1 + щелочь  соль 2 + основание:
соль 2 + основание:
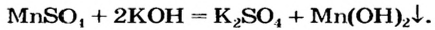
Способ 10: соль 1 -I- соль 2 —> соль 3 + соль 4 (рис. 43):
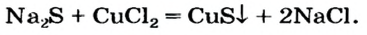
Это интересно. Солис  и некоторые другие до сих пор не получены.
и некоторые другие до сих пор не получены.

Способы 5 и 6 непригодны для получения солей безоксигеновых кислот, поскольку эти кислоты не имеют кислотных оксидов.
Выбирая способы 8—10, учитывают то, что реакция обмена возможна в случае образования осадка, газа или слабой кислоты (§11, 12, 14).
Вышеизложенное обобщено в схеме 9.
Пример №
Предложить максимальное количество способов получения магний сульфата 
Решение
Магний сульфат — оксигенсодержащая соль. Поэтому способ 1 для получения соединения не подходит.
Эту соль можно получить, исходя из металла (способы 2 и 3): 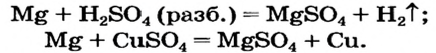
Магний сульфат может образоваться в результате реакций между соответствующими соединениями основного и кислотного характера (способы 4—7):
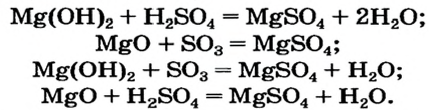
Для реакции соли с кислотой (способ 8) нужно взять соль Магния, образованную слабой или летучей кислотой либо способной разлагаться с выделением газа, и сульфатную кислоту:
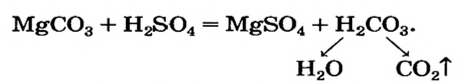
Реакция соли со щелочью (способ 9) для получения магний сульфата не подходит, поскольку одним из реагентов должен быть гидроксид 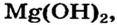 а он является малорастворимым соединением.
а он является малорастворимым соединением.
Магний сульфат растворяется в воде. Учитывая это, выберем для реакции между двумя солями (способ 10) такие реагенты:
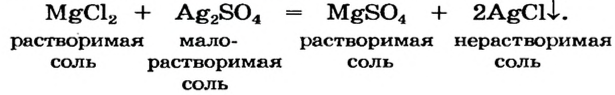
Выводы:
Соли получают несколькими способами. Часть способов основана на реакциях металлов с неметаллами, кислотами, солями. Другие способы предусматривают осуществление реакций между соединениями с основными и кислотными свойствами, а также реакций обмена с участием солей.
Химические свойства солей
Соли, как и другие классы неорганических соединений, способны участвовать в химических реакциях.
Взаимодействие солей с металлами
Соли (в растворе) взаимодействуют с металлами, расположенными в вытесни-тельном ряду до того металла, из атомов которого они образовались. В результате реакции образуются новая соль и металл.
Опыт 1. Четыре химических стакана наполним растворами солей: два — сульфатом меди и еще два — сульфатом железа
и еще два — сульфатом железа В стакан с сульфатом меди
В стакан с сульфатом меди опустим железную пластину, второй оставим для сравнения. То же проделаем с растворами сульфата железа
опустим железную пластину, второй оставим для сравнения. То же проделаем с растворами сульфата железа но в один из стаканов опустим медную пластину. Вскоре в стакане с железной пластиной голубой раствор станет светлее по сравнению с контрольным раствором. А в стакане с медной пластиной коричневая окраска раствора сульфата железа
но в один из стаканов опустим медную пластину. Вскоре в стакане с железной пластиной голубой раствор станет светлее по сравнению с контрольным раствором. А в стакане с медной пластиной коричневая окраска раствора сульфата железа не изменится и будет одинаковой с контрольным раствором. Через 5—10 мин достанем железную пластину и увидим, что та ее часть, которая находилась в растворе сульфата меди
не изменится и будет одинаковой с контрольным раствором. Через 5—10 мин достанем железную пластину и увидим, что та ее часть, которая находилась в растворе сульфата меди покрылась слоем меди. Достанем также медную пластину — с ней не произошло никаких изменений, и цвет растворов сульфата железа
покрылась слоем меди. Достанем также медную пластину — с ней не произошло никаких изменений, и цвет растворов сульфата железа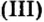 в обоих стаканах остался одинаковым. Запишем уравнения реакций:
в обоих стаканах остался одинаковым. Запишем уравнения реакций:
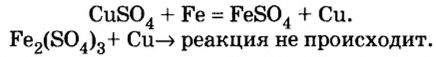
В реакции, которая состоялась, атомы простого вещества замещают атомы металлического элемента в сложном веществе. Поэтому эта реакция относится к реакциям замещения. Результаты опыта согласовываются с местом в вытеснительном ряду металлов, взятых для проведения опыта.
Взаимодействие солей с основаниями (щелочами)
В предыдущем параграфе вы узнали о том, что единственный способ, которым можно получить нерастворимое основание определенного металлического элемента,— это взаимодействие его растворенной в воде соли со щелочью. Такое взаимодействие мы рассматривали и при изучении свойств щелочей. Поэтому вспомним, что для протекания реакции вещества должны находиться в растворенном состоянии, а один из образовавшихся продуктов реакции — выпадать в осадок, например:
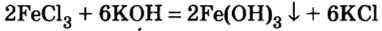
Взаимодействие солей с кислотами
Соли вступают в реакцию обмена с кислотами при условии, что среди продуктов реакции есть осадок или газ. (Вспомните взаимодействие соляной кислоты с нитратом серебра или питьевой соды — с уксусной кислотой.) Проведем соответствующие опыты.
Опыт 2. К раствору хлорида бария  добавим раствор серной кислоты
добавим раствор серной кислоты 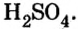 Реакция происходит быстро и завершается образованием белого осадка:
Реакция происходит быстро и завершается образованием белого осадка:
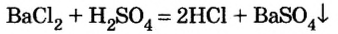
Среди образовавшихся продуктов нерастворимым веществом является сульфат бария.
Взаимодействие солей с солями
Повторим опыт 2, заменив серную кислоту на одну из ее растворимых солей.
Опыт 3. К раствору сульфата натрия 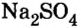 добавим раствор хлорида бария
добавим раствор хлорида бария 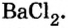 Взаимодействие происходит так же быстро, и так же образуется белый осадок:
Взаимодействие происходит так же быстро, и так же образуется белый осадок:
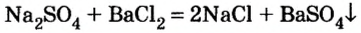
С помощью раствора хлорид бария или другого растворенного в воде соединения бария можно обнаружить в растворе серную кислоту и ее соли.
Опыт 4. К раствору карбоната натрия добавим раствор азотной кислоты. Наблюдается выделение газообразного вещества. Поднесенная к отверстию пробирки зажженная спичка гаснет. Следовательно, выделяется углекислый газ:
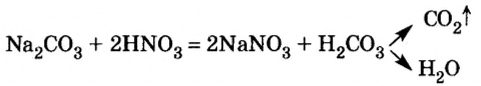
Для формулировки окончательного обоснованного вывода о химических свойствах солей проведите химический эксперимент, предусмотренный лабораторными опытами 7, 8, 9.
Итоги:
- Взаимодействие солей с другими веществами происходит в растворе.
- Одним из продуктов взаимодействия солей с другими веществами всегда является соль.
- Соли проявляют такие типичные химические свойства:
- Соли серной кислоты можно обнаружить в растворе с помощью растворов солей бария.
Соли, при образовании которых в молекуле кислоты все атомы водорода замещаются атомами металла, получили название средних солей. Средние соли не содержат ни атомов водорода, ни гидроксильных групп, а в их состав входят атомы одного металлического элемента, например: 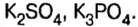
Кроме средних, существуют еще и другие соли, в частности кислые, основные, двойные.
Кислые соли являются продуктом неполного замещения атомов водорода в молекуле кислоты на металл. Поэтому кислотные остатки таких солей содержат атомы водорода, например: 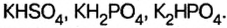
В молекулах серной и ортофосфорной кислот замещен на металл 1 атом водорода, поэтому остатки 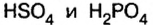 одновалентны. В формуле
одновалентны. В формуле  замещены на металл 2 атома водорода, следовательно, валентность кислотного остатка
замещены на металл 2 атома водорода, следовательно, валентность кислотного остатка  равна 2. Как видим, кислые соли образуются кислотами, которые содержат 2 и более атомов водорода. Наличие одного атома водорода в составе кислых солей обозначают, добавляя слово «гидро», двух — «дигидро»:
равна 2. Как видим, кислые соли образуются кислотами, которые содержат 2 и более атомов водорода. Наличие одного атома водорода в составе кислых солей обозначают, добавляя слово «гидро», двух — «дигидро»:  — гидросульфат калия;
— гидросульфат калия; 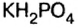 — дигидросульфат калия;
— дигидросульфат калия; 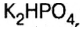 — гидрофосфат калия.
— гидрофосфат калия.
Основными называют соли, полученные частичной нейтрализацией основания кислотой (например,  — гидроксохлорид магния), двойными — соли, полученные замещением атомов водорода атомами двух металлов (например,
— гидроксохлорид магния), двойными — соли, полученные замещением атомов водорода атомами двух металлов (например, 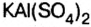 — сульфат калия алюминия).
— сульфат калия алюминия).
Какая образуется соль — средняя, кислая или основная — зависит от количества взятых для проведения реакции реагентов.
Соли в природе
По распространенности неорганических соединений в природе соли занимают второе место после оксидов. Так, горные породы и глина состоят из солей кремниевой кислоты, которые имеют сложное строение. Их формулы записывают с помощью формул оксидов, например формула полевого шпата — 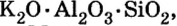 глины —
глины — 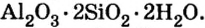
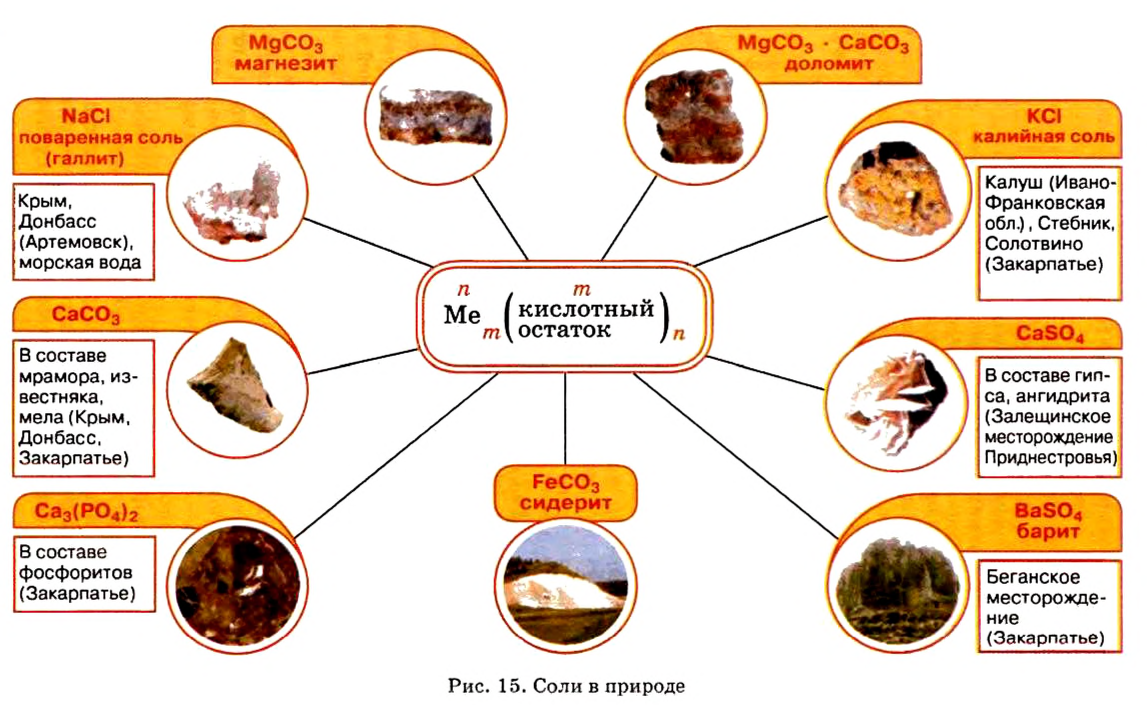
Местонахождение залежей солей в Украине представлено на рисунке 15.
Наиболее известная вам соль — хлорид натрия 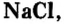 или поваренная соль (минерал такого состава называется галит). Месторождения этой соли в Украине расположены вблизи г. Артемовен Донецкой области, в Автономной Республике Крым, в Карпатах. Человек очень давно оценил значение хлорида натрия и стал использовать эту соль как пищевой продукт и консервант (соление рыбы, мяса, грибов, квашение овощей и т. п.). Было время, когда соль стоила дороже золота: еще в старину возник обычай встречать гостей хлебом-солью. Существует поговорка: «Чтобы узнать человека, нужно с ним пуд соли съесть». Пуд долгое время был распространенной единицей массы, он равен 16 кг. Человек за год потребляет около 3 кг соли. Нетрудно подсчитать, что два человека пуд соли съедят примерно за 2,5—3 года. Так жизненный опыт подтверждает мудрость этой поговорки.
или поваренная соль (минерал такого состава называется галит). Месторождения этой соли в Украине расположены вблизи г. Артемовен Донецкой области, в Автономной Республике Крым, в Карпатах. Человек очень давно оценил значение хлорида натрия и стал использовать эту соль как пищевой продукт и консервант (соление рыбы, мяса, грибов, квашение овощей и т. п.). Было время, когда соль стоила дороже золота: еще в старину возник обычай встречать гостей хлебом-солью. Существует поговорка: «Чтобы узнать человека, нужно с ним пуд соли съесть». Пуд долгое время был распространенной единицей массы, он равен 16 кг. Человек за год потребляет около 3 кг соли. Нетрудно подсчитать, что два человека пуд соли съедят примерно за 2,5—3 года. Так жизненный опыт подтверждает мудрость этой поговорки.
Как сырье хлорид натрия используется для производства гидроксида натрия, натрия, хлора, соляной кислоты, мыла, синтетических моющих средств. В пищевой, кондитерской и фармацевтической промышленности используют такие соли: хлорид натрия, карбонат натрия, нитрат натрия, сульфат магния и другие.
Карбонат кальция 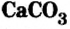 является основной составляющей известняка, мрамора, мела. Известняк используют для получения оксида кальция (негашеной извести), известкования кислых почв (уменьшение в них содержания кислот), удаления из состава чугуна (во время его производства) таких кислотных оксидов, как оксид кремния
является основной составляющей известняка, мрамора, мела. Известняк используют для получения оксида кальция (негашеной извести), известкования кислых почв (уменьшение в них содержания кислот), удаления из состава чугуна (во время его производства) таких кислотных оксидов, как оксид кремния и оксид фосфора
и оксид фосфора Вместе с глиной и песком известняк используют в производстве цемента.
Вместе с глиной и песком известняк используют в производстве цемента.
Кости позвоночных животных и человека содержат ортофосфат кальция 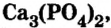 а зубы — еще и фторид кальция
а зубы — еще и фторид кальция 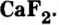 Если на зубной пасте отмечено, что она содержит фтор, в действительности это означает наличие в ней фторида кальция и других соединений фтора.
Если на зубной пасте отмечено, что она содержит фтор, в действительности это означает наличие в ней фторида кальция и других соединений фтора.
Соли входят также в состав крови, клеточного сока, нервной и мускульной тканей.
Из курсов природоведения и ботаники вам известно, что для полноценного роста и развития растениям нужны химические элементы калий, азот, фосфор. Их вносят в почву в виде минеральных удобрений. По своему составу почти все минеральные удобрения — это соли, в частности 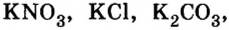
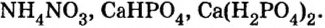
Широко применяется и соль сульфата кальция 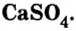 Порошок природного минерала гипса
Порошок природного минерала гипса 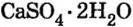 нагревают до температуры
нагревают до температуры 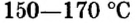 и превращают в алебастр
и превращают в алебастр 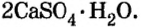 Как видно из приведенных формул, в алебастре на 1 моль сульфата кальция приходится в 4 раза меньше молей воды, чем в гипсе. Гипсовые повязки, гипсовые строительные материалы, барельефы, статуи и т. п. сделаны из алебастра, который после смешивания с водой твердеет и становится гипсом.
Как видно из приведенных формул, в алебастре на 1 моль сульфата кальция приходится в 4 раза меньше молей воды, чем в гипсе. Гипсовые повязки, гипсовые строительные материалы, барельефы, статуи и т. п. сделаны из алебастра, который после смешивания с водой твердеет и становится гипсом.
Карбонат натрия 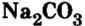 применяют для изготовления стекла, бумаги, тканей, в мыловарении.
применяют для изготовления стекла, бумаги, тканей, в мыловарении.
В плавательных бассейнах цвет воды обусловлен наличием в ней сульфата меди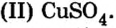 Эту соль добавляют в воду не для подкрашивания, а чтобы не допустить размножения и роста водорослей.
Эту соль добавляют в воду не для подкрашивания, а чтобы не допустить размножения и роста водорослей.
Хлорид калия 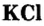 распространен в природе в виде минерала сильвина. Это вещество используют в качестве калийного удобрения, а также в производстве калия и гидроксида калия.
распространен в природе в виде минерала сильвина. Это вещество используют в качестве калийного удобрения, а также в производстве калия и гидроксида калия.
Из ортофосфата кальция 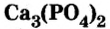 получают ортофосфорную кислоту и фосфорные удобрения.
получают ортофосфорную кислоту и фосфорные удобрения.
Сульфат бария 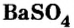 применяют как рентгеноконтрастное вещество в медицинской практике.
применяют как рентгеноконтрастное вещество в медицинской практике.
Ознакомившись с рисунком 16, вы пополните знания о применении солей новыми сведениями.
Приведенные здесь примеры — лишь небольшая часть того, как используются соли.

Итоги:
- Соли относятся к распространенным в природе сложным неорганическим веществам, среди которых больше всего хлоридов, силикатов, карбонатов, сульфатов, ортофосфатов.
- Часть солей используется непосредственно после добычи, а часть поддается химической переработке с целью получения новых веществ.
- Соли находят самое разнообразное применение в химической промышленности и многих других отраслях народного хозяйства, а также в быту.
Вода морей и океанов из-за содержащихся в ней различных солей на вкус солено-горькая. 100 г морской воды в среднем содержат 3,5 г солей, среди которых хлорида натрия почти 78 %. Моря и океаны имеют разную соленость — YaK называют содержание солей в единице объема морской воды. Однако состав солей в морской воде практически одинаков. Поэтому ученые считают, что Мировой океан в давние времена был единым.
Морские растения и животные приспособились к жизни в соленой воде. Более того, в их организмах накапливаются ионы, которые входят в состав солей морей и океанов. Морепродукты богаты кальцием, кремнием, иодом, медью, магнием, фосфором и другими элементами.
Используя сведения из географии и различных информационных источников, подготовьте рассказ (сообщение, реферат) о распространении какой-либо соли в природе и ее использовании.
Поработайте самостоятельно с дополнительной литературой, Интернетом и выясните, на каких химических свойствах солей основывается производство из них других веществ. Рассказ подтвердите примерами.
Справочный материал по солям
Соли можно получить многими способами:
1) взаимодействием металла с кислотой:
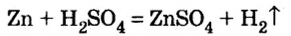
(Какой это тип реакции?)
Вспомните особенности взаимодействия кислот с металлами. Для получения солей каких металлов можно применить этот способ?
2) взаимодействием оксида металла с кислотой:
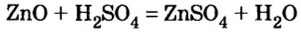
3) взаимодействием гидроксида металла с кислотой:
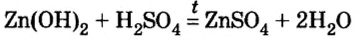
4) взаимодействием соли с кислотой:
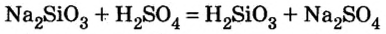
5) взаимодействием основного или амфотерного оксида с кислотным оксидом:
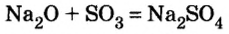
6) взаимодействием металла с раствором соли другого металла:
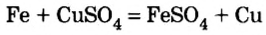
7) взаимодействием металла с неметаллом (получают соли бескислородных кислот):
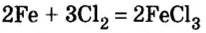
Итоги:
- В результате химических реакций образуются различные соединения. Это позволяет из соответствующих реагентов получать необходимые вещества.
- К общим способам получения оксидов относятся: окисление простых и сложных веществ, разложение нерастворимых гидроксидов при нагревании и др.
- К общим способам получения растворимых оснований (щелочей) относятся: взаимодействие металлов с водой, взаимодействие оксидов с водой и электролиз (разложение) растворов солей бескислородных кислот.
- Нерастворимые основания получают взаимодействием раствора их соли с раствором щелочи.
- Соли получают взаимодействием простого вещества (металла), сложных веществ (оксида металла, гидроксида металла, соли) с веществами, в состав которых входит кислотный остаток (кислота, соль), а также взаимодействием кислотных оксидов с основными оксидами или щелочами.
В лаборатории щелочь можно получить из металла и из оксида. Но чистых металлов натрия, калия, кальция, бария и их оксидов в природе не существует. Поэтому этими способами получают щелочи лишь в лабораториях. Чтобы обеспечить щелочами различные производства, нужны другие способы их получения из природного сырья. Впервые щелочь была получена электролизом (разложением постоянным электрическим током) раствора соли хлорида натрия. Электролиз стал основным промышленным способом производства щелочей гидроксида натрия и гидроксида калия.
Как происходит электролиз, вы будете изучать позже. А пока запишем суммарное уравнение электролиза водного раствора хлорида натрия:
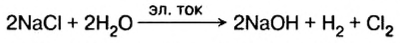
Из записи уравнения видно, что из доступных природных веществ — поваренной соли и воды — получают три новых вещества, которых в природе нет, но каждое из них используется в промышленности, а значит есть потребность в их получении.
Классификация
Заполните таблицу.
| Химическая формула | Название | Тип соли |
| (CuOH)2CO3 | ? | ? |
| Fe2(SO4)3 | ? | ? |
| (NH4)2Cr2O7 | ? | ? |
| BaClNO3 | ? | ? |
| NaKSO4 | ? | ? |
Какие соли вам известны ? Как можно отличить соли друг от друга?
Соли получаются в результате замещения атомов водорода в молекуле кислоты атомами металла, а в основаниях гидроксильной группы (ОН.) кислотными остатками.
Солями называются вещества, в составе которых содержатся атомы металла (или аммония) и кислотный остаток. Соли классифицируют по их составу.
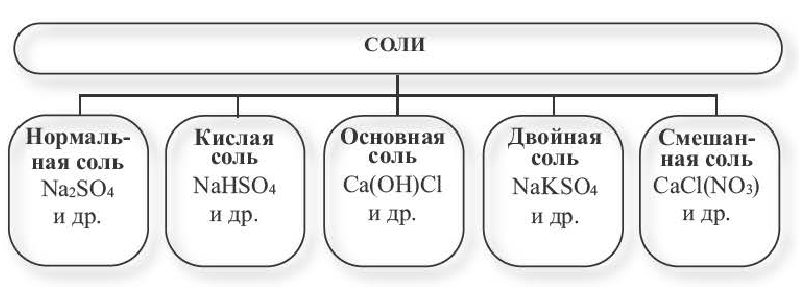
Графические формулы
Нормальные, кислые и двойные соли рассматриваются как продукты замещения атомов водорода в молекуле кислоты атомами металла.
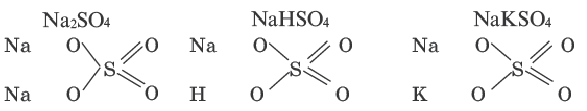
Основные же соли рассматриваются как продукты замещения гидроксильной группы кислотным остатком.

Номенклатура
Нормальные соли. Соли, полученные в результате полного замещения атомов водорода, относящихся к основности кислот, атомами металлов, называются нормальными солями.
При наименовании нормальных солей, если металл обладает постоянной валентностью, то вначале дается название кислотного остатка, а затем название металла. Если же металл имеет переменную валентность, то вначале дается название кислотного остатка, следом название металла и его валентность (в скобках римскими цифрами).
| Нормальная соль | Название | Нормальная соль | Название | |
| Ah(SO4)3 | Сульфат алюминия | FeSO4 | Сульфат железа (II) |
Кислые соли
Соли, полученные в результате частичного замещения атомов водорода, относящихся к основности кислоты, атомами металлов (или же сложными ионами, например, ионами аммония), называются кислыми солями.
При наименовании кислых солей вначале дается название кислотного остатка с указанием на греческом количества атомов водорода, относящихся к основности кислоты и не замещенных металлом, с приставкой «гидро». При одном атоме водорода приставка «моно» не употребляется.
| Кислые соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| CaHPO4 | гидроортофосфат кальция | NH4H2PO4 | дигидроортофосфат аммония |
Основные соли
Соли, полученные в результате частичного замещения гидроксильных групп оснований кислотными остатками, называются основными солями.
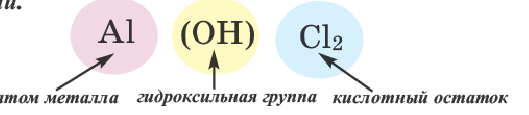
Как и нормальные соли, при наименовании основных солей к кислотным остаткам здесь добавляется приставка «гидроксо» с указанием на греческом количества гидроксильных групп (ОН), не замещенных кислотным остатком. Если гидроксильная группа одна, то приставка «моно» не употребляется.
| Основные соли | ||||
| Гидросоли | Дигидросоли | |||
| Формула | Название | Формула | Название | |
| Al(OH)Cl2 | гидроксохлорид алюминия | Al(OH)2Cl | дигидроксохлорид алюминия |
Двойные соли. Соли, полученные в результате замещения атомами двух разных металлов атомов водорода, относящихся к основности кислот в многоосновных кислотах, называются двойными солями.
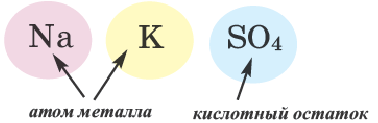
При наименовании двойных солей после названия кислотного остатка даются оба названия металлов.
| Двойная соль | Название | Двойная соль | Название |
| NaKCO3 | карбонат натрия-калия | Na2KPO4 | ортофосфат динатрия-калия |
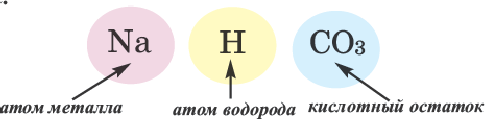
Смешанные соли
Соли, полученные в результате замещения гидроксильных групп в многокислотных основаниях двумя различными кислотными остатками, называются смешанными солями.
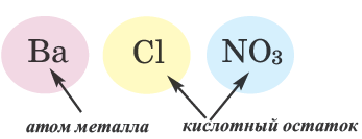
Если в составе смешанных солей содержатся бескислородные и кислородсодержащие кислотные остатки, то вначале даются названия бескислородных, а затем кислородсодержащих кислотных остатков.
| Смешанная соль | Название | Смешанная соль | Название |
| CaCl(OCl) (или CaOC2) | Хлорид гипохлорит кальция | BaClNO3 | хлорид нитрат бария |
Получение
При взаимодействии металлов с неметаллами
2Fe + ЗСЕ  2FeCl3
2FeCl3
2Na + Cl2  2NaCl
2NaCl
При взаимодействии металлов с солями. Начиная с элемента Mg в ряду активности металлов, каждый металл вытесняет последующие металлы из растворов их солей.
Zn + CuSO4 → ZnSO4 + Cu
При взаимодействии солей с солями. Такие реакции протекают в растворе в том случае, если обе исходные соли растворимы в воде и при их взаимодействии получится нерастворимая в воде соль.
Ca(NO3)2 + Na2CO3 → CaCO3↓ + 2NaNO3
Соли не вступают в реакцию с нерастворимыми в воде солями и основаниями.
Ca(NO3)2 + Cu(OH)2  реакция не протекает
реакция не протекает
При взаимодействии однокислотных оснований с одноосновными кислотами, независимо от количества их молей, всегда получится нормальная соль.
KOH + HCI → KCl + H2O
При взаимодействии многоосновных кислот с многокислотными основаниями, в зависимости от количества молей веществ, получаются нормальная соль, кислая соль или основная соль. Для этого следует сравнить количество атомов водорода, показывающих основность кислоты, с количеством гидроксильных групп (ОН), выражающих кислотность основания.
При добавлении многоосновной кислоты к смеси двух различных оснований получится двойная соль.
NaOH + KOH + H2SO4 → 2H2O + NaKSO4
При нейтрализации одного многокислогного основания двумя различными кислотами получится смешанная соль.
Ca(OH)2+ HCl + HBr → CaClBr+ 2H2O
Физические и химические свойства солей
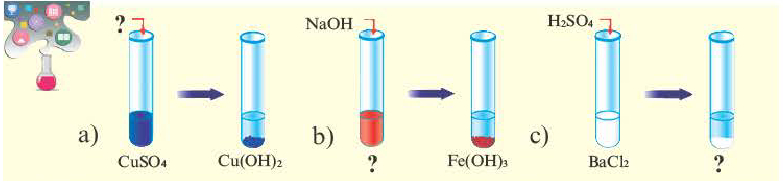
Определите вещества в соответствии с вопросительными знаками. Какие из представленных солей нерастворимы в воде?
Физические свойства:
Соли это твердые вещества с разной способностью к растворению и цветом. Все соли натрия (Na), калия (К) и аммония (NH ), а также кислые соли растворяются в воде. C увеличением количества атомов водорода, относящихся к основности кислых солей, увеличивается и их растворимость в воде (за исключением NaHCO3).
), а также кислые соли растворяются в воде. C увеличением количества атомов водорода, относящихся к основности кислых солей, увеличивается и их растворимость в воде (за исключением NaHCO3).
Ca3(PO4)2 → CaHPO4 → Ca(H2PQ4)2

увеличивается растворимость
Солям в основном присуща высокая температура плавления и кипения.
| Растворимость солей в воде | |
| Нерастворимые и малорастворимые | Растворимые |
| СaS04, BaS04, SrS04, PbS04, Ag2S04 | Остальные сульфаты растворяются в воде |
| AgCl, PbCl2, Hg2Cl2 | Другие хлориды растворяются в воде |
| FeS, CuS, PbS, ZnS и др. | Na2S, K2S, (NH4)2S |
| Другие ортофосфаты не растворяются вводе | Na3PO4, K3PO4, (NH4)3PO4 |
| Другие силикаты не растворяются в воде | Na2SiO3, K2SiO3 |
| Другие карбонаты не растворяются в воде | Na2CO3, K2CO3, (NH4)2CO3 |
| Все соли азотной кислоты, Na, К, NH4 растворяются в воде |
Химические свойства:
C химическими свойствами солей вы ознакомились при изучении свойств щелочей и кислот, способов получения оксидов и солей.
Кислые, основные, в том числе и двойные соли могут проявлять многие химические свойства нормальных солей. Кроме того, кислые соли легко нейтрализуются щелочами, а основные соли кислотами.
NaHSO4 + NaOH  Na2SO4 +H2O
Na2SO4 +H2O
Mg(OH)Cl + HCl → MgCl2 + H2O
Основные соли могут взаимодействовать с щелочами.
Al(OH)2Cl+ NaOH → Al(OH)3↓ +NaCl
При нагревании большинства кислых солей (кроме солей аммония) они разлагаются с образованием нормальной соли.
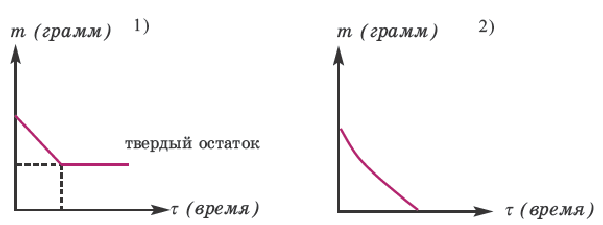
При разложении солей металлов (кроме Hg(NO3)2) всегда выделяется твердый остаток (или оксид металла, или же полученная новая соль в твердом виде). Поэтому разложение этих солей происходит как в 1-ом графике. При разложении большинства аммонийных солей твердый остаток не выделяется. Вот почему их разложение происходит как во 2-ом графике.
Некоторые соли при взаимодействии с водой образуют вещества кристаллогидраты.
Na2CO3 +10H2O → Na2CO3 . 10H2O
кристаллическая сода
При нагревании кристаллогидраты вновь обезвоживаются.
CuSO4 . 5H2O  CuSO4+ 5H2O
CuSO4+ 5H2O
синий кристалл белый кристалл
Вода, входящая в состав кристаллов в виде химических соединений, называется кристаллизационной водой. Кристаллогидрат это не просто набор из воды и соли, а вещество. Вода и соль лишь условно разделены точкой.
Многоосновные кислоты, вступая в реакцию соединения с нормальными солями, образуют кислую соль.
Применение солей
Большинство солей широко применяются в промышленности и быту. Так, например, всем хорошо известно применение поваренной соли (NaCl) в быту. В промышленности ее используют при получении гидроксида натрия, соды, хлора, натрия и др. Соли азотной и оргофосфорной кислот в основном считаются минеральными удобрениями.
Многие средства защиты растений от болезнетворных микробов и вредителей, ряд лекарственных препаратов также относятся к классу солей. Более подробные сведения о применении отдельных солей будут представлены при изучении химических элементов.
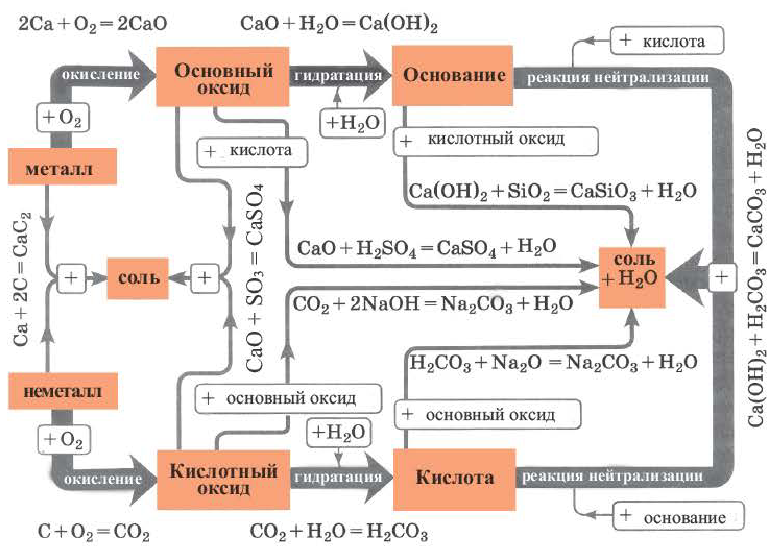
Генетическая связь между классами неорганических соединений
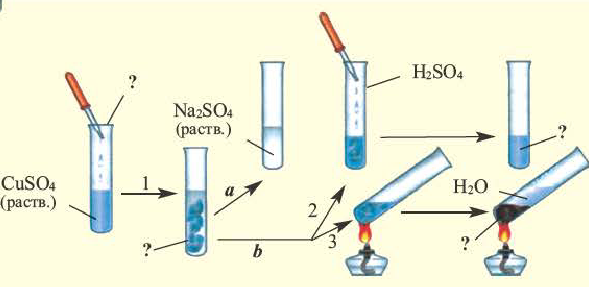
Обратите внимание на пробирки и содержащиеся в них вещества. Определите генетическую связь между этими веществами и запишите уравнения реакций.
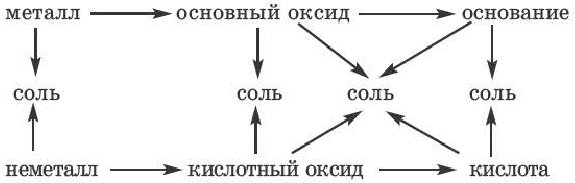
Возможность получения из представителей одного класса неорганических соединений представителей другого класса свидетельствует о наличии между ними генетической связи. Взаимосвязь между веществами отдельных классов можно проследить по нижеприведенной схеме:
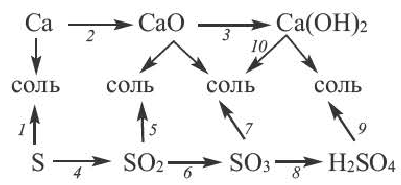
Получение одного представителя неорганических соединений из другого основывается на их химических свойствах. Приведем один пример относительно генетических связей неорганических соединений.
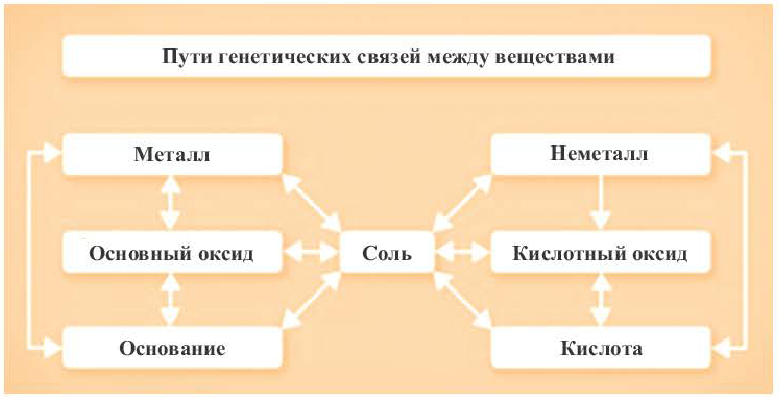
В качестве примера генетической связи между неорганическими веществами можно привести следующие схемы.
Задача:
Какие вещества взаимодействуют и с Na2CO3, и с Zn(OH)2?
1) HCl 2) MgSO4 3)K0H 4) Ca(OH)2 5) H2SO4
Решение: Na2CO3, вступая в реакцию с сильными кислотами (HC1, HBr, HI, HNO2, H2SO4, H2PO4), выделяет соль и CO2.
В таком случае:
1) Na2CO3+ 2HC1 → 2NaCl + C02↑ + H2O
2) Na2CO3+ H2SO4 → Na2SO4+ CO2↑ + H2O
Поскольку Zn(OH)2 является амфотерным основанием, оно вступает в реакцию как с сильными кислотами (HC1, HBr, HI, HNO3, H3PO4, H2SO4), так и с щелочами (NaOH, КОН, Ca(OH)2, Ba(OH)2). В таком случае:
1) Zn(OH)2+ 2HC1 → ZnCl2+ 2H2O
2) Ca(OH)2 + Zn(OH)2 → CaZnO + 2H2O
3) Zn(OH)2+ H2SO4→ ZnSO4+ 2H2O
В то время как Zn(OH)2 вступает в реакцию с КОН, Na2CO3 в эту реакцию не вступает.
C другой стороны, основание Zn(OH)2, находящееся в виде осадка, не вступает в реакцию ни с одной солью.
Ответ: 1, 4, 5
- Хлор в химии
- Сера в химии
- Азот в химии
- Фосфор в химии
- Озон как химический элемент
- Оксиды в химии
- Основания в химии
- Кислоты в химии
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
- Галогениды серебра (кроме AgF):
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Химические свойства солей

О чем эта статья:
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Так получают только соли бескислородных кислот.
Металл, стоящий левее H2 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + H2
Металл с раствором соли менее активного металла:
Основный оксид + кислотный оксид:
Основный оксид и кислота:
Основание с кислотным оксидом:
Основание с кислотой (реакция нейтрализации):
Взаимодействие соли с кислотой:
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.
Реакция раствора основания с раствором соли:
Взаимодействие растворов двух солей с образованием новых солей:
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Кислот с оксидами металлов:
Гидроксидов металлов с кислотами:
Кислот с солями:
Аммиака с кислотами:
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
Получение основных солей
Взаимодействие кислоты с избытком основания:
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Взаимодействие солей слабых кислот со средними солями:
Получение комплексных солей
Реакции солей с лигандами:
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Химические свойства солей
Химические свойства средних солей
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы. Средние соли диссоциируют сразу:
Нитраты разлагаются в зависимости от активности металла соли:
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства. В остальных случаях разложение солей аммония сопровождается выделением аммиака:
Взаимодействие солей с металлами:
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
Химические свойства кислых солей
Диссоциация. Кислые соли диссоциируют ступенчато:
Термическое разложение с образованием средней соли:
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Химические свойства основных солей
Реакции солей с кислотами — образование средней соли:
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.
Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза. Продукты реакции — два амфотерных гидроксида и соль активного металла:
Разлагаются при нагревании:
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Формула какого вещества пропущена в уравнении реакции:
Химия
План урока:
Оксиды
В состав оксидов ВСЕГДА входит ТОЛЬКО два элемента, один из которых будет кислород. В этом классе соединений срабатывает правило, третий элемент лишний, он не запасной, его просто не должно быть. Второе правило, степень окисления кислорода равна -2. Из выше сказанного, определение оксидов будет звучать в следующем виде.
Оксиды в природе нас окружают повсюду, честно говоря, сложно представить нашу планету без двух веществ – это вода Н2О и песок SiO2.
Вы можете задаться вопросом, а что бывают другие бинарные соединения с кислородом, которые не будут относиться к оксидам.
Поранившись, Вы обрабатываете рану перекисью водорода Н2О2. Или для примера соединение с фтором OF2. Данные вещества вписываются в определение, так как состоят из 2 элементов и присутствует кислород. Но давайте определим степени окисления элементов.
Данные соединения не относятся к оксидам, так как степень окисления кислорода не равна -2.
Кислород, реагируя с простыми, а также сложными веществами образует оксиды. При составлении уравнения реакции, важно помнить, что элементу О свойственна валентность II (степень окисления -2), а также не забываем о коэффициентах. Если не помните, какую высшую валентность имеет элемент, советуем Вам воспользоваться периодической системой, где можете найти формулу высшего оксида.
Рассмотрим на примере следующих веществ кальций Са, мышьяк As и алюминий Al.
Подобно простым веществам реагируют с кислородом сложные, только в продукте будет два оксида. Помните детский стишок, а синички взяли спички, море синее зажгли, а «зажечь» можно Чёрное море, в котором содержится большое количество сероводорода H2S. Очевидцы землетрясения, которое произошло в 1927 году, утверждают, что море горело.
Чтобы дать название оксиду вспомним падежи, а именно родительный, который отвечает на вопросы: Кого? Чего? Если элемент имеет переменную валентность в скобках её необходимо указать.
Классификация оксидов строится на основе степени окисления элемента, входящего в его состав.
Реакции оксидов с водой определяют их характер. Но как составить уравнение реакции, а тем более определить состав веществ, строение которых Вам ещё не известно. Здесь приходит очень простое правило, необходимо учитывать, что эта реакция относиться к типу соединения, при которой степень окисления элементов не меняется.
Возьмём основный оксид, степень окисления входящего элемента +1, +2(т.е. элемент одно- или двухвалентен). Этими элементами будут металлы. Если к этим веществам прибавить воду, то образуется новый класс соединений – основания, состава Ме(ОН)n, где n равно 1, 2 или 3, что численно отвечает степени окисления металла, гидроксильная группа ОН- имеет заряд –(минус), что отвечает валентности I.При составлении уравнений не забываем о расстановке коэффициентов.
Аналогично реагируют с водой и кислотные оксиды, только продуктом будет кислота, состава НхЭОу. Как и в предыдущем случае, степень окисления не меняется, тип реакции – соединение. Чтобы составить продукт реакции, ставим водород на первое место, затем элемент и кислород.
Особо следует выделить оксиды неметаллов в степени окисления +1 или +2, их относят к несолеобразующим. Это означает, что они не реагируют с водой, и не образуют кислоты либо основания. К ним относят CO, N2O, NO.
Чтобы определить будет ли оксид реагировать с водой или нет, необходимо обратиться в таблицу растворимости. Если полученное вещество растворимо в воде, то реакция происходит.
Золотую середину занимают амфотерные оксиды. Им могут соответствовать как основания, так и кислоты, но с водой они не реагируют. Они образованные металлами в степени окисления +2 или +3, иногда +4. Формулы этих веществ необходимо запомнить.
Кислоты
Если в состав оксидов обязательно входит кислород, то следующий класс узнаваем будет по наличию атомов водорода, которые будут стоять на первом месте, а за ними следовать, словно нитка за иголкой, кислотные остатки.
В природе существует большое количество неорганических кислот. Но в школьном курсе химии рассматривается только их часть. В таблице 1 приведены названия кислот.
Валентность кислотного остатка определяется количеством атомов водорода. В зависимости от числа атомов Н выделяют одно- и многоосновные кислоты.
Если в состав кислоты входит кислород, то они называются кислородсодержащими, к ним относится серная кислота, угольная и другие. Получают их путём взаимодействия воды с кислотными оксидами. Бескислородные кислоты образуются при взаимодействии неметаллов с водородом.
Только одну кислоту невозможно получить подобным способом – это кремниевую. Отвечающий ей оксид SiO2 не растворим в воде, хотя честно говоря, мы не представляем нашу планету без песка.
Основания
Для этого класса соединений характерно отличительное свойство, их ещё называют вещества гидроксильной группы – ОН.
Чтобы дать название, изначально указываем класс – гидроксиды, потом добавляем чего, какого металла.
Классификация оснований базируется на их растворимости в воде и по числу ОН-групп.
Следует отметить, что гидроксильная группа, также как и кислотный остаток, это часть целого. Невозможно получить кислоты путём присоединения водорода к кислотному остатку, аналогично, чтобы получить основание нельзя писать уравнение в таком виде.
В природе не существуют отдельно руки или ноги, эта часть тела. Варианты получения кислот были описаны выше, рассмотрим, как получаются основания. Если к основному оксиду прибавить воду, то результатом этой реакции должно получиться основание. Однако не все основные оксиды реагируют с водой. Если в продукте образуется щёлочь, значит, реакция происходит, в противном случае реакция не идёт.
Данным способом можно получить только растворимые основания. Подтверждением этому служат реакции, которые вы можете наблюдать. На вашей кухне наверняка есть алюминиевая посуда, это могут быть кастрюли или ложки. Эта кухонная утварь покрыта прочным оксидом алюминия, который не растворяется в воде, даже при нагревании. Также весной можно наблюдать, как массово на субботниках белят деревья и бордюры. Берут белый порошок СаО и высыпают в воду, получая гашеную известь, при этом происходит выделение тепла, а это как вы помните, признак химического процесса.
Раствор щёлочи можно получить ещё одним методом, путём взаимодействия воды с активными металлами. Давайте вспомним, где они размещаются в периодической системе – I, II группа. Реакция будет относиться к типу замещения.
Напрашивается вопрос, а каким же образом получаются нерастворимые основания. Здесь на помощь придёт реакция обмена между щёлочью и растворимой солью.
С представителями веществ этого класса вы встречаетесь ежедневно на кухне, в быту, на улице, в школе, сельском хозяйстве.
Объединяет все эти вещества, что они содержат атомы металла и кислотный остаток. Исходя из этого, дадим определение этому классу.
Средние соли – это продукт полного обмена между веществами, в которых содержатся атомы металла и кислотный остаток (КО) (мы помним, что это часть чего-то, которая не имеет возможности существовать отдельно).
Выше было рассмотрено 3 класса соединений, давайте попробуем подобрать комбинации, чтобы получить соли, типом реакции обмена.
Чтобы составить название солей, необходимо указать название кислотного остатка, и в родительном падеже добавить название металла.
Ca(NO3)2– нитрат (чего) кальция, CuSO4– сульфат (чего) меди (II).
Наверняка многие из вас что-то коллекционировали, машинки, куклы, фантики, чтобы получить недостающую модель, вы менялись с кем-то своей. Применим этот принцип и для получения солей. К примеру, чтобы получить сульфат натрия необходимо 2 моль щёлочи и 1 моль кислоты. Допустим, что в наличии имеется только 1 моль NaOH, как будет происходить реакция? На место одного атома водорода станет натрий, а второму Н не хватило Na. Т.е в результате не полного обмена между кислотой и основанием получаются кислые соли. Название их не отличается от средних, только необходимо прибавить приставку гидро.
Однако бывают случаи, с точностью наоборот, не достаточно атомов водорода, чтобы связать ОН-группы. Результатом этой недостачи являются основные соли. Допустим реакция происходит между Ва(ОН)2 и HCl. Чтобы связать две гидроксильные группы, требуется два водорода, но предположим, что они в недостаче, а именно в количестве 1. Реакция пойдёт по схеме.
Особый интерес и некоторые затруднения вызывают комплексные соли, своим внешним, казалось,громоздким и непонятным видом, а именно квадратными скобками:K3[Fe(CN)6] или [Ag(NH3)2]Cl. Но не страшен волк, как его рисуют, гласит поговорка. Соли состоят из катионов (+) и анионов (-). Аналогично и с комплексными солями.
Образует комплексный ион элемент-комплексообразователь, обычно это атом металла, которого, как свита, окружают лиганды.
Теперь необходимо справиться с задачей дать название этому типу солей.
Попробуем дать название K3[Fe(CN)6]. Существует главный принцип, чтение происходит справа налево. Смотрим, количество лигандов, а их роль выполняют циано-группы CN − , равно 6 – приставка гекса. В комплексообразователем будут ионы железа. Значит, вещество будет иметь название гексацианоферрат(III) (чего) калия.
Образование комплексных солей происходит путём взаимодействия, к примеру, амфотерных оснований с растворами щелочей. Амфотерность проявляется способностью оснований реагировать как с кислотами, так и щелочами. Так возьмём гидроксид алюминия или цинка и подействуем на них кислотой и щёлочью.
В природе встречаются соли, где на один кислотный остаток приходится два разных металла. Примером таких соединений служат алюминиевые квасцы, формула которых имеет вид KAl(SO4)2. Это пример двойных солей.
Из всего вышесказанного можно составить обобщающую схему, в которой указаны все классы неорганических соединений.
[spoiler title=”источники:”]
http://skysmart.ru/articles/chemistry/khimicheskie-svojstva-solej
http://100urokov.ru/predmety/urok-8-oksidy-kisloty-osnovaniya
[/spoiler]
