Составьте соли KF, FeS, CaF.
И назовите их названия.
Вы зашли на страницу вопроса Составьте соли KF, FeS, CaF?, который относится к
категории Химия. По уровню сложности вопрос соответствует учебной
программе для учащихся 5 – 9 классов. В этой же категории вы найдете ответ
и на другие, похожие вопросы по теме, найти который можно с помощью
автоматической системы «умный поиск». Интересную информацию можно найти в
комментариях-ответах пользователей, с которыми есть обратная связь для
обсуждения темы. Если предложенные варианты ответов не удовлетворяют,
создайте свой вариант запроса в верхней строке.
У этого термина существуют и другие значения, см. Сульфиды железа.
| Сульфид железа(II) | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Сульфид железа(II) | |
| Хим. формула | FeS | |
| Физические свойства | ||
| Состояние | твёрдое | |
| Молярная масса | 87,910 г/моль | |
| Плотность | 4,84 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | 1194 °C | |
| Классификация | ||
| Рег. номер CAS | 1317-37-9 | |
| PubChem | 14828 | |
| Рег. номер EINECS | 215-268-6 | |
| SMILES |
[Fe+2].[S-2] |
|
| InChI |
InChI=1S/Fe.S MBMLMWLHJBBADN-UHFFFAOYSA-N |
|
| ChemSpider | 8466211 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
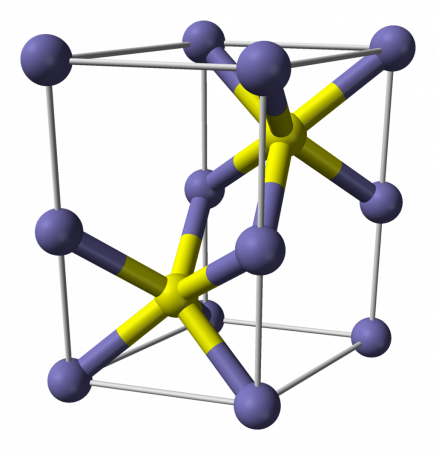
Сульфи́д желе́за(II) — сложное неорганическое вещество с химической формулой FeS класса неорганических сульфидов .
Описание и структура[править | править код]
Сульфид железа(II) — бескислородная соль. Кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой[1], тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа(II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода. Не притягивается магнитом[2].
Получение[править | править код]
1. Взаимодействие железа с серой[3]:
Реакция начинается при нагревании смеси железа с серой в пламени горелки, далее может протекать и без подогрева, с выделением теплоты[2].
2. Взаимодействие оксида железа(III) с водородом и сероводородом:
Химические свойства[править | править код]
1. Взаимодействие с концентрированной HCl:
2. Взаимодействие с концентрированной HNO3:
Применение[править | править код]
Сульфид железа(II) служит обычным исходным продуктом при получении сероводорода в лабораторных условиях. Гидросульфид железа [Fe(SH)2] и/или отвечающая ему основная соль [Fe(SH)OH] является важнейшей составной частью некоторых лечебных грязей.
Примечания[править | править код]
- ↑ Железа сульфиды // Краткая химическая энциклопедия. — Советская Энциклопедия, 1963. — Т. 2. Ж—Малоновый эфир.
- ↑ 1 2 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 8. Простые и сложные вещества // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 18-20. — 240 с. — 1 630 000 экз.
- ↑ Реакция соединения серы с железом Архивная копия от 6 июня 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
Литература[править | править код]
- Лидин Р. А. «Справочник школьника. Химия» М.: Астрель, 2003.
- Некрасов Б.В. Основы общей химии. — 3-е издание. — Москва: Химия, 1973. — Т. 2. — С. 363. — 688 с.
Ссылки[править | править код]
 На Викискладе есть медиафайлы по теме Сульфид железа(II)
На Викискладе есть медиафайлы по теме Сульфид железа(II)
Содержание
- Гидролиз сульфида железа (II)
- Общие сведения о гидролизе сульфида железа (II)
- Гидролиз сульфида железа (II)
- Примеры решения задач
- Сульфид железа (II)
- Содержание
- Описание и структура
- Получение
- Химические свойства
- Применение
- Сульфид железа (II), характеристика, свойства и получение, химические реакции
- Сульфид железа (II), характеристика, свойства и получение, химические реакции.
- Краткая характеристика сульфида железа (II):
- Физические свойства сульфида железа (II):
- Получение сульфида железа (II):
- Химические свойства сульфида железа (II). Химические реакции сульфида железа (II):
- Применение и использование сульфида железа (II):
- Мировая экономика
- Справочники
- Востребованные технологии
- Поиск технологий
- О чём данный сайт?
- О Второй индустриализации
- Соединения серы
- Сероводород
- Сульфиды
- Оксид серы (IV), диоксид серы, сернистый газ, сернистый ангидрид (SO2)
- Оксид серы (VI), триоксид серы, серный ангидрид (SO3)
- Сернистая кислота (H2SO3)
- Соли сернистой кислоты, сульфиты и гидросульфиты
- Серная кислота (H2SO4)
- Соли серной кислоты, сульфаты, гидросульфаты
Гидролиз сульфида железа (II)
Общие сведения о гидролизе сульфида железа (II)
Молярная масса – 88 г/моль. Представляет собой вещество черного цвета с кристаллической структурой и металлическим блеском.

Рис. 1. Сульфид железа (II). Внешний вид.
Гидролиз сульфида железа (II)
Гидролизуется по катиону и аниону. Характер среды – нейтральный. Ввиду того, что соль образована слабыми кислотой и основанием гидролиз протекает до конца, т.е. полностью. Уравнение гидролиза выглядит следующим образом:
FeS ↔ Fe 2+ + S 2- (диссоциация соли);
FeS +2H2O↔ Fe(OH)2↓ + H2S↑ (уравнение в молекулярной форме).
Примеры решения задач
| Задание | Сульфид железа (II) массой 13,8 г растворили в соляной кислоте. Какая масса хлорида железа (II) при этом образовалась? |
| Решение | Запишем уравнение реакции взаимодействия сульфида железа (II) с соляной кислотой: |
Рассчитаем количество вещества сульфида железа (II) (молярная масса – 88 г/моль):
υ (FeS) = m (FeS)/ M(FeS) = 13,8/88 = 0,16моль.
Согласно уравнению υ (FeS) = υ (FeCl2) =0,16 моль. Найдем массу хлорида железа (II) (молярная масса – 127 г/моль):
Ответ Масса образовавшегося в ходе реакции хлорида железа (II) равна 20,32 г.
| Задание | Сульфид железа (II) растворили в 120 мл 7%-ой азотной кислоты (плотность 1,03 г/мл). Рассчитайте массу нитрата железа (II), который образовался в ходе реакции. |
| Решение | Запишем уравнение реакции взаимодействия сульфида железа (II) и азотной кислоты: |
Рассчитаем массу раствора азотной кислоты:
Найдем массу растворенного вещества азотной кислоты:
Тогда, количество вещества азотной кислоты будет равно (молярная масса – 63 г/моль):
Найдем массу нитрата железа (II)(молярная масса – 180 г/моль):
Источник
Сульфид железа (II)

| Сульфид железа (II) | |
|---|---|
 |
|
| Систематическое наименование |
Сульфид железа (II) |
| Хим. формула | FeS |
| Состояние | твёрдое |
| Молярная масса | 87,910 г/моль |
| Плотность | 4,84 г/см³ |
| Температура | |
| • плавления | 1194 °C |
| Рег. номер CAS | 1317-37-9 |
| PubChem | 14828 |
| Рег. номер EINECS | 215-268-6 |
| SMILES | |
| ChemSpider | 8466211 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид железа (II) — сложное неорганическое вещество с химической формулой FeS класса неорганических сульфидов .
Содержание

Описание и структура
Сульфид железа (II) — бескислородная соль. Кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа (II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода. Не притягивается магнитом.
Получение
1. Взаимодействие железа с серой:
Реакция начинается при нагревании смеси железа с серой в пламени горелки, далее может протекать и без подогрева, с выделением теплоты.
2. Взаимодействие оксида железа (III) с водородом и сероводородом:
Химические свойства
1. Взаимодействие с концентрированной HCl:
2. Взаимодействие с концентрированной HNO3:
Применение
Сульфид железа (II) служит обычным исходным продуктом при получении сероводорода в лабораторных условиях. Гидросульфид железа [Fe(SH)2] и/или отвечающая ему основная соль [Fe(SH)OH] является важнейшей составной частью некоторых лечебных грязей.
Источник
Сульфид железа (II), характеристика, свойства и получение, химические реакции

Сульфид железа (II), характеристика, свойства и получение, химические реакции.




Сульфид железа (II) – неорганическое вещество, имеет химическую формулу FeS.
Краткая характеристика сульфида железа (II):
Сульфид железа (II) – неорганическое вещество коричнево-черного цвета с металлическим блеском, соединение железа и серы, соль железа и сероводородной кислоты.
Сульфид железа (II) представляет собой коричнево-черные кристаллы.
Химическая формула сульфида железа (II) FeS.
Не растворяется в воде . Не притягивается магнитом. Тугоплавок.
Разлагается при нагревании в вакууме.
Во влажном состоянии чувствителен к кислороду воздуха, т.к. вступает с кислородом в реакцию, образуя сульфит железа (II).
Физические свойства сульфида железа (II):
| Наименование параметра: | Значение: |
| Химическая формула | FeS |
| Синонимы и названия иностранном языке | iron (II) sulfide (англ.) |
| Тип вещества | неорганическое |
| Внешний вид | коричнево-черные гексагональные кристаллы |
| Цвет | коричнево-черный |
| Вкус | —* |
| Запах | без запаха |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м 3 | 4840 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см 3 | 4,84 |
| Температура кипения, °C | — |
| Температура плавления, °C | 1194 |
| Молярная масса, г/моль | 87,91 |
Получение сульфида железа (II):
Сульфид железа (II) получается в результате следующих химических реакций:
- 1. взаимодействия железа и серы:
Fe + S → FeS (t = 600-950 о С).
Реакция протекает путем сплавления алюминия с углеродом в дуговой печи.
- 2. взаимодействия оксида железа и сероводорода:
FeO + H2S → FeS + H2O (t = 500 о С).
- 3. взаимодействия хлорида железа и сульфида натрия:
- 4. взаимодействия сульфата железа и сульфида натрия:
Химические свойства сульфида железа (II). Химические реакции сульфида железа (II):
Химические свойства сульфида железа (II) аналогичны свойствам сульфидов других металлов . Поэтому для него характерны следующие химические реакции:
1. реакция сульфида железа (II) и кремния:
Si + FeS → SiS + Fe (t = 1200 о С).
В результате реакции образуются сульфид кремния и железо.
2. реакция сульфида железа (II) и кислорода:
В результате реакции образуются сульфат железа (II). Реакция протекает медленно. В ходе реакции используется влажный сульфид железа. Также образуются примеси: сера S, полигидрат оксида железа (III) Fe2O3 • nH2O.
3. реакция сульфида железа (II), кислорода и воды:
В результате реакции образуются гидроксид железа и сероводород.
4. реакция сульфида железа (II), оксида кальция и углерода:
FeS + CaO + C → Fe + CO + CaS (t о ).
В результате реакции образуются железо , оксид углерода и сульфид кальция.
5. реакция сульфида железа (II) и сульфида меди:
В результате реакции образуются дитиоферрата (II) меди (II) (халькопирит).
6. реакции сульфида железа (II) с кислотами:
Сульфид железа (II) реагирует с сильными минеральными кислотами.
7. реакция термического разложения сульфида железа (II):
FeS → Fe + S (t = 700 о С).
В результате реакции термического разложения сульфида железа (II) образуются железо и сера . Реакция протекает в вакууме .
Применение и использование сульфида железа (II):
Сульфид железа (II) используется лишь в нескольких отраслях:
– в качестве исходного продукта для получения сероводорода в лабораторных условиях,
– в качестве сырья в производстве чугуна, как твердый источник сероводорода.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 746)
- Экономика Второй индустриализации России (104 724)
- Этилен (этен), получение, свойства, химические реакции (36 090)
- Программа искусственного интеллекта ЭЛИС (31 697)
- Крахмал, свойства, получение и применение (29 801)
- Природный газ, свойства, химический состав, добыча и применение (29 786)
- Метан, получение, свойства, химические реакции (29 626)
- Целлюлоза, свойства, получение и применение (28 387)
- Пропилен (пропен), получение, свойства, химические реакции (27 861)
- Прямоугольный треугольник, свойства, признаки и формулы (26 709)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Источник
Соединения серы
Сероводород
Получение сероводорода
- Получение из простых веществ:
- Взаимодействие минеральных кислот и сульфидов металлов, расположенных в ряду напряжений левее железа:
- Нагревание парафина с серой:
Физические свойства и строение сероводорода
Сероводород H2S – это бинарное летучее водородное соединение соединение с серой. H2S — бесцветный ядовитый газ, с неприятным удушливым запахом тухлых яиц. При концентрации > 3 г/м 3 вызывает смертельное отравление.
Сероводород тяжелее воздуха и легко конденсируется в бесцветную жидкость. Растворимость в воде H2S при обычной температуре составляет 2,5.
В твердом состоянии имеет молекулярную кристаллическую решетку.
Геометрическая форма молекулы сероводорода представляет собой сцепленные между собой атомы H-S-H с валентным углом 92,1 о .

Качественная реакция для обнаружения сероводорода
Для обнаружения анионов S 2- и сероводорода используют реакцию газообразного H2S с Pb(NO3)2:
Влажная бумага, смоченная в растворе Pb(NO3)2 чернеет в присутствии H2S из-за получения черного осадка PbS.
Химические свойства серы
H2S является сильным восстановителем
При взаимодействии H2S с окислителями образуются различные вещества — S, SО2, H2SO4
- Окисление кислородом воздуха:
- Окисление галогенами:
- Взаимодействие с кислотами-окислителями:
- Взаимодействие со сложными окислителями:
- Сероводородная кислота H2S двухосновная кислота и диссоциирует по двум ступеням:
1-я ступень: H2S → Н + + HS —
2-я ступень: HS — → Н + + S 2-
H2S очень слабая кислота, несмотря на это имеет характерные для кислот химические свойства. Взаимодействует:
- с активными металлами
- с малоактивными металлами (Аg, Си, Нg) при совместном присутствии окислителей:
- с основными оксидами:
- с некоторыми солями сильных кислот, если образующийся сульфид металла нерастворим в воде и в сильных кислотах:
Реакция с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Сульфиды
Получение сульфидов
- Непосредственно из простых веществ:
S + Fe → FeS
- Взаимодействие H2S с растворами щелочей:
- Взаимодействие H2S или (NH4)2S с растворами солей:
- Восстановление сульфатов при прокаливании с углем:
Физические свойства сульфидов
Сульфиды – это бинарные соединения серы с элементами с меньшей электроотрицательностью, в том числе с некоторыми неметаллами (С, Si, Р, As и др.).
По растворимости в воде и кислотах сульфиды классифицируют на:
- растворимые в воде — сульфиды щелочных металлов и аммония;
- нерастворимые в воде, но растворимые в минеральных кислотах — сульфиды металлов, расположенных до железа в ряду активности (белые и цветные сульфиды ZnS, MnS, FeS, CdS);
- нерастворимые ни в воде, ни в минеральных кислотах — черные сульфиды (CuS, HgS, PbS, Ag2S, NiS, CoS)
- гидролизуемые водой — сульфиды трехвалентных металлов (алюминия и хрома (III))
По цвету сульфиды можно разделить на:
Химические свойства сульфидов
Обратимый гидролиз сульфидов
- Хорошо растворимыми в воде являются сульфиды щелочных металлов и аммония, но в водных растворах они в значительной степени подвергаются гидролизу. Реакция среды — сильнощелочная:
S 2- + H2O → HS — + ОН —
- Сульфиды щелочно-земельных металлов и Mg, при взаимодействии с водой подвергаются полному гидролизу и переходят в растворимые кислые соли — гидросульфиды:
При нагревании растворов сульфидов гидролиз протекает и по 2-й ступени:
Необратимый гидролиз сульфидов
- Сульфиды некоторых металлов (Cr2S3, Fe2S3, Al2S3) подвергаются необратимому гидролизу, полностью разлагаясь в водных растворах:
Нерастворимые сульфиды гидролизу не подвергаются
NiS + HСl ≠
- Некоторые из сульфидов растворяются в сильных кислотах:
- Сульфиды Ag2S, HgS, Hg2S, PbS, CuS не pacтворяются не только в воде, но и во многих кислотах.
- Сульфиды обладают восстановительными свойствами и вступают в реакции с окислителями:
- Окислительный обжиг сульфидов является важной стадией переработки сульфидного сырья в различных производствах
Взаимодействия сульфидов с растворимыми солями свинца, серебра, меди являются качественными на ион S 2− :
Оксид серы (IV), диоксид серы, сернистый газ, сернистый ангидрид (SO2)
Способы получения сернистого газа
- Окисление серы, сероводорода и сульфидов кислородом воздуха:
- Действие высокой температуры на сульфиты (термическое разложение):
- Действие сильных кислот на сульфиты:
- Взаимодействие концентрированной H2SO4 с восстановителями, например с неактивными металлами:
Физические свойства сернистого газа
При обычной температуре SO2 — газ с резким запахом без цвета. В воде растворим хорошо — при 20°С в 1 л воды растворяется 40 л SO2.
Химические свойства сернистого газа
SO2 – типичный кислотный оксид. За счет того, что сера находится в промежуточной степени окисления (+4) SO2 может проявлять свойства как окислителя так и восстановителя.
- При растворении в воде SO2 частично соединяется с молекулами воды с образованием слабой сернистой кислоты.
- Как кислотный оксид, SO2 вступает в реакции с щелочами и оксидами щелочных и щелочноземельных металлов:
- При взаимодействии с окислителями SO2проявляет восстановительные свойства. При этом степень окисления серы повышается:
Обесцвечивание раствора перманганата калия KMnO4 является качественной реакцией для обнаружения сернистого газа и сульфит-иона
- SO2 проявляет окислительные свойства при взаимодействии с сильными восстановителями, восстанавливаясь чаще всего до свободной серы:
Оксид серы (VI), триоксид серы, серный ангидрид (SO3)
Способы получения серного ангидрида
- SO3 можно получить из SO2путем каталитического окисления последнего кислородом:
- ОкислениемSO2другими окислителями:
- Разложением сульфата железа (III):
Физические свойства серного ангидрида
При обычных условиях SO3 представляет собой бесцветную жидкость с характерным резким запахом. На воздухе SO3 «дымит» и сильно поглощает влагу.
SO3 – тяжелее воздуха, хорошо растворим в воде.
Химические свойства серного ангидрида
Оксид серы (VI) – это кислотный оксид.
- Хорошо поглощает влагу и реагирует с водой образуя серную кислоту:
- Как кислотный оксид, SO3взаимодействует с щелочами и основными оксидами, образуются средние или кислые соли:
SO3 + MgO → MgSO4 (при сплавлении):
SO3 + ZnO = ZnSO4
- SO3проявляет сильные окислительные свойства, так как сера в находится в максимальной степени окисления (+6).
Вступает в реакции с восстановителями:
- При растворении в концентрированной серной кислоте образует олеум (раствор SO3 в H2SO4).
Сернистая кислота (H2SO3)
Способы получения сернистой кислоты
При растворении в воде SO2 образует слабую сернистую кислоту, которая сразу частично разлагается:
Физические свойства сернистой кислоты
Сернистая кислота H2SO3 – двухосновная кислородсодержащая кислота. При обычных условиях неустойчива.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.

Химические свойства сернистой кислоты
Общие свойства кислот
- Сернистая кислота – слабая кислота, диссоциирует в две стадии. Образует два типа солей:
- кислые – гидросульфиты
- Сернистая кислота самопроизвольно распадается на SO2 и H2O:
Соли сернистой кислоты, сульфиты и гидросульфиты
Способы получения сульфитов
Соли сернистой кислоты получаются при взаимодействии SO2 с щелочами и оксидами щелочных и щелочноземельных металлов:
Физические свойства сульфитов
Сульфиты щелочных металлов и аммония растворимы в воде, сульфиты остальных металлов — нерастворимы или не существуют.
Гидросульфиты металлов хорошо растворимы в Н2O, а некоторые из них, такие как Ca(HSO3)2 существуют только в растворе.
Химические свойства сульфитов
Cернистая кислота – двухосновная, образует нормальные (средние) соли — сульфиты Mex(SO3)y и кислые соли — гидросульфиты Me(HSO3)x.
- Водные растворы сульфитов подвергаются гидролизу. Реакция среды – щелочная(окрашивают лакмус в синий цвет):
Реакции, протекающие без изменения степени окисления:
- Реакция с сильными кислотами:
- Термическое разложение сульфитов:
- Нормальные сульфиты в водных растворах, при избытке SO2, переходят в гидросульфиты:
- Ионно-обменные реакции с другими солями, протекающие с образованием нерастворимых сульфитов:
Сульфиты, также как и SO2, могут быть как восстановителями, так и окислителями, т.к. атомы серы в анионах находятся в промежуточной степени окисления +4
- Окисление водных растворов сульфитов, и гидросульфитов до сульфатов:
- Твердые сульфиты при хранении на воздухе также медленно окисляются до сульфатов:
- При нагревании сухих сульфитов с активными восстановителями (С, Mg, Al, Zn) сульфиты превращаются в сульфиды:
- При нагревании сухих сульфитов до высоких температур сульфиты диспропорционируют, превращаются в смесь сульфатов и сульфидов:
Серная кислота (H2SO4)
Способы получения серной кислоты
В промышленности серную кислоту производят из серы, сульфидов металлов, сероводорода и др.
Наиболее часто серную кислоту получают из пирита FeS2.
Основные стадии получения серной кислоты включают:
1.Обжиг пирита в кислороде в печи для обжига с получением сернистого газа:
2. Очистка полученного сернистого газа от примесей в циклоне, электрофильтре.
3. Осушка сернистого газа в сушильной башне
4. Нагрев очищенного газа в теплообменнике.
5. Окисление сернистого газа в серный ангидрид в контактном аппарате:
6. Поглощение серного ангидрида серной кислотой в поглотительной башне – получение олеума.

Физические свойства, строение серной кислоты
При обычных условиях серная кислота – тяжелая бесцветная маслянистая жидкость, хорошо растворимая в воде. Максимальная плотность равна 1,84 г/мл
При растворении серной кислоты в воде выделяется большое количество теплоты. Поэтому, по правилам безопасности в лаборатории при приготовлении разбавленного раствора серной кислоты во избежание разбрызгивания необходимо наливать серную кислоту в воду тонкой струйкой по стеклянной палочке при постоянном перемешивании. Но не наоборот!
Валентность серы в серной кислоте равна VI.

Качественные реакции для обнаружения серной кислоты и сульфат ионов
Для обнаружения сульфат-ионов используют реакцию с растворимыми солями бария. В результате взаимодействия, образуется белый кристаллический осадок сульфата бария:
Химические свойства серной кислоты
Серная кислота — сильная двухосновная кислота, образует два типа солей: средние – сульфаты, кислые – гидросульфаты.
- Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени и достаточно по второй ступени:
Характерны все свойства кислот:
- Реагирует с основными оксидами, основаниями, амфотерными оксидами, амфотерными гидроксидами и аммиаком:
- Вытесняетболее слабые кислоты из их солей в растворе (карбонаты, сульфиды и др.) и летучие кислоты из их солей (кроме солей HBr и HI):
- Концентрированная серная кислота реагирует с твердыми солями, например нитратом натрия, хлорида натрия.
- Вступает в обменные реакции ссолями:
- Взаимодействует с металлами:
Разбавленная серная кислота взаимодействует с металлами, расположенными в ряду напряжения металлов до водорода. В результате реакции образуются соль и водород:
Концентрированная серная кислота — сильный окислитель. Реакция с металлами протекает без вытеснения водорода из кислоты. В зависимости от активности металла образуются различные продукты реакции:
- Активные металлы и цинк при обычной температуре с концентрированной серной кислотой образуют соль, сероводород (или серу) и воду:
- Металлы средней активности с концентрированной H2SO4 образуют соль, серу и воду:
- Такие металлы, как железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании, при удалении оксидной пленки реакция возможна.
- Неактивные металлы восстанавливают концентрированную серную кислоту до сернистого газа:

- В реакциях с неметаллами концентрированная серная кислота также проявляет окислительные свойства:
- Концентрированная серная кислота широко используется в химических процессах как водоотнимающий агент, т.к. проявляет сильное водоотнимающее действие. В органической химии ее используют при получении спиртов, простых и сложных эфиров, альдегидов и т.д.
Соли серной кислоты, сульфаты, гидросульфаты
Способы получения солей серной кислоты
Сульфаты можно получить при взаимодействии серной кислоты с металлами, оксидами, гидроксидами (см. Химические свойства серной кислоты). А также при взаимодействии с другими солями, если продуктом реакции является нерастворимое соединение.
Физические свойства солей серной кислоты
Кристаллы разного цвета. Многие средние и кислые сульфаты растворимы в воде. Плохо растворяются или не растворяются в воде сульфаты многозарядных щёлочноземельных металлов (BaSO4, RaSO4), сульфаты лёгких щёлочноземельных металлов (CaSO4, SrSO4) и сульфат свинца.
Средние сульфаты щелочных металлов термически устойчивы. Кислые сульфаты щелочных металлов при нагревании разлагаются.
Многие средние сульфаты образуют устойчивые кристаллогидраты:
CuSO4 ∙ 5H2O − медный купорос
FeSO4 ∙ 7H2O − железный купорос
ZnSO4 ∙ 7H2O − цинковый купорос
KАl(SO4)2 x 12H2O – алюмокалиевые квасцы.
Химические свойства солей серной кислоты
Разложение сульфатов на различные классы соединений в зависимости от металла, входящего в состав соли.
- Сульфаты щелочных металлов плавятся без разложения.
- Кислые сульфаты щелочных металлов разлагаются с отщеплением воды:
- Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
- Сульфаты тяжёлых или малоактивных металлов разлагаются с образованием металла и кислорода:
- Некоторые сульфаты проявляют окислительные свойства и вступают в реакции с простыми веществами:
Источник
| Сульфид железа (II) | |
|---|---|
 |
|
| Систематическое наименование |
Сульфид железа (II) |
| Хим. формула | FeS |
| Состояние | твёрдое |
| Молярная масса | 87,910 г/моль |
| Плотность | 4,84 г/см³ |
| Температура | |
| • плавления | 1194 °C |
| Рег. номер CAS | 1317-37-9 |
| PubChem | 14828 |
| Рег. номер EINECS | 215-268-6 |
| SMILES |
[Fe+2].[S-2] |
| InChI |
1S/Fe.S MBMLMWLHJBBADN-UHFFFAOYSA-N |
| ChemSpider | 8466211 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Сульфид железа (II) — сложное неорганическое вещество с химической формулой FeS класса неорганических сульфидов .

Описание и структура
Сульфид железа (II) — бескислородная соль. Кристаллы чёрного цвета с металлическим блеском и гексагональной кристаллической решёткой, тугоплавкий, разлагается при нагревании в вакууме. Во влажном состоянии чувствителен к кислороду воздуха. Нерастворим в воде. Не выпадает в осадок при насыщении растворов солей железа (II) сероводородом. Разлагается кислотами. Применяется как сырье в производстве чугуна, твердый источник сероводорода. Не притягивается магнитом.
Получение
1. Взаимодействие железа с серой:
-
- Fe + S ⟶ FeS
Реакция начинается при нагревании смеси железа с серой в пламени горелки, далее может протекать и без подогрева, с выделением теплоты.
2. Взаимодействие оксида железа (III) с водородом и сероводородом:
-
- Fe2O3 + H2 + 2H2S ⟶ 2FeS + 3H2O
Химические свойства
1. Взаимодействие с концентрированной HCl:
-
- FeS + 2HCl ⟶ FeCl2 + H2S
2. Взаимодействие с концентрированной HNO3:
-
- FeS + 12HNO3 ⟶ Fe(NO3)3 + 9NO2 + 5H2O + H2SO4
Применение
Сульфид железа (II) служит обычным исходным продуктом при получении сероводорода в лабораторных условиях. Гидросульфид железа [Fe(SH)2] и/или отвечающая ему основная соль [Fe(SH)OH] является важнейшей составной частью некоторых лечебных грязей.
![]()
6
1 ответ:
![]()
0
0
KF-фторид калия FeS-сульфид железаCaF-фторид кальция
Читайте также
![]()
Ответ:
1. Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
2. BaO + H2SO4 = BaSO4 + H2O
3. Mg(OH)2 + 2HNO3 = Mg(NO3)2 + 2H2O
4. CuSO4 + Na2S = CuS + Na2SO4
Объяснение:
![]()
Не растворился кремний,
m(Si)=5,6г; W(Si)=5,6/10=0,56(56%);
n(газа)=13,44/22,4=0,6моль;
0,1 0,3
S+2H2SO4 -> 3SO2↑ + 2H2O
0,1 0,1 0,2
C+2H2SO4 -> CO2↑ + 2SO2↑ + 2H2O
0,5 1,5
SO2 + 2H2S -> 3S↓ + 2H2O
n(S)=48/32=1,5моль;
m(C)=0,1*12/10=0,12(12%);
m(S)=0,1*32/10=0,32(32%)
![]()
20л x
2H2+O2 – 2H2O
22.4 22.4
х= 20л*22.4л/м / 22.4л/м= 20л
![]()
1-D 2-D 3- вообще неон, не знаю почему его нет 4-D
![]()
А) 4-метилфенол
б) 4-хлорфенол
в) <span>бензолдиол-1,4 (гидрохинон)</span>
г) 3-нитрофенол
д) 2-этил, 4,5-диметилфенол
е) 4-изобутилфенол






