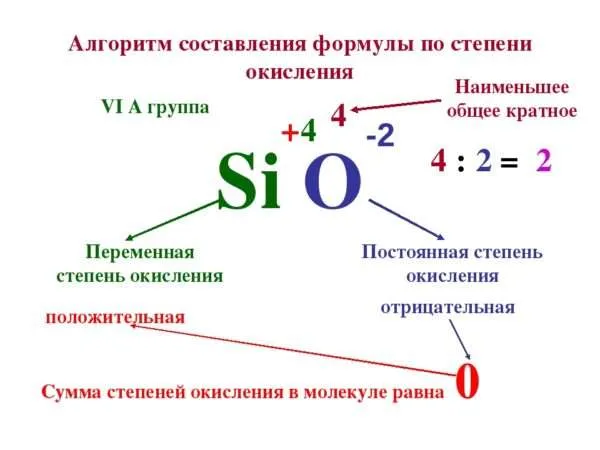
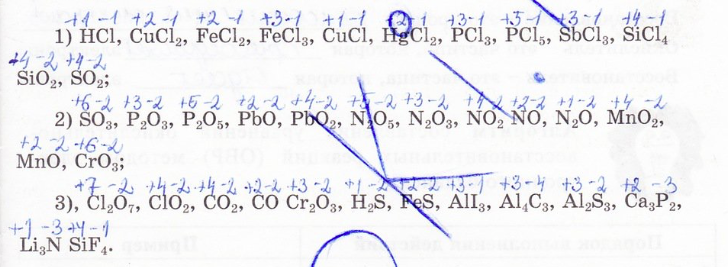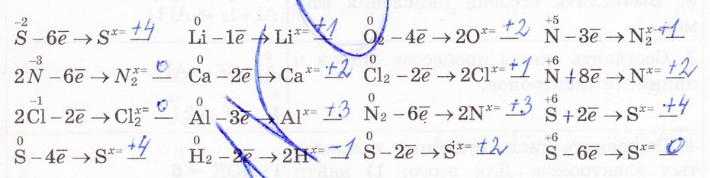Сегодня мы обозначим и постараемся объяснить все сведения необходимые для комфортного и непринуждённого расставления степеней окисления, небезусловную сущность которых мы раскрыли в предыдущем материале.
Итак, прежде всего необходимо понять, что степени окисления – это заряды, а следовательно значения, имеющиеся знак и размещаемые в верхнем правом углу от химического символа.
Заряды эти образуются в результате отдачи и взаимного принятия электронов. При этом в ходе отдачи электронов образуется положительно заряженная частица, а входе принятия – отрицательно заряженная частица.
Так как атомы, из представления о которых мы пока что исходим, электронейтральны, то отдача электронов приводит к преобладанию в частице положительно заряженного ядра, и образованию так называемого катиона, а принятие электронов – к преобладанию отрицательного заряда электронной оболочки и образованию аниона.
И на этом моменте мы подбираемся не только к ключевой, но и чрезвычайно логичной мысли, согласно которой число отданных электронов равно числу принятых электронов, а значит, суммарный положительный заряд по модулю должен быть равен суммарному отрицательному заряду, то есть:
суммарная степень окисления в химической формуле вещества всегда равна нулю!
И вот теперь-то мы готовы ввести правила расстановки степеней окисления:
Правило №1: у простых веществ степень окисления всегда равна нулю.
Напомню, простые вещества – вещества, состоящие из атомов одного химического элемента.
Но прежде чем обозначить следующее правило, необходимо пояснить, что каждое последующее правило не отменяет предыдущее.
Правило №2: у фтора (F) в составе всех сложных веществ степень окисления всегда равна -1.
Для того, чтобы понять это правило, бросим взгляд в ряд электроотрицательности неметаллов:
Фтор (F) – самый электроотрицательный неметалл (напомню, что электроотрицательность – способность атомов химических элементов оттягивать на себя электронную плотность), это значит, что, будучи в составе любого вещества, фтор (F) по теории степеней окисления всегда принимает электроны, а так как фтор (F) – элемент главной подгруппы 7-й группы, то нуждается он только в одном электроне, необходимом ему для достижения электронной конфигурации инертного благородного газа.
Итого по фтору:
Правило №3. У кислорода (O) в составе всех сложных соединений степень окисления равна -2.
Исключения: пероксиды и фторид кислорода.
Дело в том, что в перекисях присутствует ковалентная неполярная химическая связь между атомами кислорода, а фтор – единственный более электроотрицательный атом, чем кислород.
Правило №4: у водорода (H) степень окисления всегда +1
Исключение: гидриды металлов.
Водород, согласно приведённому выше ряду электроотрицательности неметаллов, обладает среди перечисленных в нём наименьшим значением электроотрицательности, что означает, что по отношению к ним он будет донором электронной плотности. Однако водород (H) остаётся неметаллом и будет проявлять свои неметаллические свойства, то есть способность принимать электроны, а точнее один электрон, в солеподобных бинарных соединениях с металлами – так называемыми гидридами.
Правило №5 – у металлов всегда положительные степени окисления.
Это и понятно, если учесть, что металлы характеризуются металлическими свойствами, то есть способностью отдавать электроны. Но не стоит забывать, что у простых веществ степень окисления всё-таки 0
Правило №6:
у металлов главной подгруппы первой группы IA (Li, Na, K и т.д.) в составе всех сложных соединений степень окисления всегда +1
у Me главной подгруппы второй группы IIА (Mg, Ca, Sr, Ba) – всегда +2
IIIA (Al) – всегда +3
Итоговая таблица:
На этом хотелось бы и закончить, но мы ещё ничего не сказали о расчёте степени окисления центрального атома, когда это необходимо. Рассмотрим пример дихромата калия:
-согласно правилам, у калия +1, у кислорода -2.
– “атомов” кислорода (O) семь, у каждого степень окисления -2. Это означает, что каждый “атом” кислорода (O) принимает два электрона. В сумме семь “атомов” кислорода (O) приняли 14 электронов.
– откуда “атомы” кислорода (O) приняли 14 электронов? Степень окисления калия (K) +1. Это означает, что “атом” калия(K) отдал 1 электрон. Атомов калия (K) два, каждый отдал 1 электрон. В сумме атомы калия (K) отдали 2 электрона.
– значит, оставшиеся 12 электронов были получены атомами кислорода (O) от двух атомов хрома (Cr). То есть, каждый атом хрома (Cr) отдал 6 электронов. Таким образом, степень окисления хрома +6.
Рассмотрим ещё несколько неочевидных примеров.
1) Единственное правило, которое мы можем применить к данному примеру, – это правило, согласно которому у железа (Fe), как у металла, в данном случае положительная степень окисления, то есть железо отдаёт электроны. Значит, у хлора (Cl) – отрицательная, то есть хлор (Cl) принимает электроны.
2) Смотрим, сколько хлор (Cl) будет принимать электронов, видим, что хлор (Cl) – элемент главной подгруппы 7-й группы, значит хлор (Cl) принимает 1 электрон.
3) Атомов хлора (Cl) в составе рассматриваемого соединения три, значит в сумме они принимают 3 электрона.
4) Откуда они принимают эти три электрона – от одного атома железа (Fe), значит у железа (Fe) степень окисления +3.
А что если рассмотреть пример, к которому мы не сможем применить ни одно из известных правил? Например, сероуглерод.
1) В данном случае смотрим в ряд электроотрицательности неметаллов, выясняем, какой из атомов более электроотрицательный, – он и будет принимать электроны.
2) Сера (S) обладает большей электроотрицательностью. При этом сера (S) – элемент главной подгруппы 6-й группы, значит, атому серы (S) до электронной конфигурации инертного благородного газа не хватает 2-х электронов, то есть сера (S), будет принимать 2 электрона, приобретая степень окисления -2.
3) Атомов серы (S) два, каждый принимает 2 электрона, в сумме они принимают 4 электрона. От кого они принимают 4 электрона? От одного атома углерода (C), значит у углерода (C) степень окисления +4.
Есть примеры веществ, в формулах которых невозможно без предварительных знаний правильно расставить степени окисления. К таковым, например относятся карбид кальция и пирит, формулы и степени окисления в составе которых я обозначу как данность.
И вот теперь у меня всё! Спасибо всем, кто дошёл до конца. Пока.
Просмотров 8.5к. Опубликовано 04.09.2022
Простые вещества, такие как Cl2и О2 в этом случае не происходит сдвига электронов и степень окисления равна нулю.
Качественная характеристика окислительно-восстановительных реакций
Окислительно-восстановительные реакции являются наиболее распространенными химическими реакциями в природе. К ним относятся, например, фотосинтез, метаболизм и биологические процессы, а также сжигание топлива, производство металлов и многие другие реакции.
Реакции восстановления давно и успешно используются человечеством для самых разных целей, но сама теория электронов в окислительно-восстановительных процессах возникла совсем недавно, т.е. в начале 20 века.
Для того чтобы перейти к современной теории окислительно-восстановительных процессов, необходимо ввести различные понятия, такие как сила, степень окисления и структура электронной оболочки атома. Мы уже сталкивались с этими понятиями при изучении таких модулей, как периодический закон Менделеева, основные принципы атомной структуры элементов, химическая связь и молекулярная структура. Давайте теперь рассмотрим их более подробно.
Валентность
Живучесть — это сложное понятие, которое возникает с понятием химической связи и определяется как свойство атома соединяться с определенным количеством атомов другого элемента или вытеснять их, т.е. способность атома образовывать химические связи в соединении.
Изначально валентность определялась по водороду (считался как 1) или кислороду (валентность 2).
Впоследствии были выделены положительные и отрицательные значения. Количественно, положительная валентность — это число электронов, поставляемых атомом, а отрицательная валентность — это число электронов, которые должны быть присоединены к атому для выполнения правила октавы (т.е. для завершения внешнего энергетического уровня).
Совсем недавно в понятие жизненной силы стали включать природу химических связей, образующихся при объединении людей.
Как правило, наибольшая интенсивность данных соответствует номеру группы в периодической таблице.
Однако, как и во всех правилах, есть исключения.
Например, медь и золото находятся в первой группе периодической таблицы, и их интенсивность должна быть равна номеру группы, т.е. 1, тогда как на практике медь имеет максимальную интенсивность 2, а золото — 3.
Степень окисления
Степень окисления, иногда называемая окислительным числом, электрохимической валентностью или состоянием окисления, является относительным понятием.
Например, при расчете степеней окисления большинство соединений вообще не являются ионными, а молекулами считаются только ионы.
Количественно, степень окисления атомов элемента в соединении определяется числом электронов, присоединенных к атомам или смещенных с них.
Таким образом, если смещения электронов не происходит, степень окисления будет равна нулю, отрицательной — если электроны смещены в сторону конкретного атома, и положительной — если они смещены в сторону от конкретного атома.
Нахождение степени окисления химического вещества — простое занятие, требующее лишь внимания и знания основных правил и исключений. Для того чтобы разобраться в исключениях и использовать специальные таблицы, не требуется много времени.
Как расставлять и как определить степень окисления элементов
Атомы и молекулы играют важную роль в химических процессах, а их свойства определяют последствия химических реакций. Одним из важных свойств атомов является их число окисления. Это упрощает метод расчета переноса электронов на частицы. Как определить степень окисления или типичный заряд частицы и какие правила для этого нужно знать?
Все химические реакции происходят в результате взаимодействия атомов различных веществ. Свойства мелких частиц определяют процесс реакции и ее последствия.
Термин окисление в химии относится к реакции, в которой группа атомов или один из них теряет или приобретает электрон. В случае усиления реакция называется «восстановлением».
Состояние окисления — это количественная мера перераспределения электронов в реакции. Другими словами, в процессе окисления электроны внутри атома уменьшаются или увеличиваются и перераспределяются между другими взаимодействующими частицами, а степень окисления показывает, как именно они реорганизуются. Это понятие тесно связано с электроотрицательностью частиц, т.е. их способностью притягивать и отталкивать свободные ионы.
Это интересно! Что такое алканы: структура и химические свойства
Определение степени окисления зависит от свойств и характеристик каждого вещества, поэтому процесс расчета нельзя однозначно охарактеризовать как простой или сложный, но результаты помогают документировать процесс обычных окислительно-восстановительных реакций. Важно понимать, что результаты расчета являются следствием переноса электронов, не имеют физического смысла и не представляют фактический заряд ядра.
Важно знать! Обратите внимание, что в неорганической химии термин валентность часто используется вместо состояния окисления элемента, что не является ошибкой, но второй термин более распространен.
Понятия и правила расчета движения электронов лежат в основе классификации химических веществ (номенклатуры), описания их свойств и синтеза типов связей. Однако часто этот термин используется для описания и проведения окислительно-восстановительных реакций.
Правила определения степени окисления
Как узнать состояние окисления? Имея дело с окислительно-восстановительными реакциями, важно знать, что типичный заряд частицы всегда равен численно выраженному значению электрона. Эта специфика обусловлена предположением, что электронная пара, образующая связь, всегда полностью смещается к наиболее отрицательной частице. Если мы говорим об ионной связи, то следует понимать, что в случае реакций ковалентной связи электроны поровну распределяются между одними и теми же частицами.
Число окисления может иметь как положительное, так и отрицательное значение. Важно отметить, что во время реакции атомы должны стать нейтральными. Для этого необходимо добавить электрон, если ион положительный, или удалить его, если он отрицательный. Чтобы указать на это значение при записи типа, принято писать арабскую цифру с соответствующим символом над названием предмета. Например, или и т.д.
Следует отметить, что заряд металла всегда положительный и в большинстве случаев его можно определить с помощью таблицы Менделеева. Существует несколько характеристик, которые необходимо учитывать для правильного определения цены
Как определить степень окисления
- У простых элементов всегда равна нулю: или .
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение +3.
Запомнив эти свойства, очень легко определить номер окисления элемента, независимо от его атомной сложности или количества уровней.
Полезное видео: определение степени окисления
Регулярные таблицы Менделеева содержат практически всю информацию, необходимую для работы с химическими веществами. Например, студенты используют их только для описания химических реакций. Например, чтобы определить максимальные положительные и отрицательные числа окисления, им нужно проверить названия химических веществ в таблице.
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Поэтому очень легко найти стандартные пределы погрузки для того или иного товара. Такие действия можно выполнить с помощью расчетов, основанных на таблице Менделеева.
Это важно знать! Элемент может одновременно иметь множество различных значений окисления.
Существует два основных способа определения уровня окисления. Примеры приведены ниже. Первый метод требует знания и умения применять химические законы. Как с помощью этого метода можно определить степень окисления?
Правила определения состояния окисления.
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Курс химии: что такое галоген?
В качестве примера рассмотрим соединение ионов алюминия с общим зарядом, равным нулю. Правила химии подтверждают тот факт, что число окисления иона Cl равно -1, и в этом случае в соединении их три. Поэтому, чтобы нейтрализовать все соединение, ион al должен иметь значение +3.
Этот метод очень хорош тем, что, суммируя все уровни окисления вместе, всегда можно контролировать точность раствора.
Второй метод можно применять без знания химических законов.
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, где отдельные S не определены.
Это интересно! Курс химии: катионы и анионы — что это такое?
Для того чтобы все степени окисления были одинаковыми, необходимо
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
С ионом NH4 + ион, вид азотной нагрузки — x + (+1) x 4 = 1. Ясно, что x = -3, т.е. степень окисления азота равна -3.
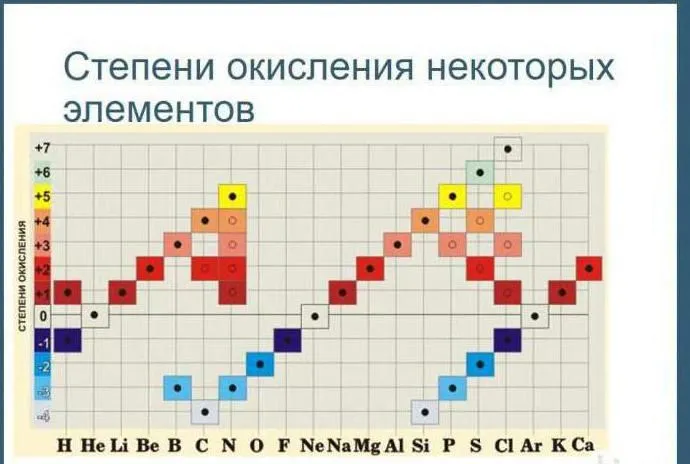
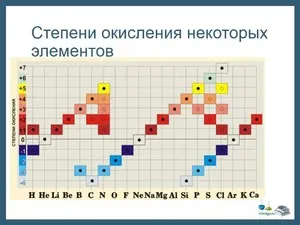
Таблица окисления химических элементов
Таблицы химического окисления используются для определения состояния загрузки индивида в реакции окисления. В зависимости от качества индивида элемент может иметь положительное или отрицательное состояние окисления.
Что такое степень окисления
Элементарная нагрузка элемента в композитном материале называется его состоянием окисления. Величина нагрузки индивидуума регистрируется в окислительно-восстановительной реакции, чтобы понять, какие элементы восстанавливаются и какие окислители восстанавливаются.
Степень окисления связана с электричеством и указывает на способность человека принимать или отдавать электроны. Чем выше значение электронов, тем больше способность человека потреблять электроны в реакции.
Рисунок 1. Ряд электрических свойств.
Для состояния окисления существует три значения.
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степень окисления в реакции между натрием и хлором составляет
В реакциях с неметаллическими металлами металл всегда является восстановителем, а неметалл — окислителем.
Как определить
Существует таблица, показывающая все возможные состояния окисления элементов.
Состояние окисления
В качестве альтернативы используйте эту версию таблицы в уроке.
Рисунок 2.Таблица окисления.
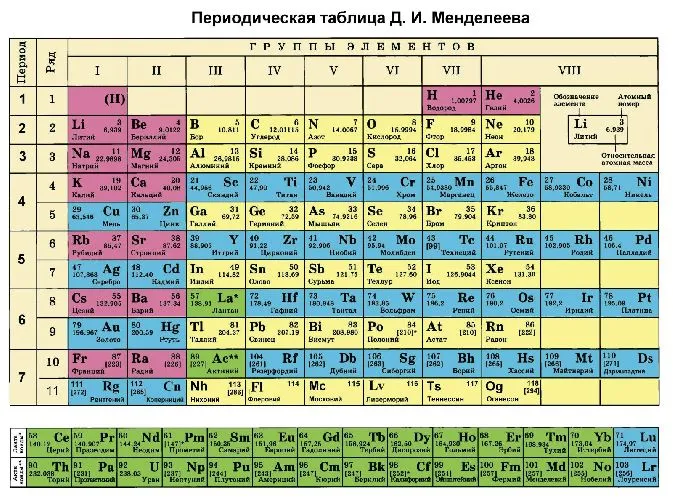
В качестве альтернативы, степень окисления химического элемента можно определить по периодической таблице Менделеева.
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Рисунок 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степень окисления. Например, кремний относится к группе IV и имеет максимальную степень окисления +4 и минимальную -4. К неметаллическим соединениям (так3co2, sic) окислительные среды — это неметаллы с отрицательной степенью окисления или высшей электризуемостью. Например, в Союзе PCL3Фосфор имеет степень окисления +3, а хлор -1. Электроны фосфора составляют 2,19, а хлора — 3,16.
Второе правило не применяется к щелочным и щелочноземельным металлам, которые всегда имеют положительную степень окисления, равную номеру группы. Исключение составляют магний и бериллий (+1 и +2). Состояние окисления также является постоянным.
Другие металлы не имеют стабильного состояния окисления. В большинстве реакций они выступают в качестве восстановителей. В редких случаях это могут сделать окислители с отрицательной степенью окисления.
Фтор является сильнейшим окислителем. Его степень окисления всегда равна -1.
Для соединений определяется, состоят ли они из ионов. Для многоатомных ионов сумма всех степеней окисления равна их нагрузке. Найдите эту сумму из таблицы растворителей и приравняйте ее к известному числу окисления.
Как расставлять степень окисления в солях
Соль состоит из металла и одного или нескольких кислотных остатков. Метод определения такой же, как и для кислых кислот.
Металл, непосредственно образующий соль, находится в главной подгруппе, и его степень равна номеру группы. Это означает, что они всегда остаются стабильными.
В качестве примера рассмотрим расположение степеней окисления нитрата натрия. Соль образована элементами главной подгруппы в группе 1, поэтому ее степень окисления положительна и равна 1. В нитрате кислород имеет значение -2. Чтобы получить числовое значение, сначала строится уравнение с неизвестными, учитывающее все отрицательные и положительные значения, +1 +x-6 = 0. Решив уравнение, можно прийти к тому, что число положительное и равно + 5. Такова цена азота. Таблица является ключом к расчету степени окисления.
1. Степень окисления – это условный заряд элемента, рассчитанный исходя из условий, что все связи в соединении ионные.
2. Вычислите степени окисления атомов химических элементов в следующих соединениях и запишите их под символом:
3. Определите степень окисления атомов по следующим схемам:
4. Определите число отданных или принятых электронов по следующим схемам:
5. Оксиление – это процесс отдачи электронов.
Восстановление – это процесс присоединения электронов.
Окислитель – это частица, которая присоединяет электроны.
Восстановитель – это частицы, которая отдает электроны.
6. Расставьте коэффициенты в уравнениях ОВР методом электронного баланса, определите окислитель и восстановитель, укажите процессы окисления и восстановления:
Сохраните или поделитесь с одноклассниками:
Задачи:
– сформировать понятие «степень окисления», «бинарные соединения»;
– научить определять степени окисления, называть бинарные соединения, составлять формулы бинарных соединений по степени окисления;
– совершенствовать умения высказываться, обсуждать суждения;
– воспитывать у учащихся внимательность и сосредоточенность.
Мотивация и целеполагание:
– Какие элементы отдают, а какие элементы принимают электроны? Чем отличаются металлы от неметаллов? В чем сущность ионной и ковалентной связи?
Изучение нового материала:
С бинарными соединениями вы уже знакомились. Их еще называют двухэлементными соединениями, потому что би от лат. — два. Т. е. бинарные соединения — это сложные вещества, состоящие из двух химических элементов.
Например, при изучении ионной и ковалентной связи, мы встречали такие соединения. Помните, при образовании молекулы NaCl, Na отдает свой электрон атому Cl, при этом они оба превращаются в ионы Na+ и Cl–.
При образовании молекулы HCl, общая пара электронов смещена к атому Cl, т.к. он более электроотрицательный и на атомах появляются частичные заряды: на атоме H+δ , на атоме Cl-δ. Если предположить, что электрон от Н полностью перешел к атому Cl, то их заряды будет не частичные, а +1 и -1: H+1 и Cl-1. Эти условные заряды и называют степенью окисления.
Значения степеней окисления ставят над символом элемента арабской цифрой, впереди которой ставят «+» или «-». Например, MgCl2, степень окисления Mg (+2), Cl (-1). Следует различать степени окисления и заряды ионов. Например, в молекуле NaCl, степень окисления Na (+1), а Cl (-1). В зарядах этих ионов цифры опускают и записывают ионы Na+, Cl–.
Запомните, что степень окисления — это условный заряд атомов химического элемента в соединении, если предположить, что оно состоит только из ионов.
Степень окисления может быть положительной, отрицательной и нулевой. Положительную степень окисления имеют как металлы, так и неметаллы, кроме фтора, гелия и неона. Максимальная степень окисления равна номеру группы. Т. е. у N высшая степень окисления равна +5, т.к. он находится в V группе. Отрицательную степень окисления имеют только неметаллы, т.к. они присоединяют электроны до завершения внешнего уровня. Минимальная степень окисления равна №группы — 8. Т.о. у N минимальная степень окисления будет 5 — 8 = -3. Кроме максимальной и минимальной степени окисления есть еще промежуточная степень окисления. Например, у N она равна +3.
Нужно знать, что степень окисления простых веществ равна 0, т. е. у N2, H2, S8, Cu, O3 и др. простых веществ она — 0.
Степень окисления F всегда -1, потому что он самый электроотрицательный элемент и принимает электроны при образовании химической связи. Например, в соединении NaF, у F степень окисления (-1).
У кислорода степень, окисления -2, потому что он второй элемент по электроотрицательности, иск. cоставляет соединение кислорода с фтором, где его степень окисления +2. Например, в соединении CaO, степень окисления О (-2), а в соединении OF2, степень окисления О (+2).
У металлов степень окисления всегда положительная, т.к. они отдают электроны другим атомам. Степень окисления металлов, А групп численно совпадает с валентностью. Например, в соединении Na2O степень окисления Na (+1), т.к. он является металлом, значит, у него только положительная степень окисления, а 1, потому что он является металлом I A группы, значит, и валентность его — единица. Аналогично и в соединении BaS, степень окисления Ва (+2), т.к. он металл II A группы, в соединении Al2O3, степень окисления Al (+3), т.к. это металл III, А группы.
Степень окисления Н всегда (+1), за исключением его соединений с металлами, где у него степень окисления (-1). Например, CaH2, KH, LiH, в этих соединениях у водорода степень окисления (-1).
Как было сказано, валентность численно совпадает со степенью окисления. Однако не всегда. Степень окисления имеет знак заряда, а валентность — нет.
Давайте вспомним, что валентность — это число связей, которыми атом связан с другими атомами, а степень окисления — это условный заряд атомов.
Давайте сравним валентность и степень окисления у азота (N2). Степень окисления равна 0, т.к. это простое вещество, а вот валентность равна III, потому что атом азота связан с другим атомом азота тройной связью.
Или в пероксиде (Н2О2) степень окисления О (-1), а валентность равна II, т.к. О связан двумя связями с атомами водорода: Н — О — О — Н.
А в ацетилене (С2Н2) степень окисления С (-1), а валентность IV: Н — С == С — Н.
Учитывая, что суммарная степень окисления равна 0, можно найти степени окисления элементов в соединении, а также составить формулу соединения, зная степени окисления.
Определим степени окисления элементов в соединении Fe2O3. Степень окисления О нам известна (-2). Следовательно, три атома О будут иметь общий заряд (-6), т.к. (-2) · 3 = -6. Тогда общий заряд двух атомов железа будет равен (+6), помните, что суммарный заряд равен 0. Значит, степень окисления одного атома Fe будет (+3), т.к. (+6) ׃ 2 = +3.
Составим формулу соединения Al с C. Для этого запишем символы элементов Al, C. Углерод на втором месте, потому что он более электроотрицательный. Al — элемент III A группы. Он является металлом, поэтому он отдаст свои 3 электрона и получит степень окисления (+3), а С — элемент IV A, он примет еще 4 электрона для завершения своего внешнего уровня, на котором уже есть 4 электрона, при этом получит степень окисления (-4). Запишем значения степеней окисления в формулу сверху. Теперь найдем наименьшее общее кратное. Оно будет 12. Затем НОК разделим на абсолютные значения степеней окисления и получим соответствующие индексы. 12: 3 = 4, значит индекс у Al — 4, 12: 4 = 3, значит индекс у С — 3. Следовательно, формула будет Al4C3.
Чтобы дать название бинарному соединению нужно сделать следующим образом: сначала называют более электроотрицательный элемент — это неметалл. Его латинское название стоит в именительном падеже и употребляется с суффиксом — ид. Например: оксид, хлорид, сульфид, нитрид. Второе слово обозначает элемент менее электроотрицательный, его название стоит в родительном падеже.
Например, назовем следующие соединения: Na2S, K2O, BaCl2, Mg3N2.
Na2S — сульфид натрия, K2O — оксид калия, BaCl2 — хлорид бария, Mg3N2 — нитрид магния. Если элемент имеет переменную степень окисления, то после названия в скобках римскими цифрами указывают степень окисления. Например, назовем следующие соединения: MnO2, CO2, P2O5.
MnO2 — оксид марганца (IV), CO2 — оксид углерода (IV), P2O5 — оксид фосфора (V).
В некоторых случаях, число атомов элементов обозначают при помощи названий числительных на греческом языке. Т. е. 1 — моно, 2 — ди, 3 — три, 4 — тетра, 5 — пента и т. д. Например, СО — монооксид углерода, или оксид углерода (II); СО2 — диоксид углерода, или оксид углерода (IV).
Для того чтобы химики всего мира понимали друг друга, необходимо было создать единую терминологию и номенклатуру, т. е. названия веществ. Впервые в 1785 г. такими учеными, как А. Лавуазье, А Фуркруа, Л. Гитоном де Мерво и К. Бертолле, были разработаны принципы номенклатуры. В настоящее время принципы номенклатуры и терминологии разрабатывает Международный союз теоретической и прикладной химии (ИЮПАК).
Обобщение и систематизация знаний:
1. Фронтальный опрос по теме.
2. § 12, упр. 1, 2.
Закрепление и контроль знаний:
1. § 12, упр. 5
2. Определите степени окисления у следующих соединения:
а) CH4; б) Ba3N2; в) CCl2; г) PCl3; д) F2O.
Ответы: а) -4 и +1; б) +2 и -3; в) +2 и -1; г) +3 и -1; д) -1 и +2.
3. Назовите следующие бинарные соединения:
а) КH; б) Al2O3; в) NaCl; г) CuO; д) CaH2.
Ответы: а) гидрид калия; б) оксид алюминия; в) хлорид натрия; г) оксид меди (II); д) гидрид кальция.
4. Составьте бинарные соединения фосфора с кислородом.
Ответ: у фосфора может быть с кислородом степень окисления +5 и +3, следовательно, соединения будут Р2О5 и Р2О3.
Рефлексия и подведение итогов:
На доске числовая ось, оцените свои знания по новой теме по этой шкале.
Домашнее задание:
I уровень: § 12, упр. 4, 6;
II уровень: тоже + упр. 7.