Прежде чем анализировать, как составлять изомеры предельных углеводородов, выявим особенности данного класса органических веществ.
Насыщенные углеводороды
В органической химии выделяется множество классов CxHy. У каждого есть своя общая формула, гомологический ряд, качественные реакции, применение. Для насыщенных углеводородов класса алканов характерны одинарные (сигма) связи. Общая формула данного класса органических веществ CnH2n+2. Этим объясняются основные химические свойства: замещение, горение, окисление. Для парафинов не характерны присоединение, так как связи в молекулах этих углеводородов одинарные.

Изомерия
Такое явление, как изомерия объясняет многообразие органических веществ. Под изомерией принято понимать явление, при котором существует несколько органических соединений, имеющих одинаковый количественный состав (число атомов в молекуле), но различное расположение их в молекуле. Получаемые вещества называют изомерами. Они могут быть представителями нескольких классов углеводородов, а потому отличаются химическими свойствами. Разное соединение в молекуле алканов атомов С приводит к возникновению структурной изомерии. Как составлять изомеры алканов? Существует определенный алгоритм, согласно которому можно изобразить структурные изомеры данного класса органических веществ. Появляется подобная возможность только с четырех углеродных атомов, то есть, с молекулы бутана С4Н10.
Разновидности изомерии
Для того чтобы понять, как составлять формулы изомеров, важно иметь представление о ее видах. При наличии внутри молекулы одинаковых атомов в равном количестве, располагающихся в пространстве в разном порядке, идет речь о пространственной изомерии. Иначе ее называют стереоизомерией. В подобной ситуации применения одних только структурных формул будет явно недостаточно, потребуется использование специальных проекционных или пространственных формул. Предельные углеводороды, начиная с H3C–СН3 (этана), имеют различные пространственные конфигурации. Это обусловлено вращением внутри молекулы по связи С–С. Именно простая σ-связь создает конформационную (поворотную) изомерию.

Структурная изомерия парафинов
Поговорим о том, как составлять изомеры алканов. Класс имеет структурную изомерию, то есть, атом углерода образует разные цепи. Иначе возможность изменения положения в цепи атомов углерода называют изомерией углеродного скелета.
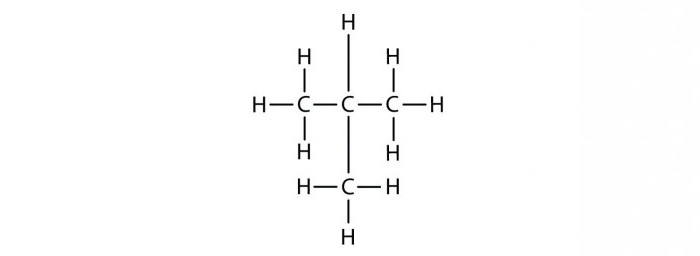
Изомеры гептана
Итак, как оставлять изомеры для вещества, имеющего состав C7H16? Для начала можно расположить все атомы углерода в одну длинную цепочку, добавить для каждого определенное число атомов С. Сколько? Учитывая, что валентность углерода равна четырем, у крайних атомов будет по три атома водорода, а у внутренних – по два. Полученная молекула имеет линейное строение, такой углеводород называют н – гептаном. Буква «н» подразумевает прямой углеродный скелет в данном углеводороде.
Теперь меняем расположение углеродных атомов, «укорачивая» при этом прямую углеродную цепочку в C7H16. Составить изомеры можно в развернутом либо сокращенном структурном виде. Рассмотрим второй вариант. Сначала один атом С расположим в виде радикала метил в разных положениях.
Данный изомер гептана имеет следующее химическое название: 2-метилгексан. Теперь «передвигаем» радикал к следующему углеродному атому. Полученный предельный углеводород называется: 3-метилгексан.
Если мы будем далее передвигать радикал, нумерация будет начинаться с правой стороны (ближе к началу располагается углеводородный радикал), то есть, мы получим такой изомер, который у нас уже есть. Поэтому думая над тем, как составлять формулы изомеров для исходного вещества, попробуем сделать скелет еще «короче».
Оставшиеся два углерода можно представить в виде двух свободных радикалов – метил.
Расположим сначала их у разных углеродов, входящих в главную цепь. Назовем полученный изомер -2,3 диметилпентан.
Теперь оставим один радикал на том же месте, а второй перенесем к следующему углеродному атому главной цепи. Данное вещество называется 2,4 диметилпентан.
Теперь расположим углеводородные радикалы у одного углеродного атома. Сначала у второго, получим 2,2 диметилпентан. Затем у третьего, получив 3,3 диметилпентан.
Теперь оставляем в основной цепи четыре атома углерода, оставшиеся три используем в качестве радикалов метил. Располагаем их следующим образом: два у второго атома С, один – у третьего углерода. Называем полученный изомер: 2,2, 3 триметилбутан.
На примере гептана мы разобрали, как правильно составлять изомеры для предельных углеводородов. На фото представлены примеры структурных изомеров для бутена6 его хлорпроизводных.
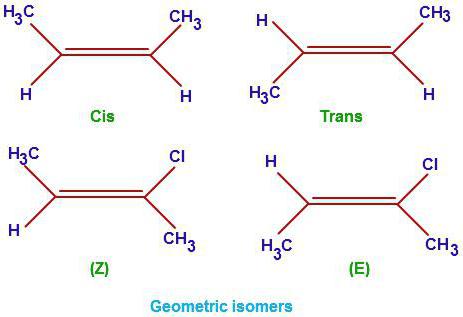
Алкены
Данный класс органических веществ имеет общую формулу CnH2n. Помимо насыщенных связей С-С в данном классе есть также двойная связь. Именно она определяет основные свойства данного ряда. Поговорим о том, как оставлять изомеры алкенов. Попробуем выявить их отличия от предельных углеводородов. Помимо изомерии главной цепи (структурные формулы) для представителей данного класса органических углеводородов также характерны еще три разновидности изомеров: геометрические (цис- и трансформы), положения кратной связи, а также межклассовая изомерия (с циклоалканами).
Изомеры C6H12
Попробуем выяснить, как составить изомеры c6h12, учитывая тот факт, что вещество с данной формулой может принадлежать сразу к двум классам органических веществ: алкенам, циклоалканам.
Для начала подумаем, как составлять изомеры алкенов, если есть двойная связь в молекуле. Ставим прямую углеродную цепочку, поставим кратную связь после первого углеродного атома. Попробуем не только составить изомеры с6н12, но и назвать вещества. Данное вещество – гексен – 1. Цифрой указывается положение в молекуле двойной связи. При ее передвижении по углеродной цепочке, получаем гексен -2, а также гексен – 3
Теперь порассуждаем, как составлять изомеры для данной формулы, меняя количество атомов в главной цепи.
Для начала укоротим углеродный скелет на один углеродный атом, его будет рассматривать в качестве радикала метил. Двойную связь оставим после первого атома С. Полученный изомер по систематической номенклатуре будет иметь следующее название: 2 метилпентен – 1. Теперь передвигаем углеводородный радикал по главной цепи, оставив положение двойной связи неизменным. Данный непредельный углеводород разветвленного строения называют 3 метилпентен -1.
Возможен без изменения основной цепи и положения двойной связи еще один изомер: 4 метилпентен -1.
Для состава C6H12 можно попробовать переместить двойную связь из первого во второе положение, не преобразуя саму главную цепочку. Радикал при этом будет передвигать по углеродному скелету, начиная со второго атома С. Данный изомер имеет название 2 метилпентен-2. Кроме того, можно поместить радикал CH3 третьего атома углерода получив при этом 3 метилпентен-2
Если поместить радикал у четвертого углерода атома в данной цепи, образуется еще одно новое вещество непредельный углеводород с извилистым углеродным скелетом – 4 метилпентен-2.
При дальнейшем сокращении числа С в главной цепи, можно получить еще один изомер.
Двойную связь оставим после первого углеродного атома, а два радикала поставим к третьему атому С основной цепи, получаем 3,3 диметилутен-1.
Теперь поставим радикалы у соседних углеродных атомов, не меняя положения двойной связи, получим 2,3 диметилбутен-1. Попробуем, не меняя размер главной цепи, передвинуть двойную связь во второе положение. Радикалы при этом мы может поставить только у 2 и 3 атомов С, получив 2,3 диметилбутен-2.
Других структурных изомеров для данного алкена нет, любые попытки их придумать приведут к нарушению теории строения органических веществ А. М. Бутлерова.

Пространственные изомеры C6H12
Теперь выясним, как составлять изомеры и гомологи с точки зрения пространственной изомерии. Важно понимать, что цис- и трансформы алкенов возможны только для положения двойной связи 2 и 3.
При нахождении в одной плоскости углеводородных радикалов, образуется цис – измер гексена -2, а при расположении радикалов в разных плоскостях, транс-форма гексена – 2.
Межклассовые изомеры C6H12
Рассуждая над тем, как составлять изомеры и гомологи, нельзя забывать и о таком варианте, как межклассовая изомерия. Для непредельных углеводородов ряда этилена, имеющих общую формулу CnH2n, такими изомерами являются циклоалканы. Особенностью данного класса углеводородов является наличие циклической (замкнутой) структуры при насыщенных одинарных связях между атомами углерода. Можно составить формулы циклогексана, метилциклопентана, диметилциклобутана, триметилциклопропана.
Заключение
Органическая химия многогранна, загадочна. Количество органических веществ превышает в сотни раз число неорганических соединений. Данный факт легко объясняется существованием такого уникального явления, как изомерия. Если в одном гомологическом ряду располагаются сходные по свойствам и строению вещества, то при изменении положения атомов углерода в цепи, появляются новые соединения, названные изомерами. Только после появления теории химического строения органических веществ удалось классифицировать все углеводороды, понять специфику каждого класса. Одно из положений данной теории, непосредственно касается явления изомерии. Великий русский химик сумел понять, объяснить, доказать, что именно от расположения углеродных атомов зависят химические свойства вещества, его реакционаня активность, практическое применение. Если сравнивать количество изомеров, образуемых предельными алканами и непредельными алкенами, лидируют, безусловно, алкены. Объясняется это тем, что в их молекулах есть двойная связь. Именно она позволяет этому классу органических веществ образовывать не только алкены разного вида и строения, но и вести речь о меклассовой изомерии с циклоалканами.
И.М. ХАРЧЕВА
Учебно-методическое пособие
по органической химии
Тема 2.
Предельные углеводороды.
Циклопарафины
Знать: общие формулы алканов и
циклоалканов, строение алканов, гомологический
ряд алканов, изомерию и номенклатуру алканов и
циклоалканов, их физические и химические
свойства; получение, применение и механизмы
реакций замещения алканов и циклоалканов.
Уметь: давать названия алканам и
циклоалканам, составлять их формулы по названиям
веществ; составлять структурные формулы
гомологов и изомеров для предложенного алкана
или циклоалкана; составлять уравнения реакций,
характеризующих свойства алканов, циклоалканов
и галогеналканов; составлять структурные
формулы галогеналканов, называть их, графически
обозначать распределение электронной плотности
в молекулах; решать расчетные задачи на
нахождение молекулярной формулы вещества по
массовым долям элементов и по массе (объему)
продуктов сгорания.
Основные понятия: алканы, циклоалканы,
тетраэдрическое строение молекул, общая формула,
гомологи, гомологическая разность, взаимное
влияние атомов, заместитель, изомерия положения
заместителей, индукционный эффект, цепная
реакция, простейшая формула, истинная формула.
Алгоритм 2.1. Номенклатура алканов
Задание 1. Назвать вещество по
систематической номенклатуре:
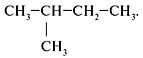
Решение
1. Выбрать главную цепь (наиболее длинная цепь
углеродных атомов):
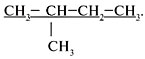
2. Пронумеровать атомы углерода в главной цепи с
того конца, к которому ближе стоит заместитель
(углеводородный радикал):
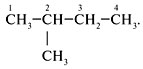
Последовательно назвать:
1) номер углеродного атома, с которым связан
радикал;2) радикал;
3) углеводород, которому соответствует длинная
цепь: 2-метилбутан.
Задание 2. Составить структурную
формулу углеводорода по его названию
«2,3-диметилпентан».
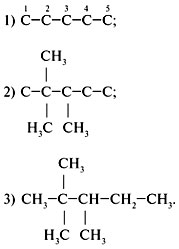
Решение
Анализируем название углеводорода, начиная с
конца слова.
1. «Пентан» – в главной цепи находится пять
атомов углерода:
![]()
2. «Диметил» – в состав углеводорода входят два
радикала CH3.
3. «2, 3-» – радикалы находятся у 2-го и 3-го
углеродных атомов:
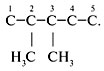
4. Дописать недостающие атомы водорода,
соблюдая четырехвалентность атома углерода:
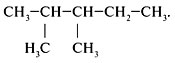
Алгоритм 2.2. Гомологи и изомеры
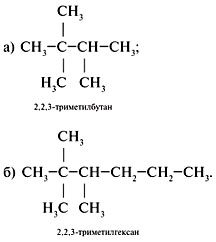
Задание. Для 2,2,3-триметилпентана
составить формулы двух гомологов и двух
изомеров.
Решение
1. Составить формулу исходного вещества,
используя задание 2 алгоритма 2.1:
2. Составить формулы г о м о л о г о в, сохраняя
строение (разветвление 2,2,3-триметил-). Для этого
уменьшить главную цепь на группу СН2
(гомологическая разность) – пример а или
увеличить главную цепь на СН2 – пример б:
3. Составляя формулы и з о м е р о в, изменить
строение, сохраняя состав исходного
углеводорода (C8H18), примеры в, г:
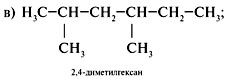
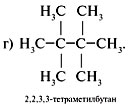
Алгоритм 2.3. Решение расчетных задач на
вывод
молекулярной формулы вещества по массовым долям
элементов
Задача 1. Найти молекулярную формулу
вещества, содержащего 81,8% углерода и 18,2% водорода.
Относительная плотность вещества по азоту равна
1,57.
Решение
1. Записать условие задачи.

2. Вычислить относительную молекулярную массу Mr(CхHy)
по относительной плотности:
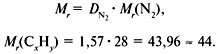
3. Найти индексы х и y по отношению ![]() :
:
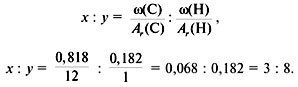
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44,
следовательно, C3H8 – истинная
формула.
Задача 2. Найти молекулярную формулу
предельного углеводорода, массовая доля
углерода в котором 83,3%.
Решение
1. Записать условие задачи.

2. Найти массовую долю водорода:
![]() (Н) = 100%
(Н) = 100%
– 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для
углеводорода CхHy:
![]()
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая
формула алканов СnH2n+2, то
истинная формула – С4Н10.
Алгоритм 2.4. Решение расчетных задач
на вывод
молекулярной формулы вещества по массе (объему)
продуктов сгорания
Задача 1. При сжигании 29 г углеводорода
образовалось 88 г углекислого газа и 45 г воды,
относительная плотность вещества по воздуху
равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
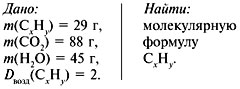
2. Найти относительную молекулярную массу
вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29
= 58.
3. Найти количество вещества образовавшегося
оксида углерода(IV):
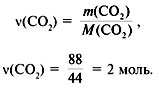
4. Найти количество вещества углерода в
сожженном веществе:
![]() (C) =
(C) = ![]() (CO2) = 2 моль.
(CO2) = 2 моль.
5. Найти количество вещества воды:
![]() (H2O)
(H2O)
= 45/18 = 2,5 моль.
6. Найти количество вещества водорода в
сожженном веществе:
![]() (H) = 2
(H) = 2![]() (H2O),
(H2O),
![]() (H) = 2,5•2 =
(H) = 2,5•2 =
5 моль.
7. Найти простейшую формулу углеводорода:
![]() (C) :
(C) : ![]() (Н) = 2 : 5,
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
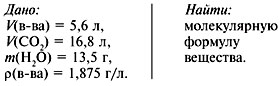
Задача 2. При сжигании 5,6 л (н.у.)
газообразного органического вещества было
получено 16,8 л (н.у.) углекислого газа и 13,5 г воды.
Масса 1 л исходного вещества при н.у. равна 1,875 г.
Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из
пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и
углерода:
![]() (CO2)
(CO2)
= 16,8/22,4 = 0,75 моль,
![]() (C) = 0,75
(C) = 0,75
моль.
4. Найти количества веществ воды и водорода:
![]() (H2O)
(H2O)
= 13,5/18 = 0,75 моль,
![]() (H) = 0,75•2
(H) = 0,75•2
= 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
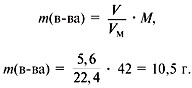
Следовательно, вещество содержит только
углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
![]() (C) :
(C) : ![]() (H) = 0,75 : 1,5 = 1 : 2,
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) =
42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Контрольные вопросы
1. Какие углеводороды называют предельными?
2. Строение метана.
3. Физические свойства алканов.
4. Виды изомерии алканов и циклоалканов.
5. Причины инертности алканов.
6. Какие типы химических реакций характерны
для алканов, циклоалканов и галогеналканов?
7. Какова последовательность замещения
атомов водорода на галоген в алканах, содержащих
более двух углеродных атомов?
8. Каков механизм реакции замещения?
9. Каковы способы получения алканов,
галогеналканов и циклоалканов?
10. Дайте определения следующим понятиям: гомологи,
изомеры, заместитель, электронный эффект,
электронная плотность связи, индуктивный эффект,
электронодоноры, электроноакцепторы.
Задания для самоконтроля
1. Назвать предельные углеводороды:
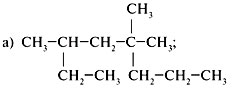
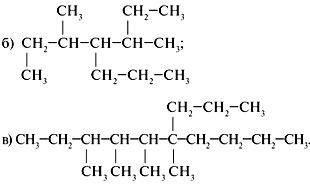
2. Составить структурную формулу
2,4,5,5-тетраметил-3-этилоктана. Указать все
первичные, вторичные, третичные и четвертичные
углеродные атомы.
3. Составить структурные формулы трех
углеводородов, содержащих четвертичный
углеродный атом, выбирая из первых семи членов
ряда алканов С1–С7. Назвать эти
углеводороды.
4. Привести структуры и названия продуктов
взаимодействия следующих алканов с хлором (в
мольном соотношении 1:1):
а) пропан;
б) 2,2-диметилбутан;
в) 2,3-диметилбутан.
5. Написать уравнения реакций, которые нужно
провести для осуществления следующих
превращений:
CH3COONa ![]() CH4
CH4
![]() CH3Br
CH3Br ![]() C2H6
C2H6 ![]() CO2
CO2 ![]() CO
CO ![]() CH4
CH4 ![]() C3H8.
C3H8.
6. Привести уравнения реакций получения и
названия дигалогеналканов, необходимых для
получения следующих соединений:
а) 1,2-диметилциклобутан;
б) пропилциклобутан;
в) метилциклопропан.
7. Органическое вещество содержит 84,21%
углерода и 15,79% водорода. Плотность паров
вещества по воздуху 3,93. Определить формулу
вещества.
Ответ. С8Н18.
8. Алкан имеет плотность паров по воздуху
4,414. Определить формулу алкана.
Ответ. С9Н20.
9. При сгорании 3,6 г алкана получили 5,6 л
оксида углерода(IV) (н.у.). Какие объемы кислорода и
воздуха затратились на эту реакцию?
Ответ. 8,96 л О2 и 42,67 л воздуха.
10. Углеводород содержит 82,76% углерода и 17,24%
водорода (по массе). При монохлорировании этот
углеводород образует два изомерных алкилхлорида
– первичный и третичный. Определить строение
исходного углеводорода.
Ответ. 2-метилпропан.
При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять – свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд – определения и примеры
Гомология – химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
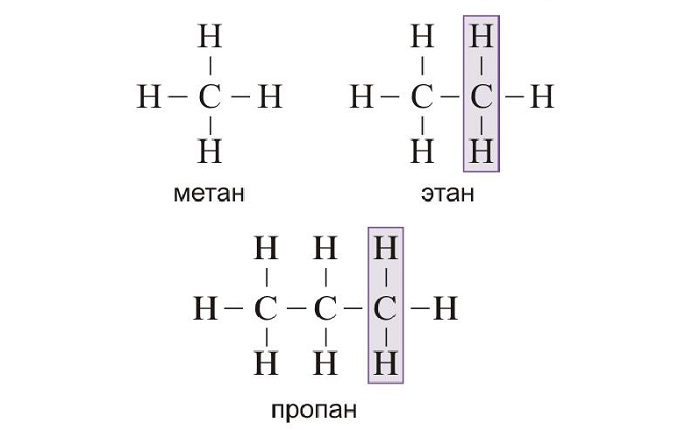
Гомологический ряд – последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
-
этин — C2H2;
-
пропин — C3H4;
-
бутин — C4H6;
-
пентин — C5H8 и т. д.
Гомологический ряд алканов в таблице
Алканы – ациклические предельные углеводороды:
-
всеобщая формула алканов — СnH2n+2;
-
названия веществ имеют суффикс -ан-.
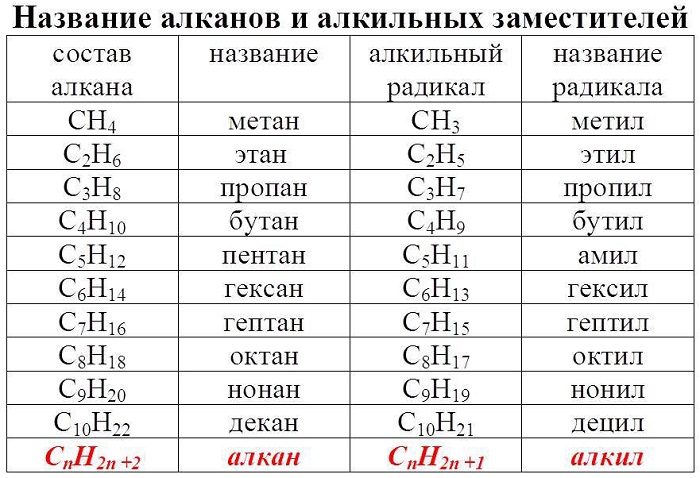
Алканы обладают следующими свойствами:
-
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
-
нерастворимы в воде, но могут растворяться в неполярных растворителях;
-
используются в промышленности (метан – топливо, пропан – автомобильное топливо, бутан – сырье для производства каучука, пропан и бутан – балонные газы).
|
Метан |
СН4 |
|
Этан |
С2Н6 |
|
Пропан |
С3Н8 |
|
Бутан |
С4Н10 |
|
Пентан |
С5Н12 |
|
Гексан |
С6Н14 |
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана – метилбутан.
Алканы могут вступать в следующие реакции:
-
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
-
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
-
Разложение при высокой температуре: СН4 = C + 2H2.
Гомологический ряд алкенов в таблице
Алкены – углеводороды, имеющие ациклический непредельный характер.
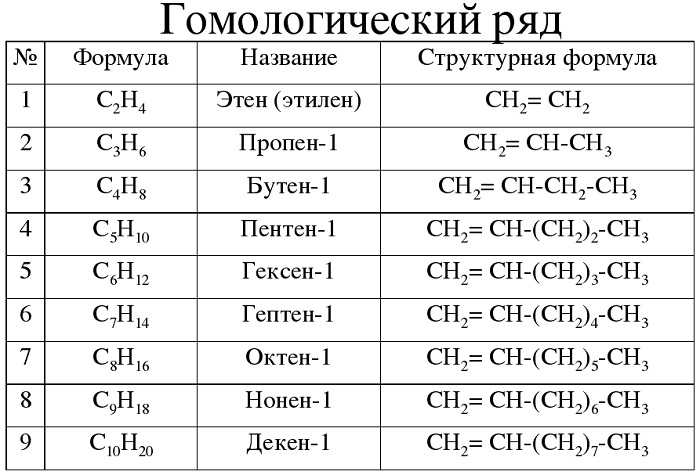
Краткая характеристика:
-
общая формула — CnH2n;
-
имеют суффикс -ен-.
Алкены обладают следующими свойствами:
-
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
-
имеют очень высокую температуру плавления и кипения;
-
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
|
Этилен |
C2H4 |
|
Пропен |
C3H6 |
|
Бутен |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
Алкены участвуют в следующих химических реакциях:
-
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
-
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
-
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
-
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
-
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
Гомологический ряд альдегидов
Альдегиды – органические вещества, имеющие в своём составе группу -CHO.
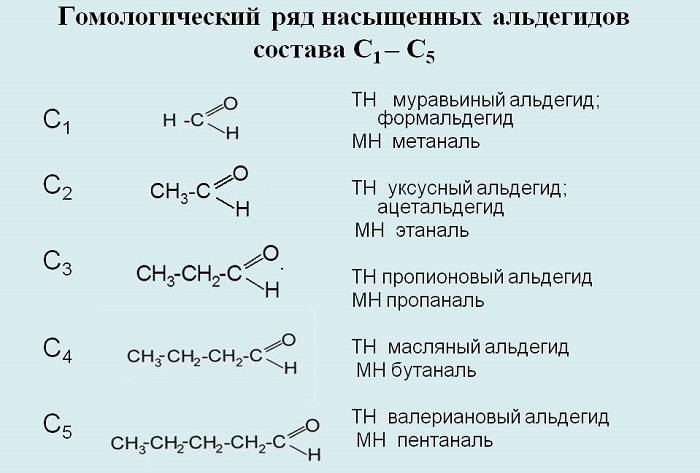
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых – СnH2nO, вторых – СnH2n+1CHO соответственно.
Названия составляются с помощью суффикса -аль-.
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
-
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
-
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
-
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
-
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
-
низшие представители класса имеют резкий запах;
-
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
-
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
myart989
Вопрос по химии:
Составить структурные формулы 3х гомологов и 3х изомеров состава C8H18 класса предельных углеводородов и дать им названия
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
cecholfethw214
как-то так но можно и больше намного больше)

Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Содержание
- 1 Строение ароматической связи
- 2 Гомологический ряд бензола
- 3 Номенклатура и изомерия алкилбензолов
- 3.1 Строение углеродного скелета
- 3.2 Позиции одинаковых заместителей
- 4 Физические свойства некоторых алкилбензолов
- 5 Химические свойства алкилбензолов
- 5.1 Замещение
- 5.2 Присоединение
- 5.3 Окисление
- 6 Взаимодействие радикалов с бензольным ядром
- 7 Заключение
Первым представителем ряда простейших ароматических углеводородов – аренов – является бензол. Все ароматические соединения – как гомологи бензола, так и арены более сложного строения – представляют собой его производные. Отличительный признак аренов – наличие в структуре молекулы бензольного кольца.
Строение ароматической связи
Химическая формула бензола – C6H6. Бензольная молекула – это циклическое образование, построенное из шести ![]() -гибридизованных углеродных атомов, каждый из которых соединен с одним атомом водорода.
-гибридизованных углеродных атомов, каждый из которых соединен с одним атомом водорода.
Углеродный скелет бензольного кольца имеет форму шестиугольника, в плоскости которого лежат оси соединяющих атомы ![]() -связей. Все эти связи одинаковы, угол между ними равен 120°. Поэтому негибридные p-облака, ориентированные перпендикулярно плоскости цикла, также равнозначны.
-связей. Все эти связи одинаковы, угол между ними равен 120°. Поэтому негибридные p-облака, ориентированные перпендикулярно плоскости цикла, также равнозначны.
Результатом их перекрывания становится обобществление всех p-электронов в единое ![]() -электронное облако с делокализованной плотностью. Сочетание прочных
-электронное облако с делокализованной плотностью. Сочетание прочных ![]() -связей и
-связей и ![]() -облака – ароматическая связь – образует стабильную структуру, называемую бензольным ядром.
-облака – ароматическая связь – образует стабильную структуру, называемую бензольным ядром.

При записи ядро условно обозначается шестиугольным циклом либо с тремя чередующимися двойными связями, либо с вписанной делокализационной окружностью, которая подчеркивает особый характер ароматической связи.
Гомологический ряд бензола
Молекула бензола состоит только из ароматического ядра. Остальные представители гомологического ряда имеют в составе молекулы алкильные радикалы, присоединенные к ядру, и называются алкилбензолами.
Состав гомологов бензола определяется общей формулой ![]() . Гомологическая разность выражается через звено
. Гомологическая разность выражается через звено ![]() углеводородной цепочки радикала.
углеводородной цепочки радикала.
Ряд бензола включает только арены с насыщенными радикалами и одним бензольным ядром. К числу ароматических углеводородов относятся соединения с непредельными радикалами, а также с несколькими бензольными кольцами, например:
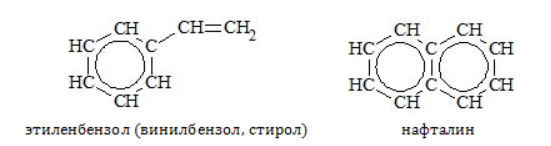
Эти углеводороды не являются гомологами бензола, они входят в состав других рядов класса аренов.
Строение углеводородов бензольного ряда представлено в таблице:
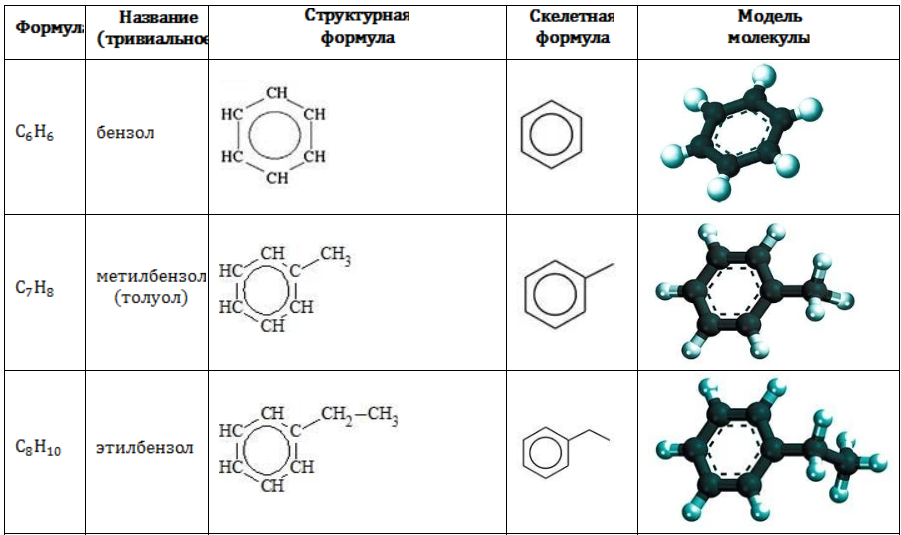
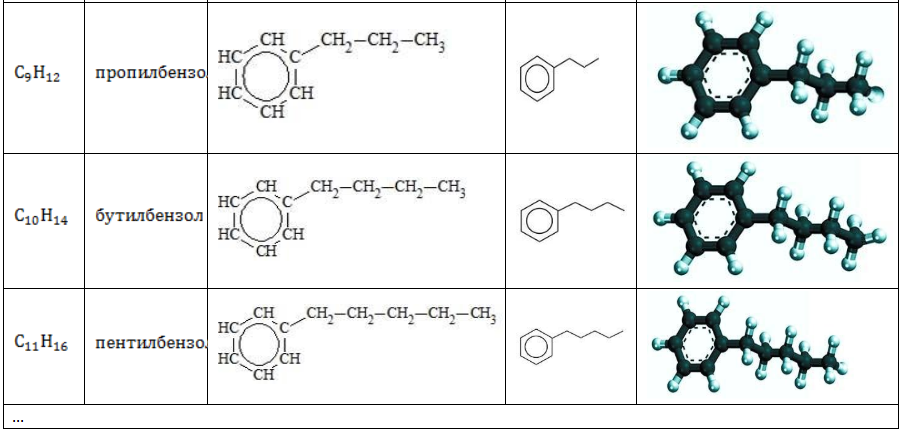
Арильные (содержащие бензольное ядро) радикалы носят следующие названия:

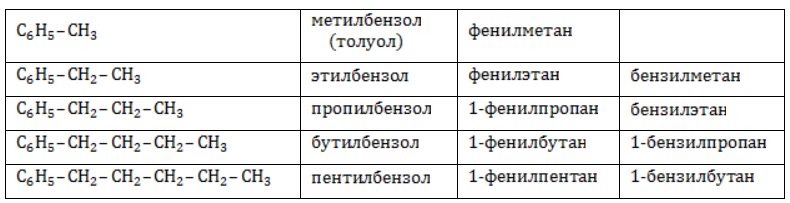
Каждый гомолог бензола может быть представлен как предельный углеводород с ароматическим радикалом:
Номенклатура и изомерия алкилбензолов
Всем соединениям гомологического ряда свойственна структурная изомерия, обусловленная наличием одной или нескольких боковых цепей. Не имеют изомеров только бензол и его ближайший гомолог – толуол, обладающий единственным простейшим метильным радикалом ![]() .
.
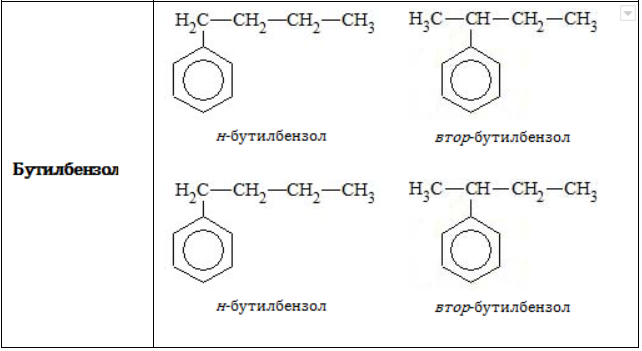
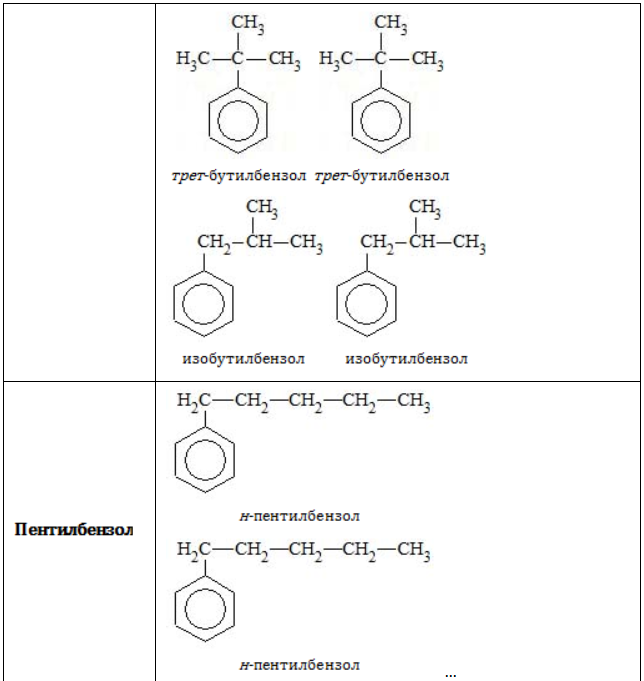
Строение углеродного скелета
В зависимости от количества, состава и строения алкильных заместителей для соединений состава ![]() характерно широкое разнообразие. Число изомерных форм быстро растет с увеличением n.
характерно широкое разнообразие. Число изомерных форм быстро растет с увеличением n.

При наименовании алкилбензолов соблюдаются следующие правила:
- ароматический цикл считается главной цепью и носит название «бензол»;
- алкильный заместитель указывается перед главной цепью: «метилбензол»;
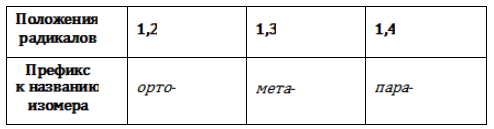
- в случае если радикалов более одного, их позиции нумеруются в направлении кратчайшего промежутка между ними: «1,2», «1,3», «1,4», но не «1,5» или «1,6»;
- количество одинаковых заместителей обозначается после их номеров греческими численными приставками: «1,2-диметилбензол»;
- разные заместители перечисляются по старшинству: «1,2-диметил-4-бутилбензол»;
- посредством приставок «н-», «втор-» или «трет-» указывается, по какому углеродному атому в заместителе (первичному, вторичному или третичному) осуществляется связь с бензольным ядром: «1,2-диметил-4-трет-бутилбензол».
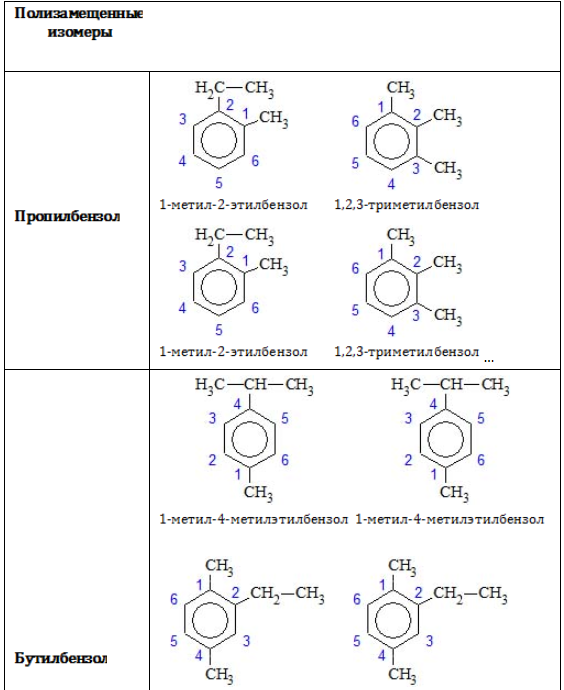
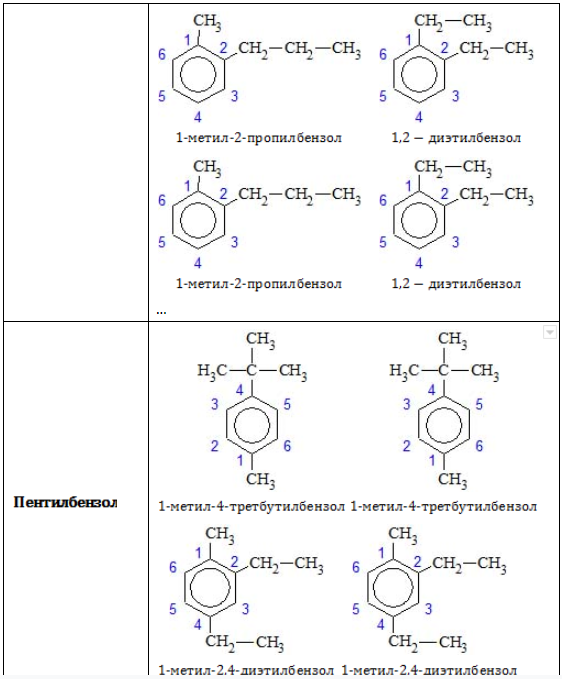
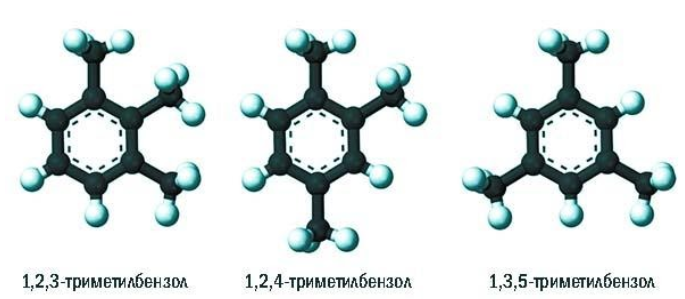
Позиции одинаковых заместителей
В полизамещенных алкилбензолах с радикалами одного типа возникает изомерия, связанная с их взаимным положением. Для позиционных изомеров в ряду бензола существуют специальные обозначения:
Например, дизамещенные изомеры этилбензола (имеют распространенное тривиальное наименование «ксилолы») образуют следующие изомеры по позициям метильных заместителей:

Физические свойства некоторых алкилбензолов
Бензол и углеводороды его ряда – бесцветные жидкости со специфическим запахом, не смешивающиеся с водой и нерастворимые в ней. Высшие гомологи представляют собой твердые вещества. Термические характеристики соединений бензольного ряда зависят от изомерии и длины боковых алкильных цепей.
Основные физические свойства бензола и наиболее близких его гомологов приведены в таблице.
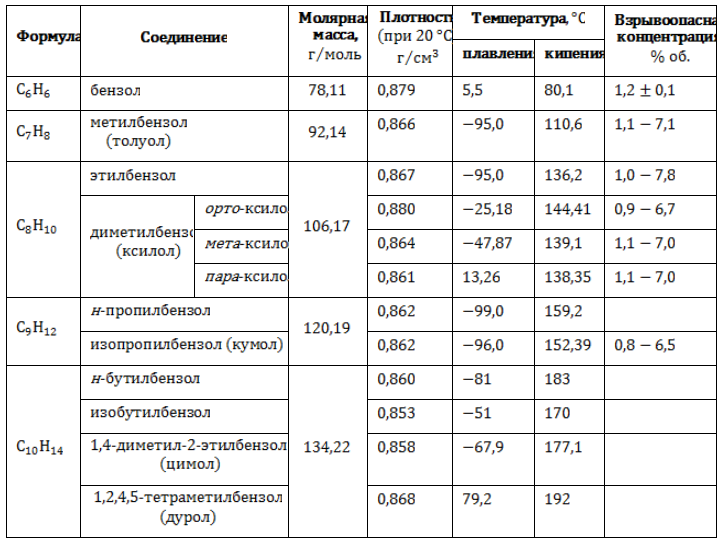
Химические свойства алкилбензолов
Несмотря на то, что по составу бензол и другие представители гомологического ряда являются ненасыщенными соединениями, они склонны к типичным для алканов реакциям замещения, а ароматическое ядро чрезвычайно устойчиво. Тем не менее, алкилбензолы способны и к процессам присоединения, хотя реакции данного типа значительно затруднены по сравнению с непредельными углеводородами.
Различные заместители оказывают влияние на стабильность и реакционную способность бензольного ядра; оно, в свою очередь, воздействует на свойства радикалов. Поэтому изомерия играет важную роль в химических взаимодействиях алкилбензолов.
Замещение
Поскольку ароматическая система насыщена электронной плотностью, бензол и гомологи охотно реагируют с электрофильными соединениями по донорно-акцепторному механизму. Для бензольного кольца типичны процессы ионного замещения.
- Галогенирование
В отсутствие катализатора алкилбензолы не взаимодействуют с галогенами и их растворами (хлорной или бромной водой). На никелевом, железном или алюминиевом катализаторе, способствующем активации галогена, замещение идет по преимуществу в бензольном ядре:
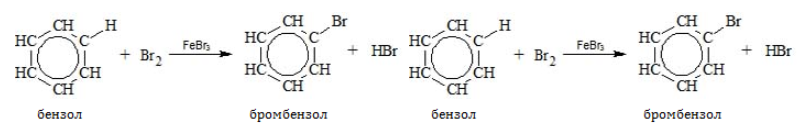
В молекулах гомологов галогены замещают водород главным образом в орто-и пара-позициях к углеводородному радикалу:

Замещение может происходить и в боковой цепи. Для этого требуется воздействие яркого света либо нагревание до 300°C:

При этом галоген атакует ближайший к кольцу углеродный атом.
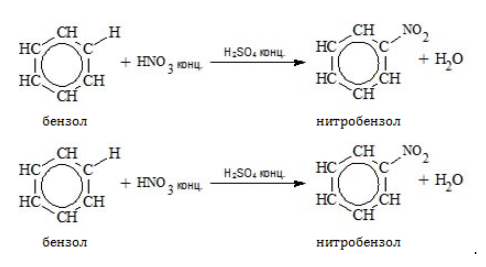
- Нитрование
Для реакции необходима нитрующая смесь концентрированных азотной и серной кислот:
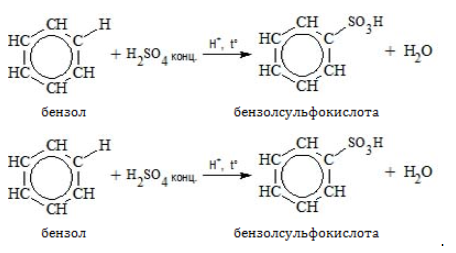
- Сульфирование
Бензол сульфируется концентрированной или «дымящей» кислотой (олеумом):
- Алкилирование
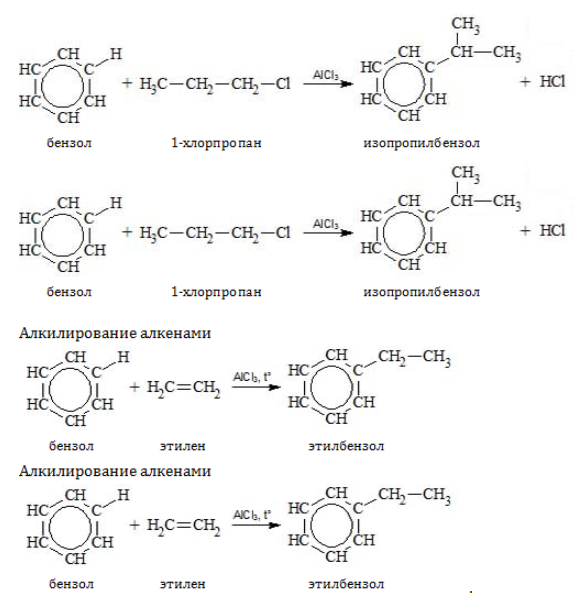
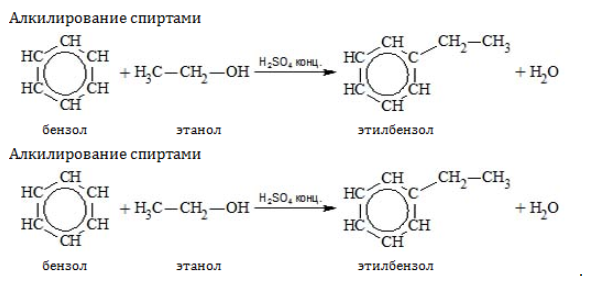
Замещение водорода алкильными радикалами является одним из методов получения гомологов бензола. Оно проводится несколькими путями:
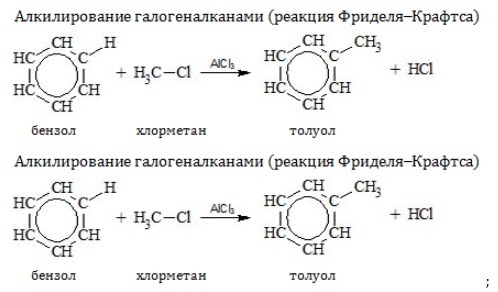
Если неразветвленный галогеналкан содержит более двух углеродных атомов, происходит изомеризация продукта алкилирования:
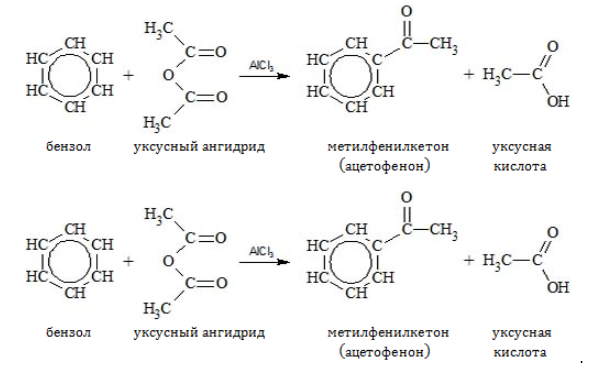
- Ацилирование
Водород может замещаться ацильным остатком ![]() галогенангидрида или ангидрида карбоновой кислоты:
галогенангидрида или ангидрида карбоновой кислоты:
Присоединение
В специальных условиях алкилбензолы способны к реакциям присоединения с разрушением ароматической связи.
- Гидрирование
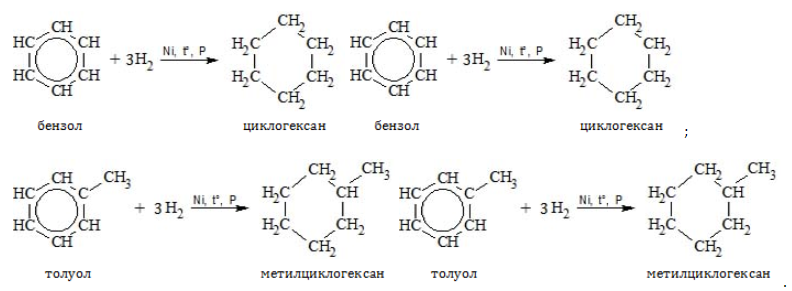
- Хлорирование
Из всех соединений гомологического ряда хлор присоединяется только к бензолу:
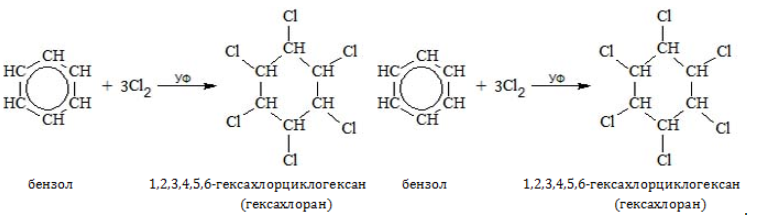
При воздействии галогена на любой из гомологов бензола происходит не присоединение, а замещение в алкильном радикале.
Окисление
Бензол стоек к воздействию окислителей, таких как перманганат калия, даже в присутствии кислот и щелочей. Но его гомологи в жестких условиях подвергаются окислению.
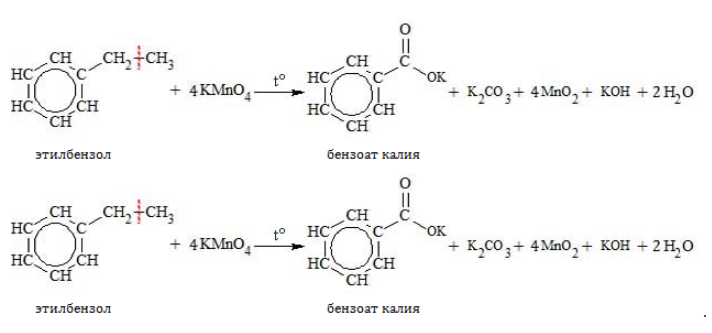
- Жесткое окисление
При повышенной температуре в нейтральной среде алкилбензолы окисляются до калиевой соли бензойной кислоты:

В кислой среде происходит образование бензойной кислоты:
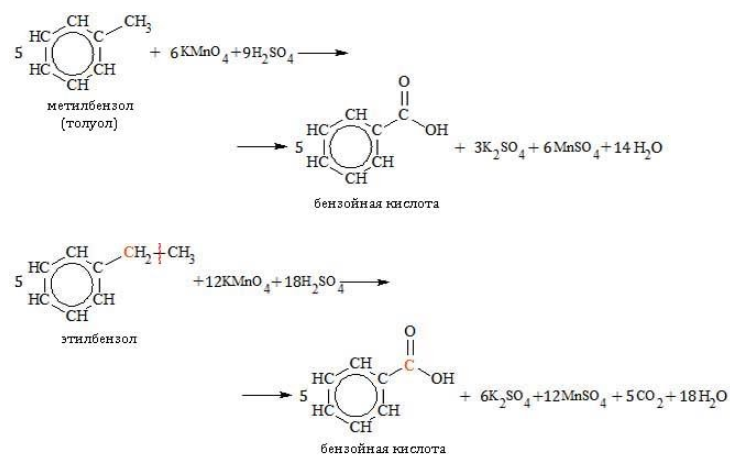
Гомологи с длинной боковой цепью образуют две кислоты, так как при отрыве цепи от углеродного атома, соединенного с бензольным циклом, образуется остаток, содержащий более одного атома:
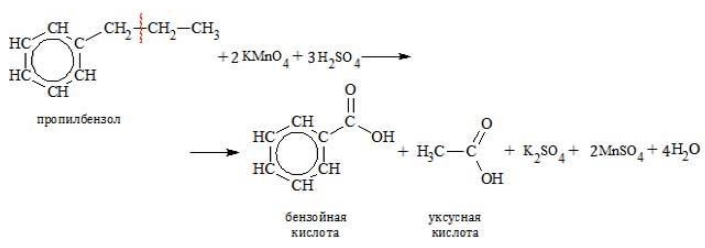
Если в реакции участвует полизамещенный алкилбензол, продуктом его окисления становится многоосновная ароматическая кислота:

- Полное окисление
Углеводороды ряда бензола горят с интенсивным выделением теплоты. Продукты горения зависят от количества вступающего в реакцию кислорода:
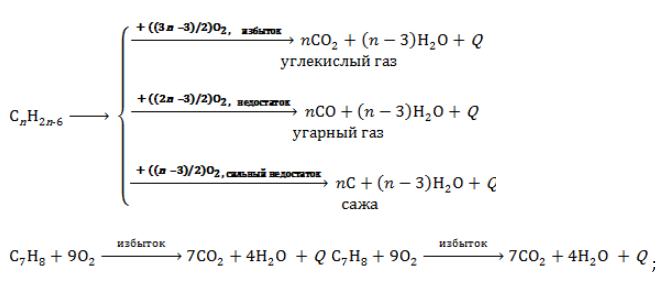

Взаимодействие радикалов с бензольным ядром
Заместители в зависимости от своей электрической природы по-разному влияют на распределение электронной плотности в ароматической системе. Соответственно изменяется и реакционная активность бензольного ядра в процессах замещения.
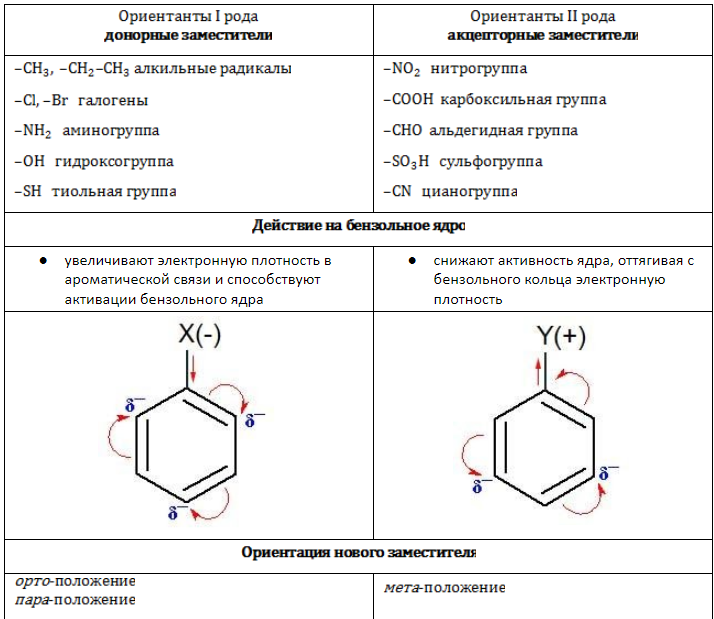

Это интересно:
Изомеры пентена
Общая формула циклоалканов
Окисление алкенов перманганатом калия
Заключение
Особенности электронного строения алкилбензолов не только оказывают влияние на их структуру и обусловливают многообразие изомерных форм. Они также непосредственно воздействуют на реакционную активность, определяя направление химических процессов с участием бензола и его гомологов. Это свойство алкилбензолов делает их ценным химическим продуктом, благодаря чему они находят широкое применение в промышленности и науке.
