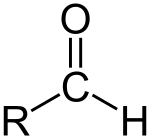
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:

Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Структурная формула альдегидов:

Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Структурная формула кетонов:

Строение карбонильных соединений
Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ-связи и одну π-связь.
Одна из σ–связей – связь С–О, все три σ–связи расположены в одной плоскости под углом 120о друг к другу.

π-Связь образована р-электронами атомов углерода и кислорода.

Из-за большей электроотрицательности атома кислорода по сравнению с атомом углерода связь С=О сильно поляризована, электронная плотность смещена к более электроотрицательному атому кислорода.
На атоме кислорода возникает частичный отрицательный (δ–), а на атоме углерода – частичный положительный (δ+) заряды.
Номенклатура карбонильных соединений
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-АЛЬ».
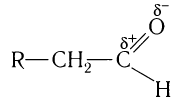
Нумерация ведется от атома углерода карбонильной группы.
Например, 2-метилпропаналь

- К названию кетонов добавляют в название суффикс «-ОН». После этого добавляют номер атомов углерода карбонильной группы.

- Тривиальные названия альдегидов и кетонов приведены в таблице.

Изомерия карбонильных соединений
Изомерия альдегидов
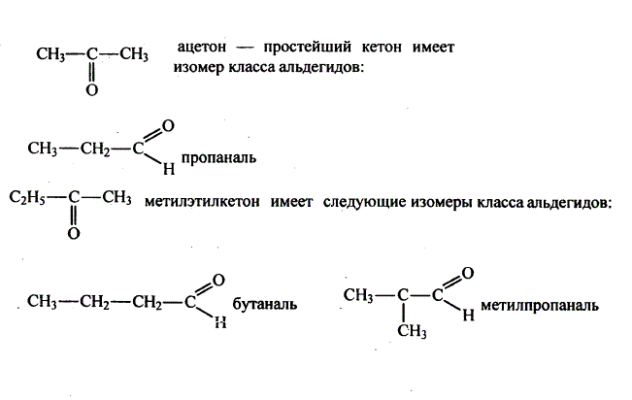
Для альдегидов характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета характерна для альдегидов, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О соответствуют два альдегида-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Альдегиды являются межклассовыми изомерами с кетонами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для альдегидов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Изомерия кетонов
Для кетонов характерна изомерия углеродного скелета, изомерия положения карбонильной группы и межклассовая изомерия.
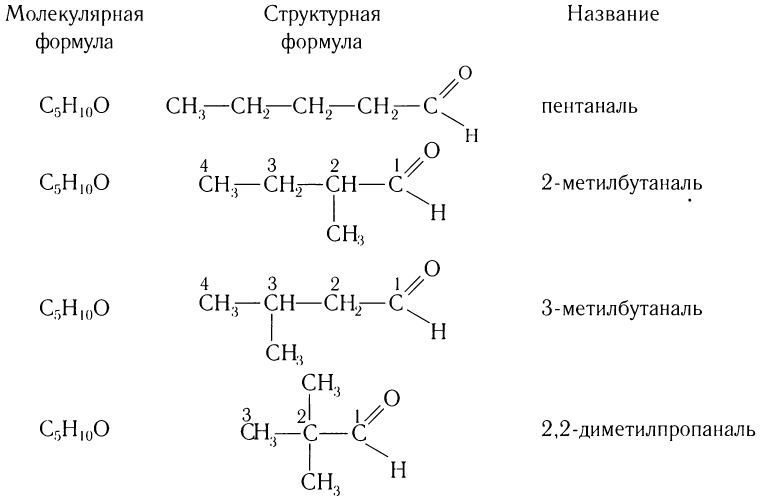
Изомерия углеродного скелета характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют кетоны-изомеры углеродного скелета
Изомерия положения карбонильной группы характерна для кетонов, которые содержат не менее пяти атомов углерода.
Например. Формуле С5Н10О соответствуют два кетона-изомера углеродного скелета
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Кетоны являются межклассовыми изомерами с альдегидами, непредельными спиртами и непредельными простыми эфирами, содержащими одну двойную связь в молекуле. Общая формула этих классов органических соединений — CnH2nО.
Межклассовая изомерия характерна для кетонов, которые содержат не менее трех атомов углерода.
Например. Межклассовые изомеры с общей формулой С3Н6О: пропаналь СН3–CH2–CHO и ацетон CH3–СO–CH3
Физические свойства альдегидов и кетонов
Все альдегиды и кетоны, кроме формальдегида – жидкости. Лёгкие альдегиды хорошо растворимы в воде из-за водородных связей, которые они образуют с водой.
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
1.1. Гидрирование
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:


1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.

1.3. Присоединение спиртов
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.

Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:

1.4. Присоединение циановодородной (синильной) кислоты
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):

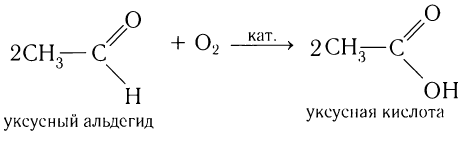
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
вторичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
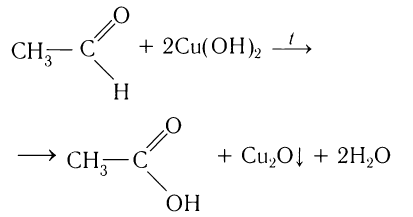
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.

Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + Cu(OH)2 = Cu + HCOOH + H2O
Чаще в этой реакции образуется оксид меди (I):
HCHO + 2Cu(OH)2 = Cu2O + HCOOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).

Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония

Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:

2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота

Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |

2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + 3n/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания метаналя:
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя

Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:

Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:

Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:

Получение карбонильных соединений
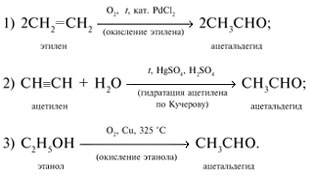
1. Окисление спиртов
При окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны.
1.1. Окисление спиртов оксидом меди (II)
Например, при окислении этанола оксидом меди образуется уксусный альдегид

Например, при окислении изопропанола оксидом меди образуется ацетон

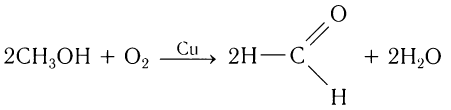
1.2. Окисление спиртов кислородом на меди
При пропускании паров спирта с кислородом над медной сеткой образуются альдегиды и кетоны.
Например, при окислении пропанола-1 кислородом в присутствии меди образуется пропаналь

В промышленности формальдегид получают окислением метанола на серебряном катализаторе при температуре 650оС и атмосферном давлении:
![]()
1.3. Окисление спиртов сильными окислителями
Вторичные спирты при этом окисляются до кетонов. Первичные спирты можно окислить до альдегидов, если предотвратить дальнейшее окисление альдегида (например, отгонять образующийся альдегид в ходе реакции).
2. Дегидрирование спиртов
При пропускании спирта над медной сеткой при нагревании образуются карбонильные соединения.
Например, при дегидрировании этанола образуется этаналь

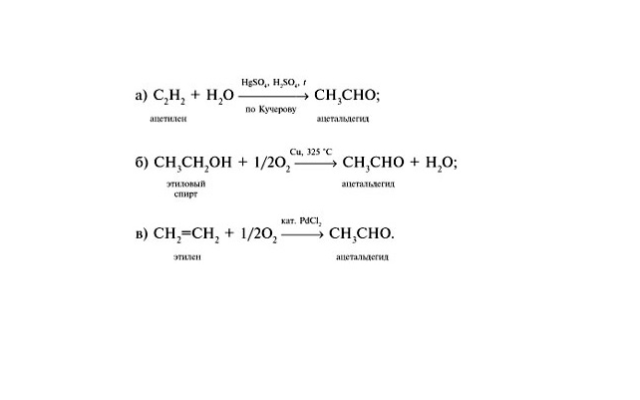
3. Гидратация алкинов
Присоединение воды к алкинам в присутствии солей ртути (II) приводит к образованию карбонильных соединений.
Например, при гидратации ацетилена образуется уксусный альдегид
Например: при гидратации пропина образуется ацетон

4. Гидролиз дигалогенпроизводных алканов
Под действием водного раствора щелочи образуется неустойчивый диол с двумя ОН-группами при одном атоме С, он теряет воду, превращаясь в альдегид или кетон.
Например: при гидролизе 1,1-дихлорэтана образуется этаналь

5. Пиролиз солей карбоновых кислот
При нагревании солей карбоновых кислот и двухвалентных металлов образуются неорганические соли (карбонаты) и кетоны.
Например: при пиролизе ацетата кальция образуется ацетон и карбонат кальция:

6. Кумольный способ получения ацетона
Ацетон в промышленности получают каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

7. Каталитическое окисление алкенов
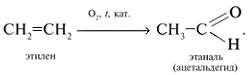
При окислении этилена кислородом в присутствии катализаторов образуется уксусный альдегид.

Общая структурная формула альдегидов
Альдеги́ды (от лат. alcohol dehydrogenatus — спирт, лишённый водорода) — класс органических соединений, содержащих альдегидную группу (-CHO)[1]. ИЮПАК определяет альдегиды как вещества вида R-CHO, в которых карбонильная группа связана с одним атомом водорода и одной группой R[2].
Названия альдегидов[править | править код]
Этимология[править | править код]
Слово альдегид было придумано Юстусом фон Либихом как сокращение латинского alcohol dehydrogenatus — дегидрированный спирт[3] (в некоторых источниках — alcohol dehydrogenatum[1]). Название радикала формил, а также другие однокоренные слова (формальдегид, формиаты), произошли от лат. formica — муравей[4].
Тривиальные названия[править | править код]
В популярной и научной литературе можно нередко встретить исторические, или тривиальные, названия альдегидов, которые вследствие сложившейся традиции используются вместо систематических названий. Тривиальные названия обычно происходят от названия соответствующих карбоновых кислот, а также от названия источника, из которого был выделен тот или иной альдегид. Так, например, формальдегид называют муравьиным альдегидом, этаналь — уксусным, пентаналь — валериановым альдегидом, цитронеллаль получил своё название, поскольку был выделен из масла цитрусовых.
Исторически сложилось, что парфюмеры называют многие пахучие вещества альдегидами, даже те, которые не имеют ничего общего с ними. Среди таковых, например, персиковый, земляничный и кокосовый альдегид, которые являются не альдегидами, а сложными эфирами или лактонами. Также некоторые альдегиды традиционно называются по числу атомов углерода, например, персиковый альдегид, обозначаемый как «альдегид C14», на самом деле имеет лишь 11 атомов углерода[5].
Систематическая номенклатура[править | править код]
По номенклатуре ИЮПАК названия простых альдегидов образуются от названий соответствующих алканов с добавлением суффикса –аль, а диальдегидов — суффикса –диаль (в данном случае атом углерода альдегидной группы уже входит в состав родоначального алкана). При этом в названии номер при альдегидной группе, как правило, не ставят, поскольку она всегда занимает крайнее положение. Если карбонильная группа не входит в родоначальную структуру (например, если родоначальной структурой является циклический углеводород или гетероцикл), то к названию добавляется суффикс –карбальдегид[6][7].
Если в данном соединении альдегидная группа не является старшей, то в таких случаях её обозначают используя приставку формил-, указывая её положение[7].
В устаревших Женевской (1892) и Льежской (1930) номенклатурах, впоследствии заменённых систематической номенклатурой ИЮПАК, альдегиды обозначались при помощи суффикса –ал[8].

Классификация альдегидов[править | править код]
Альдегиды классифицируются следующим образом (в скобках приведены примеры)[9]:
- В зависимости от насыщенности углеводородного заместителя:
- предельные (насыщенные) альдегиды (ацетальдегид);
- непредельные (ненасыщенные) альдегиды (акролеин);
- ароматические альдегиды (бензальдегид).
- По числу карбонильных групп:
- альдегиды с одной карбонильной группой (формальдегид);
- диальдегиды (глиоксаль);
- многоатомные альдегиды.
Нахождение в природе[править | править код]

Структурная формула ретиналя

Альдегидная группа содержится во многих природных веществах, таких, как углеводы (альдозы), некоторые витамины (ретиналь, пиридоксаль). Их следы содержатся в эфирных маслах и часто способствуют их приятному запаху, например, коричный альдегид (в кассиевом масле его может быть до 75 %, а в цейлонском коричном масле даже до 90 %) и ванилин.
Алифатический альдегид СН3(СН2)7С(Н)=О (тривиальное название — пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор[10].
Цитраль содержится в лемонграссовом и кориандровом маслах (до 80 %), цитронеллаль — в цитронелловом (приблизительно 30 %) и эвкалиптовом, бензальдегид — в масле горького миндаля. Куминовый альдегид содержится в масле тмина, гелиотропин — в масле гелитропа и сирени, анисовый альдегид и жасминальдегид в небольших количествах содержатся во многих эфирных маслах[1][5].
Методы синтеза альдегидов[править | править код]
Лабораторные методы получения альдегидов[править | править код]
Окислительные методы[править | править код]
- Для получения альдегидов в лабораторных условиях часто используется реакция окисления первичных спиртов реагентами, представляющими собой комплексные соединения оксида хрома(VI) с третичными аминами, в частности, лучшими реагентами являются комплекс с пиридином (CrO3 · 2C5H5N, реагент Саррета — Коллинза) и хлорхромат пиридиния (C5H5NH+CrO3Cl–, реагент Кори, PCC). Данные реагенты позволяют получать альдегиды с высоким выходом, а хлорхромат пиридиния также не затрагивает двойную связь. Для этих же целей применяют и другие селективные окислители, например оксид марганца(IV) MnO2, карбонат серебра на цеолите, а также диметилсульфоксид в присутствии основания (окисление по Сверну[en])[11].
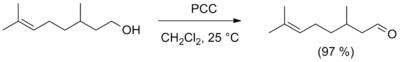

- Реакция окисления периодинаном Десса-Мартина. Первичные спирты при этом селективно окисляются до альдегидов.[12]
- Как метод получения альдегидов может использоваться восстановительный озонолиз симметричных дизамещённых алкенов либо циклических алкенов (в данном случае реакция приводит к образованию диальдегида). Аналогичное превращение может быть проведено под действием смеси OsO4 и NaIO4[13].

- Также к данному типу реакций относится окисление вицинальных диолов йодной кислотой или тетраацетатом свинца[14].
- Важным методом также является гидроборирование — окисление алкинов, в ходе которого к алкину против правила Марковникова присоединяется диалкилборан (например, дисиамилборан), а полученный продукт окисляется щелочным раствором пероксида водорода, что приводит к образованию альдегида[15].

Восстановительные методы[править | править код]
Ряд производных карбоновых кислот (хлорангидриды, сложные эфиры, нитрилы, амиды) могут быть восстановлены до альдегидов под действием специфических восстановителей[16].
- Так, например, в реакции Розенмунда хлорангидриды восстанавливают под действием водорода на палладиевом катализаторе. Аналогичное превращение можно провести под действием три(трет-бутокси)алюмогидрида лития[17].

- Сложные эфиры селективно восстанавливаются до альдегидов под действием диизобутилалюминийгидрида[18].
Синтез ароматических альдегидов[править | править код]
Ароматические альдегиды могут быть синтезированы принципиально отличными методами, основанными на реакциях ароматического электрофильного замещения.
- Альдегидную группу можно ввести в ароматические соединения реакциями Гаттермана, Гаттермана — Коха, Вильсмейера — Хаака, Рихе и Раймера — Тимана. Исторически первая реакция Гаттермана — Коха (1897) применима к бензолу и его алкилзамещённым производным, которые вступают в реакцию с оксидом углерода(II) CO и хлороводородом HCl в присутствии AlCl3 и CuCl, давая соответствующие бензальдегиды (альдегидная группа вводится в пара-положение). Улучшенный метод (реакция Гаттермана) состоит в использовании цианида цинка Zn(CN)2 и соляной кислоты и позволяет формилировать фенолы и гетероароматические соединения. Для формилирования фенолов также используется реакция Раймера — Тимана. Введение альдегидной группы в ароматические ядра, активированные гидроксильной, алкоксильной или диалкиламинной группой, осуществляется по реакции Вильсмейера — Хаака с использованием диметилформамида и хлорокиси фосфора (или аналогичных реагентов)[19].


- Также ароматические альдегиды могут быть получены окислением метилзамещённых бензолов под действием ряда окислителей, в том числе оксида хрома(VI) CrO3, оксида марганца(IV) MnO2 и нитрата церия — аммония[en][20].
- Реакция Соммле позволяет окислять бензилгалогениды ArCH2X под действием уротропина с последующим гидролизом образующейся соли до альдегида. Данная реакция применима для синтеза разнообразных ароматических и гетероциклических альдегидов. Подобное превращение можно осуществить, также окисляя бензилгалогениды солями 2-нитропропана[20].

- Ароматические альдегиды можно получать из производных ароматических карбоновых кислот общими методами, однако существуют и специфические реакции. Например, реакция Стефена позволяет восстанавливать ароматические нитрилы хлоридом олова(II) SnCl2 с последующим гидролизом, что приводит к ароматическому альдегиду[20].
Другие методы[править | править код]
Альдегиды также можно получать реакциями гидратации алкинов (реакция Кучерова), пиролизом карбоновых кислот и их смесей в виде паров над оксидами некоторых металлов (ThO2, MnO2, CaO, ZnO) при 400—500 °C, гидролизом геминальных дигалогенопроизводных (если атомы галогена находятся у одного из крайних атомов углерода) и другими реакциями[9].
Промышленные методы получения альдегидов[править | править код]
Известно много методов синтеза альдегидов, однако их использование в промышленности зависит во многом от доступности исходного сырья. Основными промышленными методами получения насыщенных алифатических альдегидов являются[21]:
- гидроформилирование алкенов (оксосинтез);
- дегидрирование или окисление первичных спиртов;
- гидратация ацетилена;
- окисление этилена;
- окисление насыщенных углеводородов (С3, С4).
Также большое значение имеют некоторые специфические синтезы альдегидов, широко применяемых в парфюмерной промышленности[21].
Оксосинтез является наиболее важным процессом для получения альдегидов с тремя атомами углерода и выше. В этой реакции алкены реагируют с синтез-газом (CO + H2) с образованием альдегида, содержащего на один атом углерода больше, чем исходный алкен. При использовании несимметричных алкенов образуется смесь продуктов, соотношение которых можно варьировать путём подбора катализатора[21].

Среди процессов отщепления водорода от первичных спиртов различают дегидрирование, окисление и окислительное дегидрирование. Дегидрирование спиртов проводят при атмосферном давлении и температуре 250—400 °С в присутствии медного или серебряного катализатора. В ходе процесса выделяется водород, который можно использовать без очистки в других процессах. Дегидрирование имеет коммерческое значение в получении уксусного альдегида из этанола: реакцию проводят при 270—300 °С на медном катализаторе, активированном церием, при этом за цикл превращается 25—50 % этанола с селективностью 90—95 %. Побочными продуктами являются этилацетат, этилен, кротоновый альдегид и высшие спирты. Окисление спиртов проводится в избытке воздуха или кислорода при 350—450 °С на катализаторе, содержащем оксиды железа и молибдена. Процесс используется в производстве формальдегида. Данные процессы также применяются в синтезе душистых альдегидов[21].
Окисление алкенов является основным промышленным методом получения ацетальдегида и акролеина. В первом случае окислению подвергается этилен в присутствии хлоридов палладия и меди Вакер-процесс [21][9].
Процесс получения ацетальдегида, основанный на гидратации ацетилена, в последнее время потерял былое значение. Последние фабрики в Западной Европе, синтезирующие ацетальдегид по данной схеме, были закрыты в 1980 году. Причиной этому послужила бо́льшая доступность этилена в качестве сырья, а также токсичность катализатора — сульфата ртути[21].
Ежегодное мировое производство формальдегида (по данным на 1996 год) составило 8,7·106 т[22], ацетальдегида (на 2003 год) — 1,3·106 т[23].
Основным методом получения бензальдегида является гидролиз бензальхлорида в кислой или щелочной средах. В качестве гидролизующих агентов могут применяться гидроксид кальция, карбонат кальция, гидрокарбонат натрия, карбонат натрия, а также различные кислоты с добавлением солей металлов. Исходное сырьё, в свою очередь, получают при хлорировании толуола в боковую цепь. Менее распространённый процесс основан на частичном окислении толуола[24].
Физические свойства альдегидов[править | править код]
Формальдегид представляет собой газообразное при комнатной температуре вещество. Альдегиды до С12 — жидкости, а альдегиды нормального строения с более длинным неразветвлённым углеродным скелетом являются твёрдыми веществами.
Температуры кипения альдегидов с неразветвлённым строением углеродной цепи выше, чем у их изомеров. Например, валериановый альдегид кипит при 100,4 °C, а изовалериановый — при 92,5 °C. Они кипят при более низких температурах, чем спирты с тем же числом углеродных атомов, например, пропионовый альдегид кипит при 48,8 °C, а пропанол-1 при 97,8 °C. Это показывает, что альдегиды, в отличие от спиртов, не являются сильно ассоциированными жидкостями[9]. Данное свойство используется в синтезе альдегидов путём восстановления спиртов: поскольку температура кипения альдегидов в целом ниже, они могут быть легко отделены и очищены от спирта перегонкой[25]. В то же время их температуры кипения намного выше, чем у углеводородов с той же молекулярной массой, что связано с их высокой полярностью[9].
Вязкость, плотность и показатель преломления при 20 °C увеличиваются с увеличением молярной массы альдегидов. Низшие альдегиды являются подвижными жидкостями, а альдегиды от гептаналя до ундеканаля имеют маслообразную консистенцию[25].
Формальдегид и ацетальдегид практически неограниченно смешиваются с водой, однако, с ростом длины углеродного скелета, растворимость альдегидов в воде сильно уменьшается, например, растворимость гексаналя при 20 °С составляет лишь 0,6 % по массе. Алифатические альдегиды растворимы в спиртах, простых эфирах и других распространённых органических растворителях[25].
Низшие альдегиды имеют резкий запах, а высшие гомологи (С8-С13) являются компонентами многих парфюмерных изделий[25].
| Название | Формула | Температура плавления, °C | Температура кипения, °C | Плотность, г/см³ (при 20 °C) |
|---|---|---|---|---|
| Формальдегид | HCHO | −93 | −21 | 0,82 (при –20 °С) |
| Ацетальдегид | CH3CHO | −123 | 21 | 0,778 |
| Пропаналь | CH3CH2CHO | −81 | 49 | 0,797 |
| Бутаналь | CH3CH2CH2CHO | −99 | 76 | 0,803 |
| Акролеин | CH2=CH–CHO | −88 | 53 | 0,841 |
| Кротоновый альдегид | CH3-CH=CH–CHO | −74 | 104 | 0,852 |
| Бензальдегид | C6H5CHO | −56 | 179 | 1,05 |
| Салициловый альдегид | о-HO–C6H4CHO | 2 | 197 | 1,16 |
| Ванилин |
|
82 | 285 | — |
Строение[править | править код]
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации. Углы R-C-H, R-C-O и H-C-O составляют приблизительно 120° (где R — алкил).
Двойная связь карбонильной группы сходна по физической природе с двойной связью между углеродными атомами, однако в то же время энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых связей (2×358 кДж/моль) C-O. С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы составляет ~9⋅10−30 Кл·м[9]. Длина связи С=О составляет 0,122 нм[14].
Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие резонансные структуры:

Подобное разделение зарядов подтверждается физическими методами исследования и во многом определяет реакционную способность альдегидов как выраженных электрофилов и позволяет им вступать в многочисленные реакции нуклеофильного присоединения[28].
Химические свойства[править | править код]
Высокая реакционная способность связана с наличием полярной связи С=О. Альдегиды являются жёсткими основаниями Льюиса и, в соответствии с этим, атом кислорода в них может координироваться с жёсткими кислотами: H+, ZnCl2, BF3, AlCl3 и т. д.[14] В общем случае химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе.
Реакции присоединения к карбонильной группе[править | править код]
Альдегиды содержат поляризованную карбонильную группу и склонны присоединять нуклеофильные реагенты, как нейтральные (аммиак, амины, воду, спирты, тиолы и др.), так и анионные (цианид-ион CN–, алкоголяты, гидрид-ион H–, карбанионы и др.). За исключением реакций восстановления гидридами типа алюмогидрида лития LiAlH4, а также взаимодействия с реактивами Гриньяра, данные процессы являются обратимыми. Необходимо также различать два типа обратимых реакций присоединения: первый тип приводит к образованию тетраэдрического продукта присоединения, а второй тип включает в себя также последующую реакцию дегидратации, в результате которой происходит образование двойной связи между электрофильным атомом углерода и нуклеофилом. Реакции второго типа характерны, в основном, для азотсодержащих нуклеофилов[29].
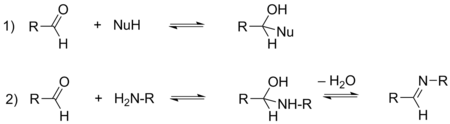
В данных реакциях альдегиды являются более реакционноспособными по сравнению с кетонами. Это связано с большей термодинамической устойчивостью кетонов, а также меньшими пространственными затруднениями в случае присоединения к альдегидам[29].
Простейшей модельной реакцией данного типа является реакция гидратации альдегидов, протекающая в их водных растворах. Согласно правилу Эльтекова — Эрленмейера, образующиеся при этом 1,1-диолы неустойчивы и с отщеплением молекулы воды превращаются обратно в исходные карбонильные соединения. Гидратация наблюдается в существенной степени лишь для низших альдегидов. Так, формальдегид гидратирован на 99,999 %, ацетальдегид — на 58 %. Когда положительный заряд на атоме углерода увеличивается в достаточной степени за счёт связанных с ним радикалов, 1,1-диолы становятся устойчивыми и могут быть выделены (например, хлораль легко присоединяет воду с образованием устойчивого аддукта — хлоральгидрата). Реакция гидратации катализируется как кислотами, так и основаниями[14][30].

Подобным образом протекает и реакция присоединения спиртов по карбонильной группе, имеющая важное значение в органическом синтезе для защиты карбонильной группы. Первичный продукт присоединения называется полуацеталем, далее под действием кислоты он превращается в ацеталь. При стоянии альдегиды также образуют циклические или полимерные ацетали (например, триоксан или параформ для формальдегида и паральдегид для ацетальдегида). При нагревании этих соединений со следовыми количествами кислот происходит деполимеризация и регенерация исходных альдегидов[31].

Аналогичные превращения происходят также с участием серосодержащих аналогов спиртов — тиолов; они приводят, соответственно, к тиоацеталям, также играющим важную роль в тонком органическом синтезе[31].
Альдегиды могут присоединять циановодород HCN с образованием циангидринов, применяемых в органическом синтезе для получения α,β-ненасыщенных соединений, α-гидроксикислот, α-аминокислот. Данная реакция также является обратимой и катализируется основаниями. В лабораторных условиях циановодород (т. кип. 26 °C) обычно получают действием эквивалентного количества минеральной кислоты на цианид натрия или калия[32].
![]()
Относительно небольшие пространственные затруднения при присоединении нуклеофилов к альдегидам позволяют превращать их в бисульфитные производные под действием большого избытка гидросульфита натрия NaHSO3. Данные соединения представляют собой кристаллические вещества и часто используются для выделения, очистки или хранения соответствующих альдегидов, поскольку последние могут быть легко из них регенерированы под действием кислоты или основания[32].

Реакция альдегидов с магний- и литийорганическими соединениями приводит к образованию вторичных спиртов (в случае формальдегида — первичных). Процесс может осложняться побочными реакциями енолизации и восстановления карбонильного соединения, которые приводят к снижению выхода. При использовании литийорганических соединений эти помехи удаётся устранить[33].


При реакции альдегидов с первичными и вторичными аминами происходит образование иминов и енаминов соответственно. В основе обеих реакций лежит присоединение нуклеофильных реагентов по карбонильной группе с последующим отщеплением воды от полученного тетраэдрического интермедиата. Реакция образования иминов требует кислотного катализа и наиболее эффективно протекает в области pH от 3 до 5. Для получения енаминов с удовлетворительным выходом необходимо применять азеотропную отгонку воды, что позволяет сместить равновесие в сторону образования продукта. Обычно в качестве вторичных аминов используют циклические амины (пирролидин, пиперидин или морфолин)[34].
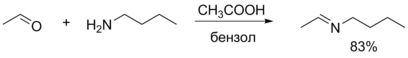
Аналогичным образом альдегиды реагируют с гидроксиламином, гидразином, 2,4-динитрофенилгидразином, семикарбазидом и другими подобными соединениями. Большинство получаемых при этом соединений являются кристаллическими и могут быть использованы для идентификации альдегидов по температуре плавления и другим характеристикам. Также эти соединения находят применение в органическом синтезе, например, гидразоны могут быть восстановлены по реакции Кижнера — Вольфа[34].
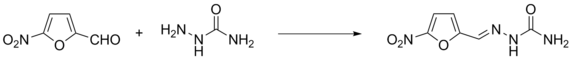
Реакции сопряжённого присоединения[править | править код]
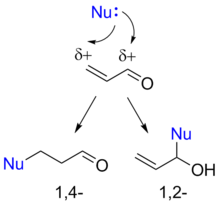
Присоединение к α,β-ненасыщенным альдегидам может протекать с образованием 1,2- и 1,4-продуктов
Присоединение нуклеофильных реагентов к α,β-ненасыщенным альдегидам может протекать как по карбонильной группе, так и по «четвёртому» положению сопряжённой системы. Причина этого заключается в том, что двойная углерод-углеродная связь поляризуется под действием полярной карбонильной группы (мезомерный эффект), и дальний от карбонильной группы атом углерода двойной связи приобретает частичный положительный заряд. Реакция нуклеофила с данным атомом углерода называется сопряжённым присоединением, или 1,4-присоединением. Присоединение к карбонильной группе по аналогии называют 1,2-присоединением. Формальным результатом 1,4-присоединения является присоединение нуклеофила по углерод-углеродной двойной связи. Во многих случаях 1,2- и 1,4-присоединение являются конкурирующими реакциями, однако иногда удаётся проводить селективные реакции с получением продуктов 1,2- либо 1,4-присоединения[35].
Присоединение первичных и вторичных аминов к α,β-ненасыщенным альдегидам протекает в мягких условиях и приводит к образованию 1,4-продукта. Напротив, в случае циановодорода наблюдается конкурентное образование обоих продуктов с преобладанием продукта 1,2-присоединения. Чтобы в данной реакции исключить возможность 1,2-присоединения, используют специальный реагент — диэтилалюминийцианид (C2H5)2AlCN[36].
Литийорганические соединения присоединяются исключительно по карбонильной группе, давая аллиловые спирты. Сопряжённое присоединение проводят под действием медьорганических реагентов — диалкилкупратов, которые позволяют ввести в карбонильное соединение не только первичную, но также вторичную или третичную алкильную, алкенильную или арильную группу. Магнийорганические реагенты (реактивы Гриньяра), полученные из магния сверхвысокой чистоты, также присоединяются с образованием 1,2-продуктов, в то время как обыкновенные реактивы Гриньяра, предположительно из-за примесей других металлов (например, меди и железа) вступают и в 1,2-, и в 1,4-присоединение, что регулируется пространственными факторами. В настоящее время магнийорганические реагенты утратили своё значение в данной области[37].
Борорганические соединения (триалкилбораны) реагируют с непредельными альдегидами, давая продукты 1,4-присоединения[38]
Реакции α-метиленового звена[править | править код]
Альдегиды вступают в реакцию с галогенами (хлором, бромом или иодом), образуя галогенпроизводные, при этом галогенирование осуществляется исключительно в α-положение (в положение, соседнее с карбонильной группой)[39].
Альдегиды проявляют свойства слабых кислот: под действием оснований они способны отщеплять протон от α-метиленовой группы, превращаясь в енолят-ион. Обычно для достаточно полного депротонирования используют сильные основания (гидрид натрия, гидрид калия, диизопропиламид лития и др.) в апротонных растворителях (тетрагидрофуран, ДМСО). Превращение карбонильной формы альдегидов в енольную форму протекает и в отсутствие сильных оснований. Образующиеся при этом енолы, как правило, намного менее стабильны, чем карбонильная форма, например, для ацетальдегида константа равновесия — только 6⋅10−5 при комнатной температуре[40]). Данное равновесие, существующее между карбонильной и енольной формами называется кето-енольной таутомерией[41].

Благодаря способности образовывать енолят-ионы альдегиды вступают в ряд химических реакций, где эти частицы выступают как нуклеофилы. В частности, для них характерны реакции конденсации. В слабоосновной среде (в присутствии ацетата, карбоната или сульфита калия) подвергаются альдольной конденсации, в ходе которой часть молекул альдегида выступает как карбонильная компонента (реагирует карбонильной группой), а часть молекул альдегида под действием основания превращается в енолят-ионы и выступает как метиленовая компонента (вступает в реакцию α-метиленовым звеном). Образующийся альдоль при нагревании отщепляет воду с образованием α,β-непредельного альдегида (переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией или альдольно-кротоновой конденсацией)[9][42].
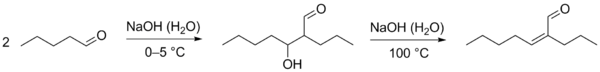
При реакции между двумя разными альдегидами образуется смесь четырёх различных альдолей. Исключение составляют случаи, когда разделение реагентов на карбонильную и метиленовую компоненту очевидно (например, один из альдегидов не содержит α-метиленового звена и может выполнять роль только карбонильной компоненты). Разработаны также методы повышения селективности подобных реакций. Перекрёстная конденсация ароматических альдегидов с кетонами, получила название реакции Кляйзена — Шмидта[42]. Известны также схожие реакции альдегидов: реакция Кнёвенагеля, реакция Тищенко, реакция Перкина, бензоиновая конденсация и другие[1].
Реакции окисления[править | править код]
Окисление альдегидов до соответствующих карбоновых кислот кислородом протекает по радикально-цепному механизму (автоокисление) с образованием промежуточных продуктов — пероксокислот.
Альдегиды легко окисляются до соответствующих карбоновых кислот под действием разнообразных окислителей. Наиболее часто используются перманганат калия, а также реагент Джонса (CrO3 + H2SO4), который даёт наилучшие результаты (в течение короткого времени при низкой температуре достигается более чем 80%-ый выход карбоновой кислоты). Реагент Джонса также не лишён недостатков, в частности, он недостаточно селективен и окисляет другие функциональные группы, а кислая среда способствует нежелательной изомеризации или разложению субстрата[43].

Избежать этих проблем можно при использовании более мягкого окислителя — реактива Толленса (аммиачного раствора оксида серебра), который не затрагивает кратные связи и гидроксильные группы спиртов. Эта реакция широко применяется для обнаружения альдегидов (реакция «серебряного зеркала»)[43].

Окисление метиленовых групп в α-положении альдегидов диоксидом селена приводит к образованию 1,2-дикарбонильных соединений[14][43].
Альдегиды медленно окисляются на воздухе при комнатной температуре. Этот радикальный процесс ускоряется при облучении или в присутствии ионов Fe2+. Ароматические альдегиды подвергаются окислению легче, чем алифатические. Данная реакция не имеет синтетического значения, однако её протекание необходимо учитывать при хранении альдегидов: желательно хранить их в темноте и инертной атмосфере[44].
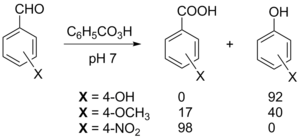
Ароматические альдегиды также окисляются до карбоновых кислот или сложных эфиров фенолов (реакция Байера — Виллигера) под действием надкислот, причём соотношение продуктов зависит как от заместителей в ароматическом ядре, так и от кислотности среды[44].
Реакции восстановления[править | править код]
Альдегиды можно восстанавливать до первичных спиртов. Наиболее распространённые методы восстановления включают реакции с комплексными гидридами: боргидридом натрия NaBH4, боргидридом лития LiBH4 и алюмогидридом лития LiAlH4. Чуть реже применяется боргидрид цинка B2H8Zn.
Боргидрид натрия является более избирательным реагентом и позволяет восстанавливать карбонильную группу альдегидов и кетонов, не затрагивая сложноэфирные, нитрильные, амидные, лактонные и оксирановые группы. Он также не восстанавливает изолированную двойную углерод-углеродную связь. Алюмогидрид лития менее селективен и восстанавливает перечисленные выше функциональные группы, поэтому восстановление альдегидов с его применением возможно только в отсутствие этих групп[45].

Историческую роль играет реакция Меервейна — Пондорфа — Верлея[en], в которой в качестве восстановителя используется изопропилат алюминия. В настоящее время этот метод вытеснен более эффективной реакцией восстановления альдегидов и кетонов изопропиловым спиртом в присутствии окиси алюминия[45].
Алифатические альдегиды обычно не гидрируют на палладиевых катализаторах, но для этих целей можно использовать рутений на угле, никель Ренея или платину[45].
Альдегиды как основания Льюиса[править | править код]
В соответствии с наличием неподелённых электронных пар атома кислорода карбонильной группы альдегиды являются жёсткими основаниями Льюиса и, в соответствии с этим, атом кислорода в них может координироваться с жёсткими кислотами: H+, ZnCl2, BF3, AlCl3 и т. д.[14]. В кислой среде альдегиды протонируются с образованием оксониевого катиона. Альдегиды являются очень слабыми основаниями, намного более слабыми, чем вода и спирты, но тем не менее эти свойства играют исключительно важную роль в химических реакциях[46].
Другие реакции[править | править код]
Альдегиды, не имеющие атомов водорода при α-углеродном атоме (то есть имеющие общую формулу R3CCHO) под действием водно-спиртового раствора щёлочи вступают в реакцию Канниццаро, в которой одновременно выступают в роли окислителя и восстановителя. Сфера применения данного процесса расширяется за счёт перекрёстной реакции Канниццаро, протекающей между ароматическим альдегидом и формальдегидом в присутствии щёлочи. При этом восстановителем является формальдегид, а другой альдегид восстанавливается до соответствующего спирта[47].

Альдегиды могут вступать в реакции с илидами фосфора по реакции Виттига, образовывая алкены с заданной конфигурацией двойной связи (как правило, образуются Z-алкены, но разработаны и модификации, позволяющие получать E-алкены). В данное время это один из лучших методов региоспецифического синтеза алкенов[48].
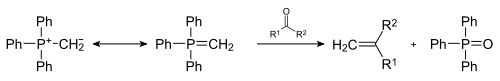
Также альдегиды взаимодействуют с илидами серы, давая оксираны (реакция Кори — Чайковского[en])[49].
Альдегиды подвергаются реакции декарбонилирования в присутствии некоторых комплексов переходных металлов, например, катализатора Уилкинсона[50].
Химические методы идентификации альдегидов[править | править код]
Качественный анализ карбонильных групп[править | править код]
- Тест Бреди — 2,4-динитрофенилгидразин с альдегидами даёт жёлтый, оранжевый (если альдегид алифатический) или красный (если альдегид ароматический) осадок:
- RCHO + C6H3(NO2)2NHNH2 → C6H3(NO2)2NHNCHR + H2O
- Реакция «серебряного зеркала» и реакция с фелинговой жидкостью предназначена для распознавания альдегидов и кетонов — альдегиды окисляются до карбоновых кислот, кетоны с этими реагентами не реагируют.
- Реакция с гидроксидом меди (II), происходящая при нагревании, при этом альдегиды окисляются до карбоновых кислот, а гидроксид меди (II) восстанавливается до оксида меди (I)[51][52]:
- RCHO + 2Cu(OH)2 → RCOOH + Cu2O + 2H2O
- Реактив Шиффа (фуксинсернистая кислота) реагирует с альдегидами с образованием яркоокрашенного фиолетового продукта[53]:
Количественный анализ альдегидов[править | править код]
- При действии хлорида гидроксиламиния образуется соответствующий альдоксим и выделяется эквивалентное количество хлоридной кислоты. Выделившуюся после реакции кислоту титруют щелочью; индикатор — раствор бромфенолового синего (окраска раствора изменяется от желто-зеленой до фиолетово-синей)[54]:
- В аналитической практике используется окисление альдегидов и кетонов йодом в щелочной среде. Йод добавляют в избытке, а затем избыток его оттитровывают тиосульфатом натрия[54]:
Спектральные методы анализа альдегидов[править | править код]
ИК-спектроскопические методы анализа альдегидов[править | править код]
Альдегиды легко идентифицировать по ИК-спектру — он содержит специфические полосы поглощения, относящиеся к валентным колебаниям связи C-H в альдегидной группе: два острых пика, расположенные далеко за пределами области поглощения, характерной для связей C-H обычного типа. Кроме того, в ИК-спектрах альдегидов обычно присутствуют полосы поглощения, обусловленные валентными колебаниями связей С=O и C-H: νС=O=1725-1685 см−1, νС-H=2850; 2750 см−1[14].
Масс-спектрометрические методы анализа альдегидов[править | править код]
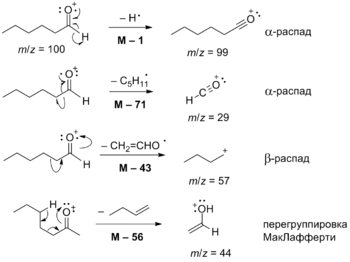
Масс-спектры альдегидов имеют довольно выраженный молекулярный ион, хотя его содержание может быть довольно низким. Потеря алкильных радикалов приводит к образованию ацил-катионов. Для них особенно характерны α- и β-расщепление и перегруппировка Мак-Лафферти[55]. Для альдегидов с подвижным γ-атомом H и не содержащих заместителя у α-углерода характерен пик m/z=44, а для содержащих заместитель появляется интенсивный пик замещённого иона с m/z=44+12n[1][56].
ЯМР-спектроскопические методы анализа альдегидов[править | править код]
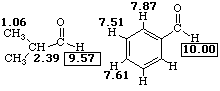
В 1Н ЯМР-спектре альдегида наиболее характеристичным является сигнал формильного протона, обычно расположенный в наиболее слабом поле в области δ 9,4—10,1 м д. (9,4-9,7 -алифатические, 9,6-10,1 -ароматические)[1]. Сигнал альдегидной группы в 13C ЯМР-спектре расположен в области 182—215 м д.[57].
УФ-спектроскопические методы анализа альдегидов[править | править код]
Два максимума поглощения от р до р* (<200 нм) и от n до р* (> 200 нм)[57].
Электронно-спектроскопические методы анализа альдегидов[править | править код]
Электронные спектры содержат полосы с λмакс 290 нм для RCHO (R=CH3, C2H5, C3H7), 345 нм для акролеина и 327 для кротонового альдегида[1].
Биологическое действие[править | править код]
Токсичны. Способны накапливаться в организме. Кроме общетоксического, обладают раздражающим и нейротоксическим действием. Эффект зависит от молекулярной массы: чем она больше, тем слабее раздражающее, но сильнее наркотическое действие, причём ненасыщенные альдегиды токсичнее насыщенных. Некоторые обладают канцерогенными свойствами[58].
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
Ацетальдегид СН3СНО вызывает возбуждение, сменяющееся наркозом. Он является промежуточным продуктом метаболизма этилового спирта в организме. Действие тримера этого альдегида — паральдегида (С2Н4O)3 — сильнее и продолжительнее, в то время как тетрамер — метальдегид (С2Н4O)4 — является более токсичным. Удлинение алкильного радикала в молекуле альдегида приводит к усилению физиологической активности, но вместе с этим возрастает и токсичность[59].
Введение галогена в молекулу альдегида повышает его наркотическое (снотворное) действие. Так, наркотические свойства хлораля более выражены, чем у ацетальдегида. Альдегидная группа усиливает токсичность вещества, но она может быть значительно снижена путём образования гидратной формы альдегида. Гидратные формы мало токсичны, в такой форме хлораль применяется в медицине под названием хлоралгидрата, проявляющего снотворное действие. Введение гидроксильных групп в молекулу альдегида или конденсация их с образованием альдолей существенно снижает реакционную способность, а также физиологическую активность соединений. Так, сахара представляют собой фармакологически инертные вещества. Большинство ароматических альдегидов имеет низкую токсичность, так как они легко окисляются до соответствующих кислот, которые обычно довольно инертны[59].
Лекарственные препараты, содержащие в молекуле альдегидную группу, и их основное действие на организм
| Название | Действие на организм |
|---|---|
| Формальдегид (формалин) | Антисептическое |
| Хлоральгидрат | Снотворное, противосудорожное |
| Цитраль | Снижает артериальное давление |
| Циминаль | Противомикробное |
Применение[править | править код]

Важнейшие альдегиды и родственные соединения. Альдегидная (формильная группа) обозначена красным. Слева направо: (1) формальдегид, (2) его тример, (3) ацетальдегид и (4) его енол виниловый спирт, (5) глюкоза, (6) ароматизатор коричный альдегид, (7) пигмент ретиналь и (8) витамин пиридоксаль
Из всех альдегидов больше всего производится формальдегида (около 6 млн тонн/год). Он, в основном, используется в производстве смол — бакелита, галалита (в сочетании с мочевиной, меламином и фенолом), для дубления кож, протравливания зерна. Также из него синтезируют лекарственные средства (уротропин) используют как консервант биологических препаратов (благодаря способности свертывать белок). Он является предшественником метилендифенилдиизоцианата, использующегося в производстве полиуретанов и гексогена (довольно сильной взрывчатки).
Второй по масштабам производства альдегид — масляный альдегид (получают около 2,5 млн тонн/год методом гидроформилирования). Некоторые альдегиды синтезируют только в небольших масштабах (менее 1000 тонн / год) и используют в качестве ингредиентов в парфюмерии и ароматов (в основном альдегиды с числом атомов углерода от 8 до 12)[1]. Например, это коричный альдегид и его производные — цитраль и лилиаль[60].
Ацетальдегид используется для синтеза уксусной кислоты, этилового спирта, бутадиена для получения производных пиридина, пентаэритрита и кротонового альдегида, а также при синтезе поливинилацетата и пластмасс.
Альдегиды применяют для синтеза спиртов (бутиловых, 2-этилгексанола, пентаэритрита), карбоновых кислот, полимеров, антиоксидантов, пиридиновых оснований[1].
Примечания[править | править код]
- ↑ 1 2 3 4 5 6 7 8 9 Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — С. 196-198. — 623 с. — 100 000 экз.
- ↑ IUPAC Gold Book — aldehydes. Дата обращения: 7 июля 2013. Архивировано 9 июля 2013 года.
- ↑ Liebig J. Sur les Produits de l’Oxidation de l’Alcool (фр.) // Annales de chimie et de physique. — 1835. — Vol. 59. — P. 290.
- ↑ Senning A. Elsevier’s Dictionary of Chemoetymology. — Elsevier, 2007. — P. 151. — ISBN 978-0-444-52239-9.
- ↑ 1 2 Леенсон И. А. Откуда твоё имя? Статья шестая. Органические соединения. Дата обращения: 25 июня 2013. Архивировано 29 июня 2013 года.
- ↑ IUPAC Nomenclature of Organic Chemistry (англ.). ACD/Labs. Дата обращения: 24 августа 2009. Архивировано 21 августа 2011 года.
- ↑ 1 2 Кан Р., Дермер О. Введение в химическую номенклатуру = Introduction to Chemical Nomenclature / Пер. с англ. Н. Н. Щербиновской, под ред. В. М. Потапова, Р. А. Лидина. — М.: Химия, 1983. — С. 139—140.
- ↑ Справочник химика / Редколлегия: Никольский Б. П. и др.. — 2-е издание. — Ленинград, Москва: Химия, 1964. — Т. 2. — С. 270, 285, 295.
- ↑ 1 2 3 4 5 6 7 Петров А. А., Бальян Х. В., Трощенко А. Т. Органическая химия. — Иван Федоров, 1981. — Т. 1. — С. 165-184. — 672 с. — ISBN 5-81940-067-4.
- ↑ Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. М., ,. Начала органической химии. — Химия, 1974.
- ↑ Реутов, 2004, т. 2, с. 265—273.
- ↑ Десс-Мартина Реагент (Dess Martin Periodinane). www.khimia.ru. Дата обращения: 21 июля 2016. Архивировано 22 августа 2016 года.
- ↑ Реутов, 2004, т. 3, с. 12—13.
- ↑ 1 2 3 4 5 6 7 Шабаров Ю.С. Органическая химия. — Лань, 2011. — С. 218-221. — 848 с.
- ↑ Реутов, 2004, т. 1, с. 480—483.
- ↑ Реутов, 2004, т. 3, с. 13—14.
- ↑ Реутов, 2004, т. 3, с. 203—205.
- ↑ Реутов, 2004, т. 3, с. 235.
- ↑ Марч Дж. Органическая химия. — М.: Мир, 1987. — Т. Т. 2. — С. 359—363.
- ↑ 1 2 3 Реутов, 2004, т. 3, с. 16—20.
- ↑ 1 2 3 4 5 6 Kohlpaintner и др., 2013, p. 6—8.
- ↑ Reuss G., Disteldorf W., Gamer A. O., Hilt A. Formaldehyde // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a11_619.
- ↑ Eckert M., Fleischmann G., Jira R., Bolt H. M., Golka K. Acetaldehyde // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2006. — doi:10.1002/14356007.a01_031.pub2.
- ↑ Brühne F., Wright E. Benzaldehyde // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2011. — doi:10.1002/14356007.a03_463.pub2.
- ↑ 1 2 3 4 Kohlpaintner и др., 2013, p. 2—3.
- ↑ Реутов, 2004, т. 3, с. 10—11.
- ↑ Kohlpaintner и др., 2013, p. 3, 13.
- ↑ Реутов, 2004, т. 3, с. 23.
- ↑ 1 2 Реутов, 2004, т. 3, с. 23—26.
- ↑ Реутов, 2004, т. 3, с. 27—28.
- ↑ 1 2 Реутов, 2004, т. 3, с. 29—37.
- ↑ 1 2 Реутов, 2004, т. 3, с. 38—39.
- ↑ Реутов, 2004, т. 3, с. 40—42.
- ↑ 1 2 Реутов, 2004, т. 3, с. 44—49.
- ↑ Реутов, 2004, т. 3, с. 59—60.
- ↑ Реутов, 2004, т. 3, с. 60—62.
- ↑ Реутов, 2004, т. 3, с. 62—64.
- ↑ Реутов, 2004, т. 3, с. 64—65.
- ↑ Реутов, 2004, т. 3, с. 86.
- ↑ March, J. «Organic Chemistry: Reactions, Mechanisms, and Structures» J. Wiley, New York: 1992. ISBN 0-471-58148-8.
- ↑ Реутов, 2004, т. 3, с. 95—99.
- ↑ 1 2 Реутов, 2004, т. 3, с. 124—134.
- ↑ 1 2 3 Реутов, 2004, т. 3, с. 75—76.
- ↑ 1 2 Реутов, 2004, т. 3, с. 79—81.
- ↑ 1 2 3 Реутов, 2004, т. 3, с. 69—75.
- ↑ Реутов, 2004.
- ↑ Реутов, 2004, т. 3, с. 82—83.
- ↑ Реутов, 2004, т. 3, с. 49—57.
- ↑ Реутов, 2004, т. 3, с. 57—59.
- ↑ Реутов, 2004, т. 3, с. 84—85.
- ↑ Цветков Л.А. § 26. Альдегиды // Органическая химия. Учебник для 10 класса. — 20-е изд. — М.: Просвещение, 1981. — С. 120—129.
- ↑ Качественная реакция на альдегиды с гидроксидом меди (II) Архивная копия от 24 декабря 2014 на Wayback Machine — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ Качественная реакция на альдегиды с фуксинсернистой кислотой Архивировано 24 декабря 2014 года. — видеоопыт в Единой коллекции цифровых образовательных ресурсов
- ↑ 1 2 Пассет Б. В., Антипов М. А. Практикум по техническому анализу и контролю в производстве химико-фармацевтических препаратов и антибиотиков. — Медицина, 1981. — 272 с.
- ↑ Dr. Neil Glagovich. Fragmentation – Aldehydes. Архивировано 6 июля 2013 года.
- ↑ Н.С.Вульфсон, В.Г.Заикин,А.И.Микая. Масс-спектроскопия органических соединений. — Химия, 1986. — С. 197—198.
- ↑ 1 2 Dr. Ian Hunt. Spectroscopic Analysis of Aldehydes (англ.). Department of Chemistry University of Calgary. Архивировано 6 июля 2013 года.
- ↑ Общая токсикология / под ред. А. О. Лойта. СПб.: ЭЛБИ-СПб., 2006
- ↑ 1 2 Альдегиды. Дата обращения: 27 июня 2013. Архивировано из оригинала 29 июня 2013 года.
- ↑ G. Reuss, W. Disteldorf, A. O. Gamer, A. Hilt. “Formaldehyde” in Ullmann’s Encyclopedia of Industrial Chemistry (англ.). — 2005. — doi:10.1002/14356007.a11 619.
Литература[править | править код]
- Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — 623 с. — 100 000 экз.
- Реутов О. А. и др. Органическая химия. В 4 частях. — М.: Бином. Лаборатория знаний, 2004.
- Kohlpaintner C., Schulte M., Falbe J., Lappe P., Weber J., Frey G. D. Aldehydes, Araliphatic // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2013. — doi:10.1002/14356007.m01_m03.pub2.
- Kohlpaintner C., Schulte M., Falbe J., Lappe P., Weber J., Frey G. D. Aldehydes, Aliphatic // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2013. — doi:10.1002/14356007.a01_321.pub3.

Продолжение. Начало см. в № 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 26, 28, 29, 30, 31/2004
Урок 23. Альдегиды
Альдегидами называют соединения общей
формулы ![]()
Группа R может быть алифатической (R = алкил,
алкенил, алкинил), алициклической
(R = циклоалкил) или ароматической (R = арил), у
простейшего альдегида (формальдегида) R = Н.
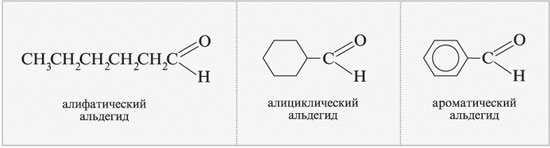 |
Альдегиды разных классов |
Функциональная группа альдегидов –
альдегидная группа – ![]()
В альдегидной группе СНО имеется карбонильная
группа С=О, связанная с атомом водорода.
Карбонильный углерод соединен с другими атомами
тремя ![]() -связями.
-связями.
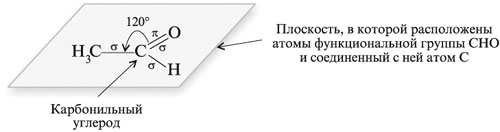
Эти связи образованы гибридными sp2-орбиталями
углерода и лежат в одной плоскости под углом 120°
друг к другу. Остающаяся негибридизованной р-орбиталь
углерода перекрывается с р-орбиталью
кислорода, образуя ![]() -связь.
-связь.
Таким образом, углерод и кислород связаны
двойной связью, причем кислород, карбонильный
углерод и два атома, соединенные с карбонильным
углеродом, лежат в одной плоскости. Например, для
ацетальдегида Н3ССНО валентный угол между
химическими связями при карбонильном атоме
углерода: ![]() ССО =
ССО = ![]() ОСН =
ОСН = ![]() НСС = 120°:
НСС = 120°:
Электроны карбонильной двойной связи С=О не в
равной степени принадлежат атомам разной
электроотрицательности, подвижное ![]() -облако сильно смещено к
-облако сильно смещено к
кислороду.
Номенклатура. По номенклатуре ИЮПАК
названия альдегидов производят от
соответствующих алканов по числу атомов
углерода в цепи с прибавлением суффикса –аль-.
Положение заместителей в главной цепи указывают
цифрами, считая карбонильный углерод как С-1.
По рациональной номенклатуре названия
альдегидов получают из названий соответствующих
карбоновых кислот. Альдегиды с боковыми цепями
называют как производные соединений с линейной
цепью. Положение заместителей указывают
греческими буквами ![]() ,
, ![]() ,
, ![]() ,
, ![]() и т. д.;
и т. д.;
![]() -углерод – это
-углерод – это
атом, связанный с группой СНО (табл. 9):
![]()
Таблица 9
Химические формулы и названия
альдегидов
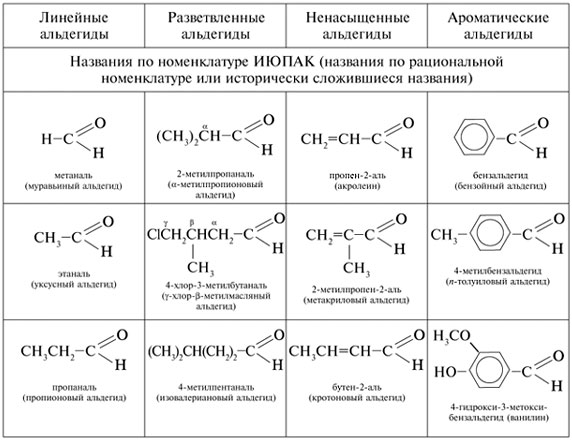
Некоторые английские названия альдегидов
имеют у нас равноправное хождение: формальдегид
НСНО, ацетальдегид СН3СНО, бензальдегид С6Н5СНО.
Изомерия альдегидов RCHO состоит в
изменении строения углеродного скелета радикала
R:
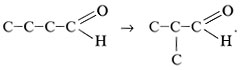
Межклассовая изомерия наблюдается между
альдегидами и непредельными спиртами, а также
циклическими спиртами, непредельными и
циклическими простыми эфирами. Например,
молекулярной формуле С4Н8О отвечают
соединения по крайней мере пяти различных
классов:
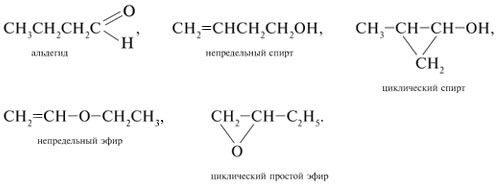
Получение альдегидов
Главные методы синтеза альдегидов связаны с
окислением спиртов и углеводородов.
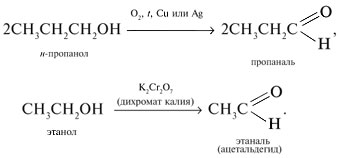
1. Окисление первичных спиртов. В
качестве окислителей применяют кислород воздуха
О2 в присутствии медных или серебряных
катализаторов, пероксид водорода Н2О2,
соединения хрома(VI) и т.д., например:
2. Окисление алкилбензолов –
способ получения ароматических альдегидов:
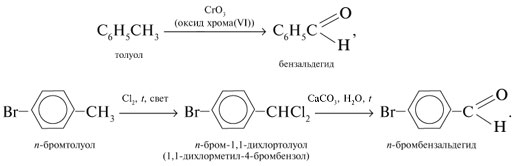
Методы 1 и 2 часто используют
в лабораторных условиях.
В промышленности применяют другие методы – 3–5.
3. Синтез метаналя окислением метана:
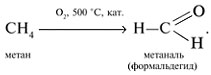
4. Окисление этилена в этаналь
кислородом воздуха в водной среде в
присутствии каталитических добавок солей меди,
железа и палладия:
5. Реакция Кучерова – гидратация
ацетилена в кислой среде в присутствии солей
ртути(II) – метод синтеза ацетальдегида:
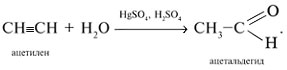
Более понятной будет запись этой реакции как
присоединение воды Н–ОН по кратной связи С![]() С с промежуточным
С с промежуточным
образованием непредельного винилового спирта СН2=СН–ОН.
Спирты с гидроксильной группой ОН при двойной
связи С=С неустойчивые. Так, в нашем примере
двойная связь перемещается по цепи к кислороду,
что сопровождается миграцией атома Н из
гидроксила OН к углероду С-2:
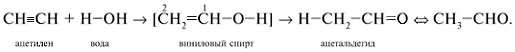
УПРАЖНЕНИЯ
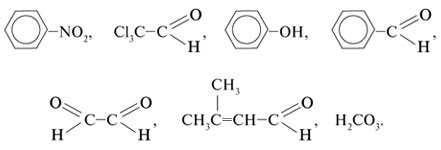
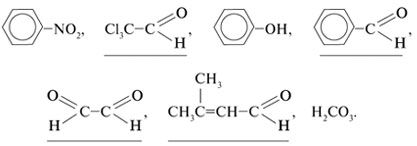
1. Подчеркните химические формулы
альдегидов:
2. Назовите следующие соединения:
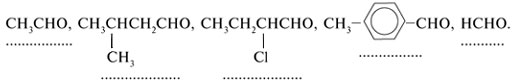
3. Напишите структурные формулы
изомерных альдегидов с общей формулой С6Н12О,
имеющих заместители в ![]() -положении. Назовите эти соединения.
-положении. Назовите эти соединения.
4. Составьте уравнения реакций
получения ацетальдегида в промышленности.
5. Составьте структурные формулы
альдегидов по названиям веществ:
а) н-гексаналь; б) изопентаналь (3-метилбутаналь);
в) акролеин (пропен-2-аль);
г) кротоновый альдегид (бутен-2-аль); д) цитраль
(3,7-диметилоктадиен-2,6-аль).
6. Объясните, почему альдегиды
кипят при температуре значительно более низкой,
чем спирты с тем же числом углеродных атомов
(например, температура кипения ацетальдегида –
21 °С, а этанола – 78 °С).
Ответы на упражнения к теме 2
Урок 23
1. Подчеркнуты химические формулы
альдегидов:
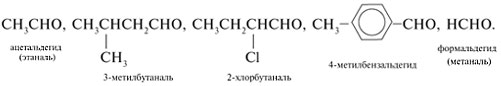
2. Названия соединений по их
химическим формулам:
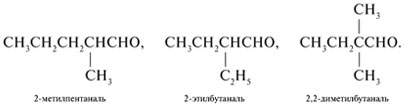
3. Структурные формулы и названия
изомерных альдегидов состава С6Н12О с
заместителями в
![]() -положении:
-положении:
4. Уравнения реакций получения
ацетальдегида в промышленности:
5. По названиям веществ – структурные
формулы:
а) н-гексаналь, СН3(СН2)4СНО;
б) изопентаналь (3-метилбутаналь), (СН3)2СНСН2СНО;
в) акролеин (пропен-2-аль), СН2=СНСНО;
г) кротоновый альдегид (бутен-2-аль), СН3СН=СНСНО;
д) цитраль (3,7-диметилоктадиен-2,6-аль),
6. Соединения молекулярного строения,
содержащие группы ОН и NH, несут заметные заряды:
![]() .
.
Вещества с такими группами атомов способны
образовывать прочные так называемые водородные
связи (ВС) между молекулами – межмолекулярные
связи. Эти вещества имеют более высокие
температуры кипения, чем вещества близкой
молекулярной массы, в которых нет водородных
связей:
Альдегиды


4.2
Средняя оценка: 4.2
Всего получено оценок: 713.
4.2
Средняя оценка: 4.2
Всего получено оценок: 713.
Органические соединения, содержащие альдегидную группу -СН=О, называются альдегидами. Вместе с кетонами они относятся к карбонильным веществам. Общая формула альдегидов и кетонов – CnH2nO или R-CHO.
Гомологи
Гомологический ряд альдегидов С-С10:
- метаналь или формальдегид (CH2O);
- этаналь или ацетальдегид (C2H4O);
- пропаналь (C3H6O);
- бутаналь (C4H8O);
- пентаналь (C5H10O);
- гексаналь (C6H12O);
- гептаналь (C7H14O);
- октаналь (C8H16O);
- нонаналь (C9H18O);
- деканаль (C10H20O).
Названия альдегидов, согласно номенклатуре ИЮПАК, образуются с помощью прибавления к названию алканов суффикса «аль» или «диаль» (у диальдегидов). Также в литературе встречаются тривиальные названия. Например, альдегид муравьиный (метаналь), уксусный (этаналь), валериановый (пентаналь).
Виды
Классификация альдегидов по двум признакам приведена в таблице.
|
Признак |
Вид |
Описание |
Пример |
|
Возможность образовывать новые связи |
Предельные |
Содержат максимальное количество атомов водорода |
Ацетальдегид |
|
Непредельные |
Способны присоединять атомы водорода |
Акролеин |
|
|
Ароматические |
Циклические соединения с тремя двойными связями |
Бензальдегид |
|
|
Количество карбонильных групп |
Простые |
Содержат только одну группу =С=О |
Формальдегид |
|
Диальдегиды |
Содержат две группы =С=О |
Глиоксаль |
Альдегидам, начиная с бутаналя, характерны два вида изомерии: межклассовая с кетонами и структурная. Например, изомерия углеродного скелета: СН3-СН2-СН2-СН=О (бутаналь) и СН3-СН(СН3)-СН=О (2-метилпентаналь). При присоединении к водороду метиленовой группы СН2 из пропаналя образуется пропанол (ацетон): СН3-СН2-СОН → СН3-СО-СН3.
Получение
Соединения получают:
- окислением спиртов оксидом меди (II):
R-CH2-OH + CuO → R-CHO + Cu + H2O;
- гидратацией ацетилена (получение ацетальдегид):
H-С≡C-H + H2O → CH3CHO;
- окислением этилена:
2C2H4 + O2 → 2CH3CHO;
- окислением метана (получение формальдегида):
CH4 + O2 → CH2O + H2O;
- дегидрированием спиртов:
CH3-CH(OH)-CH3 → CH3-CO-CH3 + H2.
Физические свойства
Физическое состояние альдегидов зависит от количества атомов углерода:
- формальдегид – газообразное вещество;
- альдегиды, содержащие от двух до 12 атомов углерода, – жидкости;
- альдегиды с 13 и более атомами углерода – твёрдые вещества.
Температуры кипения альдегидов, имеющих линейное строение, выше, чем у разветвлённых изомеров. Плотность, вязкость, показатель преломления при нормальных условиях увеличиваются с возрастанием молекулярной массы.
Два первых альдегида в гомологическом ряду – формальдегид и этаналь – неограниченно смешиваются с водой. Далее в гомологическом ряду растворимость уменьшается с увеличением углеродного скелета. Альдегиды хорошо растворяются в спиртах, эфирах и других органических растворителях.
Гомологи С8-С13 используются в парфюмерной промышленности.
Химические свойства
Функциональная альдегидная группа определяет химические свойства альдегидов, которые аналогичны свойствам кетонов. Ниже описаны основные реакции с альдегидами.
|
Реакция |
Описание |
Уравнение |
|
Присоединения |
Альдегиды присоединяют молекулы воды, спиртов, тиололов, неорганических солей, аминов по двойной связи карбонильной группы |
|
|
Восстановление |
При взаимодействии с водородом образуются спирты |
HCHO + H2 → CH3OH |
|
Окисление |
Качественные реакции оксидом серебра («серебряное зеркало») и гидроксидом меди (II) с образованием красного осадка |
|

Что мы узнали?
Из урока химии 10 класса узнали, что такое альдегиды. Это родственные кетонам вещества, содержащие группу -СН=О. Альдегиды образуют гомологический ряд с общей формулой CnH2nO. Названия в ряду соответствуют названиям алканов с суффиксом «аль». Простейший альдегид – формальдегид или метаналь – бесцветный газ. Альдегиды ряда С2-С12 – жидкости. Высшие альдегиды с 13 и более атомами углерода – твёрдые вещества. Альдегиды участвуют в реакциях окисления, восстановления, присоединения.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Венера Насырова
9/10
-

Данила Суслин
10/10
-

Наташа Торгаева
10/10
-

Хадиджа Муслимова
10/10
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 713.
А какая ваша оценка?
Содержание:
Альдегиды:
Органические соединения, в молекулах которых имеется карбонильная группа 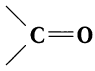
Карбонильные соединения делятся на две большие группы — альдегиды и кетоны. Со строением и свойствами альдегидов вы познакомитесь в данном параграфе.
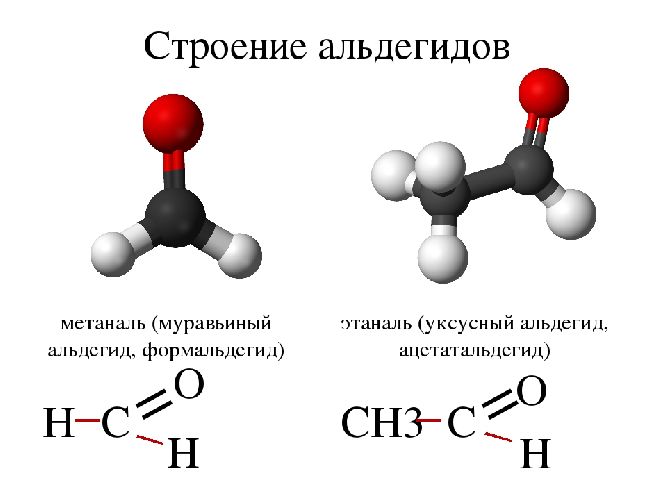
Альдегидами называют органические соединения, в которых карбонильная группа 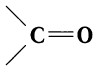
Для альдегидов группа атомов  является функциональной и называется альдегидной; сокращенно она записывается —СНО.
является функциональной и называется альдегидной; сокращенно она записывается —СНО.
Простейшим представителем альдегидов является метаналь
(формальдегид, или муравьиный альдегид) .
.
Это единственный альдегид, в молекуле которого карбонильная группа соединена с двумя атомами водорода.
В зависимости от строения углеводородного заместителя различают альдегиды:
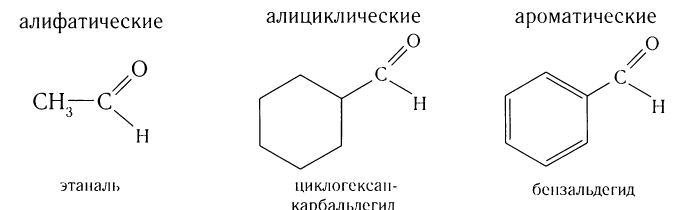
Многие альдегиды и их производные встречаются в живой природе. Например, в миндале обнаружены бензальдегид и его производные:
в корице — З-фенилпропеналь (коричный альдегид):
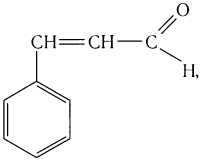
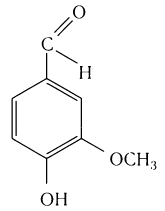
в стручках ванили — пахучее вещество ванилин:
В данном курсе химии вы познакомитесь с алифатическими альдегидами, производными алканов (насыщенных углеводородов).
Общая формула, отражающая химическое строение алифатических насыщенных альдегидов, 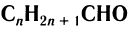 или
или 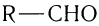 , где
, где 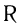 — алкильная группа.
— алкильная группа.
Общая формула насыщенных альдегидов
Общая формула насыщенных альдегидов 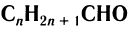 .
.
Общая формула, отражающая молекулярный состав насыщенных альдегидов, 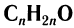 .
.
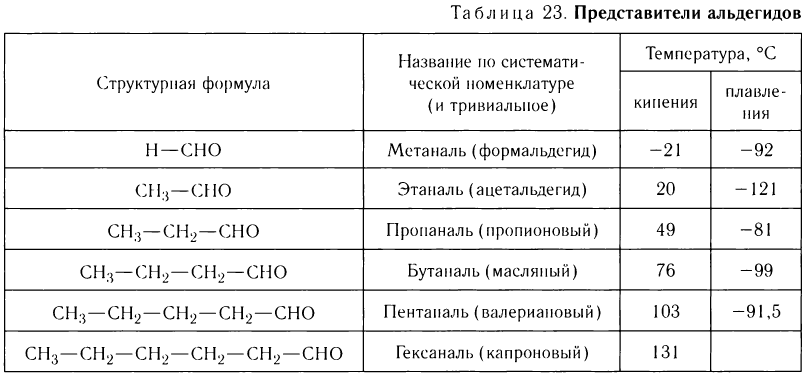
В таблице 23 приведены названия, сокращенные структурные формулы и некоторые физические свойства нескольких представителей насыщенных альдегидов.
Рассмотрим электронное строение карбонильной группы (рис. 51).
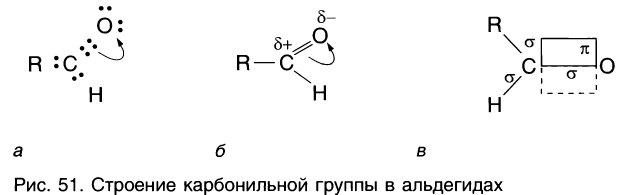
В карбонильной группе связь между атомами углерода и кислорода двойная. Атом углерода образует три  -связи, которые располагаются в одной плоскости под углом 120° друг к другу,
-связи, которые располагаются в одной плоскости под углом 120° друг к другу,  -связь С — О образована при перекрывании 2р-орбиталей атомов углерода и кислорода. Двойная связь С = О является сочетанием одной
-связь С — О образована при перекрывании 2р-орбиталей атомов углерода и кислорода. Двойная связь С = О является сочетанием одной 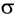 – и одной
– и одной 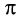 -связей. В силу высокой электроотрицательности атома кислорода электронная плотность двойной связи смещена в сторону атома кислорода(см. рис. 51). Атом кислорода приобретает частичный отрицательный заряд, а атом углерода — частичный положительный заряд:
-связей. В силу высокой электроотрицательности атома кислорода электронная плотность двойной связи смещена в сторону атома кислорода(см. рис. 51). Атом кислорода приобретает частичный отрицательный заряд, а атом углерода — частичный положительный заряд:
Связь С = О полярна.
Связь С = О короче и ее анергия больше, чем связи С = С.
Длина связи С = С – 0,134 нм, а С = 0 — 0,121 нм, энергия связи С = С – 620 кДж/моль, а С = 0 — 710 кДж/моль.
Полярность связи С = О сказывается на физических и химических свойствах альдегидов, которые являются высоко реакционноспособными веществами.
Номенклатура альдегидов
По правилам номенклатуры ИЮПАК названия альдегидов образуются от названий соответствующих алканов с добавлением суффикса –аль, например НСНО — метаналь, СН3СНО — этаналь.
При названии альдегидов с разветвленной углеродной цепью нумерация главной цепи начинается с атома углерода альдегидной группы.
Например:
Для альдегидов сохраняются и тривиальные названия, например: НСНО — формальдегид, или муравьиный альдегид, СН3СНО — уксусный альдегид, СН3СН2СНО — пропионовый альдегид и т. д.
Изомерия альдегидов
Изомерия альдегидов обусловлена изомерией углеродной цепи.
Первые три члена гомологического ряда альдегидов — метаналь, этаналь, пропаналь — изомеров не имеют.
Число изомеров у альдегидов с увеличением числа углеродных атомов в молекуле сильно возрастает. Например, для альдегидов состава С5Н10О существует четыре изомера альдегида (без учета стереоизомеров).
Составу С6Н12О соответствует семь изомерных альдегидов (без учета пространственных изомеров) и т. д.
Физические свойства альдегидов
В обычных условиях метаналь (формальдегид, или муравьиный альдегид) находится в газообразном состоянии, имеет резкий неприятный запах, ядовит. Остальные альдегиды — жидкости или твердые вещества. Низшие альдегиды имеют резкий неприятный запах, а высшие альдегиды обладают цветочными запахами и широко применяются в парфюмерии.
Имеется характерный запах также у некоторых ароматических альдегидов и альдегидов ненасыщенного ряда. Например: фенилуксусный альдегид С6Н5СН2СНО имеет запах гиацинтов и потому его называют гиацинтовым.
Ознакомиться с характерными запахами некоторых альдегидов можно в домашних условиях. При выпечке широко используется ванилин, получающийся синтетически. Многим чистящим средствам, использующимся в домашнем хозяйстве, запах лимона придает синтетический альдегид строения
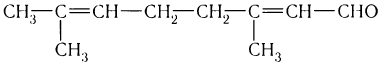 ,
,
Температуры кипения альдегидов более низкие, чем соответствующих спиртов. Это объясняется тем, что в альдегидах в отличие от спиртов отсутствуют межмолекулярные водородные связи.
Простейшие альдегиды легко растворяются в воде. Например, растворимость уксусного альдегида в воде неограниченная, формальдегида — хорошая (раствор альдегида с массовой долей 40 % называют формалином), растворимость пропионового альдегида:
44 г на 100 см3 (25 °С).
Органические соединения, в которых карбонильная группа связана с одним атомом водорода и одним углеводородным заместителем, называют альдегидами.
Общая формула насыщенных алифатических альдегидов 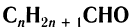 .
.
Структурная изомерия альдегидов обусловлена изомерией углеродной цепи.
Химические свойства альдегидов
Рассмотрим важнейшие химические свойства насыщенных алифатических альдегидов.
Реакции присоединения
По месту двойной связи С = О у альдегидов могут проходить реакции присоединения.
Альдегиды способны присоединять водород по связи С = О на никелевом или платиновом катализаторе с образованием первичных спиртов:
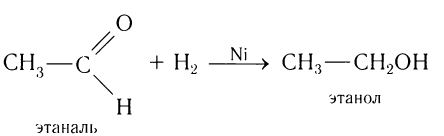
Гидрирование альдегидов относят к реакции восстановления. В промышленности реакцию гидрирования альдегидов используют для получения первичных спиртов.
В качестве эффективных восстановителей альдегидов используется алюмогидрид лития. В этих реакция он является источником гидридных анионов:
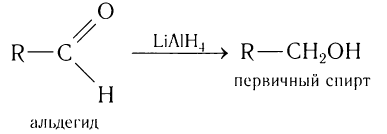
Реакция окисления
Альдегиды легко окисляются (значительно легче, чем спирты) в соответствующие карбоно-вые кислоты. Их можно окислить даже такими мягкими окислителями, как оксид серебра(І) и гидроксид меди(ІІ).
Так, если к аммиачному раствору оксида серебра(І) прилить раствор уксусного альдегида и смесь нагрет то происходит окисление альдегида с образованием уксусной кислоты. Внутренняя поверхность колбы, в которой нагревается смесь, покрывается при этом тонким слоем серебра (рис. 52).
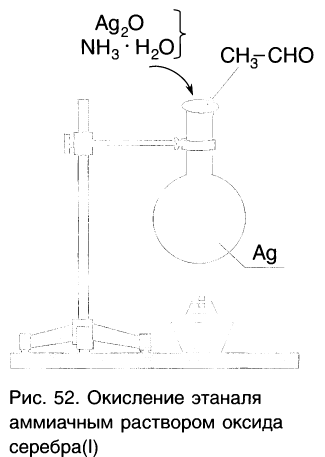
Эту реакцию называют реакцией серебряного зеркала. Она является одной из качественных реакций для обнаружения альдегидной группы:
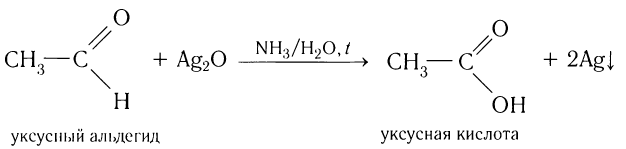
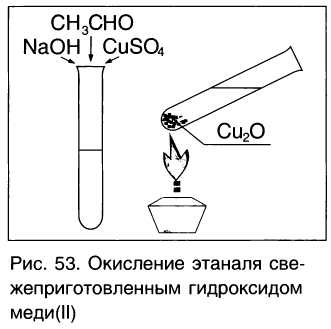
Другая качественная реакция на альдегиды — реакция со свежеприготовленным гидроксидом меди(ІІ). При окислении гидроксид меди(ІІ), имеющий светло – голубой цвет, восстанавливается в гидроксид меди(І) желтого цвета, который при нагревании превращается в оксид меди(І) красного цвета (рис. 53):
Окислить альдегиды в соответствующие кислоты можно также такими окислителями, как 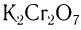 ,
, 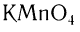 , или кислородом воздуха в присутствии катализатора:
, или кислородом воздуха в присутствии катализатора:
Высокая реакционная способность альдегидов обусловлена строением карбонильной группы.
Для альдегидов характерны реакции присоединения по месту двойной связи С=О и окисления по месту связи С — Н в альдегидной группе.
Получение альдегидов. Применение альдегидов и их производных
Получение:
Многие альдегиды и их производные используются в различных областях производства органических соединений.
Природными источниками для их промышленного получения являются углеводороды крекинга нефти, галогенпроизводные, спирты.
Рассмотрим лабораторные, а затем промышленные способы получения альдегидов.
Лабораторные способы:
1.Окисление первичных спиртов оксидом металла (СuО) или подкисленным раствором бихромата калия:
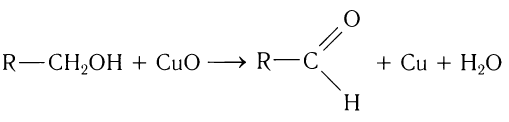
2. Гидратация ацетилена в условиях реакции Кучерова в присутствии солей двухвалентной ртути идет с образованием ацетальдегида:
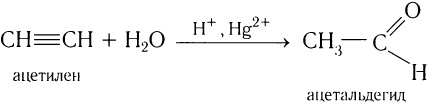
Промышленные способы:
1.Окисление алкенов в присутствии солей палладия:
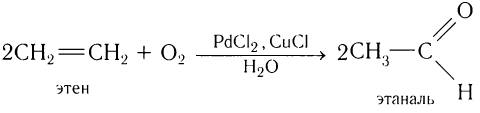
Этот метод является одним из современных промышленных методов и относится к экологически чистым.
2.Окисление спиртов. Спирты могут быть превращены в карбонильные соединения в результате окислительных процессов. При окислении первичных спиртов образуются альдегиды:
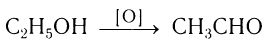
Метаналь (формальдегид) в промышленности получают окислением метанола кислородом воздуха в присутствии катализаторов (медь или серебро):
Получение альдегидов дегидрированием спиртов широко используется в современной промышленности. Само название класса органических соединений «альдегиды» возникло именно благодаря этому способу их получения (лат. alcohol dehydrogenates — спирт дегидрированный).
При пропускании паров спирта над катализатором при высоких температурах происходит дегидрирование первичных спиртов в альдегиды:
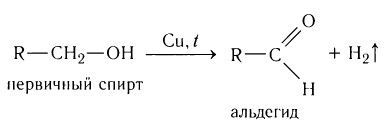
Применение альдегидов и их производных:
Альдегиды находят применение в различных областях промышленности. Формальдегид используется в качестве исходного сырья для получения фенолформальдегидных пластмасс, синтетического каучука и лекарственных средств.
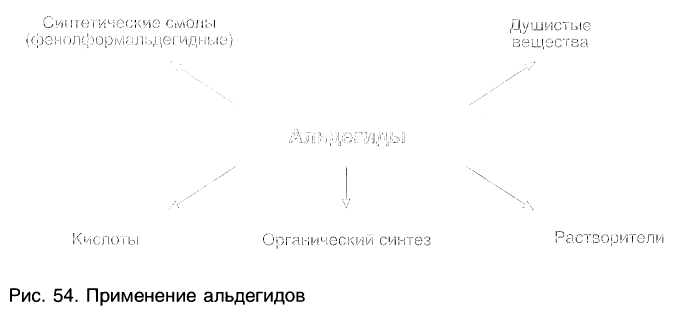
А. М. Бутлеров н 1860 г. впервые синтезировал из формальдегида и аммиака органическое вещество гексаметилентетрамин, или уротропин, которое используется в медицине.
Ацетальдегид применяют для производства уксусной кислоты и уксусного ангидрида, этилацетата, хлораля.
Бензальдегид С6Н5СНО в природе встречается в связанном виде в листьях лавровишен, косточках персиков, абрикосов, слив, в горьком миндале. Он используется для получения душистых и лекарственных веществ, некоторых красителей.
Пропеналь СН2 = СН — СНО применяют для получения пластмасс, отличающихся боль-шой твердостью, глицерина, акриловой кислоты, лекарственных средств.
На рисунке 54 показаны области использования альдегидов.
Существуют лабораторные и промышленные способы получения альдегидов. К основным промышленным способам относят: окисление алкенов, спиртов, дегидрирование спиртов.
Альдегиды
Агьдегиды и карбоновые кислоты относятся к карбонильным соединениям (рис. 56). Карбонильными называют вещества, в состав которых входит карбонильная (или оксо-) группа 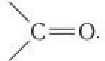 К карбонильным соединениям, кроме альдегидов и карбоновых кислот, относят кетоны.
К карбонильным соединениям, кроме альдегидов и карбоновых кислот, относят кетоны.
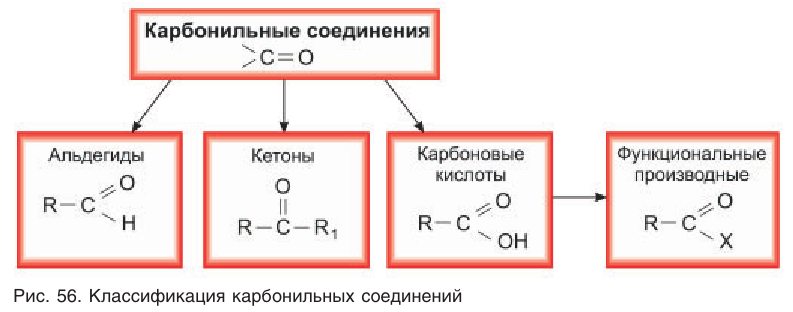
В молекулах альдегидов карбонильная группа связана с одним атомом водорода и одним углеводородным заместителем (R), а в кетонах — с двумя углеводородными заместителями (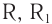 ). В молекулах карбоновых кислот карбонильная группа входит в состав карбоксильной группы, состоящей из связанных между собой карбонильной и гидроксильной групп.
). В молекулах карбоновых кислот карбонильная группа входит в состав карбоксильной группы, состоящей из связанных между собой карбонильной и гидроксильной групп.
Карбонильные соединения в школьном курсе химии изучаются на примере альдегидов и карбоновых кислот. Рассматриваются также строение и свойства сложных эфиров — функциональных производных карбоновых кислот.
Строение: Альдегидами называют производные углеводородов, в молекулах которых атом водорода замещен на группу 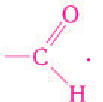
Карбонильную группу 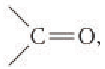 связанную с атомом водорода, называют альдегидной:
связанную с атомом водорода, называют альдегидной: 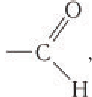 для альдегидов она является функциональной группой. Сокращенно альдегидная группа записывается
для альдегидов она является функциональной группой. Сокращенно альдегидная группа записывается 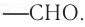 Общая формула альдегидов
Общая формула альдегидов 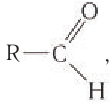 где R — углеводородный заместитель или атом водорода.
где R — углеводородный заместитель или атом водорода.
В молекуле простейшего альдегида метаналя  карбонильная группа связана с двумя атомами водорода. Шаростержневая и масштабная модели молекулы метаналя приведены на рисунке 57.
карбонильная группа связана с двумя атомами водорода. Шаростержневая и масштабная модели молекулы метаналя приведены на рисунке 57.
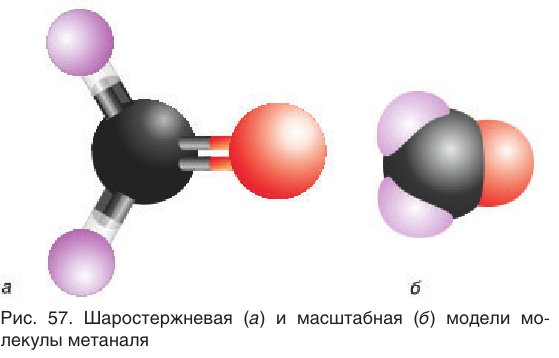
В зависимости от строения углеводородного заместителя, связанного с альдегидной группой, различают насыщенные, ненасыщенные, ароматические альдегиды и др. В данном курсе вы будете изучать строение и свойства альдегидов — производных насыщенных углеводородов (алканов).
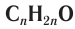 — общая формула, отражающая молекулярный состав альдегидов. Рассмотрим электронное строение карбонильной группы (рис. 58). В карбонильной группе между атомами углерода и кислорода две химические связи:
— общая формула, отражающая молекулярный состав альдегидов. Рассмотрим электронное строение карбонильной группы (рис. 58). В карбонильной группе между атомами углерода и кислорода две химические связи: 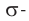 и
и 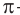 -связь. Атом углерода карбонильной группы в альдегидах образует три
-связь. Атом углерода карбонильной группы в альдегидах образует три 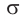 -связи, расположенные в одной плоскости под углом примерно 120° друг к другу. Вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь
-связи, расположенные в одной плоскости под углом примерно 120° друг к другу. Вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь  сильно поляризована за счет смещения электронной плотности л-связи к кислороду. При этом на атоме кислорода образуется избыток (
сильно поляризована за счет смещения электронной плотности л-связи к кислороду. При этом на атоме кислорода образуется избыток ( ), а на атоме углерода — недостаток (
), а на атоме углерода — недостаток ( ) электронной плотности. Связь
) электронной плотности. Связь  полярна. Под влиянием карбонильной группы происходит смещение электронной плотности соседней с карбонильным центром связи
полярна. Под влиянием карбонильной группы происходит смещение электронной плотности соседней с карбонильным центром связи 
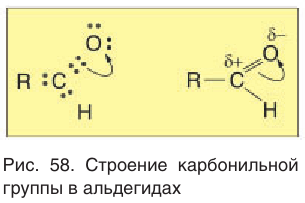
Номенклатура: По правилам номенклатуры ИЮПАК названия насыщенных альдегидов образуются из названий соответствующих алканов с добавлением суффикса -аль, например НСНО — метаналь, 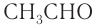 — этаналь. В таблице 25 приведены названия гомологов насыщенных альдегидов нормального строения по номенклатуре ИЮПАК и тривиальные.
— этаналь. В таблице 25 приведены названия гомологов насыщенных альдегидов нормального строения по номенклатуре ИЮПАК и тривиальные.
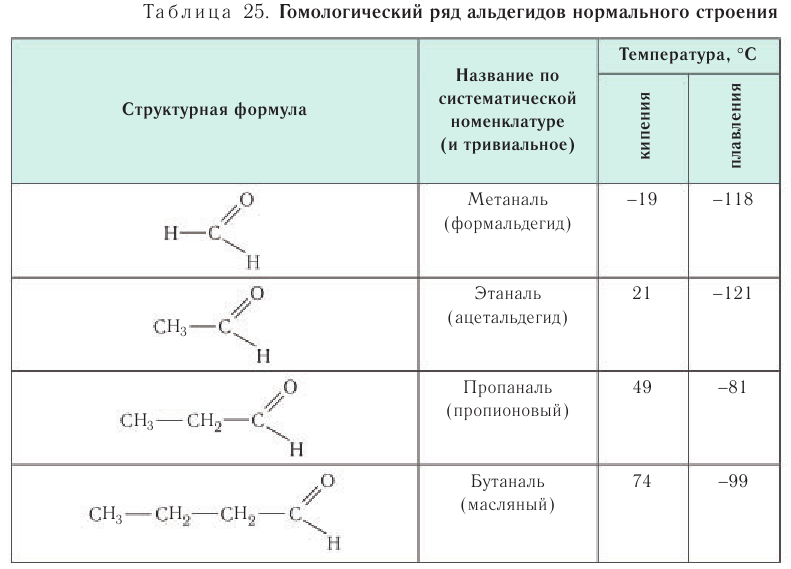
При названии альдегидов с разветвленной углеводородной цепью нумерация атомов углерода главной цени начинается с атома углерода альдегидной группы. Названия заместителей перечисляются в алфавитном порядке с указанием номера атома углерода, с которым они связаны. Например:
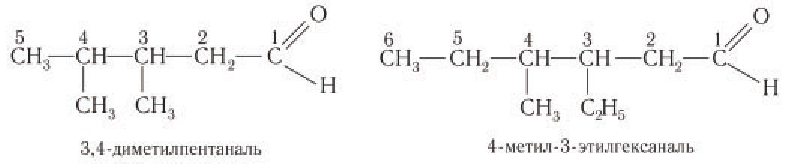
Для альдегидов сохраняются и тривиальные названия, например: НСНО — формальдегид, или муравьиный альдегид, 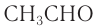 — уксусный альдегид,
— уксусный альдегид,  — пропионовый альдегид и т. д.
— пропионовый альдегид и т. д.
Масштабная модель молекулы уксусного альдегида приведена на рисунке 59.
Изомерия: Структурная изомерия альдегидов обусловлена изомерией углеродного скелета.
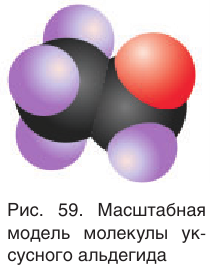
Первые три представителя класса — метаналь, этаналь, пропаналь — изомеров альдегидов не имеют.
Число изомеров у альдегидов с увеличением числа углеродных атомов в молекуле возрастает. Например, для альдегидов состава 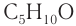 существует четыре изомера альдегида (без учета стереоизомеров):
существует четыре изомера альдегида (без учета стереоизомеров):
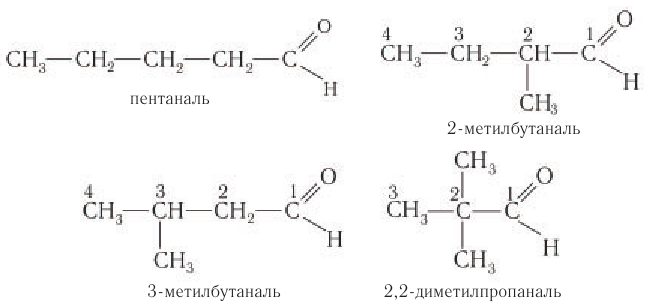
Составу 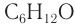 соответствует семь изомерных альдегидов (без учета стереоизомеров) и т. д.
соответствует семь изомерных альдегидов (без учета стереоизомеров) и т. д.
Для альдегидов характерна и межклассовая изомерия. Насыщенные альдегиды изомерны кетонам — карбонильным производным насыщенных углеводородов с тем же числом атомов углерода в молекуле, что и у альдегидов. К кетонам относятся производные углеводородов, молекулы которых содержат карбонильную группу 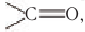 связанную с двумя углеводородными заместителями.
связанную с двумя углеводородными заместителями.
Например, простейший кетон ацетон  изомерен пропаналю
изомерен пропаналю 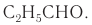 Молекулярная формула обоих веществ
Молекулярная формула обоих веществ 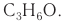
Ацетон — важнейший в промышленном отношении продукт, получаемый, как вам уже известно, кумольным методом как сопутствующий фенолу продукт.
Физические свойства: Метаналь (при и. у.) — бесцветный газ, альдегиды  — жидкости, а начиная с альдегида
— жидкости, а начиная с альдегида  — твердые вещества. Низшие альдегиды имеют резкий запах, у альдегидов
— твердые вещества. Низшие альдегиды имеют резкий запах, у альдегидов 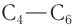 неприятный запах, высшие альдегиды обладают цветочными запахами.
неприятный запах, высшие альдегиды обладают цветочными запахами.
Имеется характерный запах также у некоторых ароматических альдегидов и альдегидов ненасыщенного ряда. Например, фенилуксусный альдегид 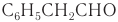 имеет запах гиацинтов, поэтому его называют гиацинтовым.
имеет запах гиацинтов, поэтому его называют гиацинтовым.
Низшие альдегиды хорошо растворяются в воде. Например, растворимость этаналя в воде неограниченная, метаналя (формальдегида) — хорошая (раствор с массовой долей альдегида 40% называют формалином). С увеличением молярной массы альдегидов их растворимость в воде уменьшается.
Температуры кипения и плавления альдегидов по мере увеличения молярной массы закономерно возрастают (см. табл. 25), но при этом они ниже, чем у соответствующих спиртов. Это явление связано с тем, что в молекулах альдегидов карбонильная группа не настолько полярна, чтобы образовывать водородные связи с другими молекулами этого же соединения, как это происходит у спиртов.
Альдегиды — производные углеводородов, у которых атом водорода замещен на группу —СНО.
Общая формула альдегидов — производных алканов — 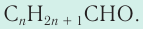
Структурная изомерия альдегидов обусловлена изомерией углеродного скелета.
Химические свойства альдегидов
Химические свойства альдегидов обусловлены наличием в составе молекул карбонильной группы с полярной  -связью. Альдегиды — химически активные соединения, для которых характерны реакции присоединения по связи
-связью. Альдегиды — химически активные соединения, для которых характерны реакции присоединения по связи  и окисления по связи
и окисления по связи  в альдегидной группе. Метаналь является самым химически активным альдегидом.
в альдегидной группе. Метаналь является самым химически активным альдегидом.
Реакции присоединения: Альдегиды способны присоединять водород по связи  на никелевом или платиновом катализаторе с образованием первичных спиртов.
на никелевом или платиновом катализаторе с образованием первичных спиртов.
Например, при пропускании паров этаналя вместе с водородом над нагретым никелевым катализатором происходит присоединение водорода и образуется спирт этанол:
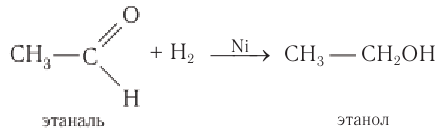
Гидрирование альдегидов относят к реакции восстановления.
В промышленности реакцию гидрирования альдегидов используют для получения насыщенных первичных спиртов.
В качестве эффективных восстановителей альдегидов используется также алюмогидрид лития. В этих реакциях он является источником гидридных анионов:
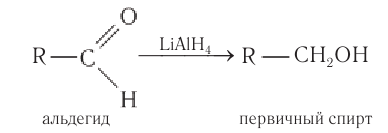
Реакция окисления: Альдегиды способны не только восстанавливаться, но и окисляться значительно легче, чем спирты, при этом образуются соответствующие карбоновые кислоты. Альдегиды можно окислить даже такими мягкими окислителями, как оксид серебра(I) и гидроксид меди(II). Реакции окисления альдегидов протекают при расщеплении связи  в альдегидной группе.
в альдегидной группе.

Так, если к аммиачному раствору оксида серебра(I) прилить раствор уксусного альдегида и смесь нагреть, то происходит окисление альдегида с образованием уксусной кислоты. Внутренняя поверхность пробирки, в которой нагревается смесь, покрывается при этом тонким слоем серебра (рис. 60):
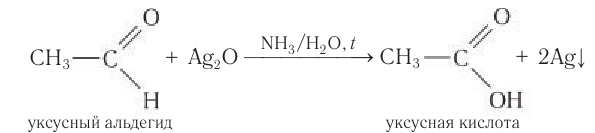
Это так называемая реакция серебряного зеркала, которая может служить качественной реакцией на альдегиды.
Если к свежеосажденному гидроксиду меди(II) прилить раствор уксусного альдегида и смесь нагреть, то также происходит окисление альдегида до уксусной кислоты. При этом гидроксид меди(II) светло-голубого цвета восстанавливается в гидроксид меди(I) желтого цвета, который при нагревании превращается в оксид меди(I) красного цвета:
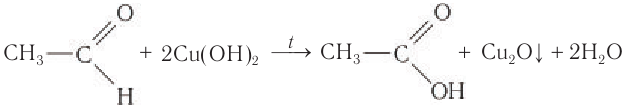
Эта реакция так же, как реакция серебряного зеркала, используется для качественного обнаружения альдегидов.
Окислить альдегиды в соответствующие кислоты можно также такими окислителями, как 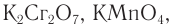 или кислородом воздуха в присутствии катализатора:
или кислородом воздуха в присутствии катализатора:
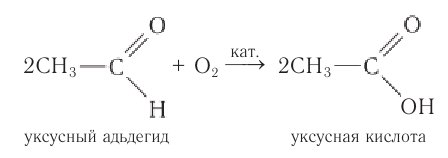
Высокая реакционная способность альдегидов обусловлена строением карбонильной группы.
Для альдегидов характерны реакции присоединения по двойной связи  и окисления по связи
и окисления по связи  в альдегидной группе.
в альдегидной группе.
Получение и применение альдегидов
Получение: Альдегиды получают окислением первичных насыщенных одноатомных спиртов. В лаборатории в качестве окислителей используют оксид меди(II) или пероксид водорода, в общем виде этот процесс можно записать так:
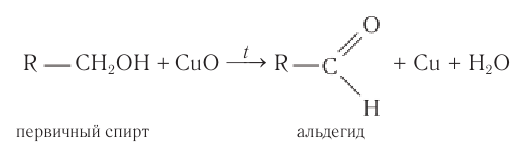
В промышленных условиях метаналь получают окислением метанола кислородом воздуха в присутствии медного или серебряного катализатора:
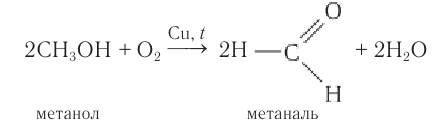
Этаналь получают аналогичным методом:
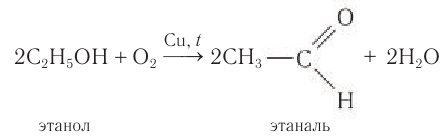
Уксусный альдегид был выделен в лаборатории немецким химиком Ю.Либихом в 1835 г., а первый представитель класса альдегидов — муравьиный альдегид — был получен в лаборатории также немецким химиком А. Гофманом в 1868 г.
Одним из современных промышленных методов получения низших альдегидов является окисление алкенов кислородом воздуха в присутствии хлоридов палладия и меди. Этаналь в промышленности получают преимущественно этим методом:
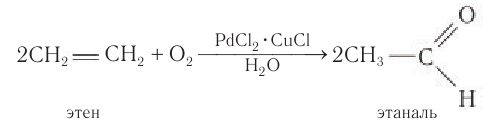
В современной промышленности широко используется такой способ получения альдегидов, как каталитическое дегидрирование первичных насыщенных спиртов. Так, например, при пропускании паров этанола при высокой температуре над поверхностью медного катализатора происходит дегидрирование этанола и образование этаналя:
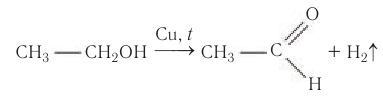
Этот способ получения альдегидов объясняет само название класса — спирт дегидрированный (от лат. alcohol dehydrogenates).
Этаналь можно получить гидратацией ацетилена в условиях реакции Кучерова в присутствии солей двухвалентной ртути:
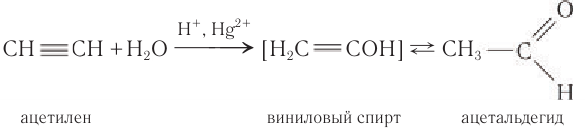
В реакции сначала к ацетилену идет присоединение воды по одной связи, и образуется ненасыщенный виниловый спирт, у которого гидроксильная группа связана с атомом углерода при двойной связи. Ненасыщенные спирты неустойчивы и легко изомеризуются. Поэтому виниловый спирт превращается в уксусный альдегид. Эта реакция впервые была открыта русским химиком М. Г. Кучеровым. Используемые в реакции в качестве катализатора соли ртути опасны для здоровья человека, поэтому эту реакцию для промышленного получения карбонильных соединений не используют.
Применение: Рассмотрим области применения важных в промышленном отношении альдегидов — метаналя и этаналя. Основное количество получаемого в промышленности метаналя (формальдегида) расходуется на производство фенолфор-мальдегидных смол, из которых получают фенолформальдегидные пластмассы (см. § 28). Полиформальдегид 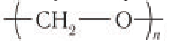 используется для изготовления пленок и волокон. Метаналь применяют для производства некоторых лекарственных веществ, в частности широко известного лекарства уротропин. Впервые уротропин из метаналя и аммиака в 1860 г. синтезировал А. М. Бутлеров.
используется для изготовления пленок и волокон. Метаналь применяют для производства некоторых лекарственных веществ, в частности широко известного лекарства уротропин. Впервые уротропин из метаналя и аммиака в 1860 г. синтезировал А. М. Бутлеров.
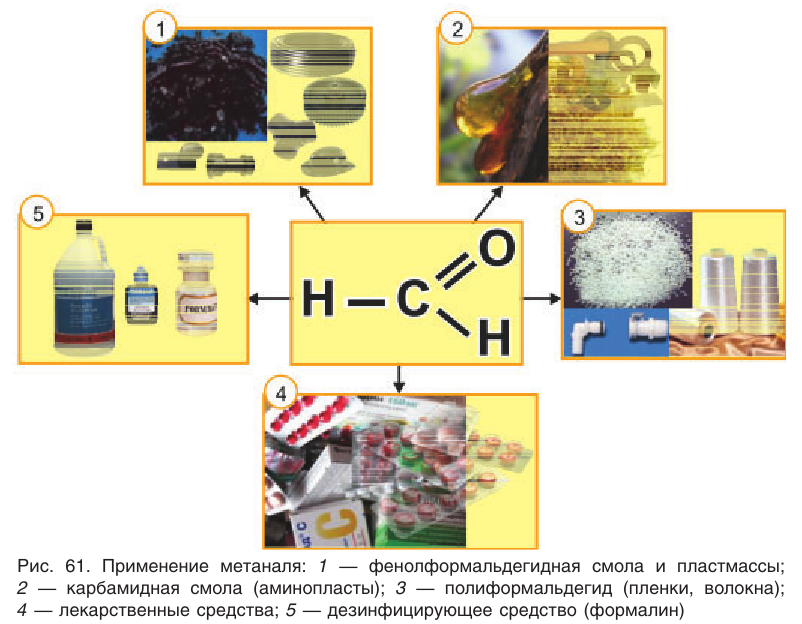
Метаналь используется обычно в виде водного раствора — формалина. Формалин обладает сильными дезинфицирующими свойствами. Его применяют для дезинфекции и дубления кож, хранения анатомических препаратов, в сельском хозяйстве — для протравливания семян.
На рисунке 61 показаны области применения метаналя.
Этаналь (уксусный альдегид) используют в промышленных масштабах для получения уксусной кислоты и ее производных.
В некоторых отраслях производства находят применение альдегиды, производные ненасыщенных и ароматических углеводородов. Например, ненасыщенный альдегид пропеналь 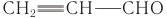 применяют для получения акриловой кислоты, глицерина, некоторых полимеров, лекарственных веществ.
применяют для получения акриловой кислоты, глицерина, некоторых полимеров, лекарственных веществ.
Ароматический альдегид бензальдегид 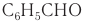 используется для получения душистых и лекарственных веществ, некоторых красителей. В природе бензальдегид встречается в связанном виде в листьях лавровишен, косточках персиков, абрикосов, слив, в горьком миндале.
используется для получения душистых и лекарственных веществ, некоторых красителей. В природе бензальдегид встречается в связанном виде в листьях лавровишен, косточках персиков, абрикосов, слив, в горьком миндале.
К основным промышленным способам получения альдегидов относят окисление алкенов и спиртов, дегидрирование спиртов.
Метаналь и этаналь используются во многих отраслях производства.
- Карбоновые кислоты в химии
- Сложные эфиры в химии
- Жиры в химии
- Углеводы в химии
- Ненасыщенные углеводороды
- Ароматические углеводороды
- Спирты в химии
- Фенолы в химии

![{displaystyle {mathsf {R{-}CH_{2}OH{xrightarrow[{DMP}]{}}R{-}CHO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0b15841cd676b1573a947db0d7935b136295db0)
![{mathsf {CH_{2}(OH){-}CH_{2}(OH){xrightarrow[ {HIO_{4}}]{}}2CH_{2}O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9d6919d90b037d655c0f4715fe8c3855c8c1732)



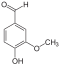
![{mathsf {[NH_{3}OH]Cl+RCOHrightarrow RCH{=}N{-}OH+H_{2}O+HCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32eccdf5904f7cf37dee598b419a22c5ccb733be)


