Аминокислоты (АМК, аминокорбоновые кислоты, пептиды) – органические соединения на основе аминов, под которыми подразумеваются производные аммония 16%.
Из чего состоят заменимые и незаменимые аминокислоты
Аминокислоты играют важную роль — принимают участие в биосинтезе белка. Расщепление белка на аминокислоты происходит в желудочно-кишечном тракте человека. Сколько существует аминокислот? Сегодня известно около двухсот пептидов, но всего 20 аминокислот принимают участие в строительстве биологического организма. Поэтому если перед вами стоит вопрос, как запомнить аминокислоты, не стоит паниковать: нужно запомнить всего 20.
Есть заменимые и незаменимые аминокислоты. Также некоторые выделяют условно заменимые аминокислоты.
Заменимые аминокислоты
Заменимые аминокислоты — те аминокислоты, которые попадают в организм человека вместе с продуктами питания.
В самом человеке они тоже могут производиться — из прочих веществ.
Среди таких аминокислот выделяются:
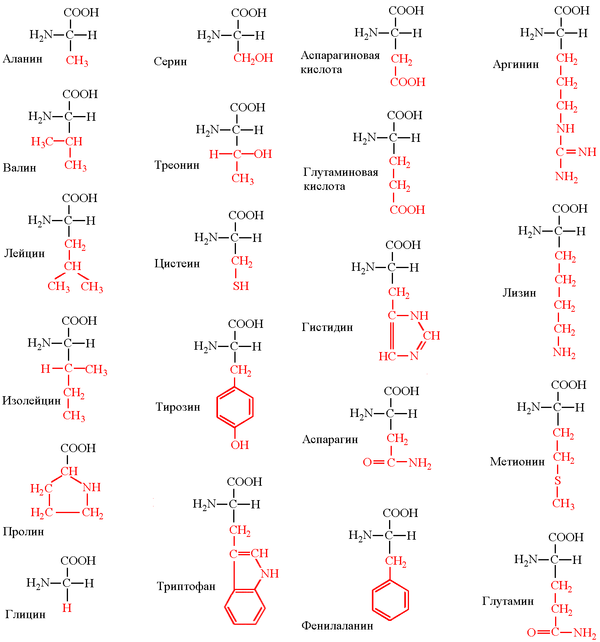
- аланин. Это мономер белков. Он принимает участие в процессе глюкогенеза, становясь глюкозой в человеческой печени. Отвечает за регулирование метаболических процессов;
- аргинин. Синтезируется только в организме взрослых людей — в организме детей образоваться не может. Играет важную роль, к примеру, в системе синтеза гормона роста. Единственная аминокислота, переносящая азот. С ее помощью увеличивается мышечная масса и снижается жировая;
- аспарагин. Является пептидом азотного обмена. Действуя с ферментами, отщепляет аммониак и преобразуется в аспарагиновую кислоту;
- аспарагиновая кислота. Отвечает за образование иммуноглобулинов и деактивацию аммиака. Помогает восстановить баланс в работе сердечного цикла и нервной системы;
- гистидин. Применяют в лечении кишечных заболеваний и в качестве профилактики СПИДа. Уменьшает негативное влияние на человеческий организм стрессовых факторов;
- глицин. Нейромедиатор. Успокаивает;
- глутамин. Составляющая гемоглобина. Отвечает за стимуляцию метаболизма в ЦНС;
- глютаминовая кислота. Отвечает за регуляцию периферической нервной системы;
- пролин. Есть в составе протеинов. Например, в коллагене и эластине;
- серин. Аминокислота, которую можно найти в нейронах головного мозга. Облегчает выработку и высвобождение энергии. Возникает из глицина;
- тирозин. Из этой аминокислоты состоят, в том числе, растительные и животные ткани. В некоторых случаях восстанавливаются из фенилаланина;
- цистеин. Компонент кератина. Принадлежит к антиоксидантам. В отдельных случаях воспроизводится из серина.
Описанные функции кислот не являются полными и могут быть продолжены.
Незаменимые аминокислоты
Незаменимые аминокислоты — те, синтез которых человеческим организмом не предусмотрен.
Содержатся в отдельных продуктах и поступают в организм с приемом пищи.
В список аминокислот, которые в организме не вырабатываются, входят:
- валин. Повышает координацию функционирования мышц, обеспечивает устойчивость организма к изменениям температуры;
- изолейцин. Его еще называют естественным анаболиком. Отвечает за насыщение мышц необходимой энергией;
- лейцин. Отвечает за регуляцию всех процессов метаболизма. Важный участник процесса построения белковой структуры. Вместе с двумя описанными выше аминокислотами составляет комплекс BCAA (который отвечает за построение мышечной массы). Эта аминокислота, и комплекс в целом, важна для людей, занимающихся спортом. Она помогает увеличить мышечную массу, понизить уровень развития ПЖК (подкожно-жировая клетчатка), поддерживать гомеостаз при больших физнагрузках;
- лизин. Его наличие в организме влияет на улучшение регенерации тканей, выработку гормонов, антител и ферментов. Также немаловажную роль эта аминокислота играет в укреплении сосудов. Находится в составе коллагена;
- метионин. Принимает участи в синтезе холина. Сокращает количество жира в печени;
- треонин. Отвечает за укрепление сухожилий и эмали зубов;
- триптофан. Помогает в регуляции эмоционального состояния, лечении психических расстройств личности;
- фениалалнин. Принимает участие в регуляции деятельности кожных покровов путем снижения их пигментации. Восстанавливает водно-солевой баланс верхних слоев кожи.
Химические формулы аминокислот
Условная формула аминокислоты в общем виде:
Вот как выглядит структурная формула аминокислот:
Ниже представлено фото с названиями аминокислот и структурными формулами:
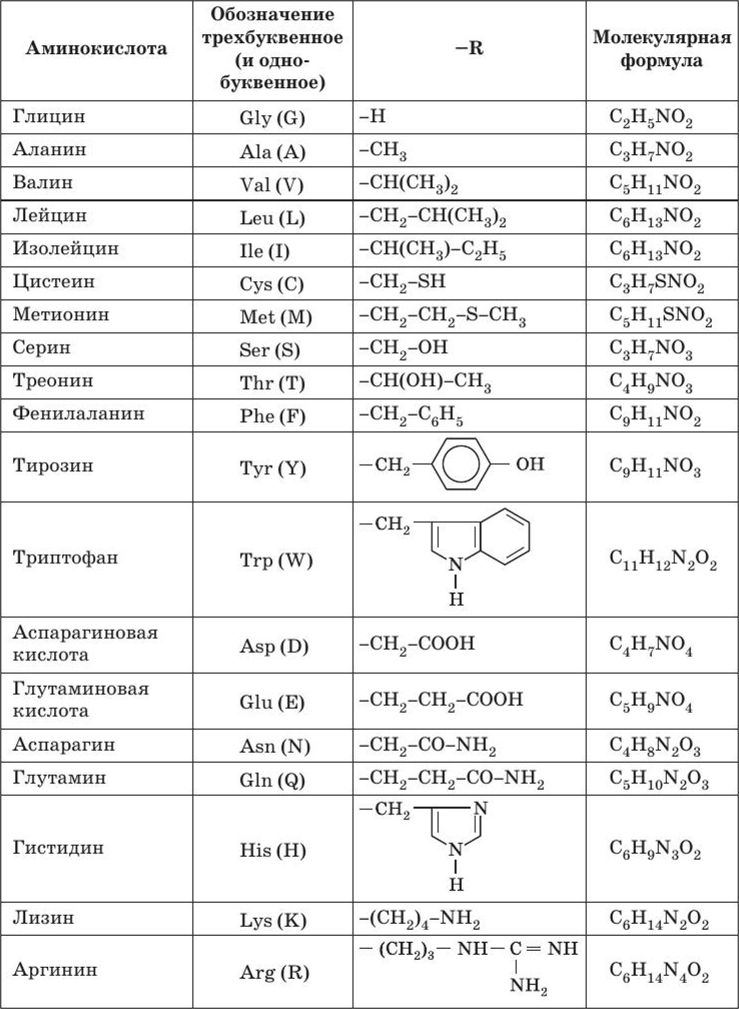
Вот еще список аминокислот с молекулярными формулами в виде таблицы:
Чем грозит нехватка или избыток аминокислот в организме
Большинство аминокислот связано с регуляцией метаболизма. Практически любая аминокислота обеспечивает организм нужным количеством энергии для реализации химических реакций. Эти реакции отвечают за важные функции: дыхание, когнитивную деятельность, регуляцию психоэмоционального состояния и др.
Согласно исследованиям ученых в области биохимии, аминокислот, которые содержались бы только в продуктах животного происхождения, не существует. К тому же, растительный белок усваивается организмом намного лучше животного. Однако стоит отметить, что веганы должны контролировать свой рацион тщательнее. И вот почему.
В 100 граммах мяса и 100 граммах бобов процентное соотношение АМК будет разным. По этой причине первое время количество аминокислот, потребляемых с пищей, нужно контролировать.
Негативно на организме сказывается голодание и диеты, связанные с концентрацией на какой-либо одной группе продуктов: баланс полезных веществ будет нарушен.
Если аминокислот в организме не хватает, это выражается:
- Плохим самочувствием.
- Плохим аппетитом.
- Высокой утомляемостью.
- Нарушением гомеостаза.
При этом стоит отметить, что проблемы с самочувствием наблюдаются даже если в организме есть недостаток хотя бы одной аминокислоты.
Но и избыток аминокислот сказывается на организме не лучшим образом: появляются симптомы, напоминающие пищевые отравления.
Если человек ведет здоровый образ жизни, то ему нет необходимости задумываться о том, как выучить все аминокислоты и всех ли аминокислот хватает в его организме: все 20 основных аминокислот поступают вместе с пищей. Исключение — спортсмены, для которых важно высокое содержание белка, необходимого для строительства мышечной массы.
Своевременная корректировка пищевых привычек и соблюдение мер при разработке рациона питания — важная составляющая здоровья. И об этом стоит помнить.
Преподаватель биологии и химии
Строение основных аминокислот: 20 «магических», входящих в состав белка. Структура. Классификации. Таблицы с формулами. Название и международные сокращения протеиногенных аминокислот. С вами я, Галина Баева, 20 «магических» аминокислот и красивые таблицы со структурными формулами природных аминокислот.
Природные аминокислоты — это структурные единицы (мономеры) белков. В состав белков входят всего 20 т.н. «магических» аминокислот, которые также называются протеиногенными. Все они имеют сходное строение.
Кроме протеиногенных аминокислот в организме присутствуют и непротеиногенные, которые выполняют различную работу, в основном это промежуточные соединения в биохимическом конвейере, как например, орнитин, сигнальные молекулы, как β-аланин или нейромедиаторы, как ГАМК.
Особенности строения природных аминокислот
Строение аминокислот тесно связано с их функциями. Сходные по химической структуре вещества делают сходную работу. Попробуем разобраться, чтобы потом не путаться в аннотациях к препаратам.
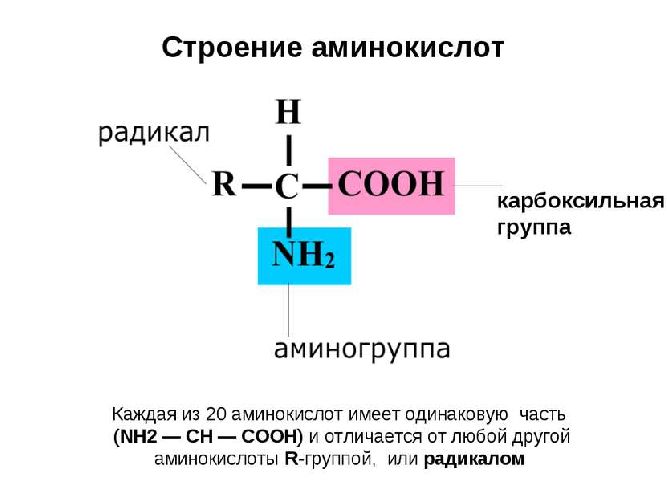
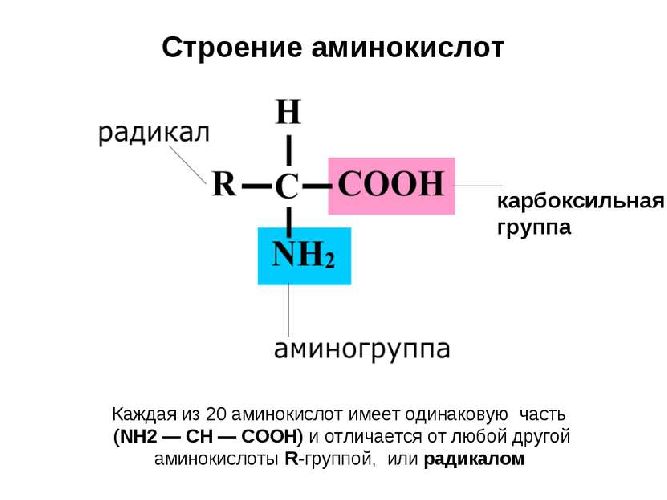
Все аминокислоты слеплены по одному лекалу.
Голова – аминный остаток, содержащий азот N.
Углеродный скелет, состоящий из цепочки атомов углерода (в простейшем случае – один углерод, к которому «спереди» прицеплен аминный остаток, а сзади – карбоновый хвост)
Хвост – остаток карбоновой кислоты – СООН
Сбоку к углеродному скелету может быть присоединена еще какая-нибудь химическая группировка, которая придает данному веществу особые свойства.
Углеродная цепочка вместе с кислотным хвостом, присоединенная к аминной голове, называется мудреным словом «алифатический радикал».
Номенклатура аминокислот
Углеродная цепочка (скелет) может состоять как из 1 атома углерода, так и из нескольких. В последнем случае имеет значение, к какому атому углерода, начиная счет от карбоксильной группы, присоединится аминная голова. Это может быть как 1-ый атом углерода, так и 2-ой, 3-ий и далее. Химики договорились обозначать атомы углерода не цифрами, а буквами греческого алфавита: α – 1-ый атом углерода, начиная с карбоксильного хвоста, β— 2-ой, γ — 3-й, и т.д.
Если аминогруппа присоединяется к углероду в α-положении, такую аминокислоту называют α-аминокислотой, соответственно, если аминогруппа присоединена в β-положении — то это β-аминокислота, если в γ — то γ -аминокислота.
Все 20 природных протеиногенных аминокислот относятся к группе α -аминокислот.
Из β — аминокислот наиболее известен β-аланин, а из γ-аминокислот наиболее известна γ-аминомасляная кислота (ГАМК). Их структурные формулы приведены ниже.
Таблица 1 Строение протеиногенных аминокислот
Таблица 2 Структурные формулы аминокислот
Таблица 3 Модели структурных формул аминокислот
Классификация аминокислот
Существует несколько классификаций аминокислот:
- В зависимости от строения алифатического радикала, аминокислоты подразделяются на следующие группы:
- Просто аминокислоты с алифатическим радикалом, т.е. такие, у которых углеродная цепочка не содержит дополнительных затей. Их называют МоноАминоМоноКарбоновые: глицин и аланин
- Аминокислоты с разветвленной боковой цепью, у которых углеродный скелет образует боковые вилки: валин, лейцин, изолейцин. Изолейцин по химическому составу не отличим от лейцина, но его углеродный скелет по-другому загнут, т.е. он является стереоизомером. Иногда его выделяют в отдельную аминокислоту, а иногда – нет. Аминокислоты с разветвленной боковой цепью тоже относятся к группе МоноАминоМоноКарбоновых аминокислот.
- Аминокислоты, у которых в алифатическом радикале имеются разные группировки:
Спиртовая – ОН. Их называют ОксиМоноАминоМоноКарбоновые: серин и треонин
Карбоксильная, т.е. второй кислотный хвост. Это МоноАминоДиКарбоновые аминокислоты: аспарагиновая кислота (аспартат) и глутаминовая кислота (глутамат). Их называют еще Кислые аминокислоты, этакое «масло масляное».
Амидная. Карбоксильный хвост отрастил себе вторую аминную голову: аспарагин и глутамин. Кажется, понятным, что это производные соответственно аспартата и глутамата. Их называют Амиды МоноАминоДиКарбоновых аминокислот
Аминная. Вторая аминная голова присоединилась к углеродному скелету: лизин
Гуанидиновая: дополнительные аминные вставки — аргинин
Лизин и Аргинин относят также к группе ДиАминоМоноКарбоновых аминокислот, ибо у них есть по второй аминной группе. Поскольку эти аминокислоты в нейтральной среде (вода, рН=7), проявляют щелочные (основные) свойства, повышая водородный показатель (рН становится › 7), то их относят к группе Основных аминокислот
Серосодержащие аминокислоты. Имеют в радикале атом серы S: цистеин, метионин
Аминокислоты, содержащие ароматический радикал– углеродное колечко или Ароматические аминокислоты фенилаланин, тирозин, триптофан
Аминокислоты с гетероциклическим радикалом – колечко с атомом азота вместо углерода, поэтому он «гетеро» — «разнообразный»: триптофан и гистидин.
Нетрудно заметить, что триптофан входит в группу как ароматических аминокислот, так и в группу аминокислот с гетероциклическим радикалом, а все потому, что у него есть как гетороциклический радикал, так и ароматический.
Иминокислоты – углеродный скелет не вытянут в цепочку, а замкнут в колечко, из которого торчат аминная голова и рядом кислотный хвост: пролин и оксипролин
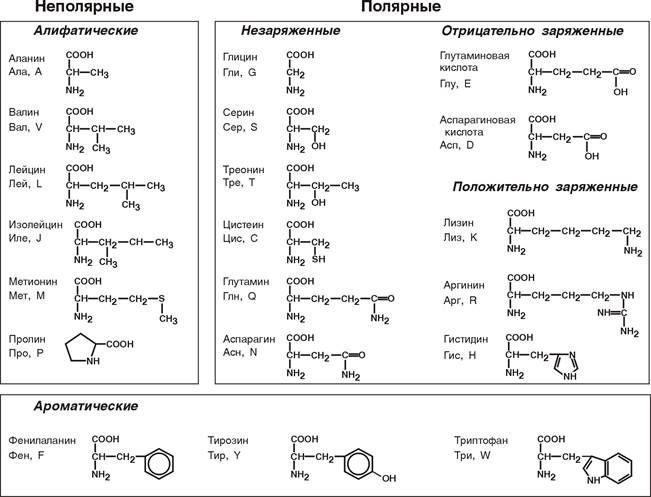
2. Классификация, в основу которой положена полярность алифатического радикала.
- Неполярные (гидрофобные) аминокислоты. Они имеют неполярные связи между атомами C-C, C-H. Это глицин, аланин, валин, лейцин, изолейцин, пролин, триптофан — 8 аминокислот
- Полярные незаряженные (гидрофильные) аминокислоты. Они имеют полярные связи между атомами С-О, C-N, O-H, S-H. Это серин, аспарагин, глутамин, треонин, метионин — 5 аминокислот
- Полярные отрицательно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН = 7) заряжены отрицательно, т.е. они выступают как отрицательно-заряженный ион (анион). Это аспарагиновая и глутаминовая кислоты, тирозин, цистеин — 4 аминокислоты
- Полярные положительно-заряженные аминокислоты. У них в радикале присутствуют группы, которые в водной среде (рН=7) заряжены положительно, т.е. они выступают как положительно-заряженный ион (катион). Это лизин, аргинин, гистидин — 3 аминокислоты.
Чем больше в белке аминокислот, обладающих полярностью, тем выше способность белка к химическим реакциям, т.е. его реактогенность. С реактогенностью белка непосредственно связаны его функции. Белки соединительной ткани, например кератин, входящий в состав волос и ногтей, имеет мало полярных аминокислот. Напротив, ферменты — белки-катализаторы биохимических реакций, обладают аминокислотным составом с множеством полярных групп.
3. Классификация по отношению к водородному показателю (рН)
- Аминокислоты, обладающие нейтральными свойствами с рН 5,97 – 6,02. Это глицин, аланин, серин, валин, лейцин, изолейцин,треонин, цистин, метионин — 9 аминокислот. Они имеют одну аминную голову и один карбоксильный хвост
- Аминокислоты, обладающие слабокислыми свойствами рН 3,0 – 5,7. Это аспарагиновая и глутаминовая кислоты. Они имеют одну аминную голову, но два карбоксильных хвоста, поэтому их называют «кислотами».
- Аминокислоты, обладающие щелочными свойствами с рН 9,7 – 10,7. У них две аминные головы и один карбоксильный хвост. Это лизин, аргинин, гистидин.
4. Классификация по способности к синтезу в организме человека и животных.
- Заменимые аминокислоты: глицин, серин, аланин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин
- Условно-заменимые аминокислоты: аргинин, гистидин, тирозин, цистеин
- Незаменимые аминокислоты: валин, лейцин, изолейцин, треонин, лизин, триптофан, фенилаланин, метионин
Подробнее о них рассказывается здесь: Аминокислоты заменимые и незаменимые: где взять.
5. Классификация аминокислот по путям биосинтеза.
В живых организмах аминокислоты могут производится (синтезироваться) из других соединений. Путь биосинтеза — это последовательность химических реакций, которые обусловлены наследственной (генетической) матрицей. Он записан в генетическом коде и обусловлен наличием ферментов, запускающих данные реакции. Биосинтез идет не хаотично, а количество исходных и промежуточных соединений ограничено. Так из всего многообразия природных аминокислот для синтеза белка используются только 20. Соответственно, исходные и промежуточные соединения на путях биосинтеза отдельных аминокислот образуют кластеры или семейства, где соединения могут преобразовываться друг в друга.
- Семейство аспартата: аспарагиновая кислота (аспартат), аспарагин, изолейцин, лизин, треонин, метионин
- Семейство глутамата: глутаминовая кислота (глутамат), глутамин, пролин, аргинин
- Семейство пирувата: аланин, валин, лейцин
- Семейство серина: серин, глицин, цистеин
- Семейство пентоз: гистидин, триптофан, фенилаланин, тирозин
- Семейство шикимата: триптофан, фенилаланин, тирозин
Надо сказать, что данные пути метаболизма реализуются в биологических системах, но не все они имеются в организме человека. Так высшие животные и человек не способны синтезировать ароматическое кольцо, поэтому путь шикимата — это не для нас. Аналогично с другими путями синтеза незаменимых аминокислот. Для наглядности незаменимые аминокислоты выделены жирным шрифтом.
6. Классификация аминокислот по путям катаболизма
Катаболизм — процесс распада, противоположен анаболизму или процессу синтеза. В организме катаболизм также обусловлен генетической программой и набором ферментов. Конечным итогом деградации аминокислот является аммиак, вода и углекислый газ, а также выделяется энергия в виде тепла или связанная в молекулах АТФ. В зависимости от промежуточных соединений, дающих энергию, аминокислоты подразделяются на следующие группы:
- Глюкогенные: дающие метаболиты (промежуточные соединения), из которых может быть синтезирована глюкоза: глицин, аланин, серин, треонин, валин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, пролин, аргинин, гистидин, цистин, метионин
- Кетогенные: распадающиеся до ацетоацетилКоА и ацетилКоА, из которых могут быть синтезированы кетонные тела: лизин, лейцин
- Промежуточные: при распаде этих аминокислот образуются метаболиты обоих типов: изолейцин, триптофан, фенилаланин, тирозин
Подробнее о глюкогенных и кетогенных аминокислотах можно прочитать здесь: Гликогенные аминокислоты
Правые и левые аминокислоты
В зависимости от прикрепления аминогруппы по отношению к карбоксильному хвосту в углеродной цепочке, аминокислоты могут быть «правыми» или «левыми», иначе говоря, их относят к D- или L- изомерам. Такие формы называют оптически активными, они не отличаются по химическому составу, но в пространстве относятся друг другу, как левая и правая рука.
В белковые молекулах присутствуют только L (левые) -изомеры аминокислот, правые (D) -изомеры могут обладать особыми свойствами и выступать как медиаторы, т.е. сигнальные молекулы, но чаще они образуют балласт. В обычных продуктах питания D-аминокислот практически нет. Они образуются при химическом синтезе и могут встречаться в искусственных протеинах, используемых в спортивном питании или в качестве биологически-активных добавок к пище. D-аминокислоты с трудом расщепляются ферментами, ибо они не физиологичны. В печени и почках содержится особый фермент — оксидаза D-аминокислот, предполагают, что она превращает нефизиологичные правые аминокислоты в физиологичные левые. Количество ее невелико, т.к. обычно в пище содержится очень мало D-аминокислот.
При химическом синтезе образуется равное количество D- и L- изомеров, но в синтезе белка участвуют аминокислоты только L – ряда. Это следует учитывать лицам, принимающим препараты аминокислот: L-аминокислоты будут существенно дороже из-за необходимости их выделения из смеси, но эффект от их применения будет существенно выше
Читайте далее о том, что делает в организме каждая аминокислота. Поверьте, им есть, чем заняться. С вами была Галина Батуро. Делитесь информацией в соц.сетях, оставляйте комментарии.
Аминокислоты: понятие, свойства
Определение
Аминокислоты – это кристаллические вещества с высокой температурой плавления и сладковатым вкусом. Они хорошо растворяются в воде, но плохо растворяются в органических растворителях. Аминогруппа обуславливает основные свойства аминокислот, карбоксильная группа – кислотные свойства.
Аминокислоты являются неотъемлемой частью процесса, связанного с биосинтезом белка.
Характерное свойство белка — это его способность к расщеплению на аминокислоты внутри пищеварительной системы в организме.
Количество основных пептидов в природе насчитывает около 200 наименований. Однако, для правильного построения биологической составляющей организма, необходимо только 20 самых основных из них.
Классификация аминокислот и их назначение
В биологии установлена основная классификация аминокислот, которая подразделяется на две группы:
- Заменимые группы аминокислот.
Определение
Аминокислоты, которые можно заменить – это четко выраженная группа аминокислот, которые попадают в организм путем употребления продуктов питания.
Так же они могут образоваться внутри организма человека и любых других веществ.
К заменимым аминокислотам относится следующие показатели:
- Аланин – это измеритель огромного количества белковой составляющей, участвует в процессе гликогенолиза, тем самым преобразовывая в глюкозу в печени человека. Является основным регулятором пищеварительных процессов в организме.
- Аргинин – это аминокислота, особенностью которой является процесс синтеза в организме взрослого человека. В организме ребенка она не образуется. Входит в состав процесса системы синтеза, который связан с гормональным ростом. Является единственным веществом в организме, которое имеет способность взаимодействовать с азотом. Оказывает существенное воздействие на рост мышечной массы, путем снижения массы жира в теле.
- Аспарагин – это составной пептид, который необходим для азотного обмена. Взаимодействуя с основными ферментами имеет способность отщеплять аммониак и преобразовываться в кислоту.
- Аспаргиновая кислота. Дает возможность для восстановления при нарушении работы, связанной с нервной системой и работой сердечно-сосудистой системы.
- Гистидин – необходим для лечения болезней, связанных с кишечником, а также для профилактического лечения при заболевании СПИДом. Является показателем снижения факторов, которые связаны с внешними воздействиями.
- Глицин. Необходим в первую очередь как компонент успокоительного действия. Иными словами, служит как нейромедиатор.
- Глутомин – это аминокислота, которая входит в состав гемоглобина. Активно стимулирует процесс обмена в центральной нервной системе человека.
- Глютаминовая кислота –это кислота, которая оказывает непосредственное воздействие на работу всей нервной системы.
- Пролин –это аминокислота, входящая в состав всех протеинов в организме, максимальное его количество содержится в эластине и коллагенах.
- Серин – это компонент аминокислот, который входит в состав нейронов головного мозга человека и отвечает частично за его работу. Способствует выработке и затрате энергии. Его образование происходит при помощи глицина.
- Тирозин, встречается в тканевых клетках животных и растений. Может преобразовываться из фенилаланина.
- Цистеин, главный компонент, который можно встретить в составе кератина. Включен в состав антиоксидантов, может образовываться из ксилина.
Нет времени решать самому?
Наши эксперты помогут!
- Незаменимые.
Определение
Незаменимые аминокислоты — это группа аминокислот, которые не обладают характерной особенностью синтеза в организме человека.
Организм способен получать данные аминокислоты, только через пищу в процессе потребления.
К незаменимым аминокислотам относятся следующие виды ферментов:
- Валин, является кислотой, повышающей координацию при активной работе мышечной части тела. Дает возможность нормализовать активную работу организма. Особенно это характерно для резких смен температуры воздуха.
- Изолейцин. Является естественным компонентом, который обогащает мышцы тела силой и энергией.
- Лейцин. Основной регулятор всех метаболических процессов, которые происходят в организме человека. Его функция заключается в строительстве структуры белка. Как и первые две аминокислоты относится к комплексу BCAA. Данные вещества оказывают существенное воздействие на повышение объема мышечной массы. Контролируют уровень содержания гомеостаза при высоких физических нагрузках.
- Лизин. Повышает скорость процесса регенерации тканей, образует необходимые организму гормоны, ферменты и разного вида антитела. Повышает прочность и надежность работы сосудов. Является составной частью коллагена.
- Метионин. Контролирует уровень жира в организме, тем самым уменьшает его содержание в печени.
- Треонин. Служит укрепляющим эффектом для сухожилий и благоприятно оказывает действие на зубную эмаль.
- Триптофан. Компонент регулирующий за психически-эмоциональное состояние человека. Оказывает значительное воздействие при лечении расстройств психики у человека.
- Фениалалнин. Регулятор правильной деятельности микрочастиц в коже человека. Значительно понижение или сводит до минимума пигментацию. Приводит в норму водно-солевой баланс для самых жизненно важных участков кожи.
Также, в некоторых случаях, возможно выделение третьей группы: условно заменимых аминокислот.
В зависимости от кислотно-основных свойств, которые основаны на строении радикала, аминокислоты принято разделять на четыре основные группы
- Неполярные или гидрофобные.
- Полярные незаряженные.
- Полярные, которые заряжены отражательными частицами, при pH=7.
- Полярные, положительно заряженные частицы при pH=7.
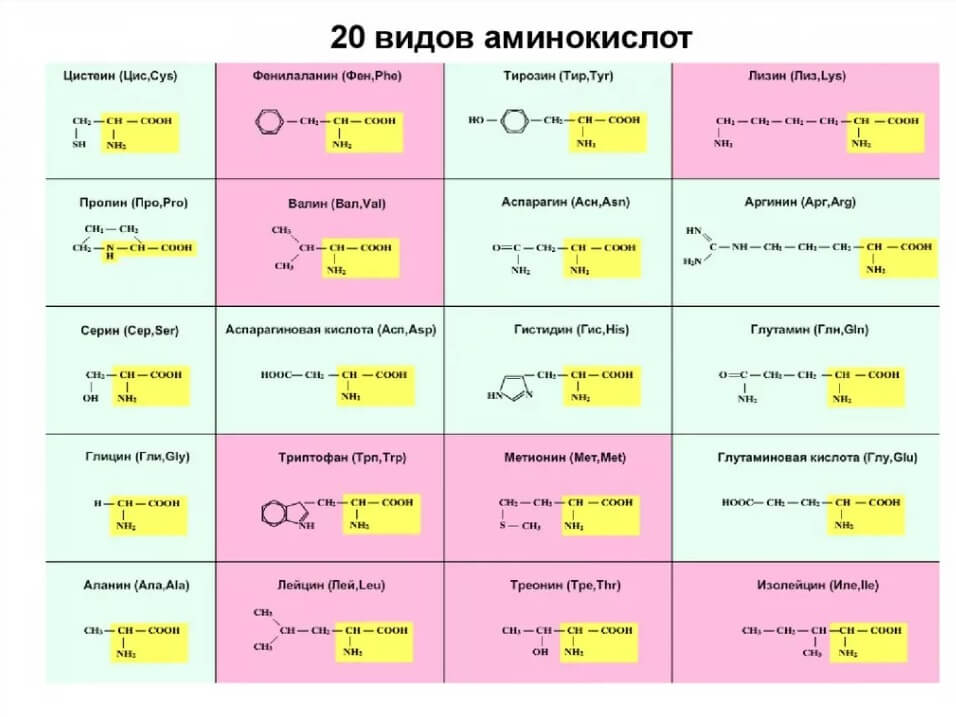
Структурные формулы и наименования аминокислот
Важнейшие аминокислоты, необходимы для правильной жизнедеятельности организма
| Наименование формулы | Научное химическое название | Аббревиатура или сокращенное название остатка аминокислоты |
| Алифатические | ||
|---|---|---|
| Н- | Глицин | Gly |
| СН3— | Аланин | Ala |
| (СН3)2СН- | Валин* | Val |
| (СН3)2СНСН2— | Лейцин* | Leu |
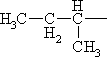 |
Изолейцин* | Ile |
| Содержащие основную группу OH компонентов. | ||
| НОСН2— | Серин | Ser |
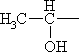 |
Треонин* | Thr |
| Имеющие в своем составе СООН группу | ||
| НООССН2— | Аспарагиновая кислота | Asp |
| НООССН2СН2— | Глутаминовая кислота | Glu |
| Имеющие в составе СОNH2 | ||
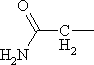 |
Аспарагин | Asn |
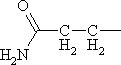 |
Глутамин | Gln |
| Содержащие NH2 | ||
| H2N(CH2)3CH2— | Лизин* | Lys |
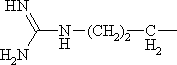 |
Аргинин | Arg |
| HSCH2— | Цистеин | Cys |
| СH3SСН2CH2— | Метионин* | Met |
| Акрилосодержашие | ||
| С6Н5СН2— | Фенилаланин* | Phe |
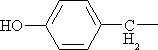 |
Тирозин | Tyr |
| Гиторилосодержащие аминокислоты | ||
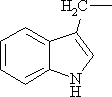 |
Триптофан* | Trp |
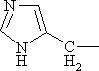 |
Гистидин | His |
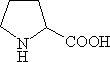 (полная формула) (полная формула) |
Пролин | Pro |
Избыток и недостаток аминокислот в организме
Большинство видов аминокислот оказывают существенное воздействие на метаболизм в организме человека. Благодаря аминокислотам в организм поступает необходимое количество энергии, позволяющая образовывать химические реакции, которые основаны на дыхательных способностях, психоэмоциональных качествах и многих других. Некоторые аминокислоты содержатся непосредственно только в продуктах питания.
Низкий уровень аминокислот в организме человека, может привести к следующим характерным симптомам:
- плохое самочувствие;
- отставшие аппетита и непереносимость пищи;
- высокий уровень утомляемости и низкая активность;
- нарушение гомеостаза;
- постоянная сонливость;
- нестабильное нервно-психическое состояние.
В случае, когда в организме низкий уровень хотя бы одной аминокислоты, может произойти существенное ухудшение здоровья.
Когда в организме перенасыщение аминокислот, то может произойти сбой работы. И у человека возникают симптомы, которые характерны в большей степени пищевому отравлению.
Для нормальной работы организма следует всегда тщательно следить за своим питание, контролировать уровень белка. Четко составлять и планировать свой рацион питания, включая в него все необходимые продукты, которые содержат важные для организма аминокислоты.
Аминокислоты

4
Средняя оценка: 4
Всего получено оценок: 839.
4
Средняя оценка: 4
Всего получено оценок: 839.
Органические вещества, в молекуле которых содержатся карбоксильные и аминные группы, называются аминокислотами или аминокарбоновыми кислотами. Это жизненно важные соединения, являющиеся основой построения живых организмов.
Строение
Аминокислота – мономер, состоящий из азота, водорода, углерода и кислорода. Также к аминокислоте могут присоединяться не углеводородные радикалы, например, сера или фосфор.
Условная общая формула аминокислот – NH2-R-COOH, где R – двухвалентный радикал. При этом аминогрупп в одной молекуле может быть несколько.
С химической точки зрения аминокислоты – производные карбоновых кислот, в молекуле которых атомы водорода заменены аминогруппами.
Виды
Аминокислоты классифицируются по нескольким признакам. Классификация по трём признакам представлена в таблице.
|
Признак |
Вид |
Описание |
Пример |
|
По расположению аминных и карбоксильных групп относительно друг друга |
α-аминокислоты |
Содержат один атом углерода между функциональными группами |
Аланин |
|
β-, γ-, δ-, ε- и другие аминокислоты |
Содержат несколько атомов углерода между функциональными группами |
β-аминопропионовая кислота (два атома между группами), ε-аминокапроновая кислота (пять атомов) |
|
|
По изменяемой части (радикалу) |
Алифатические (жирные) |
Не содержат ароматических связей. Бывают линейными и циклическими |
Лизин, серин, треонин, аргинин |
|
Ароматические |
Содержат бензольное кольцо |
Фенилаланин, триптофан, тирозин |
|
|
Гетероциклические |
Содержат гетероатом – радикал, не являющийся углеродом или водородом |
Триптофан, гистидин, пролин |
|
|
Иминокислоты |
Содержат иминогруппу NH |
Пролин, оксипролин |
|
|
По физико-химическим свойствам |
Неполярные (гидрофобные) |
Не взаимодействуют с водой |
Глицин, валин, лейцин, пролин |
|
Полярные (гидрофильные) |
Взаимодействуют с водой. Подразделяются на незаряженные, положительно и отрицательно заряженные |
Лизин, серин, аспартат, глутамат, глутамин |
Названия формируются из структурных или тривиальных наименований карбоновых кислот с приставкой «амино-». Цифры показывают, где располагается аминогруппа. Также используются тривиальные названия, заканчивающиеся на «-ин». Например, 2-аминобутановая или α-аминомасляная кислота.
Свойства
Аминокислоты отличаются физическими свойствами от других органических кислот. Все соединения класса – кристаллические вещества, хорошо растворимые в воде, но плохо растворимые в органических растворителях. Они плавятся при высоких температурах, имеют сладковатый вкус и легко образуют соли.
Аминокислоты являются амфотерными соединениями. Благодаря наличию карбоксильной группы -СООН проявляют свойства кислот. Аминогруппа -NH2 обуславливает основные свойства.
Химические свойства соединений:
- горение:
4NH2CH2COOH + 13O2 → 8CO2 + 10H2O + 2N2;
- гидролиз:
NH2CH2COOH + H2O ↔ NH3CH2COOH + OH;
- реакция с раствором щёлочи:
NH2CH2COOH + NaOH → NH2CH2COO-Na + H2O;
- реакция с раствором кислоты:
2NH2CH2COOH + H2SO4 → (NH3CH2COOH)2SO4;
- этерификация:
NH2CH2COOH + C2H5OH → NH2CH2COOC2H5 + H2O.
Из аминокислотных мономеров образуются длинные полимеры – белки. Один белок может включать несколько разных аминокислот. Например, содержащийся в молоке белок казеин состоит из тирозина, лизина, валина, пролина и ряда других аминокислот. В зависимости от строения белки выполняют различные функции в организме.
Что мы узнали?
Из урока химии 10 класса узнали, что такое аминокислоты, какие вещества содержат, как классифицируются. Аминокислоты включают две функциональные группы – аминогруппу -NH2 и карбоксильную группу -COOH. Наличие двух групп обуславливает амфотерность аминокислот: соединения обладают свойствами оснований и кислот. Аминокислоты делятся по нескольким признакам и отличаются количеством аминогрупп, наличием или отсутствием бензольного кольца, присутствием гетероатома, взаимодействием с водой.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 839.
А какая ваша оценка?
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O) и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде).
[1]
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
История[править | править код]
Большинство из около 500 известных аминокислот были открыты после 1953 года, в том числе во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречаются в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ[1].
Открытие аминокислот в составе белков[2][править | править код]
Жирным шрифтом выделены незаменимые аминокислоты.
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[3] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | 1877 | Пшеничная мука | Э. Шулце[4] |
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце[4], Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шёлка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[5], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и другие |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и другие |
Физические свойства[править | править код]
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Общие химические свойства[править | править код]
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (Хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH
N+H3 —CH2COO–
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Получение[править | править код]
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2 —CH2COOH + NH4Cl
Оптическая изомерия[править | править код]
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и только они включаются в состав белков, синтезируемых на рибосомах.
D-Аминокислоты в живых организмах[править | править код]
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[6], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счёт образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[7].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов[8]. Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[9].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин[10].
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты[править | править код]
Основная статья: Белки
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O)[11][12]. Это так называемые 21-я и 22-я аминокислоты[13].
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[14]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация[править | править код]
| Аминокислота | 3-буквы[15] | 1-буква[15] | аминокислот | мнемоническое
правило[16] |
Полярность[17] | радикалу | Mr | Vw
(Å3) |
pI | шкала гидрофобности[18] | частота в белках (%)[19] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75,067 | 48 | 6,06 | −0,4 | 7,03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89,094 | 67 | 6,01 | 1,8 | 8,76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117,148 | 105 | 6,00 | 4,2 | 6,73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131,175 | 124 | 6,05 | 4,5 | 5,49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131,175 | 124 | 6,01 | 3,8 | 9,68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6,30 | −1,6 | 5,02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105,093 | 73 | 5,68 | −0,8 | 7,14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119,119 | 93 | 5,60 | −0,7 | 5,53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Полярные | Серосодержащие | 121,154 | 86 | 5,05 | 2,5 | 1,38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149,208 | 124 | 5,74 | 1,9 | 2,32 |
| Аспарагиновая
кислота |
Asp | D | GAU, GAC | asparDic acid | Полярные | заряженные отрицательно | 133,104 | 91 | 2,85 | −3,5 | 5,49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132,119 | 96 | 5,41 | −3,5 | 3,93 |
| Глутаминовая
кислота |
Glu | E | GAA, GAG | gluEtamic acid | Полярные | заряженные отрицательно | 147,131 | 109 | 3,15 | −3,5 | 6,32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146,146 | 114 | 5,65 | −3,5 | 3,9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146,189 | 135 | 9,60 | −3,9 | 5,19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10,76 | −4,5 | 5,78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные
заряженные положительно |
Гетероциклические | 155,156 | 118 | 7,60 | −3,2 | 2,26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165,192 | 135 | 5,49 | 2,8 | 3,87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181,191 | 141 | 5,64 | −1,3 | 2,91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические,
Гетероциклические |
204,228 | 163 | 5,89 | −0,9 | 6,73 |
По радикалу[править | править код]
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[17]
По функциональным группам[править | править код]
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз[править | править код]
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза[править | править код]
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников[править | править код]
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных[править | править код]
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
- Глюкогенные — при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат
- Кетогенные — распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды
- Глюко-кетогенные — при распаде образуются метаболиты обоих типов
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты[править | править код]
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
Родственные соединения[править | править код]
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также называют аминокислотами:[источник не указан 612 дней]
- Таурин
Применение[править | править код]
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта[20].
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[21].
Примечания[править | править код]
- ↑ 1 2 Wagner I., Musso H. New Naturally Occurring Amino Acids (нем.) // Angewandte Chemie International Edition in English : magazin. — 1983. — November (Bd. 22, Nr. 11). — S. 816—828. — doi:10.1002/anie.198308161.
- ↑ S. Hansen. Entdeckung der Aminosäuren. — 2015.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ 1 2 Ernst Schulze (chemist) (англ.) // Wikipedia. — 2019-02-14.
- ↑ Карпов В. Л. От чего зависит судьба гена // Природа. — Наука, 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada. Aspartic acid racemization in tooth enamel from living humans (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1975. — Vol. 72, no. 8. — P. 2891—2894.
- ↑
CLOOS P; FLEDELIUS C.: Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (1 февраля 2000). Дата обращения: 5 сентября 2011. Архивировано 2 февраля 2012 года. - ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R—36R. — ISSN 0959-6658. Архивировано 20 августа 2018 года.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514—3526. — ISSN 1742-464X. — doi:10.1111/j.1742-4658.2008.06515.x. Архивировано 15 сентября 2018 года.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317—327. — ISSN 0950-382X. Архивировано 20 августа 2018 года.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) – General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1—13. — ISSN 0304-4165. — doi:10.1016/j.bbagen.2005.05.010. Архивировано 5 июля 2018 года.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706—712. — ISSN 1369-5274. — doi:10.1016/j.mib.2005.10.009. Архивировано 20 августа 2018 года.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29—35. — ISSN 1552-4450. — doi:10.1038/nchembio847. Архивировано 20 августа 2018 года.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — doi:10.1186/1745-6150-6-14. Архивировано 15 июня 2018 года.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил Архивная копия от 18 апреля 2018 на Wayback Machine
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157, вып. 1. — С. 105—132. — ISSN 0022-2836. Архивировано 6 июля 2018 года.
- ↑ Lukasz P. Kozlowski. Proteome-pI: proteome isoelectric point database // Nucleic Acids Research. — 2017-01-04. — Т. 45, вып. D1. — С. D1112—D1116. — ISSN 1362-4962. — doi:10.1093/nar/gkw978. Архивировано 2 июля 2018 года.
- ↑ Fumio Sanda, Takeshi Endo. Syntheses and functions of polymers based on amino acids (англ.) // Macromolecular Chemistry and Physics. — Vol. 200, iss. 12. — ISSN 1521-3935. — doi:10.1002/(sici)1521-3935(19991201)200:12%3C2651::aid-macp2651%3E3.0.co;2-p.
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
Литература[править | править код]
- Аминокислоты / Липкин В. М., Родионов И. Л. // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- Збарский И. Б., Симакова Р. А., Будковская Н. Г. Аминокислоты // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1974. — Т. 1 : А — Антибиоз. — 576 с. : ил.
- Эксперименты Миллера-Юри и обсуждения:
- Miller S. L. Production of amino acids under possible primitive earth conditions. Science, v. 117, May 15, 1953
- Miller S. L. and H. C. Urey. Organic compound synthesis on the primitive earth. Science, v. 130, July 31, 1959
- Miller Stanley L. and Leslie E. Orgel. The origins of life on the earth. Englewood Cliffs, NJ, Prentice-Hall, 1974.
- Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с.
- Аминокислоты, пептиды, белки. Под ред. Ю. В. Митина
- Аминокислоты // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки[править | править код]
- Аминокислоты в химии
- Н. С. Энтелис Аминоацил-тРНК-синтетазы: два класса ферментов // Соросовский образовательный журнал, 1998, № 9, с. 14-21