Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей.
Общая формула: CnH2n–6 при n ≥ 6.
Строение, номенклатура и изомерия ароматических углеводородов
Способы получения ароматических углеводородов
Химические свойства ароматических углеводородов
Строение аренов
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н.
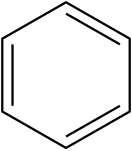
Структурная формула бензола:
Сокращенная структурная формула бензола:
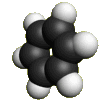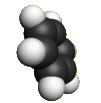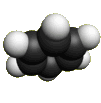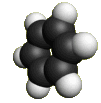
Каждый из шести атомов углерода в молекуле бензола находится в состоянии sp2-гибридизации.
Каждый атом углерода в молекуле бензола связан с двумя соседними атомами углерода и атомом водорода тремя σ-связями. Валентные углы равны 1200:
Атомы углерода и водорода в молекуле бензола, соединенные σ-связями, образуют правильный шестиугольник, в котором все атомы углерода и все σ-связи С–С и С–Н лежат в одной плоскости.
Негибридные р-орбитали атомов углерода образуют единую циклическую (ароматическую) π-систему – единое электронное облако над и под плоскостью кольца.
Соответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной (полуторная связь).
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
Поэтому структурную формулу бензола изображают в виде правильного шестиугольника и кружка внутри него, который обозначает делокализованные π-связи:
Гомологический ряд аренов
Простейший представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
Еще один представитель гомологического ряда бензола – этилбензол:
Изопропилбензол (кумол):
Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол:
Ближайший гомолог бензола – толуол (метилбензол):
При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше).
Например, 1,2-диметилбензол
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
- орто— (о-) если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения);
- мета— (м-) заместители расположены через один атом углерода (1,3-положения);
- пара— (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
Для названия многих производных бензола используют тривиальные названия:
| Структурная формула | Системное название | Тривиальное название |
 |
Метилбензол | Толуол |
 |
1,2-Диметилбензол | орто-Ксилол |
 |
Изопропилбензол | Кумол |
Названия радикалов, содержащих ароматическое кольцо:
Изомерия аренов
Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
- Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи.
Формуле С9Н12 соответствуют изомеры изопропилбензол и пропилбензол
- Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце.
Формуле С8Н10 соответствуют изомеры 1,3-диметилбензол, 1,2-диметилбензол и др.
Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов.
Для ароматических углеводородов характерны реакции:
- присоединения,
- замещения,
- окисления (для гомологов бензола).
Из-за наличия сопряженной π-электронной системы молекулы ароматических углеводородов вступают в реакции присоединения очень тяжело, только в жестких условиях — на свету или при сильном нагревании, как правило, по радикальному механизму
Бензольное кольцо представляет из себя скопление π-электронов, которое притягивает электрофилы. Поэтому для ароматических углеводородов характерны реакции электрофильного замещения атома водорода у бензольного кольца.
Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.
1. Реакции присоединения
Бензол присоединяет хлор на свету и водород при нагревании в присутствии катализатора.
1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан:
При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:
1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре, под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран).
Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C), то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце.
Например, при хлорировании толуола на свету образуется бензилхлорид
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, этилбензол реагирует с хлором на свету
2. Реакции замещения
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.).
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо.
Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения
Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»).
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
Серная кислота способствует образованию электрофила NO2+:
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
3. Окисление аренов
Бензол устойчив к действию даже сильных окислителей. Но гомологи бензола окисляются под действием сильных окислителей. Бензол и его гомологи горят.
3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C6H6 + 15O2 → 12CO2 + 6H2O + Q
Уравнение сгорания аренов в общем виде:
CnH2n–6 + (3n – 3)/2 O2 → nCO2 + (n – 3)H2O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.
3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода, соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:
Если окисление толуола идёт в нейтральном растворе при нагревании, то образуется соль бензойной кислоты – бензоат калия:
Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании.
При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.
Например, при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ
Например, при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат
Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты:
При окислении пропилбензола образуются бензойная и уксусная кислоты:
Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:
4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему.
Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).
Типы заместителей в бензольном кольце
| Заместители первого рода | Заместители второго рода |
| Дальнейшее замещение происходит преимущественно в орто— и пара-положение | Дальнейшее замещение происходит преимущественно в мета-положение |
| Электронодонорные, повышают электронную плотность в бензольном кольце | Электроноакцепторные, снижают электронную плотность в сопряженной системе. |
|
|
Например, толуол реагирует с хлором в присутствии катализатора с образованием смеси продуктов, в которой преимущественно содержатся орто-хлортолуол и пара-хлортолуол. Метильный радикал — заместитель первого рода.
В уравнении реакции в качестве продукта записывается либо орто-хлортолуол, либо пара-хлортолуол.
Например, при бромировании нитробензола в присутствии катализатора преимущественно образуется мета-бромнитробензол. Нитро-группа — заместитель второго рода
5. Особенности свойств стирола
Стирол (винилбензол, фенилэтилен) – это производное бензола, которое имеет в своем составе двойную связь в боковом заместителе.
Общая формула гомологического ряда стирола: CnH2n-8.
Молекула стирола содержит заместитель с кратной связью у бензольного кольца, поэтому стирол проявляет все свойства, характерные для алкенов – вступает в реакции присоединения, окисления, полимеризации.
Стирол присоединяет водород, кислород, галогены, галогеноводороды и воду в соответствии с правилом Марковникова.
Например, при гидратации стирола образуется спирт:
Стирол присоединяет бром при обычных условиях, то есть обесцвечивает бромную воду
При полимеризации стирола образуется полистирол:
Как и алкены, стирол окисляется водным раствором перманганата калия при обычных условиях. Обесцвечивание водного раствора перманганата калия — качественная реакция на стирол:
При жестком окислении стирола перманганатом калия в кислой среде (серная кислота) разрывается двойная связь и образуется бензойная кислота и углекислый газ:
При окислении стирола перманганатом калия в нейтральной среде при нагревании также разрывается двойная связь и образуется соль бензойной кислоты и карбонат:
Получение аренов
1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:
2. Дегидроциклизация алканов
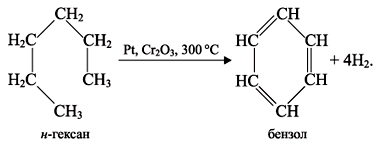
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола.
Например, при нагревании циклогексана в присутствии палладия образуется бензол и водород
Например, при нагревании метилциклогексана в присутствии палладия образуется толуол и водород
4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:
5. Алкилирование бензола и его гомологов
- Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
Например, бензол реагирует с хлорэтаном с образованием этилбензола
- Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
Например, бензол реагирует с этиленом с образованием этилбензола
Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола)
- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
Например, бензол реагирует с этанолом с образованием этилбензола и воды
6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.
При тримеризации пропина образуется 1,3,5-триметилбензол.
7. Получение стирола
Стирол можно получить дегидрированием этилбензола:
Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):
Ароматические углеводороды. Бензол, структурная формула, свойства и получение. Применение бензола и его гомологов
Ароматические
углеводороды, или арены, – это
соединения углерода с водородом, в
молекулах которых содержится бензольное
кольцо, или ядро, – циклическая группа
атомов углерода с особым характером
связей.
Простейшим
представителем аренов является бензол
C6H6.
Гомологический ряд бензола имеет общую
формулу CnH2n-6.
Первую
структурную формулу бензола предложил
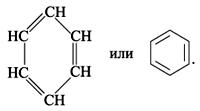
в 1865 г. немецкий химик Ф.А.Кекуле:
Атомы
С в молекуле бензола образуют правильный
плоский шестиугольник, хотя часто его
рисуют вытянутым.
Приведенная
формула правильно отражает равноценность
шести атомов С, однако не объясняет ряд
особых свойств бензола. Например,
несмотря на ненасыщенность, он не
проявляет склонности к реакциям
присоединения: не обесцвечивает бромную
воду и раствор перманганата калия, т.е.
ему не свойственны типичные для
непредельных соединений качественные
реакции.
В
структурной формуле Кекуле – три
одинарные и три двойные чередующиеся
углерод-углеродные связи. Но такое
изображение не передает истинного
строения молекулы. В действительности
углерод-углеродные связи в бензоле
равноценны. Это объясняется электронным
строением его молекулы.
Каждый
атом С в молекуле бензола находится в
состоянии sp2-гибридизации.
Он связан с двумя соседними атомами С
и атомом Н тремя
-связями.
В результате образуется плоский
шестиугольник, где все шесть атомов С
и все
-связи
С–С и С–Н лежат в одной плоскости (угол
между связями С–С равен 120o).
Третья p-орбиталь
атома углерода не участвует в гибридизации.
Она имеет форму гантели и ориентирована
перпендикулярно плоскости бензольного
кольца. Такие p-орбитали
соседних атомов С перекрываются над и
под плоскостью кольца. В результате
шесть p-электронов
(всех шести атомов С) образуют
общее
-электронное
облако и единую химическую связь для
всех атомов С.
-Электронное
облако обусловливает сокращение
расстояния между атомами С. В молекуле
бензола они одинаковы и равны 0,140 нм. В
случае простой и двойной связи эти
расстояния составили бы соответственно
0,154 и 0,134 нм. Значит, в молекуле бензола
нет чередования простых и двойных
связей, а существует особая связь –
“полуторная” – промежуточная между
простой и двойной, так
называемаяароматическая связь.
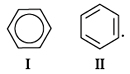
Чтобы показать равномерное распределение
p-электронного облака в молекуле бензола,
корректнее изображать ее в виде
правильного шестиугольника с окружностью
внутри (окружность символизирует
равноценность связей между атомами С)
(I). Однако часто пользуются и формулой
Кекуле с указанием двойных связей (II),
помня, однако, о ее недостатках:
Физические
свойства. Бензол –
бесцветная, летучая, огнеопасная жидкость
со своеобразным запахом. В воде практически
нерастворим, но служит хорошим
растворителем для многих органических
веществ. Горит сильно коптящим пламенем
(92,3 % массы приходится на углерод). Пары’
бензола с воздухом образуют взрывчатую
смесь. Жидкий бензол и пары’ бензола
ядовиты. Температура кипения бензола
80,1 °С. При охлаждении он легко застывает
в белую кристаллическую массу с
температурой плавления 5,5 °С.
Химические
свойства. Ядро
бензола обладает большой прочностью.
Этим и объясняется склонность аренов
к реакциям замещения. Они протекают
легче, чем у предельных углеводородов.
• Реакция замещения (ионный
механизм).
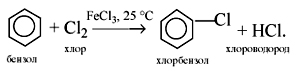
1) Галогенирование. Бензол
взаимодействует с бромом и хлором только
в присутствии катализаторов:
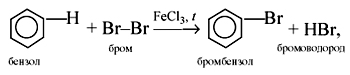
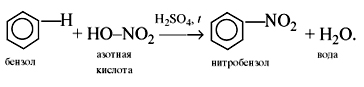
2) Нитрование. При
действии на бензол нитрующей смеси
(смесь концентрированных азотной и
серной кислот) атом водорода замещается
нитрогруппой NO2:
• Реакции присоединения к
бензолу приводят к разрушению ароматической
системы и требуют больших затрат энергии,
поэтому протекают только в жестких
условиях.
Бензол
не присоединяет галогеноводороды и
воду.
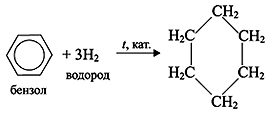
1) Гидрирование.
Бензол присоединяет водород при низкой
температуре в присутствии катализатора –
никеля или платины, образуя циклогексан:
2) Галогенирование. Бензол
при ультрафиолетовом облучении
присоединяет хлор, образуя
гексахлорциклогексан (гексахлоран):
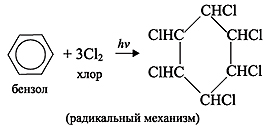
• Реакции окисления.
1)
Бензол очень устойчив к окислителям. В
отличие от непредельных углеводородов
он не обесцвечивает бромную воду и
раствор KMnO4.
2)
Бензол на воздухе горит коптящим
пламенем:
2C6H6 +
15O2
12CO2
+
6H2O.
Арены,
таким образом, могут вступать как в
реакции замещения, так и в реакции
присоединения, однако условия этих
превращений значительно отличаются от
аналогичных превращений предельных и
непредельных углеводородов. Эти реакции
бензола внешне схожи с реакциями алканов
и алкенов, но протекают по другим
механизмам.
Получение
бензола.
1)
Бензол получают из нефти и каменноугольной
смолы, образующейся при коксовании
каменного угля.
2)
Советский академик Николай Дмитриевич
Зелинский установил, что бензол образуется
из циклогексана (дегидрирование
циклоалканов):
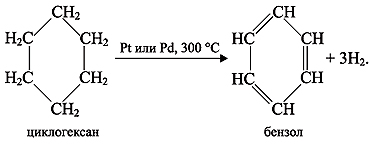
3)
При тех же условиях н-гексан
превращается в бензол (реакция
дегидроциклизации):
4)
Бензол можно получить тримеризацией
ацетилена (метод Н.Д.Зелинского и
Б.А.Казанского):
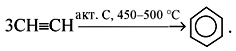
5)
Бензол получают при сплавлении солей
ароматических кислот со щелочью:
C6H5–COONa
+ NaOH —> C6H6 +
Na2CO3.
Применение
бензола и его гомологов.
Бензол C6H6 –
хороший растворитель. Бензол в качестве
добавки улучшает качество моторного
топлива. Служит сырьем для получения
многих ароматических органических
соединений – нитробензола
C6H5NO2(растворитель,
из него получают анилин), хлорбензола
C6H5Cl,
фенола C6H5OH,
стирола и т.д.
Толуол C6H5–CH3 –
растворитель, используется при
производстве красителей, лекарственных
и взрывчатых веществ (тротил (тол), или
2,4,6-тринитротолуол ТНТ).
Ксилолы C6H4(CH3)2.
Технический ксилол – смесь трех
изомеров (орто-, мета–
и пара-ксилолов) –
применяется в качестве растворителя и
исходного продукта для синтеза многих
органических соединений.
Изопропилбензол C6H5–CH(CH3)2 служит
для получения фенола и ацетона.
Хлорпроизводные
бензола используют
для защиты растений. Так, продукт
замещения в бензоле атомов Н атомами
хлора – гексахлорбензол С6Сl6 –
фунгицид; его применяют для сухого
протравливания семян пшеницы и ржи
против твердой головни. Продукт
присоединения хлора к бензолу –
гексахлорциклогексан (гексахлоран)
С6Н6Сl6 –
инсектицид; его используют для борьбы
с вредными насекомыми. Упомянутые
вещества относятся к пестицидам –
химическим средствам борьбы с
микроорганизмами, растениями и животными.
Стирол C6H5 –
CH = CH2 очень
легко полимеризуется, образуя полистирол,
а сополимеризуясь с бутадиеном –
бутадиенстирольные каучуки.
Л
е к ц и я 8.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
11.02.201549.6 Mб86Акаевский Анатомия.pdf
- #
- #
- #
- #
- #
- #
- #
- #
- #
| Бензол | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
бензол | |
| Сокращения | PhH | |
| Традиционные названия |
фен (Лоран, 1837), фениловый водород, бензен |
|
| Хим. формула | C6H6 | |
| Физические свойства | ||
| Состояние | жидкость | |
| Молярная масса | 78,11 г/моль | |
| Плотность | 0,8786 г/см³ | |
| Динамическая вязкость | 0,0652 Па·с | |
| Энергия ионизации | 9,24 ± 0,01 эВ | |
| Термические свойства | ||
| Температура | ||
| • плавления | 5,5 °C | |
| • кипения | 80,1 °C | |
| • вспышки | −11 °C | |
| • самовоспламенения | 562 °C | |
| Пределы взрываемости | 1,2 ± 0,1 об.% | |
| Энтальпия | ||
| • образования | 82 930 Дж/моль[1] и 49 080 Дж/моль[1] | |
| Давление пара | 75 ± 1 мм рт.ст. | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 0,073 г/100 мл | |
| Оптические свойства | ||
| Показатель преломления | 1,501 | |
| Классификация | ||
| Рег. номер CAS | 71-43-2 | |
| PubChem | 241 | |
| Рег. номер EINECS | 200-753-7 | |
| SMILES |
C1=CC=CC=C1 |
|
| InChI |
InChI=1S/C6H6/c1-2-4-6-5-3-1/h1-6H UHOVQNZJYSORNB-UHFFFAOYSA-N |
|
| RTECS | CY1400000 | |
| ChEBI | 16716 | |
| Номер ООН | 1114 | |
| ChemSpider | 236 | |
| Безопасность | ||
| Предельная концентрация | 5 мг/м3[2] | |
| ЛД50 | 28—100 мг/кг | |
| Токсичность | Высокотоксичен, особенно при пероральном приёме, сильный канцероген, мутаген, ирритант (раздражает кожу, опасен для органов зрения). | |
| Краткие характер. опасности (H) |
H225, H304, H315, H319, H340, H350, H372, H412 |
|
| Меры предостор. (P) |
P201, P210, P280, P308+P313, P370+P378, P403+P235 |
|
| Сигнальное слово | ОПАСНО! | |
| Пиктограммы СГС |
|
|
| NFPA 704 |
3 2 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Бензо́л (C6H6, PhH; редко употребляемые синонимы: бензе́н, фениловый водород) (циклогекса-1,3,5-триен, [6]-аннулен) — органическое химическое соединение, бесцветная жидкость со специфическим сладковатым запахом. Простейший ароматический углеводород. Широко применяется в промышленности, является исходным сырьём для производства лекарств, различных пластмасс, синтетической резины, красителей. Хотя бензол входит в состав сырой нефти, в промышленных масштабах он синтезируется из других её компонентов. Токсичен, канцерогенен[2]. Является контаминантом.
История[править | править код]
Впервые бензолсодержащие смеси, образующиеся в результате перегонки каменноугольной смолы, описал немецкий химик Иоганн Глаубер в книге Furni novi philosophici, опубликованной в 1651 году[3]. Бензол как индивидуальное вещество был описан Майклом Фарадеем, выделившим это вещество в 1825 году из конденсата светильного газа, получаемого коксованием угля. Вскоре, в 1833 году, получил бензол — при сухой перегонке кальциевой соли бензойной кислоты — и немецкий физико-химик Эйльгард Мичерлих. Именно после этого получения вещество стали называть бензолом.
К 1860-м годам было известно, что соотношение количества атомов углерода и атомов водорода в молекуле бензола аналогично таковому у ацетилена, и эмпирическая формула их — CnHn. Изучением бензола серьёзно занялся немецкий химик Фридрих Август Кекуле, которому в 1865 году и удалось предложить правильную — циклическую формулу этого соединения. Известна история о том, что Ф. Кекуле представлял в своём воображении бензол в виде змеи из шести атомов углерода[4]. Идея же о цикличности соединения пришла ему во сне, когда воображаемая змея укусила себя за хвост. Фридриху Кекуле удалось в то время наиболее полно описать свойства бензола.
Физические свойства[править | править код]
Бесцветная жидкость со своеобразным резким запахом. Температура плавления = 5,5 °C, температура кипения = 80,1 °C, плотность = 0,879 г/см³, молярная масса = 78,11 г/моль.
Подобно ненасыщенным углеводородам бензол горит сильно коптящим пламенем. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфиром, бензином и другими органическими растворителями, с водой образует азеотропную смесь с температурой кипения 69,25 °C (91 % бензола). Растворимость в воде 1,79 г/л (при 25 °C).
Химические свойства[править | править код]
Для бензола характерны реакции замещения — бензол реагирует с алкенами, хлоралканами, галогенами, азотной и серной кислотами. Реакции разрыва бензольного кольца проходят в жёстких условиях (температура, давление).
- Взаимодействие с алкенами (алкилирование), в результате реакции образуются гомологи бензола, например, этилбензол и кумол:
- Взаимодействие с хлором и бромом в присутствии катализатора с образованием хлорбензола (реакция электрофильного замещения):
- В отсутствие катализатора при нагревании или освещении идёт радикальная реакция присоединения с образованием смеси изомеров гексахлорциклогексана
- При взаимодействии бензола с бромом в растворе олеума образуется гексабромбензол:
- Взаимодействие с галогенопроизводными алканов (алкилирование бензола, реакция Фриделя — Крафтса) с образованием алкилбензолов:
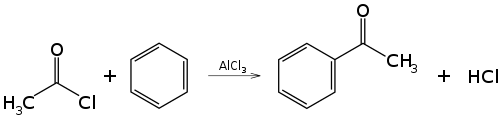
- Реакция ацилирования по Фриделю—Крафтсу, бензола ангидридами, галогенангидридами карбоновых кислот приводит к образованию ароматических и жирноароматических кетонов:
В первой и второй реакциях образуется ацетофенон (метилфенилкетон), замена хлорида алюминия на хлорид сурьмы V позволяет снизить температуру протекании реакции до 25° С.
В третьей реакции образуется бензофенон (дифенилкетон).
- Реакция формилирования — взаимодействие бензола со смесью СО и НСl, протекает при высоком давлении и под действием катализатора, продуктом реакции является бензальдегид:
- Реакции сульфирования и нитрования (электрофильное замещение):
- Восстановление бензола водородом (каталитическое гидрирование):
Реакции окисления[править | править код]
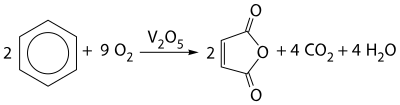
Бензол, вследствие своего строения, очень устойчив к окислению, на него не действует, например, раствор перманганата калия. Однако окисление до малеинового ангидрида можно провести при помощи катализатора оксида ванадия V:
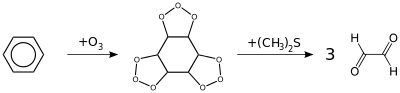
- Реакция озонолиза. Также бензол подвергается озонолизу, но процесс протекает медленнее, чем с непредельными углеводородами:
Результатом реакции является образование диальдегида — глиоксаля (1,2-этандиаля).
- Реакция горения. Горение бензола является предельным случаем окисления. Бензол легко воспламеняется и горит на воздухе сильно коптящим пламенем (содержит до 92 % углерода в молекуле):
Структура[править | править код]
Бензол по составу относится к ненасыщенным углеводородам (гомологический ряд CnH2n−6), но в отличие от углеводородов ряда этилена, C2H4, проявляет свойства, присущие ненасыщенным углеводородам (для них характерны реакции присоединения), только при жёстких условиях, а вот к реакциям замещения бензол более склонен. Такое «поведение» бензола объясняется его особым строением: нахождением атомов в одной плоскости и наличием в структуре сопряжённого 6π-электронного облака. Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углерода цикла.
В специальной и популярной литературе распространён термин бензольное кольцо, относящийся, как правило, к углеродной структуре бензола без учёта иных атомов и групп, связанных с атомами углерода. Бензольное кольцо входит в состав множества различных соединений.
Производство[править | править код]
На сегодняшний день существует несколько принципиально различных способов производства бензола.
- Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, составляет менее 10 %. Следует добавить, что бензол, получаемый из каменноугольной смолы, содержит значительное количество тиофена, что делает такой бензол сырьем, непригодным для ряда технологичных процессов.
- Каталитический риформинг (аромаизинг) бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40—60 % от общего количества вещества. В данном процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, его также частично перерабатывают в:
- бензол — методом гидродеалкилирования;
- смесь бензола и ксилолов — методом диспропорционирования.
- Пиролиз бензиновых и более тяжёлых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол, и ксилолы превращаются в бензол.
-
Получение бензола методом Реппе
Тримеризация ацетилена — при пропускании ацетилена при 400 °C над активированным углем с хорошим выходом образуется бензол и другие ароматические углеводороды: 3С2Н2 → С6H6. Получение бензола из ацетилена связывают с именем Марселена Бертло[5], работы которого были начаты в 1851 году. Однако продуктом реакции по методу Бертло, протекавшей при высокой температуре, являлась, кроме бензола, сложная смесь компонентов. Лишь в 1948 году В. Реппе удалось найти подходящий катализатор — никель — для снижения температуры реакции[6]. Полностью механизм реакции был описан только в 2020 году сотрудниками Института органической химии им. Н. Д. Зелинского РАН[7].
Применение[править | править код]
Значительную часть получаемого бензола используют для синтеза других продуктов:
- около 50 % бензола превращают в этилбензол (алкилирование бензола этиленом);
- около 25 % бензола превращают в кумол (алкилирование бензола пропиленом);
- приблизительно 10—15 % бензола гидрируют в циклогексан;
- около 10 % бензола расходуют на производство нитробензола;
- 2—3 % бензола превращают в линейные алкилбензолы;
- приблизительно 1 % бензола используется для синтеза хлорбензола.
В существенно меньших количествах бензол используют для синтеза некоторых других соединений. Изредка и в крайних случаях, ввиду высокой токсичности, бензол используют в качестве растворителя.
Кроме того, бензол входит в состав бензина. В 1920-х — 1930-х годах, бензол добавлялиrude в прямогонный бензин для повышения его октанового числа, но к 1940-м годам такие смеси не выдержали конкуренции с высокооктановыми бензинами. Ввиду высокой токсичности содержание бензола в топливе ограничено современными стандартами введением до 1 %.
Биологическое действие и токсикология[править | править код]
Бензол (C6H6) — опасный яд и является одним из самых распространённых ксенобиотиков антропогенного происхождения.
Бензол в больших концентрациях сильно ядовит. Согласно ГОСТ 12.1.005-88 и ГОСТ 12.1.007-76 он относится ко II классу опасности (вещества высокоопасного класса). Минимальная летальная доза при пероральном приёме составляет 15 мл, средняя 50—70 мл. При непродолжительном вдыхании паров бензола не возникает немедленного отравления, поэтому до недавнего времени порядок работ с бензолом особо не регламентировался.
В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Первым признаком отравления бензолом нередко бывает эйфория. Пары бензола могут проникать через неповрежденную кожу. Жидкий бензол довольно сильно раздражает кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными.
Бензол является сильным канцерогеном. Исследования показывают связь бензола с такими заболеваниями, как апластическая анемия, острые лейкозы (миелоидный, лимфобластный), хронический миелоидный лейкоз, миелодиспластический синдром и заболевания костного мозга[8][9].
Механизм трансформации и мутагенное воздействие бензола[править | править код]
Существует несколько вариантов механизма трансформации бензола в организме человека. В первом варианте происходит гидроксилирование молекулы бензола микросомальной системой окисления при участии цитохрома P450 (CYP). Согласно механизму, бензол окисляется сначала до высокореакционного эпоксида, который далее преобразуется в фенол. Помимо этого происходит генерация свободных радикалов (активные формы кислорода), вследствие высокой активации цитохрома Р450 по реакции:
Цит Р450 + NADPH + H– + O2→ Цит Р450 + NADP+ + HOOH.
HOOH → 2ОH·
C6H6 + 2ОH· → C6H5OH + Н2О.
Таким образом бензол проявляет радиомиметический эффект (эффект сходный с воздействием ионизирующего излучения).
Биотрансформация бензола, механизм I. Цифрами обозначены: 1 бензол, 2 бензолоксид, 3 эпоксибензол, 4 фенол, 5 пирокатехин, 6 гидрохинон.
Молекулярный механизм мутагенеза бензола[править | править код]
Бензол является промутагеном, мутагенные свойства он приобретает только после биотрансформации, в результате которой образуются соединения с высокой реакционной способностью. Одним из таких является эпоксид бензола. Вследствие высокого углового напряжения эпоксидного цикла происходит разрыв связей -С-О-С- и молекула становится электрофилом, она легко вступает в реакцию с нуклеофильными центрами азотистых оснований молекул нуклеиновых кислот, в особенности ДНК.
Механизм взаимодействия эпоксидного цикла с нуклеофильными центрами — аминогруппами азотистых оснований (реакция арилирования) — протекает как реакция нуклеофильного замещения SN2. В результате образуются довольно прочные ковалентно-связанные ДНК-аддукты, наиболее часто такие дериваты наблюдаются у гуанина (так, как молекула гуанина имеет максимальное количество нуклеофильных центров), например, N7-фенилгуанин. Образовавшиеся ДНК-аддукты могут приводить к изменению нативной структуры ДНК, тем самым нарушается правильное протекание процессов транскрипции и репликации, что является источником генетических мутаций. Накопление эпоксида в гепатоцитах (клетках печени) ведёт к необратимым последствиям: увеличению арилирования ДНК, а вместе с тем и к увеличению экспрессии (сверхэкспрессии) мутантных белков, являющихся продуктами генетической мутации; торможению апоптоза; трансформации клеток и даже гибели. Помимо яркой выраженной генотоксичности и мутагенности, бензол обладает сильной миелотоксичностью и канцерогенной активностью, особенно этот эффект проявляется в клетках миелоидной ткани (клетки данной ткани очень чувствительны к подобному роду воздействиям ксенобиотиков).
Бензол и токсикомания[править | править код]
Бензол оказывает на человека одурманивающее воздействие и может приводить к наркотической зависимости.
Острое отравление[править | править код]
При очень высоких концентрациях — почти мгновенная потеря сознания и смерть в течение нескольких минут. Окраска лица синюшная, слизистые оболочки часто вишнёво-красные. При меньших концентрациях — возбуждение, подобное алкогольному, затем сонливость, общая слабость, головокружение, тошнота, рвота, головная боль, потеря сознания. Наблюдаются также мышечные подёргивания, которые могут переходить в тонические судороги. Зрачки часто расширены, не реагируют на свет. Дыхание сначала учащено, затем замедлено. Температура тела резко снижается. Пульс учащенный, малого наполнения. Кровяное давление понижено. Известны случаи сильной сердечной аритмии.
После тяжёлых отравлений, которые не приводят непосредственно к смерти, иногда наблюдаются длительные расстройства здоровья: плевриты, катары верхних дыхательных путей, заболевания роговицы и сетчатки, поражения печени, сердечные расстройства и т. д. Описан случай вазомоторного невроза с отёком лица и конечностей, расстройствами чувствительности и судорогами через короткое время после острого отравления парами бензола. Иногда смерть наступает спустя некоторое время после отравления.
Хроническое отравление[править | править код]
В тяжёлых случаях наблюдаются: головные боли, чрезвычайная утомляемость, одышка, головокружение, слабость, нервность, сонливость или бессонница, расстройство пищеварения, тошнота, иногда рвота, отсутствие аппетита, учащение мочеиспускания, менструаций, нередко развиваются упорные кровотечения из слизистой оболочки рта, особенно дёсен, и носа, длящиеся часами и даже сутками. Иногда упорные кровотечения наблюдаются после удаления зуба. Многочисленные мелкие геморрагии (кровоизлияния) в коже. Кровь в испражнениях, маточные кровотечения, кровоизлияния в сетчатку. Обычно именно кровотечения, а часто и сопутствующая им лихорадка (температура до 40° и выше) приводят отравленных в больницу. В подобных случаях прогноз всегда серьёзен. Причиной смерти иногда являются вторичные инфекции: известны случаи гангренозного воспаления надкостницы и некроза челюсти, тяжёлых язвенных воспалений дёсен, общего сепсиса с септическим эндометритом.
Иногда при тяжёлых отравлениях развиваются симптомы нервных заболеваний: повышение сухожильных рефлексов, двусторонний клонус, положительный симптом Бабинского, расстройство глубокой чувствительности, псевдотабетические расстройства с парестезиями, атаксией, параплегией и двигательными нарушениями (признаки поражения задних столбов спинного мозга и пирамидных путей)[10].
Наиболее типичны изменения крови. Число эритроцитов обычно резко снижено, вплоть до 1—2 млн и ниже. Содержание гемоглобина также сильно падает, иногда до 10 %. Цветной показатель в части случаев низок, иногда близок к нормальному, а порой высок (особенно при сильной анемии). Отмечают анизоцитоз и пойкилоцитоз, базофильную пунктацию и появление ядерных эритроцитов, увеличение числа ретикулоцитов и объёма эритроцитов. Типичнее резкое уменьшение числа лейкоцитов. Иногда первоначально лейкоцитоз, быстро сменяющийся лейкопенией, ускорение СОЭ. Изменения со стороны крови развиваются не одновременно. Чаще всего раньше поражается лейкопоэтическая система, позже присоединяется тромбоцитопения. Поражение эритробластической функции часто наступает ещё позже. В дальнейшем может развиться характерная картина тяжёлого отравления — апластическая анемия.
Явления отравления могут сохраняться и даже прогрессировать через месяцы и годы после прекращения работы с бензолом.
Первая помощь при отравлении и лечение[править | править код]
При остром отравлении бензолом (парами бензола) пострадавшего необходимо в первую очередь вынести на свежий воздух, в случае остановки дыхания проводят искусственное дыхание до нормализованного, в качестве стимуляторов дыхания применяют кислород и лобелин. Применение адреналина в качестве аналептика категорически запрещено! При возникновении рвоты внутривенно 40 % раствор глюкозы, в случае нарушения кровообращения — инъекцию раствора кофеина. Если отравление произошло перорально и бензол попал в желудок, необходимо промыть его с помощью растительного масла (хорошо абсорбирует бензол), процедуру следует проводить с осторожностью, так как возможна аспирация. При лёгких отравлениях больному показан покой. При возбуждённых состояниях необходимы седативные средства. При возникновении анемии проводят переливания крови, витамин B12, фолиевая кислота, при лейкопении — витамин B6, пентоксил. В случае снижения иммунитета (иммунодефицитное состояние) — иммуностимуляторы.
Действие бензола на биомембраны[править | править код]
Биологические мембраны представляют собой надмолекулярные структуры — двойной липидный слой, в который интегрированы (встроены) или прикреплены на поверхности молекулы белков, полисахаридов. Липиды, входящие в состав биомембран по своей природе амфифильные (дифильные) соединения, то есть способные к растворению, как в полярных веществах, так и в неполярных, вследствие наличия у них полярных групп т. н. «голова» (карбоксильных -СООН, гидроксильных -ОН, аминогрупп -NH2 и других) и неполярных т. н. «хвосты» (углеводородные радикалы — алкилы, арилы, полициклические структуры типа холестана и другие).
Бензол является эффективным солюбилизатором биологических мембран, он быстро растворяет неполярные группы (т. н. углеводородные «хвосты») липидов, главным образом холестерина, входящего в состав мембран. Процесс солюбилизации лимитируется концентрацией бензола, чем его больше, тем быстрее протекает этот процесс. В процессе солюбилизации выделяется энергия, буквально, разрывающая двойной липидный слой (липидный бислой), что приводит к полной деструкции (разрушению структуры) мембраны и, последующему апоптозу клетки (в процессе деструкции биомембран происходит активация мембранных рецепторов (таких, как: CD95, TNFR1, DR3, DR4, и других), которые активируют апоптоз клетки).
Действие на кожу[править | править код]
Жидкий бензол обладает свойствами ирританта. При частом соприкосновении рук с бензолом наблюдаются сухость кожи, трещины, зуд, краснота (чаще между пальцами), отёчность, просовидные пузырьковые высыпи. Иногда из-за кожных поражений рабочие вынуждены бросать работу.
Действие на органы зрения[править | править код]
Жидкий бензол в небольших количествах (до 5 мл) при попадании на глаза, способен привести к деструкции роговицы и дальнейшему поражению оптической системы, включая хрусталик, стекловидное тело и сетчатку. При попадании большого количества бензола (более 5 мл) в глаза происходит полная потеря зрения вследствие глубокого поражения сетчатки и дегенерации зрительного нерва.
Безопасность[править | править код]
Работа с применением бензола сопряжена с риском отравления и серьёзного ухудшения здоровья. Бензол — легколетучая жидкость (летучесть 320 мг/л при 20 °С)[11] с высокой степенью воспламенения, поэтому при работе с ним необходимо соблюдать технику безопасности работ с легковоспламеняющимися жидкостями. Большую опасность представляют пары бензола, так как они могут образовывать взрывоопасные смеси с воздухом. В настоящее время применение бензола в качестве органического растворителя сильно ограничено, ввиду токсичности и канцерогенного воздействия его паров и негативном воздействии на кожу. Работа с бензолом в лабораториях также предусматривает его ограничение (строго регламентирована). Бензол рекомендуется использовать в экспериментах лишь в небольших объёмах (не более 50 мл), работа должна проводиться исключительно в перчатках из фторкаучука (латекс растворяется и набухает при воздействии на него бензолом).
Категорически запрещается:
- хранить вблизи источников тепла, открытого огня, сильных окислителей, пищевых продуктов, и так далее,
- оставлять в открытом виде тару, содержащую бензол, курить,
- использовать тару из-под бензола для пищевого применения, мытья рук, посуды,
- производить работу в закрытом, плохо вентилируемом помещении с температурой воздуха больше 30°С,
- использовать большой объём вещества в качестве растворителя,
- работать без средств защиты кожи рук, глаз и органов дыхания.
ПДК в воздухе составляет 5 мг/м3 (среднесменная за 8 часов)[2].
Охрана труда[править | править код]
В России ПДК бензола в воздухе рабочей зоны установлена[2] равной 5 мг/м3 (среднесменная за 8 часов) и 15 мг/м3 (максимально-разовая). Однако по данным ряда исследований, порог восприятия запаха этого вещества может быть гораздо выше ПДКрз. Например, среднее значение порога в исследовании[12] было в ~ 100 раз выше среднесменной ПДКрз, и в ~ 30 раз выше максимально-разовой ПДКрз. А у части людей порог был значительно выше среднего значения. Поэтому можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию паров бензола на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от бензола следует использовать значительно более эффективные изменение технологии и средства коллективной защиты.
Экология[править | править код]
Бензол – экологически небезопасное вещество, токсикант антропогенного происхождения. Основными источниками бензола, поступающего в окружающую среду со сточными водами или выбросами в атмосферу, являются нефтехимические и коксохимические промышленные предприятия, производство топлива и транспорт.
Из водоёмов бензол легко улетучивается, способен к трансформации из почв в растения, что несёт серьёзную угрозу экосистемам.
Бензол обладает свойством кумуляции, вследствие своей липофильности он способен депонироваться в клетках жировой ткани животных, тем самым отравляя их.
Символы[править | править код]
| Символ | Юникод | Название |
|---|---|---|
| ⌬ | U+232C | benzene ring |
| ⏣ | U+23E3 | benzene ring with circle |
Примечания[править | править код]
- ↑ 1 2 Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics (англ.) // Journal of Chemical Education — ACS, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
- ↑ 1 2 3 4 (Роспотребнадзор). № 275 // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 23. — 170 с. — (Санитарные правила). Архивная копия от 12 июня 2020 на Wayback Machine
- ↑ Furni novi philosophici, sive Descriptio artis distillatoriæ novæ per Joannem Rudolphum Glauberum. Amsterodam, 1651 // OpenLibrary.org. Дата обращения: 8 декабря 2011. Архивировано 13 марта 2016 года.
- ↑ Серия «100 великих», Дмитрий Самин, 100 великих научных открытий, Основы мироздания, Бензол. Дата обращения: 5 ноября 2011. Архивировано 22 марта 2012 года.
- ↑ Helmut Fiege, P.J. Garratt, Christ. J. Grundmann, Gundermann, Wolfgang Loeser, Peter Müller, Heidi Müller-Dolezal, Peter L. Pauson, Renate Stoltz, Hanna Söll, M. Zander Houben-Weyl Methods of Organic Chemistry Vol. V/2b, 4th Edition: Arenes and Arynes, Издание четвёртое, Georg Thieme Verlag, 2014, ISBN 3-13-179974-9, 9783131799746
- ↑ Reppe, W.; Schweckendiek, W. Cyclisierende Polymerisation von Acetylen. III Benzol, Benzolderivate und hydroaromatische Verbindungen (нем.) // Justus Liebig’s Annalen der Chemie (нем.) (рус. : magazin. — 1948. — Bd. 560. — S. 104. — doi:10.1002/jlac.19485600104.
- ↑ Самойлова, Н. Российские химики полностью расшифровали механизм реакции получения бензола из ацетилена : [арх. 9 апреля 2020] / Наталия Самойлова // Элементы. — 2020. — 9 апреля.
- ↑ Kasper, Dennis L.et al. (2004) Harrison’s Principles of Internal Medicine, 16th ed., McGraw-Hill Professional, p. 618, ISBN 0-07-140235-7.
- ↑ Smith, Martyn T. Advances in understanding benzene health effects and susceptibility (англ.) // Ann Rev Pub Health : journal. — 2010. — Vol. 31. — P. 133—148. — doi:10.1146/annurev.publhealth.012809.103646.
- ↑ Розенцвит Г. Э. Клиника профессиональных нейротоксикозов. Л,, 1964, 18 с.
- ↑ Кушелев В. П., Орлов Г. Г., Сорокин Ю. Г. Охрана труда в нефтеперерабатывающей и нефтехимической промышленности. — М.: Химия, 1983. — С. 42. — 472 с.
- ↑ F. Nowell Jones. An Olfactometer Permitting Stimulus Specification in Molar Terms (англ.) // University of Illinois Press https://www.jstor.org/stable/1418083 The American Journal of Psychology. — Champaign, Illinois (USA), 1954. — March (vol. 67 (iss. 1). — P. 147—151. — ISSN 0002-9556. — doi:10.2307/1418083. Архивировано 24 октября 2019 года.
Литература[править | править код]
- Бензол // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- Бензол // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Энциклопедический словарь юного химика / Сост. В. А. Крицман, В. В. Станцо. — Педагогика. — М., 1982. — 368 с.
- О. С. Габриелян, И. Г. Остроумов. Настольная книга учителя химии 10 класс. — М.: Дрофа, 2010.
- Омельяненко Л. М. и Сенкевич Н. А. Клиника и профилактика отравлений бензолом. — М., 1957.
Существуют соединения углерода с водородом, в молекулах которых атомы углерода соединяются друг с другом в замкнутые циклы. Это циклические углеводороды.
Особую группу среди циклических составляют ароматические соединения. Общая формула ароматических углеводородов —
CnH2n−6
. Простейший представитель — бензол.
Молекулярная формула бензола —
C6H6
. Структурную формулу бензола можно изобразить следующим образом:

Сокращённые структурные формулы:

Более точно отражает строение бензола последняя формула, так как в его молекуле отсутствуют двойные связи, а образуется особый вид ковалентной связи — шестиэлектронная система, изображённая в виде кольца внутри шестиугольного цикла.
Используют также скелетные формулы бензола, в которых не указаны атомы углерода:

Бензол — прозрачная жидкость с характерным запахом. Относится к ядовитым соединениям.
В отличие от ненасыщенных углеводородов, бензолу характерны реакции замещения. Он вступает в реакцию с бромом (или хлором) в присутствии катализатора. При этом образуются бромбензол и бромоводород:
C6H6+Br2⟶FeBr3C6H5Br+HBr
Как и все углеводороды, бензол горит на воздухе:
2C6H6+15O2→12CO2+6H2O
Бензол и его гомологи входят в состав нефти и используются в промышленности для синтеза красителей, взрывчатых веществ, полимеров.
План урока:
Определение и формула аренов
Строение молекулы бензола
Изомерия и номенклатура аренов
Методы получения аренов
Физические свойства ароматических соединений
Химические реакции ароматических углеводородов
Области применения аренов
Определение и формула аренов
Арены (ароматические углеводороды) – соединения, включающие устойчивый цикл из шести атомов углерода (бензольное кольцо). Важнейший представитель – бензол.
Общая формула ароматических углеводородов: CnH2n-6
Молекула бензола.
Строение молекулы бензола
Бензол – первый представитель гомологического ряда ароматических углеводородов, открытый в 1825 году Майклом Фарадеем. Т.к. его молекулярная формула – С6Н6, значит, в основе лежат двойные связи. Поэтому было предположено, что бензолу свойственна ненасыщенность. В 1865 году Фридрих Кекуле предположил структурную формулу бензола.
Но в экспериментах было доказано, что бензол входит в реакции присоединения только в жестких условиях и устойчив к реакциям окисления. Для него наиболее свойственно замещение, что доказывает принадлежность к предельным соединениям.
Парадоксальное электронное строение было доказано с помощью получения бензола из ацетилена. Его особенность заключается в том, что все атомы в кольце равноценны и имеют характер одинарных и кратных связей. Это можно отразить формулой с равномерным распределением электронной плотности.
Углеродные атомы в кольце имеют по четыре валентных электрона и им свойственна sp2-гибридизация. Атомы располагаются в единой плоскости. Особенности строения бензола состоят в том, что электроны составляют единую π-систему и все связи равноценны. Т.е. формула Кекуле неточна, т.к. отражает наличие двойных связей. Бензольное кольцо – это циклическая сопряженная система, связи которой перекрываются между собой.
Пространственное строение бензола Источник
Изомерия и номенклатура аренов
Для бензола и его гомологов характерна только структурная изомерия, которая включает:
- изомерию углеродного скелета боковой цепи,
- изомерию положения заместителей в кольце.
Источник
Главной цепью в названии аренов принимается ароматическое кольцо, от которого отходят заместители. В следующем представителе гомологического ряда ксилоле (диметилбензоле) имеет значение положение заместителей в кольце. Для его обозначения используются различные приставки:
- орто- (о-) – заместители находятся у соседних углеродных атомов в кольце,
- мета- (м-) – заместители находятся через один атом,
- пара- (п-) – заместители находятся через два атома.
Методы получения аренов
В промышленности бензол и его гомологи можно получить несколькими способами.
- Из каменноугольной смолы.
- Дегидрирование и циклизация алканов при катализаторе и под действием высоких температур.
- Дегидрирование циклоалканов при катализаторе и под действием высоких температур
В лаборатории моноциклические соединения также получают несколькими путями.
- Циклотримеризация ацетилена и его гомологов при катализаторе и под действием высоких температур (реакция получения бензола)
- Реакция Вюрца-Фиттига – взаимодействие галогеналканов и арилгалогенидов с металлическим натрием
- Алкилирование галогеналканами, алкенами и спиртами в присутствии кислот Льюиса
Физические свойства ароматических соединений
Бензол и его ближайшие гомологи – бесцветные жидкости с характерным запахом. Нерастворимы в воде, но растворимы в органических растворителях. Их плотность меньше плотности воды. Они огнеопасны и токсичны для животных и человека.
Химические реакции ароматических углеводородов
Несмотря на то, что бензол включает систему из сопряженных кратных связей, аренам не характерны реакции обесцвечивания бромной воды и перманганата калия.
Реакции присоединения
Бензолу характерны реакции присоединения, образуя циклогексан или его производные.
Реакции замещения
Аренам характерны реакции замещения.
Окисление аренов
При неполной химической реакции окисления гомологи бензола образуется бензойная кислота. Самому бензолу реакции окисления перманганатом калия не характерны.
Полимеризация аренов
В реакции полимеризации способен вступать стирол, образуя полистирол.
Области применения аренов
Без бензола и его гомологов невозможно представить современное промышленное производство. Основные области применения бензола – производство этилбензола, кумола и циклогексана и анилина.





























































![{displaystyle {mathsf {C_{6}H_{6}+H_{2}C=CH_{2}{xrightarrow[{}]{AlCl_{3}*HCl}}C_{6}H_{5}CH_{2}CH_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3f61f139eb31a72d2326c147249a7b908c2ac6a)
![{displaystyle {mathsf {C_{6}H_{6}+CH_{2}=CH-CH_{3}{xrightarrow[{}]{AlCl_{3}*HCl}}C_{6}H_{5}CH(CH_{3})_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4f081cd141db22599728e1b240c5ec7ab6baa565)
![{mathsf {C_{6}H_{6}+Cl_{2}{xrightarrow[ {}]{FeCl_{3}}}C_{6}H_{5}Cl+HCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d48ae47e593005848b4abfd855049b67f6f5ea50)
![{mathsf {C_{6}H_{6}+3Cl_{2}{xrightarrow[ {}]{T,hnu }}C_{6}H_{6}Cl_{6}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9d2fca06a46bc66d3ec45fca4c8b05fadc9ba77)
![{displaystyle {mathsf {C_{6}H_{6}+6Br_{2}{xrightarrow[{}]{H_{2}SO_{4}*SO_{3}}}C_{6}Br_{6}+6HBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aa58709f8d9ac9ddc486511a31790493ba04ac76)

![{displaystyle {mathsf {C_{6}H_{6}+(CH_{3}CO)_{2}O{xrightarrow[{}]{AlCl_{3}}}C_{6}H_{5}COCH_{3}+CH_{3}COOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5ec9b3daf42ffc4dcae8dbab7396c44b330c1aa5)
![{displaystyle {mathsf {C_{6}H_{6}+C_{6}H_{5}COCl{xrightarrow[{}]{AlCl_{3}}}C_{6}H_{5}COC_{6}H_{5}+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2182024b1f4e61dfb52a2ef863d78d62105fb28a)
![{displaystyle {mathsf {C_{6}H_{6}+CO+HCl{xrightarrow[{}]{AlCl_{3}}}C_{6}H_{5}COH+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1782d8565b8315504f780c576b6f91502454da79)
![{mathsf {C_{6}H_{6}+HNO_{3}{xrightarrow[ {}]{H_{2}SO_{4}}}C_{6}H_{5}NO_{2}+H_{2}O}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ce592053321be27ccfa295dc0a41142fe6d5b4f6)

![{displaystyle {mathsf {C_{6}H_{6}+3H_{2}{xrightarrow[{}]{Ni/Pd,Pt;t}}C_{6}H_{12}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/75c5a8c023361508ed63180efe6ded5d48b3acc7)