Бутан C4H10 – это предельный углеводород, содержащий четыре атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд бутана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение бутана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:
При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:
При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:
Это соответствует тетраэдрическому строению.
Например, в молекуле бутана C4H10 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение.
Изомерия бутана
Структурная изомерия
Для бутана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Для н-бутана (алкана с линейной цепью) существует изомер с разветвленным углеродным скелетом – изобутан
Для бутана не характерна пространственная изомерия.
Химические свойства бутана
Бутан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для бутана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для бутана характерны радикальные реакции.
Бутан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Бутан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании бутана образуется смесь хлорпроизводных.
CH3-CH2-CH2-CH3 + Cl2 → CH3-CH2-CH2-CH2Cl + HCl
CH3-CH2-CH2-CH3 + Cl2 → CH3-CH2-CHCl-CH3 + HCl
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
CH3-CH2-CH2-CH3 + Br2 → CH3-CH2-CHBr-CH3 + HBr
Хлорбутан может взаимодействовать с хлором и дальше с образованием дихлорбутана, трихлорбутана, тетрахлорбутана и т.д.
1.2. Нитрование бутана
Бутан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в бутане замещается на нитрогруппу NO2.
Например. При нитровании бутана образуется преимущественно 2-нитробутана:
CH3-CH2-CH2-CH3 + HNO3 → CH3-CH2-CHNO2-CH3 + H2O
2. Дегидрирование бутана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании бутана преимущественно образуются бутен-2 (бутилен) или бутин-2.
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
3. Окисление бутана
Бутан– слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение
Бутан горит с образованием углекислого газа и воды. Реакция горения пропана сопровождается выделением большого количества теплоты.
2C4H10 + 13O2 → 8CO2 + 10H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении бутана в недостатке кислорода может образоваться угарный газ СО или сажа С.
3.2. Каталитическое окисление
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
4. Изомеризация бутана
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Получение бутана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения бутана. При этом происходит удвоение углеродного скелета.
Хлорэтан взаимодействует с натрием с образованием бутана:
2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na2CO3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
При взаимодействии пентаноата натрия с гидроксидом натрия при сплавлении образуются бутан и карбонат натрия:
CH3–CH2–CH2–CH2–COONa + NaOH → CH3–CH2–CH2–CH3 + Na2CO3
3. Гидрирование алкенов и алкинов
Бутан можно получить из бутилена или бутина:
При гидрировании бутена-1 или бутена-2 образуется бутан:
CH2=CH-CH2-CH3 + H2 → CH3-CH2-CH2-CH3
CH3-CH=CH-CH3 + H2 → CH3-CH2-CH2-CH3
При полном гидрировании бутадиена-1,3 также образуется бутан:
CH2=CH-CH=CH2 + 2H2 → CH3-CH2-CH2-CH3
4. Синтез Фишера-Тропша
Из синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды:
nCO + (3n+1)H2 = CnH2n+2 + nH2O
Это промышленный процесс получения алканов.
Из угарного газа и водорода можно получить бутан:
4CO + 9H2 = C4H10 + 4H2O
5. Получение бутана в промышленности
В промышленности бутан получают из нефти, каменного угля, природного и попутного газа. При переработке нефти используют ректификацию, крекинг и другие способы.
- Справочник
- Справочник структурных формул
- б
- Бутан
Бутан
CH3-CH2-CH2-CH3
CH3-(CH2)2-CH3
//
H-C-C-C-C-H; H|#2|H; H|#3|H; H|#4|H; H|#5|H
H3C//CH3
HC/CC/CH; $slope(60)H/#2H; H#3/H; H/#4H; H#5/H
Брутто-формула: C4H10
Молекулярная масса: 58.124
Химический состав
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод (Carbon) | 12.011 | 4 | 82.7% |
| H | Водород (Hydrogen) | 1.008 | 10 | 17.3% |
Синонимы
- Бутан(IUPAC)
- Butane
- n-butane
Входит в группы
Алканы
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 апреля 2022 года; проверки требуют 9 правок.
У этого термина существуют и другие значения, см. Бутан (значения).
| Бутан | ||
|---|---|---|
|
||
| Общие | ||
| Хим. формула | C4H10 | |
| Физические свойства | ||
| Молярная масса | 58,12 г/моль | |
| Плотность |
газ (при 0 °C) 2558 (нормальные условия) кг/м³[1] 0,6010 г/см³ |
|
| Энергия ионизации | 1,7E−18 Дж | |
| Термические свойства | ||
| Температура | ||
| • плавления | −138,4 °C | |
| • кипения | −0,5 °C | |
| • вспышки | −76 ℉[2] и −60 °C[2] | |
| • самовоспламенения | 372 °C | |
| Пределы взрываемости | 1,6 об.% | |
| Энтальпия | ||
| • сгорания |
124 МДж/м³ 47,9 МДж/кг[1] 2778 кДж/моль |
|
| Давление пара | 207 716,25 Па | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 6,1 мг в 100 мл | |
| Классификация | ||
| Рег. номер CAS | 106-97-8 | |
| PubChem | 7843 | |
| Рег. номер EINECS | 203-448-7 | |
| SMILES |
CCCC |
|
| InChI |
InChI=1S/C4H10/c1-3-4-2/h3-4H2,1-2H3 IJDNQMDRQITEOD-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E943a | |
| RTECS | EJ4200000 | |
| ChEBI | 37808 | |
| Номер ООН | 1011 | |
| ChemSpider | 7555 | |
| Безопасность | ||
| Предельная концентрация | 300 мг/м³ | |
| NFPA 704 |
4 1 1 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Бута́н (C4H10) — органическое соединение, углеводород класса алканов. В химии название используется в основном для обозначения н-бутана. Такое же название имеет смесь н-бутана и его изомера изобутана CH(CH3)3. Название происходит от корня «бут-» (французское название масляной кислоты — acide butyrique, от др.-греч. βούτῡρον, масло[3]) и суффикса «-ан» (принадлежность к алканам). Вдыхание бутана вызывает дисфункцию лёгочно-дыхательного аппарата. Содержится в природном газе, образуется при крекинге нефтепродуктов, при разделении попутного нефтяного газа, «жирного» природного газа. Как представитель углеводородных газов пожаро- и взрывоопасен, малотоксичен, имеет специфический характерный запах, обладает наркотическими свойствами. По степени воздействия на организм газ относится к веществам 4-го класса опасности (малоопасные) по ГОСТ 12.1.007-76[4]. Вредно воздействует на нервную систему[5]. При использовании в токсикомании может вызывать сильное привыкание.
Изомерия[править | править код]
Бутан имеет два изомера:
| название | формула | структурная формула | температура плавления, °С | температура кипения, °С |
|---|---|---|---|---|
| н-бутан | CH3–CH2–CH2–CH3 | −138,3 | −0,5 | |
| изобутан | CH(CH3)3 | −159,6 | −11,7 |
Физические свойства[править | править код]
- Бутан — бесцветный горючий газ, со специфическим запахом, при нормальном давлении легко сжижаем от −0,5 °C, замерзает при −138 °C; при повышенном давлении и обычной температуре — легколетучая жидкость. Критическая температура +152 °C, критическое давление 3,797 МПа.
- Растворимость в воде — 6,1 мг в 100 мл (для н-бутана, при 20 °C), значительно лучше растворяется в органических растворителях[6]). Может образовывать азеотропную смесь с водой при температуре около 100 °C и давлении 10 атм.
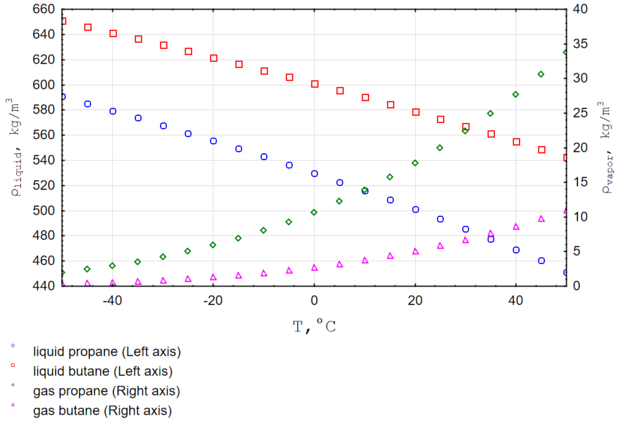
- Плотность жидкой фазы — 580 кг/м³[7]
- Плотность газовой фазы при нормальных условиях — 2,703 кг/м³.
- Теплота сгорания 45,8 МДж/кг (2657 кДж/моль (см.[8]).
Плотность бутана существенно зависит от температуры [9].
Нахождение и получение[править | править код]
- Можно получить путем электролиза пропионовой кислоты:
Сероочистка (демеркаптанизация) бутановой фракции[править | править код]
Прямогонную бутановую фракцию необходимо очищать от сернистых соединений, которые в основном представлены метил- и этил- меркаптанами. Метод очистки бутановой фракции от меркаптанов заключается в щёлочной экстракции меркаптанов из углеводородной фракции и последующей регенерации щёлочи в присутствии гомогенных или гетерогенных катализаторов кислородом воздуха с выделением дисульфидного масла.
Применение и реакции[править | править код]
При свободнорадикальном хлорировании образует смесь 1-хлор- и 2-хлорбутана. Их соотношение хорошо объясняется разницей в прочности связей С—Н в позиции 1 и 2 (425 и 411 кДж/моль).
При полном сгорании на воздухе образует углекислый газ и воду. Бутан применяется в смеси с пропаном в зажигалках, в газовых баллонах в сжиженном состоянии. Температура кипения бутана −0,5 °C, значительно выше, чем у пропана (−42 °C), поэтому в чистом виде его можно использовать только в теплом климате. Иногда используются «зимние» и «летние» смеси с различным составом (в летних бутана до 50%, в зимних — не больше 15%). Теплота сгорания 1 кг — 45,7 МДж (12,72 кВт·ч).
При недостатке кислорода образуется сажа, угарный газ или их смесь:
Фирмой DuPont разработан метод получения малеинового ангидрида из н-бутана при каталитическом окислении:
н-Бутан — сырьё для получения бутилена, 1,3-бутадиена, компонент бензинов с высоким октановым числом.
Бутан высокой чистоты и особенно изобутан может быть использован в качестве хладагента в холодильных установках. Производительность таких систем немного ниже, чем фреоновых, но бутан безопасен для окружающей среды, в отличие от фреоновых хладагентов.
В пищевой промышленности бутан зарегистрирован в качестве пищевой добавки E943a, а изобутан — E943b, как пропеллент.
Безопасность[править | править код]
Легковоспламеним. Пределы взрываемости 1,4—9,3 % в воздухе по объёму. ПДК в воздухе рабочей зоны — 300 мг/м³.
См. также[править | править код]
- Изобутан
- Циклобутан
Примечания[править | править код]
- ↑ 1 2 Теплота сгорания метана, бутана и пропана. Авторский блог Алексея Зайцева. Дата обращения: 7 октября 2022. Архивировано 7 октября 2022 года.
- ↑ 1 2 PubChem (англ.)
- ↑ В свою очередь, др.-греч. βούτῡρον «масло» происходит от βοῦς «корова, вол» и τυρός «сыр».
- ↑ ГОСТ 20448-90. Газы углеводородные сжиженные топливные для коммунально-бытового потребления. Дата обращения: 26 июня 2011. Архивировано 7 января 2012 года.
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, н-бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (УТВ. ГЛАВНЫМ ГОСУДАРСТВЕННЫМ САНИТАРНЫМ ВРАЧОМ РФ 30.03.2003) (недоступная ссылка)
- ↑ Химическая энциклопедия Т1, М. 1988, стр. 331, Статья «Бутаны»
- ↑ Физико-химические свойства пропан-бутановой смеси. Дата обращения: 11 августа 2012. Архивировано 1 октября 2012 года.
- ↑ бутан: физические и химические свойства. www.chemport.ru. Дата обращения: 9 сентября 2019. Архивировано 13 сентября 2019 года.
- ↑ Oleksiy Zivenko. LPG ACCOUNTING SPECIFICITY DURING ITS STORAGE AND TRANSPORTATION (англ.) // Measuring Equipment and Metrology. — 2019. — Vol. 80, iss. 3. — P. 21–27. — ISSN 2617-846X 0368-6418, 2617-846X. — doi:10.23939/istcmtm2019.03.021.
Литература[править | править код]
- Львов М. Д. Бутан, углеводород // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки[править | править код]
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,655 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,939 -
разное
16,901
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Сервисы
н-бутан
Изомеры
Гомологи