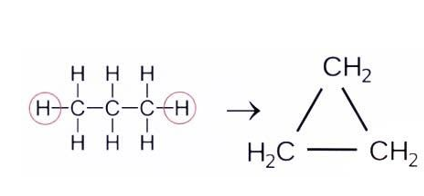
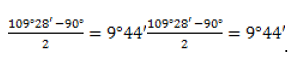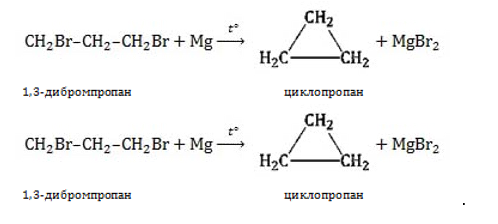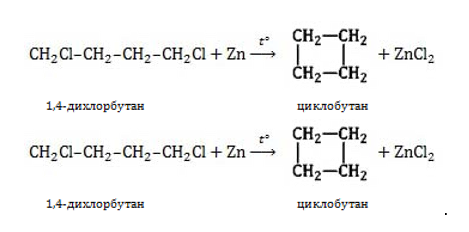Циклоалканы – это предельные (насыщенные) углеводороды, которые содержат замкнутый углеродный цикл.
Общая формула циклоалканов CnH2n, где n≥3.
Строение, номенклатура и изомерия циклоалканов
Химические свойства циклоалканов
Получение циклоалканов
Строение циклоалканов
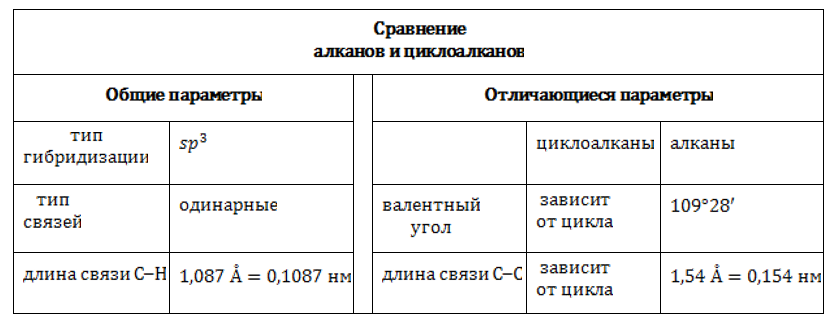
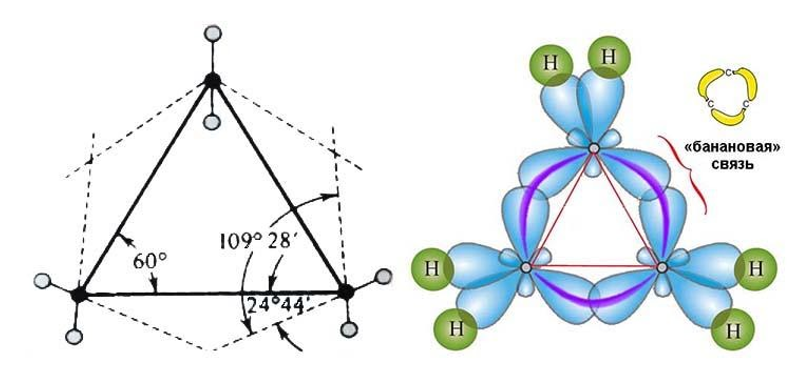
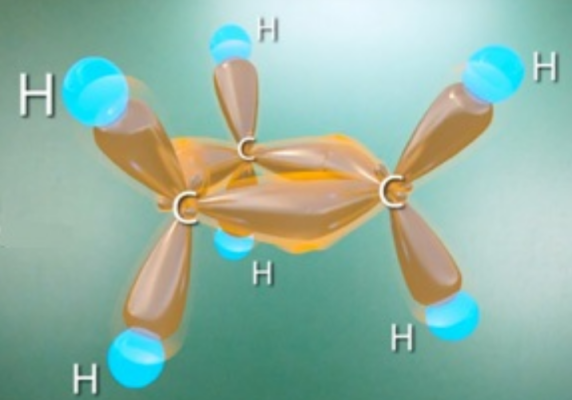
Атомы углерода в молекулах циклоалканов находятся в состоянии sp3-гибридизации и образует четыре σ-связи С–С и С–Н. В зависимости от размеров цикла меняются валентные углы.
В малых циклах (циклопропан и циклобутан) валентные углы между связями С–С сильно отличаются от валентных углов между связями С–С в алканах (109о35′). Поэтому в малых циклах возникает напряжение, которое приводит к высокой реакционной способности таких циклоалканов.
Самый простой циклоалкан — циклопропан, представляет, по сути, плоский треугольник.
σ-Связи в циклопропане называют «банановыми». Они не лежат вдоль оси, соединяющей ядра атомов, а отклоняются от неё, уменьшая напряжение в молекуле циклопропана.
По свойствам «банановые» связи напоминают π-связи. Они легко разрываются.
Поэтому циклопропан очень легко вступает в реакции присоединения с разрывом углеродного цикла.
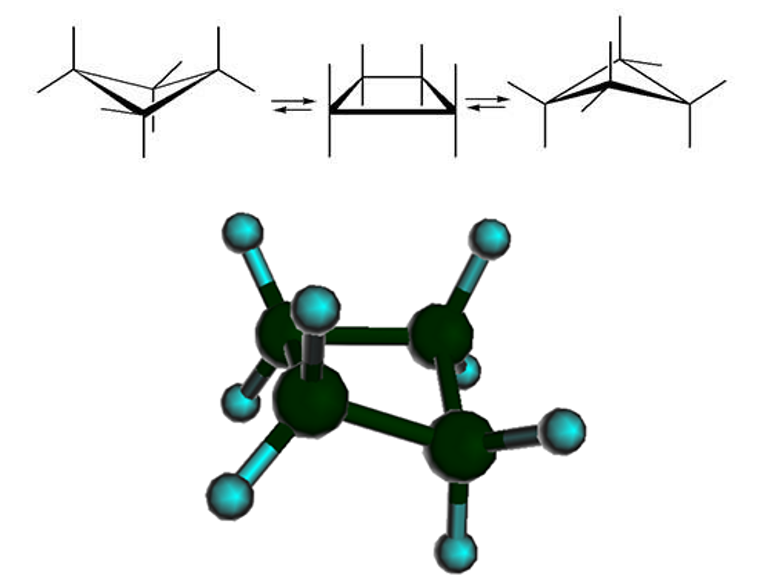
Остальные циклоалканы имеют неплоское строение. Молекула циклобутана имеет перегиб по линии, соединяющей первый и третий атомы углерода в кольце:
Циклобутан также вступает в реакции присоединения, но угловое напряжение в циклобутане меньше, чем в циклопропане, поэтому реакции присоединения к циклобутану протекают сложнее.
Большие циклы имеют более сложное, неплоское строение, вследствие чего угловое напряжение в молекулах больших циклоалканов почти отсутствует.
Циклоалканы с большим циклом не вступают в реакции присоединения. Для них характерны реакции замещения.
Строение циклопентана также неплоское, молекула представляет собой так называемый «конверт».
Молекула циклогексана не является плоским многоугольником и принимает различные конформации, имеющие названия «кресло» и «ванна»:
«кресло» «ванна»
Изомерия циклоалканов
Структурная изомерия
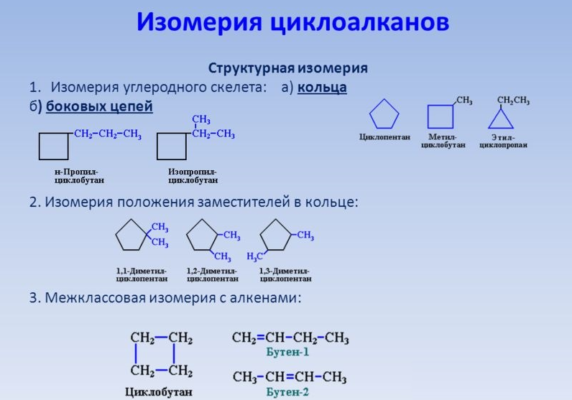
Для циклоалканов характерна структурная изомерия, связанная с разным числом углеродных атомов в кольце, разным числом углеродных атомов в заместителях и с положением заместителей в цикле.
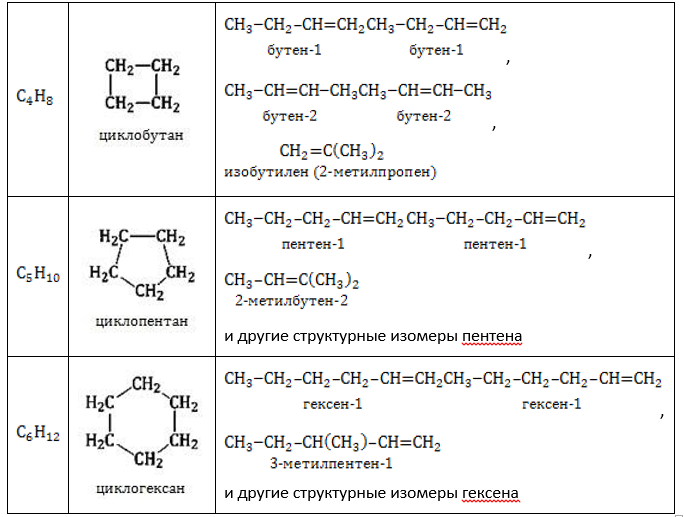
- Изомеры с разным числом атомов углерода в цикле отличаются размерами углеродного цикла.
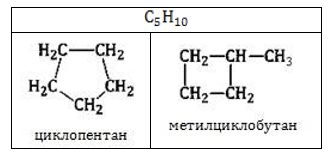
Изомеры с разным числом углеродных атомов в цикле – это этилциклопропан и метилциклобутан с общей формулой С5Н10
- Изомеры с разным числом атомов углерода в заместителях отличаются строением заместителей у одинакового углеродного цикла.
Структурные изомеры с различным числом углеродных атомов в заместителях – 1-метил-2-пропилциклопентан и 1,2-диэтилциклопентан
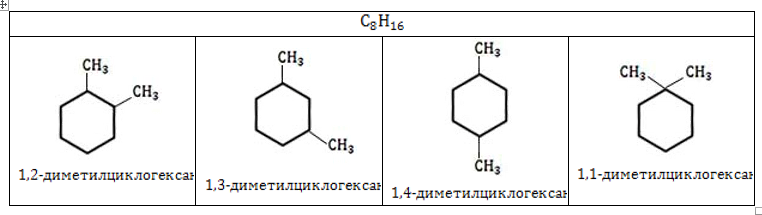
- Изомеры с разным положением одинаковых заместителей в углеродном цикле.
- Межклассовая изомерия: циклоалканы изомерны алкенам.
Формуле С3Н6 соответствуют циклопропан и пропен.
Геометрическая (цис-транс-) изомерия
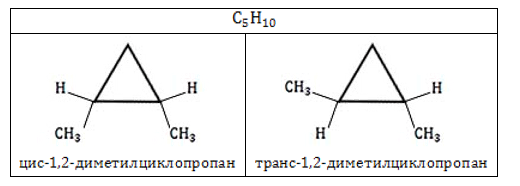
У циклоалканов с двумя заместителями, расположенными у соседних атомов углерода в цикле цис-транс-изомерия обусловлена различным взаимным расположением в пространстве заместителей относительно плоскости цикла.
В цис-изомерах заместители находятся по одну сторону от плоскости цикла, в транс-изомерах – заместители расположены по разные стороны.
В молекуле 1,2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
Для 1,1-диметилциклопропана цис-транс-изомерия не характерна.
Номенклатура циклоалканов
В названиях циклоалканов используется префикс -ЦИКЛО.
Название циклоалканов строится по следующим правилам:
1. Цикл принимают за главную углеродную цепь. При этом считают, что углеводородные радикалы, которые не входят в главной цепь, являются в ней заместителями.
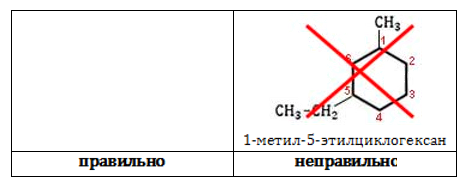
2. Нумеруют атомы углерода в цикле так, чтобы атомы углерода, которые соединены с заместителями, получили минимальные возможные номера. Причем нумерацию следует начинать с более близкого к старшей группе конца цепи.
3. Называют все радикалы, указывая впереди цифры, которые обозначают их расположение в главной цепи.
Для одинаковых заместителей эти цифры указывают через запятую, при этом количество одинаковых заместителей обозначается приставками ди- (два), три- (три), тетра- (четыре), пента- (пять) и т.д.
Например, 1,1-диметилциклопропан или 1,1,3-триметилциклопентан.
4. Названия заместителей со всеми приставками и цифрами располагают в алфавитном порядке.
Например: 1,1-диметил-3-этилциклопентан.
5. Называют углеродный цикл.
Химические свойства циклоалканов
Циклоалканы с малым циклом (циклопропан, циклобутан и их замещенные гомологи) из-за большой напряженности в кольце могут вступать в реакции присоединения.
1. Реакции присоединения к циклоалканам
Чем меньше цикл и чем больше угловое напряжение в цикле, тем легче протекают реакции присоединения. Способность вступать в реакции присоединения уменьшается в ряду: циклопропан > циклобутан > циклопентан.
1.1. Гидрирование циклоалканов
С водородом могут реагировать малые циклы, а также (в жестких условиях) циклопентан. При этом происходит разрыв кольца и образование алкана.
Циклопропан и циклобутан довольно легко присоединяют водород при нагревании в присутствии катализатора:
Циклопентан присоединяет водород в жестких условиях:
Бромирование протекает более медленно и избирательно.
Циклогексан и циклоалканы с большим число атомов углерода в цикле с водородом не реагируют.
1.2. Галогенирование циклоалканов
Циклопропан и циклобутан реагируют с галогенами, при этом тоже происходит присоединение галогенов к молекуле, сопровождающееся разрывом кольца.
Например. Циклопропан присоединяет бром с образованием 1,3-дибромпропана:
1.3. Гидрогалогенирование
Циклопропан и его гомологи с алкильными заместителями у трехчленного цикла вступают с галогеноводородами в реакции присоединения с разрывом цикла.
Например, циклопропан присоединяет йодоводород.
Присоединение галогеноводородов к гомологам циклопропана с заместителями у трехатомного цикла (метилциклопропан и др.) происходит по правилу Марковникова.
Например, при присоединении бромоводорода к метилциклопропану преимущественно образуется 2-бромбутан
2. Реакции замещения
Поэтому большие циклы гораздо более устойчивы, чем малые, и реакции присоединения с разрывом связей С-С для них не характерны. В химических реакциях они ведут себя подобно алканам, вступая в реакции замещения без разрыва кольца.
2.1. Галогенирование
Галогенирование циклопентана, циклогексана и циклоалканов с большим количеством атомов углерода в цикле протекает по механизму радикального замещения.
Например, при хлорировании циклопентана на свету или при нагревании образуется хлорциклопентан
При хлорировании метилциклопентана замещение преимущественно протекает у третичного атома углерода:
2.2. Нитрование циклоалканов
При взаимодействии циклоалканов с разбавленной азотной кислотой при нагревании образуются нитроциклоалканы.
Например, нитрование циклопентана.
2.3. Дегидрирование
При нагревании циклоалканов в присутствии катализаторов протекает дегидрирование – отщепление водорода.
Циклогексан и его производные дегидрируются при нагревании и под действием катализатора до бензола и его производных.
Например, бензол образуется при дегидрировании циклогексана.
Например, при отщеплении водорода от метилциклогексана образуется толуол.
3. Окисление циклоалканов
3.1. Горение
Как и все углеводороды, алканы горят до углекислого газа и воды. Уравнение сгорания циклоалканов в общем виде:
CnH2n + 3n/2O2 → nCO2 + nH2O + Q
Например, горение циклопентана.
2C5H10 + 15O2 → 10CO2 + 10H2O + Q
3.2. Окисление
При окислении циклогексана азотной кислотой или в присутствии катализатора образуется адипиновая (гександиовая) кислота:
Получение циклоалканов
1. Дегидрирование алканов
Алканы с длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при нагревании в присутствии металлических катализаторов образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
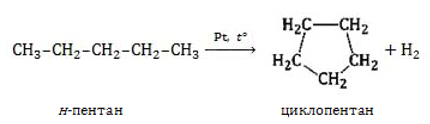
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
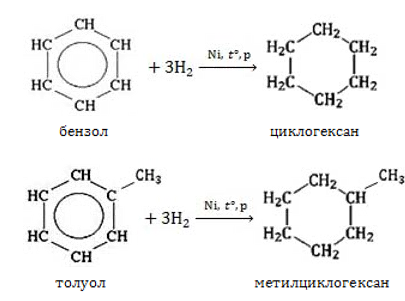
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
Дегидроциклизация алканов — важный промышленный способ получения циклоалканов.
2. Гидрирование бензола и его гомологов
При гидрировании бензола при нагревании и в присутствии катализатора образуется циклогексан:
При гидрировании толуола образуется метилциклогексан:
Этим способом можно получить только циклогексан и его гомологи с шестичленным кольцом.
3. Дегалогенирование дигалогеналканов
При действии активных металлов на дигалогеналканы, в которых между атомами галогенов находится три и более атомов углерода.
Например, 1,4-дибромбутан реагирует с цинком с образованием циклобутана
Таким образом можно синтезировать циклоалканы заданного строения, в том числе циклоалканы с малыми циклами (С3 и С4).
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Содержание
- 1 Понятие о циклоалканах. Общая формула
- 2 Строение циклоалканов
- 3 Гомологический ряд и устойчивость циклоалканов
- 3.1 Малый цикл
- 3.2 Средний цикл
- 4 Изомерия и номенклатура
- 4.1 Виды структурной изомерии циклоалканов
- 4.2 Пространственная изомерия
- 4.3 Номенклатура
- 5 Физические свойства
- 6 Химические свойства
- 7 Способы получения циклоалканов
- 8 Применение циклоалканов
Среди карбоциклических соединений различают две группы веществ, имеющих принципиально разное строение: алициклические, которые близки по свойствам к соединениям с открытой цепью, и ароматические. Предельные алициклические углеводороды называются циклоалканами, или циклопарафинами. Свойства циклоалканов аналогичны свойствам насыщенных углеводородов линейного строения.
Понятие о циклоалканах. Общая формула
Определяющий признак соединений данного ряда – отсутствие кратных связей в молекулах. Все атомы соединяются посредством одинарных связей, поэтому валентности углерода максимально насыщены.
Состав циклоалканов выражает общая формула гомологического ряда В любом циклоалкане недостает двух водородных атомов по сравнению с алканом
, имеющим такое же количество углерода. Они отщеплены от концевых звеньев линейной молекулы, за счет чего и происходит замыкание углерод-водородной цепочки в циклическую структуру:
Структурные формулы циклоалканов часто имеют упрощенный вид геометрической фигуры, а запись групп , расположенных в вершинах многоугольника, опускается:
Строение циклоалканов
Сходство циклопарафинов с алканами проявляется в полном насыщении углеродного скелета молекулы водородом. Оно возникает благодаря тому, что каждый атом углерода формирует по четыре одинарных связи: либо
и
в соединениях с боковыми углеводородными цепочками. Это указывает на тип гибридизации углерода в циклоалканах: sp3.
В sp3-гибридизованном состоянии четыре равноценных валентности углеродного атома имеют тетраэдрическую направленность, а величина валентного угла составляет 109°28`109°28`. Но, в отличие от ациклических углеводородов, в молекулах циклоалканов может возникать напряжение, степень которого зависит от числа атомов, участвующих в образовании цикла.
Валентные углы углерода в циклоалканах подчинены геометрии цикла. Связи отклоняются от нормального направления, вследствие чего и возникает напряжение. Оно, в свою очередь, влияет на прочность молекулы.
Гомологический ряд и устойчивость циклоалканов
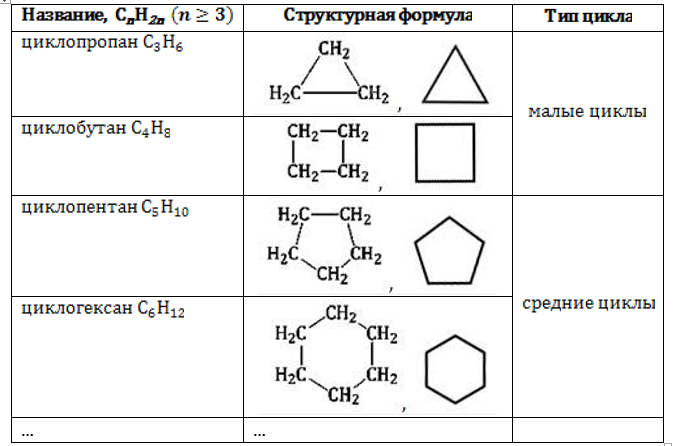
Для образования цикла необходимы как минимум три углеродных атома. Поэтому ряд начинается с соединения циклопропана. Важной особенностью ряда является внутренняя классификация соединений по типу циклов, от которого зависят их свойства.
Малый цикл
Молекулы соединений малого цикла отличаются сильным угловым напряжением из-за большого отклонения тетраэдрического угла 109°28`109°28`. В трехчленной молекуле циклопропана, где валентные углы в трехчленном цикле должны составлять 60°60°, оно особенно велико:
Это приводит к изгибанию связи, которая из-за характерной формы получила название «банановой». Перекрывание орбиталей в такой связи осуществляется не по прямой между центрами углеродных атомов, поэтому «банановая», или связь, слабее обычной
связи.
Четырехчленная структура циклобутана позволяет ослабить напряжение:
Кроме того, один из четырех атомов в цикле на 25°25° отклоняется от плоскости, в результате чего молекула циклобутана колеблется между двумя равноправными конформациями, условно называемыми «бабочка»:
Средний цикл
Молекулы циклопентана и циклогексана гораздо устойчивее, чем малые циклы, благодаря незначительному отклонению валентного угла:
В циклогексане благодаря большому числу конформаций напряжение отсутствует.
Изомерия и номенклатура
Изомерия циклоалканов может быть двух типов:
- структурная, возникающая вследствие различий в строении;
- пространственная, связанная с вариантами конфигурации одинаковых по строению молекул.
Виды структурной изомерии циклоалканов
- Существование изомеров из разных классов веществ
Гомологические ряды соединений, атомный состав которых описывается одной формулой – алкены и циклоалканы – обладают межклассовой изомерией по отношению друг к другу:
- Изомерия углеродного скелета
Возникновение изомеров данного вида зависит от трех факторов.
- размер цикла:
- строение радикала:
- расположение радикалов в цикле:
Пространственная изомерия
Циклоалканы способны образовывать геометрические изомеры. Они возникают вследствие невозможности вращения углеродных атомов в цикле вокруг их валентных связей. Положение стоящих при этих атомах радикалов тем самым зафиксировано в пространстве. Заместители у различных углеродных атомов могут находиться либо с одной стороны цикла (цис-изомер), либо с разных сторон (транс-изомер).
Номенклатура
Номенклатура циклоалканов основывается на наименованиях предельных углеводородов открытого строения – алканов. Приставка «цикло-» добавляется к названию алкана с , равным количеству звеньев в кольце циклоалкана.
Число радикалов одного состава указывается с помощью приставок «ди-», «три-», «тетра-». Старший радикал обозначается первым, а углеродные атомы нумеруют по наиболее короткому расстоянию между радикалами.
Физические свойства
В целом по физическим свойствам циклоалканы сходны с ациклическими углеводородами предельного ряда. Однако плотность и значения критических температур у них выше, чем у родственных алканов.
Циклопропан и циклобутан в обычных условиях являются газами, циклопентан и последующие шесть членов ряда, включая циклоундекан – жидкости, а начиная с циклододекана
– твердые тела.
Химические свойства
Значительные различия между соединениями малых и средних циклов обусловливают разницу в химических свойствах циклоалканов:
- соединения
менее стойки и охотно участвуют в реакциях присоединения, сближаясь по свойствам с алкенами;
и следующие за ним члены гомологического ряда в проявлении химических свойств аналогичны алканам с таким характерным типом химического взаимодействия, как замещение.
Это интересно:
Окисление алкенов перманганатом калия
Циклические углеводороды
Способы получения циклоалканов
- Дегалогенирование дигалогенпроизводных предельных ациклических углеводородов. Воздействуя активным металлом, способным отнимать галоген, на дигалогеналкан, можно получить циклическое соединение заданного состава. Условие – наличие между галогенированными группами атомов в цепочке минимум одной группы
. Реакция получения циклопропана:
- Дегидроциклизация алканов. При нагревании алканов, содержащих пять и более углеродных атомов, на металлическом катализаторе происходит отщепление водорода (дегидрирование) на концах цепочек с ее замыканием (циклизация алканов):
- Гидрирование ароматических углеводородов. Поскольку наименьшее количество углеродных атомов в углеводородах ряда бензола равно шести, этим методом возможно получение циклоалканов не менее чем с шестичленным циклом:
Применение циклоалканов
Наиболее широко используются циклоалканы с углеродным числом :
- Циклопропан применяется в медицинской практике как анестетик, однако из-за повышенной огнеопасности в последнее время его вытесняют другие препараты.
- Циклопентан находит применение в синтезе органических соединений, используется в качестве растворителя, вспенивателя в производстве пенополиуретанов и как заменитель фреонов.
- Циклогексан служит сырьем для производства соединений, из которых получают синтетические волокна капрон и нейлон, для получения ароматических углеводородов. Также его применяют в качестве органического растворителя.
Циклоалканы с более высокими углеродными числами – циклогептан и циклооктан – используются как промежуточные реагенты в синтезе некоторых органических веществ.
Циклоалканы

4.7
Средняя оценка: 4.7
Всего получено оценок: 551.
4.7
Средняя оценка: 4.7
Всего получено оценок: 551.
Насыщенные углеводороды с замкнутым, циклическим углеродным скелетом называются циклоалканами. Другие названия – нафтены, циклопарафины, цикланы. Общая формула циклоалканов – CnH2n.
Общее описание
Циклопарафины имеют схожее строение с алканами. Вещества находятся в состоянии sp3-гибридизации. Все атомы углерода заняты атомами водорода.
Простейшим веществом является циклопропан с тремя атомами углерода, образующими треугольный цикл. С увеличением атомов углерода форма цикла меняется и усложняется. Например, молекула, содержащая пять атомов углерода, имеет вид пятиугольника, а молекула с десятью атомами – форму сдвоенных пятиугольников. Молекулу веществ зарисовывают в виде фигуры, в углах которой по умолчанию находятся группы СН2.
По номенклатуре ИЮПАК названия цикланов составляются из приставки «цикло-» и названия алкана. Циклопропан образует гомологический ряд циклоалканов:
- C3H6 – циклопропан;
- C4H8 – циклобутан;
- C5H10 – циклопентан;
- C6H12 – циклогексан;
- C7H14 – циклогептан;
- C8H16 – циклооктан;
- C9H18 – циклононан;
- C10H20 – циклодекан;
- C11H22 – циклоундекан;
- C12H24 – циклододекан.
Циклоалканы отличаются от алканов двумя атомами водорода. Например, пентан – C5H12, а циклопентан – C5H10.
Нафтены выделяют из полезных ископаемых – нефти и газа. Также получают путём гидрирования ароматических углеводородов (аренов) и дегидрирования алканов:
- C6H6 + 3H2 → C6H12;
- С6Н14 ↔ C6H12 + Н2.
Циклоалканы образуют три вида изомерии: пространственную, углеродную (присоединение дополнительных групп СН2) и межклассовую с алкенами.
Свойства
Циклоалканы по физическим и химическим свойствам близки алканам. В обычных условиях первые три гомолога – газы. Соединения, содержащие от пяти до 11 атомов углерода – жидкости. Высшие нафтены с 12 и более атомами углерода – твёрдые вещества.
Температуры плавления и кипения увеличиваются с увеличением молекулярной массы. Однако нафтены плавятся и кипят при более высоких температурах, чем соответствующие алканы.
Низшие цикланы – циклопропан и циклобутан – сходны с алкенами и способны вступать в реакции присоединения. Циклоалканы выше циклопентана схожи с алканами и вступают в реакцию замещения. Основные химические свойства циклопарафинов описаны в таблице.
|
Реакция |
Описание |
Уравнения реакций |
|
Галогенирование |
Циклопропан и циклобутан присоединяют галогены. Начиная с циклопентана, нафтены вступают в реакцию замещения с галогенами |
|
|
Гидрирование |
Циклопропан и циклобутан присоединяют водород при нагревании в присутствии никеля |
C4H8 + H2 → CH3-CH2-CH2-CH3 |
|
Присоединение галогеноводородов |
Циклопропан и циклобутан присоединяют галогеноводороды |
C3H6 + HI → CH3-CH2-CH2I |
|
Дегидрирование |
Нафтены от циклопентана и выше дегидрируются в присутствии катализатора |
C6H12 ↔ C6H6 + 3H2 |
|
Окисление |
Окисление в присутствии катализатора |
C6H12 + 2O2 ↔ C6H10O4 |
Нафтены применяются для синтеза спиртов, кетонов, кислот, полимеров, используются в качестве растворителей.
Что мы узнали?
Циклоалканы или нафтены – циклические предельные углеводороды, схожие свойствами с алканами. Имеют циклическую структуру разной формы. Могут образовывать межклассовые, углеродные и структурные изомеры. Малоактивные вещества в обычных условиях. В присутствии катализатора циклопропан и циклобутан вступают в реакции присоединения с галогенами, галогеноводородами, водородом. Начиная с циклопентана, циклоалканы вступают в реакцию замещения с галогенами, а также окисляются и дегидрируются.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Рузаль Гайнетдинов
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 551.
А какая ваша оценка?
План урока:
Формула и строение циклоалканов
Номенклатура и изомерия циклоалканов
Методы получения циклоалканов
Физические свойства циклоалканов
Химические свойства циклоалканов
Области применения циклоалканов
Формула и строение циклоалканов
Углеродным атомам характерна sp3-гибридизация и формирование четырех сигма-связей (σ-связи) С-Н и С-С. От размеров цикла зависят свойства вещества. У первых двух представителей гомологического ряда валентный угол равен не 109˚35’, как в алканах, а меньше. Из-за возникающего напряжения в молекуле эти циклы имеют высокую реакционную способность.
«Банановые» σ-связи в циклопропане – особенность строения циклоалканов. Они расположены так, что соединяют ядра атомов углерода не прямой, а дугообразной линией. «Банановые» связи схожи с π-связями, т.к. легко рвутся. Они необходимы для уменьшения напряжения внутри цикла.
Рис. Малые циклопропаны. А, б, в – «банановые» связи циклоалканов; г – конформации циклоалканов. Источник
Другие нафтены имеют особенность – пространственное строение. В циклобутане есть перегиб между первым и третьим углеродным атомами. Циклопентан представлена в конформации «конверт», а циклогексан – в «кресло» и «ванна».
Общая формула циклоалканов: CnH2n, где n≥3.
Номенклатура и изомерия циклоалканов
Название состоит из приставки «цикло» и названия алкана с определенным количеством углеродных атомов. Циклоалканы подразделяются на малые и большие циклы. К первой группе относятся циклопропан и циклобутан, а ко второй все остальные вещества. Соединения этого класса часто изображают в виде геометрических фигур, где количество углов соответствует числу атомов углерода.
Для циклоалканов свойственно два вида изомерии – структурная и пространственная. Структурная включает в себя:
- изомерию углеродного скелета (расположение атомов может меняться как в цикле, так и в боковой цепи),
- изомерию положения заместителей в кольце,
- межклассовую изомерию (изомерны алкенам).
Пространственная включает в себя:
- цис-транс-изомерию,
- зеркальную изомерию (основана на существовании нескольких оптических изомеров),
- поворотную изомерию (основана на повороте относительно σ-связи).
Источник
Методы получения циклоалканов
В промышленном производстве циклоалканы получают двумя способами.
- Гидрирование аренов при нагревании с катализатором Ni
- Дегидрирование алканов при нагревании с катализатором
Циклы, имеющие шесть и более углеродных атома, получают под воздействием оксида хрома (III).
В лабораториях циклоалканы получают с помощью дегалогенирования дигалогеналканов. Особенность этого метода заключается в том, что галогены должны находиться на концах молекулы алкана.
Физические свойства циклоалканов
Циклоалканы во многом схожи с алканами. Первые два представителя гомологичного ряда – газы, следующие два – жидкости (они входят во фракции нефти), последующие соединения циклоалканов – твердые вещества. Температуры плавления и кипения выше, чем алканов с соответствующим количеством углеродных атомов. Это объясняется плотным расположением атомов внутри молекулы. Циклоалканы не растворимы в воде, но растворимы в органических растворителях.
Химические свойства циклоалканов
Свойства циклоалканов различны и меняются по мере изменения размеров молекулы. Малым циклам характерны реакции присоединения, а большим – замещения.
Реакции присоединения
Малые циклы хотя и проявляют насыщенность, но им не характерны свойства предельных углеводородов. Это связано с тем, что у первых двух простейших представителей циклоалканов валентные углы меньше. Для них свойственно напряжение внутри кольца и тяга к раскрытию при воздействии реагентов.
- Гидрирование при воздействии катализатора и высоких температур
- Галогенирование
- Гидрогалогенирование при нагревании
Реакции гидрогалогенирования гомологов циклоалканов осуществляется по правилу Марковникова.
Реакции замещения
Циклы с шестью и более углеродными атомами наиболее устойчивы из-за отсутствия углового напряжения.
- Галогенирование под действием света
У гомологов циклоалканов галоген замещается у третичного атома углерода.
Окисление
Уравнения реакции окисления характерны как для малых, так и для больших циклов.
Области применения циклоалканов
Нафтены нашли широкое применение в качестве:
- анестезирующих ингаляторов;
- продукта народного хозяйства;
- растворителей и др.
Также их применяют в получении полупродуктов при производстве синтетических волокон, адипиновой кислоты, циклогексанола. Применение циклоалканов актуально для получения аренов в нефтяной промышленности.